浮游植物水华对溶解态铝的清除机制:现场培养结果启示
2015-10-22王召伟任景玲金杰刘素美石金辉
王召伟,任景玲*,金杰,刘素美,石金辉
(1.中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东青岛266100;2.中国海洋大学海洋环境与生态教育部重点实验室,山东青岛266100)
浮游植物水华对溶解态铝的清除机制:现场培养结果启示
王召伟1,任景玲1*,金杰1,刘素美1,石金辉2
(1.中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东青岛266100;2.中国海洋大学海洋环境与生态教育部重点实验室,山东青岛266100)
本文通过现场Al加富培养实验探讨浮游植物细胞生长过程对溶解态Al的清除机制。实验分为4组,分别为对照组,N/P/Si加富组,N/P/Si/Al加富组和沙尘添加组。结果表明:对照组浮游植物细胞的比生长率为0.46 d-1,两个营养盐加富组的比生长率增加至0.68 d-1,沙尘添加组的比生长率介于两者之间。培养过程中营养盐含量不断下降,直至消耗殆尽。对照组和N/P/Si加富组中溶解态Al浓度缓慢下降,而N/P/Si/Al加富组中溶解态Al的浓度在指数增长期降低约40%,在衰亡期显著回升,沙尘添加组中溶解态Al的浓度随培养时间不断升高。利用草酸盐淋洗试剂区分指数增长期浮游植物细胞中Al的存在形态,对照组“细胞中总Al”和“细胞内结合态Al”的含量分别为(3.6± 0.1)mg/g和(2.1±0.3)mg/g,而N/P/Si/Al加富组“细胞中总Al”和“细胞内结合态Al”的含量分别增加至(5.1±0.3)mg/g和(3.2±0.4)mg/g。浮游植物细胞的生长能够显著清除海洋中溶解态Al,其清除机制是细胞内吸收作用为主,细胞外吸附作用为辅。
溶解态铝;浮游植物水华;细胞内结合态Al;现场培养实验;黄海
王召伟,任景玲,金杰,等.浮游植物水华对溶解态铝的清除机制:现场培养结果启示[J].海洋学报,2014,37(2):85-92,doi:10.3969/j.issn.0253-4193.2015.02.009
Wang Zhaowei,Ren Jingl ing,Jin Jie,et al.Scavenging mechanism of dissolved Al by phytoplankton:Inspiration from fi led incubation experiments[J].Haiyang Xuebao,2014,37(2):85-92,doi:10.3969/j.issn.0253-4193.2015.02.009
1 引言
铝(Al),地壳中含量第三的元素[1],在海水中的浓度仅在nmol/L水平[2],属于痕量金属元素。溶解态Al在海洋中的分布和行为在过去几十年的研究已较为充分,表现出较大的时空差异。早期研究结果表明:海洋中溶解态Al的源主要包括河流输入[3],大气沙尘沉降[4],沉积物溶解扩散[5]和颗粒物(包括生源颗粒)表面释放[6]。其在海洋中的汇主要包括颗粒物表面吸附[7],河口混合过程的絮凝沉降[8],生物吸收[9]等。大部分海区调查结果表明,溶解态Al是非营养型分布的痕量元素[10—11],且其在水体中存留时间相对较短(几个星期到几年),故通常将Al作为示踪剂,示踪水团混合[12—13]、大气沙尘沉降[7]等过程。但在地中海[14]、北冰洋[15]、黄海[16—17]和实验室培养的研究[18—19]等结果均发现浮游植物主动吸收溶解态Al的过程,故前期以海水中溶解态Al为示踪因子的估算应加以适当修正,特别是在受浮游植物水华影响显著的陆架边缘海。为了有效地研究浮游植物对金属离子的清除机制,H udson和M orel于[20]1989年提出利用Ti(Ⅲ)-E D TA-柠檬酸盐作为淋洗试剂洗脱“细胞外吸附”的金属离子以区分“细胞内结合态”和“细胞外吸附态”的金属离子含量的方法,Tovar-Sanchez等[21]人于2003年对其进行了改进,用草酸盐代替Ti(Ⅲ)对细胞外吸附态的痕量金属铁进行淋洗,结果表明细胞外吸附态铁占细胞中总铁的比例为16%~86%。
黄海是中国陆架边缘海的主要组成部分,大气沙尘输送是黄海中部营养物质和痕量金属Al的主要来源[22—23]。例如,2000-2002年,在影响中国边缘海的亚洲沙尘事件中,接近30.9%的沙尘到达黄海海域[24]。黄海叶绿素的平均含量夏、秋高,冬、春低,且黄海中部每年春季都会暴发季节性水华[25]。黄海的这些特点为研究溶解态Al的生物行为提供了良好的场所。本文主要通过船上现场环境条件进行Al加富/沙尘加富培养实验,以期验证浮游植物的生长对溶解态Al的清除行为,并利用痕量元素淋洗试剂区分浮游植物细胞中Al的存在形态,初步探讨其清除机制,深化对海洋中Al的生物地球化学行为的认识。
2 材料与方法
2.1采样站位及方法
于2009年3-4月乘坐“北斗”号科研调查船在黄海进行现场调查,在B26站(36.028°N,124.041°E;水深79 m)采集表层海水样品(表层温度为5.6℃)。海水采集后立即通过200μm筛绢滤除浮游动物后,分装入酸洗净的19 L聚碳酸酯桶中,用于现场培养实验。
实验分为4组,分别为对照组、氮磷硅(N/P/Si)加富组、氮磷硅铝(N/P/Si/Al)加富组和沙尘添加组,各组加标情况如表1所示。每组平行培养2份,以保证实验结果的可靠性。培养液中加入的Al标准液由K Al(SO4)2·12 H2O配制,为防止加富的Al在海水中形成氢氧化铝絮凝沉降,按1∶2的比例同时加入E D TA。所有培养用聚碳酸酯桶置于后甲板大水箱中,现场海水浴条件下培养20 d,每天摇桶3~4次,以减少浮游植物沉降及保证其呼吸。每隔1~2 d定时取样,培养液经针头滤器(德国,M E M BR A N A公司,0.45μm)过滤后,营养盐样品滴加饱和H gCl2常温避光保存,溶解态Al样品置于冰箱冷冻保存(-18℃)。叶绿素样品用0.45μm醋酸纤维膜过滤,过滤时加入饱和碳酸镁溶液防止镁离子流失和p H的改变,膜样冷冻保存。
本次培养实验添加的沙尘为2008年5月沙尘暴期间在青岛采集的自然沉降的亚洲沙尘,沙尘采集后,用20μm的筛绢分级处理并分析了其主要营养成分及微量金属元素,单位质量的沙尘在寡营养的大洋水中溶出N O-3、N H+4、P O3-4、SiO2-3的浓度分别为7.00μmol/g、3.97μmol/g、0.26μmol/g、7.33μmol/ g,而微量金属元素Ee、Zn的溶出量为0.687 mg/g、0.219 mg/g,为后续的沙尘添加实验提供参考数据[]。
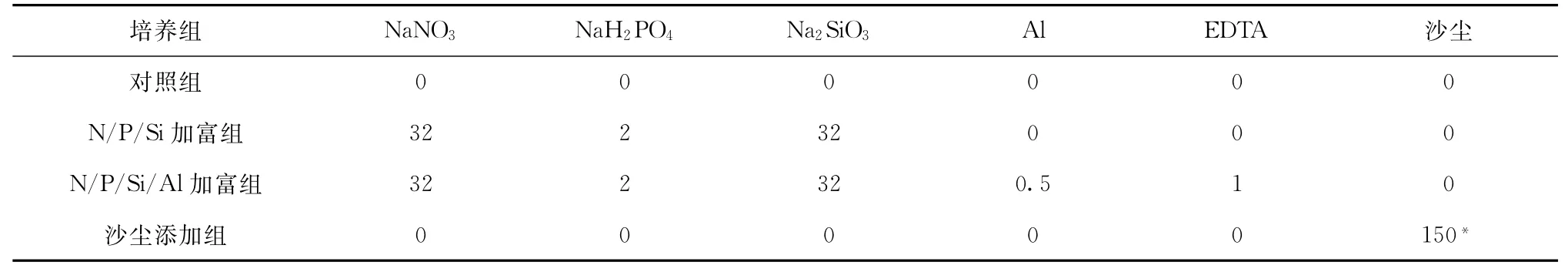
表1 船上各培养组中元素的添加量(单位:μmol/L)Tab.1 Concentration of the elements added during the culture experiments on board(units:μmol/L)
2.2测定方法
溶解态Al的分析方法采用Zhang等[27]于2000年改进的铝-荧光镓(Al-L M G)荧光光度法,其检出限是0.25 nmol/L,在40 n mol/L和1.0 nmol/L时检测精密度分别为5%和6.7%。叶绿素a(Chla)的分析方法采用荧光法测定,膜样先用90%丙酮萃取,然后采用Trilogy实验室型荧光仪(Turner Designs)测定。培养液中各种营养盐的浓度采用营养盐自动分析仪(Skalar SA Nplus)测定。浮游植物细胞中不同结合态Al的测定方法:每组取4份平行的培养液样品进行过滤(真空泵负压低于3 kPa,保证浮游植物细胞不破碎),其中2份用草酸盐淋洗试剂(草酸-E D TA-柠檬酸盐)将“细胞外吸附态Al”淋洗下来,测定淋洗后浮游植物细胞中“细胞内结合态Al”的量,另2份不加淋洗试剂,直接测定细胞中总Al的量,二者之差即为“细胞外吸附态Al”。滤膜烘干称重后在聚四氟乙烯消化罐中用浓H N O3-H ClO4(10∶2,体积比)消解36 h,采用上述方法测定消解液中Al的含量。实验对浒苔消解的精密度为5.2%(n=7),对威氏海链藻进行淋洗实验,非淋洗的精密度为3.8%,淋洗的精密度为19.3%(n=5)[19]。
3 结果与讨论
3.1浮游植物生长对水体中溶解态Al的清除行为
在B26站位采集的海水,由于海水初始温度较低,初始细胞丰度也较低,优势种主要有隐藻、中肋骨条藻、双鞭毛藻、海链藻和角毛藻组成,且细胞丰度依次降低。表2给出了现场培养实验过程中在指数增长期各组的浮游植物细胞种类数、细胞丰度和比生长率。由于营养盐的加入,使得N/P/Si和N/P/Si/Al加富组的浮游植物细胞生长较快,且细胞丰度较对照组增加3个数量级。沙尘添加组中由于沙尘的加入,其携带的营养盐进入培养液,促使浮游植物细胞的生长,但其比生长率和细胞丰度都介于对照组和营养盐加富组之间。培养过程中浮游植物优势种的变化情况如图1,营养盐加富组的优势种由原来的5种变为海链藻和中肋骨条藻两种,细胞丰度各占约50%,而沙尘添加组的优势种还出现角毛藻,约占20%。

表2 指数增长期各培养组浮游植物种类数、细胞丰度和比生长率Tab.2 The amount of phytoplankton species,cell abundance and growth rate during the exponential growth phase
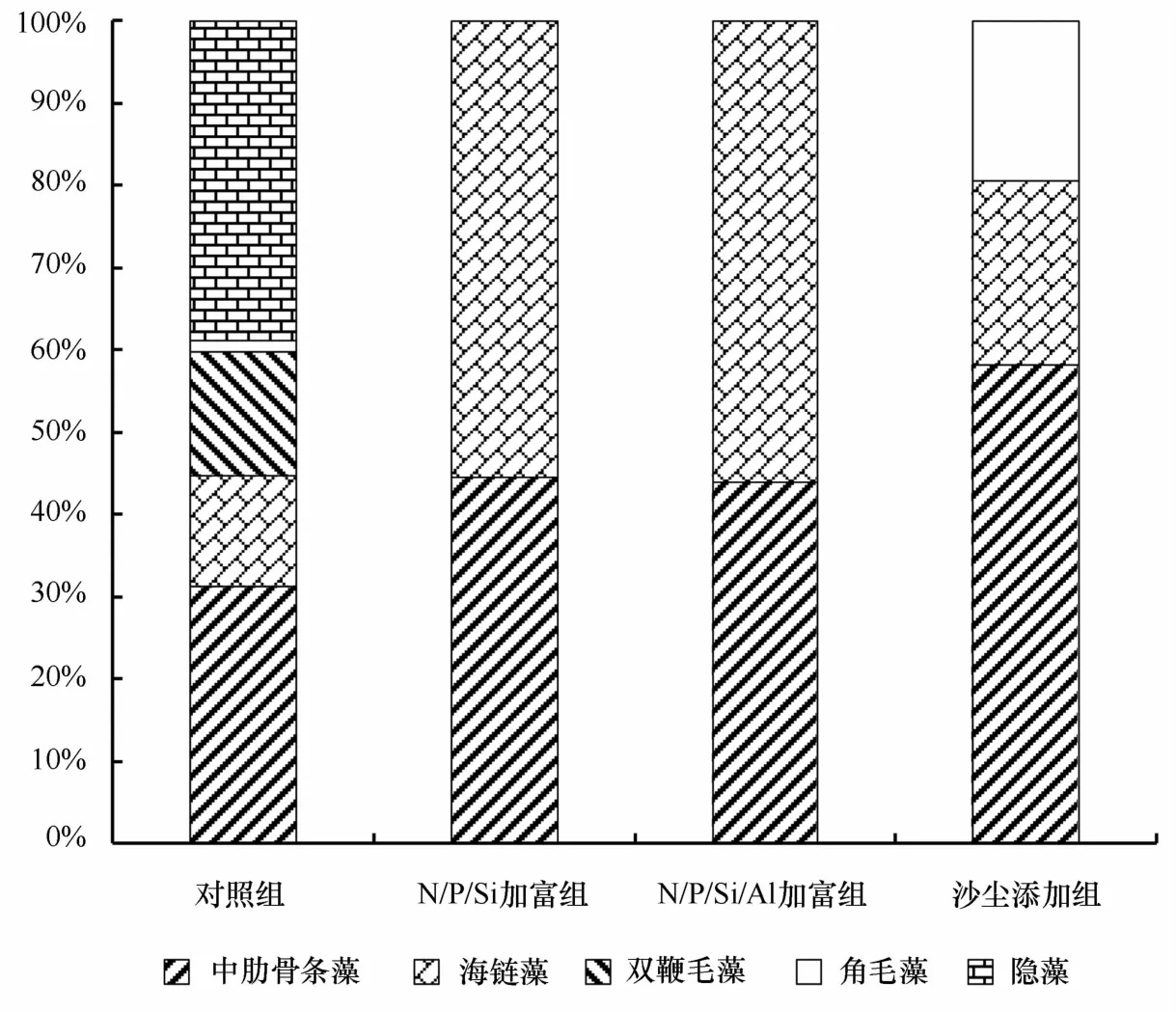
图1 指数增长期各培养组中浮游植物的比例组成Eig.1 The percentage of phytoplankton species in different culture groups during the exponential growth phase
实验结果如图2所示,整个培养过程,各组浮游植物生长状况良好(见图2a),潜伏期(0~4 d)、指数增长期(4~8 d)、稳定期(8~12 d)、衰亡期(12 d以后)。添加的Al会使浮游植物细胞在指数增长期比生长率减小,但并没有对浮游植物的生长表现出明显的生长抑制(表2)。各个培养组的营养盐含量均在第4天开始急剧下降,至第8天左右降到0.1μmol/L以下,营养盐的匮乏导致浮游植物细胞逐渐死亡,进入衰亡期(见图2b~d)。图2e指示培养过程溶解态Al的变化趋势,对照组和N/P/Si加富组的趋势基本相似,溶解态Al的浓度在培养初期即缓慢下降,而后基本保持不变。N/P/Si加富组中由于营养盐的加入浮游植物细胞生长更加旺盛,消耗培养液中更多的溶解态Al,故其溶解态Al的浓度在指数增长期显著低于对照组海水(t检验,α=0.05)。
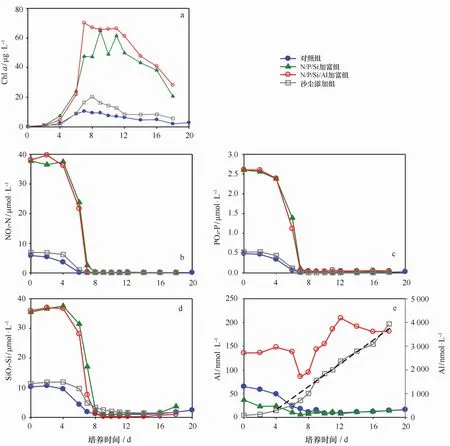
图2 培养过程中叶绿素a、营养盐及溶解态Al含量的变化Eig.2 Variation of the concentration of chlorophya,nutrients and dissolved Al during the culture process
在N/P/Si/Al加富组中,添加溶解态Al的含量为500 nmol/L,并按1∶2的比例同时加入E D TA是为了保证加入的Al能以溶解态的形式存在于海水中,但在零时刻实测的溶解态Al含量只有121 nmol/L。造成现场培养实验初期实测的溶解态Al含量低于添加的Al的浓度原因,可能是由于培养用的现场海水只用孔径200μm的筛绢滤除浮游动物,海水中仍含有大量的藻类和颗粒物(初始海水中Al:26 n mol/L;SP M:2.6 mg/L;Chla:0.47μg/L),添加的Al可能被快速的吸附在颗粒物或藻细胞表面而被清除出水体。N/P/Si/Al加富组中溶解态Al的浓度较初始时刻在指数增长期降低约40%,然后溶解态Al的浓度又显著增加。浮游植物的旺盛生长能够明显清除水体中溶解态Al,而衰亡期大量藻体细胞死亡后降解又会释放出大量的溶解态Al。浮游植物细胞死亡后降解产生的碎屑既可以是溶解态Al的源又可以是溶解态Al的汇。一方面表现为,浮游植物细胞死亡后降解,细胞吸附/吸收的Al重新释放回水体,从而造成溶解态Al浓度的升高[6]。另一方面生源颗粒物表面富含羟基、羧基,这种结构特点决定了它容易吸附Al,成为溶解态Al清除的重要载体[28]。由图2e的结果看,N/P/Si/Al加富组在细胞死亡后营养盐无明显增加,而溶解态Al的浓度增加,主要原因在于浮游植物细胞生长过程中磷能够吸附在细胞表面,而碳、氮、硅无明显的吸附现象,且“细胞表面吸附态磷”占细胞中总磷的比例不足20%[29],而Al能够快速的吸附在细胞的表面。故细胞死亡后降解,导致吸附在细胞表面的Al重新释放回水体,而营养盐则不明显。其次,浮游植物细胞死亡后并未完全降解,细胞内有机态的营养盐还未转化为无机态,故营养盐未看到明显增加。最后,细胞死亡后降解,培养液的p H降低,悬浮颗粒物溶出Al的能力加强[30],导致培养后期溶解态Al的浓度高于初始浓度。
沙尘添加组中由于添加的沙尘量较大(150 mg/L),浮游植物细胞生长较为缓慢,且沙尘中Al的溶出量远远超过浮游植物的生长对溶解态Al的清除量,故沙尘添加组中溶解态Al的浓度随培养时间不断升高。但是沙尘添加组培养液中溶解态Al的浓度在指数增长期(4~8 d)显著低于沙尘溶出Al的线性回归(图2e),间接证实浮游植物细胞在指数增长期对溶解态Al的清除作用。浮游植物的生长对溶解态Al的清除机制可能是浮游植物细胞的表面吸附,也可是浮游植物细胞的内部吸收[19],具体讨论见下节。
3.2浮游植物细胞中Al的存在形态
M ackenzie等于1978年在地中海发现溶解态Al和Si的相似行为,并提出海洋中铝和硅的循环通过硅藻的代谢活动联系在一起的假设[9]。Stoffyn在1979年通过实验室培养中肋骨条藻验证了海洋中溶解态Al受生物活动控制[18]。船上现场培养过程中,N/P/Si/Al加富组在指数增长期细胞培养液中溶解态Al和Chla的关系如图3a所示,其负相关的关系(r2=0.93)表明浮游植物的生长活动对溶解态Al的清除。溶解态Al的浓度与硅酸盐之间呈线性相关(图3b,r2=0.89),揭示了浮游植物的生长对溶解态Al的清除和硅酸盐具有相类似的行为。Koning等在2007年利用实验室培养和X射线吸收光谱等手段验证了环境中Al迅速与硅藻细胞膜结合,并将Al的结构合并到Si的结构框架中,形成铝硅酸盐[31]。Han等2008年估算了硅藻吸收溶解态Al形成硅质外壳约占30%。他们认为水体中浮游植物的主动吸收/吸附将超过被动的颗粒物清除,尤其在暴发硅藻水华,而且悬浮颗粒物的浓度相对较低的近岸海域[32]。
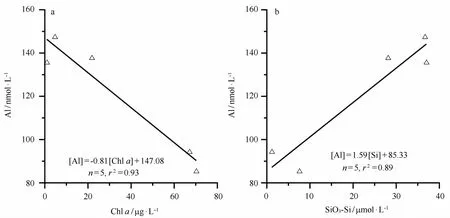
图3 指数增长期溶解态Al与叶绿素a、溶解态硅酸盐的关系Eig.3 Relationship between dissolved Al,Chlaand dissolved si l icate during exponential growth
取指数增长期(第6天)的浮游植物细胞样品用草酸盐淋洗试剂进行淋洗,以区分浮游植物细胞中Al的存在形态,结果如图4所示。指数增长期对照组细胞中总Al的含量为(3.6±0.1)mg/g,细胞内结合态Al的含量为(2.1±0.3)mg/g,细胞内结合态Al占细胞中总Al的比例为58%。而N/P/Si加富组和N/P/Si/Al加富组细胞中总Al含量分别为(4.0± 0.2)mg/g,(5.1±0.3)mg/g,细胞内结合态Al的含量分别为(2.3±0.5)mg/g,(3.2±0.4)mg/g。为验证整个培养过程Al的质量是否守恒,引入“颗粒活性Al”来估算悬浮颗粒物解析的潜在贡献。在海洋中,Al在颗粒物-水界面的分配通常用一个分配系数Kd(单位:m L/g)表示,其中,Cp代表颗粒活性Al(nmol/L),Cd代表溶解态Al(n mol/L),S P M是悬浮颗粒物的浓度(g/m L)。基于我国近海已发表的数据,Kd的范围在105~107m L/g之间,平均值约106m L/g[16,33—34]。依据指数增长期溶解态Al和SP M的浓度,可计算出Cp=224 nmol/ L,此为悬浮颗粒物溶解释放Al的潜在贡献量。培养液中溶解态Al的减少量为440 n mol/L。指数增长期培养液体积为15 L,故培养液中Al的总减少量为269μg。依据N/P/Si加富组和N/P/Si/Al加富组“细胞中总Al”的差异(1.1 mg/g)和藻细胞浓度(16 mg/L),可计算出细胞中Al的增加量为264μg。由以上计算可见,N/P/Si/Al加富组在指数增长期培养液中溶解态Al浓度的下降由浮游植物细胞的生长清除导致。细胞淋洗结果证明了浮游植物的生长能够明显清除水体中的溶解态Al,其中被清除的溶解态Al中73%被浮游植物细胞内部吸收利用,其余的27%被浮游植物细胞表面吸附,浮游植物细胞中Al的存在形态以“细胞内结合态”为主。
3.3沙尘添加培养实验中Al的溶出行为
黄海春季大面积浮游植物水华的发生与春季频发的沙尘暴密切相关[35],大气沙尘携带的营养盐或者铁能够促进浮游植物生长[36-37],从而提高初级生产力,特别是在高营养盐低叶绿素海区(H N LC)。由图2a可见,沙尘的添加对浮游植物的生长起到显著的调控作用。沙尘为浮游植物细胞的生长提供了一定量营养物质和微量营养元素(如铁),其叶绿素的含量相比于对照组也有显著增加(t检验,α=0.05),且沙尘释放的营养盐对叶绿素的支持效率高于营养盐加富组。培养液中溶解态Al的不断增加表明大气沙尘沉降及其溶解是影响海洋中溶解态Al循环的重要途径[38]。沙尘添加组中初始添加的沙尘量为150 mg/L,通过20 d的培养实验,培养液中溶解态Al的浓度高达4 073.6 n mol/L,假设沙尘中Al的含量为8.1%[1],忽略浮游植物细胞生长对溶解态Al的清除作用,估算沙尘中Al的溶解度约为0.9%,低于Shi等2013年报道的沙尘的溶解度范围在1.5%~5.1%之间[39],分析其原因,主要是培养过程浮游植物细胞的生长对溶解态Al的清除导致。
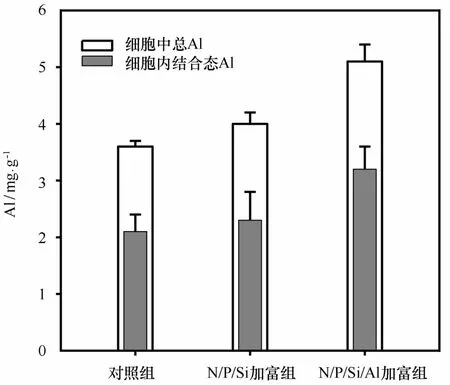
图4 浮游植物细胞中总Al和细胞内结合态Al的含量Eig.4 The content of total Al and intra-cellular Alin the phytoplankton cells
4 结论
本文通过现场培养实验得出的主要结论如下:
(1)浮游植物的生长(尤其是硅藻)对水体中溶解态Al存在明显的清除行为,在指数增长期的清除量约占40%,细胞衰亡后又会释放Al。
(2)浮游植物细胞的生长对溶解态Al的清除机制包括细胞外吸附和细胞内吸收转化两个过程,其中细胞内吸收转化的贡献约占73%,细胞中Al的存在形态以“细胞内结合态”为主。
致谢:本研究在采样过程中,得到了中国海洋大学海洋生物地球化学实验室人员的热情帮助,浮游植物种类鉴定由国家海洋局第一海洋研究所李艳老师完成,谨致谢忱!
[1]Taylor S R.Abundance of chemical elementsin the continental crust:a new table[J].Geochimica et Cosmochimica Acta,1964,28(8):1273-1285.
[2]Tria J,Butler E C V,Haddad P R,et al.Determination of aluminum in natural water samples[J].Analytica Chimica Acta,2007,588(2):153-165.
[3]Hydes D J,Liss P S.The behaviour of dissolved alu minu m in estuarine and coastal waters[J].Estuarine and Coastal Marine Science,1977,5(6):755-769.
[4]Kramer J,Laan P,Sarthou G,et al.Distribution of dissolved alu minu m in the high atmosphericinput region ofthe subtropical waters of the North Atlantic Ocean[J].M arine Chemistry,2004,88(3/4):85-101.
[5]M oran S B,M oore R M,W esterlund S.Dissolved alu minu m in the W eddel l Sea[J].Deep-Sea Research Part A.Oceanographic Research Papers,1992,39(3/4):537-547.
[6]Orians K J,Bruland K W.Dissolved aluminu m in the central North Pacific[J].Nature,1985,316(6027):427-429.
[7]Meseures C I,Vink S.On the use of dissolved alu minu m in surface waters to estimate dust deposition to the ocean[J].Global Biogeochemical Cycles,2000,14(1):317-327.
[8]Brown M T,Lippiatt S M,Bruland K W.Dissolved alu minu m,particulate aluminum,and si l icic acidin northern Gulf of Alaska coastal waters:Glacial/riverine inputs and extreme reactivity[J].M arine Chemistry,2010,122(1/4):160-175.
[9]MacKenzie E T,Stoffyn M,W ollast R.Alu minu m in seawater:control by biological activity[J].Science,1978,199(4329):680-682.
[10]Hydes D J.Aluminum in seawater:control by inorganic processes[J].Science,1979,205(4412):1260-1262.
[11]Orians K J,Bruland K W.The biogeochemistry of alu minu m in the Pacific Ocean[J].Earth and Planetary Science Letters,1986,78(4):397-410.
[12]M easures C I,Edmond J M.Alu minu m as a tracer of the deep outflow from the Mediterranean[J].Journal of Geophysical Research,1988,93(C1):591-595.
[13]Ren J L,Zhang J,Li J B,et al.Dissolved alu minu m in the Yel low Sea and East China Sea——Al as a tracer of Changj iang(Yangtze River)discharge and Kuroshio incursion[J].Estuarine,Coastal and Shelf Science,2006,68(1/2):165-174.
[14]Chou L,W ollast R.Biogeochemical behavior and mass balance of dissolved alu minu m in the western Mediterranean Sea[J].Deep-Sea Research PartⅡ:Topical Studies in Oceanography,1997,44(3/4):741-768.
[15]Middag R,de Baara H J W,Laan P,et al.Dissolved alu minum and the si l icon cycle in the Arctic Ocean[J].M arine Chemistry,2009,115(3/4):176-195.
[16]Ren J L,Zhang G L,Zhang J,et al.Distribution of dissolved alu minum in the Southern Yel low Sea:Influences of a dust storm and the spring bloom[J].Marine Chemistry,2011,125(1/4):69-81.
[17]Li E M,Ren J L,Yan L,et al.The biogeochemical behavior of dissolved aluminum in the southern Yel low Sea:influence ofthe spring phytoplankton bloom[J].Chinese Science Bulletin,2013,58(2):238-248.
[18]Stoffyn M.Biological control of dissolved alu minu m in seawater:experimental evidence[J].Science,1979,203(4381):651-653.
[19]王召伟,任景玲,闫丽,等.浮游植物对溶解态Al的清除作用实验研究[J].生态学报,2013,33(22):7140-7147.
Wang Zhaowei,Ren Jingl ing,Yan Li,et al.Prel iminary study on scavenging mechanism of dissolved aluminu m by phytoplankton[J].Acta Ecologica Sinica,2013,33(22):7140-7147.
[20]H udson R J M,M orel E MM.Distinguishing between extra-and intracel lular iron in marine phytoplankton[J].Limnology and Oceanography,1989,34(6):1113-1120.
[21]Tovar-Sanchez A,Sañudo-Wi lhelmy S A,Garcia-Vargas M,et al.A trace metal clean reagent to remove surface-bound iron from marine phytoplankton[J].Marine Chemistry,2003,82(1/2):91-99.
[22]Zhang J,Liu M G.Observations on nutrient elements and sulphatein atmospheric wet depositions overthe northwest Pacific coastal oceans-Yellow Sea[J].Marine Chemistry,1994,47(2):173-189.
[23]Zhang J,Zou L,W u Y,et al.Atmospheric wet deposition and changes in phytoplankton biomass in the surface ocean[J].Geophysical Research Letters,2004,31(11):L11310,doi:10.1029/2004G L019464.
[24]Zhang K,Gao HW.The characteristics of Asian-dust storms during 2000-2002:Erom the source to the sea[J].Atmospheric Environment,2007,41(39):9136-9145.
[25]Eu M Z,Wang Z L,Li Y,et al.Phytoplankton biomass size structure and its regulation in the Southern Yel low Sea(China):Seasonal variabi l ity[J].Continental Shelf Research,2009,29(18):2178-2194.
[26]张云.亚洲沙尘的输入对黄海和西北太平洋浮游植物生长的影响研究[D].青岛:中国海洋大学,2011.
Zhang Yun.Influence of Asian Dustinput on growth of M arine Phytoplankton in the Yel low Sea and Northwest Pacific Ocean[D].Qingdao:O-cean U niversity of China,2011.
[27]Zhang J,Xu H,Ren J L.Eluorimetric determination of dissolved alu minum in natural waters afterl iquid-l iquid extraction into n-hexanol[J].Analytica Chimica Acta,2000,405(1/2):31-42.
[28]M oran S B,M oore R M.Evidence from mesocosm studies for biological removal of dissolved alu minu m from sea water[J].Nature,1988,335(6192):706-708.
[29]Sañudo-Wi lhelmy S A,Tovar-Sanchez A,Eu E X,et al.The impact of surface-adsorbed phosphorus on phytoplankton Redfield stoichiometry[J]. Nature,2004,432(7019):897-901.
[30]Bonnet S,Guieu C.Dissolution of atmospheric iron in seawater[J].Geophysical Research Letters,2004,31(3),doi:10.1029/2003G L018423.
[31]Koning E,Gehlen M,Elank A M,et al.Rapid post-mortem incorporation of aluminu m in diatom frustules:evidence from chemical and structuralanalyses[J].Marine Chemistry,2007,106(1/2):208-222.
[32]Han Q,M oore J K,Zender C,et al.Constraining oceanic dust deposition using surface ocean dissolved Al[J].Global Biogeochemical Cycles,2008,22(2):G B2003,doi:10.1029/2007G B002975.
[33]Xu H,Zhang J,Ren J L,et al.Alu minu m in the macrotidal Yaluj iang estuary:Partitioning of Alalong the estuarine gradients and flux[J].Estuaries,2002,25(4):608-621.
[34]张国玲,任景玲,张继红,等.桑沟湾养殖区铝的分布及季节变化[J].海洋环境科学,2010,29(6):843-847.
Zhang Guol ing,Ren Jingl ing,Zhang Jihong,et al.Distributions and seasonal variations of alu minu m in Sanggou Bay[J].Marine Environ mental Science,2010,29(6):843-847.
[35]Tan S C,Shi G Y.Transport of a severe Ddst storm in M arch 2007 and impacts on chlorophyl l a concentration in the Yel low Sea[J].SO L A,2012,8:85-89.
[36]Mackie D S,Boyd P W,McTainsh G H,et al.Biogeochemistry ofiron in Austral ian dust:from eol ian upl ift to marine uptake[J].Geochemistry Geophysics Geosystems,2008,9(3):3-8.
[37]Jo C O,Lee J Y,Park K A,et al.Asian dustinitiated early spring bloom in the northern East/Japan Sea[J].Geophysical Research Letters,2007,34(5):L05602,doi:10.1029/2006G L027395.
[38]Gehlen M,Heinze C,M aier-Reimer E,et al.Coupled Al-Si geochemistry in an ocean general circulation model:a toolfor the val idation of oceanic dust deposition fields?[J].Global Biogeochemical Cycles,2003,17(1),doi:10.1029/2001G B001549.
[39]Shi J H,Zhang J,Gao H W,et al.Concentration,solubi l ity and deposition flux of atmospheric particulate nutrients over the Yel low Sea[J].Deep-Sea Research PartⅡ:Topical Studies in Oceanography,2013,97:43-50.
Scavenging mechanism of dissolved Al by phytoplankton:Inspiration from filed incubation experiments
Wang Zhaowei1,Ren Jingl ing1,Jin Jie1,Liu Su mei1,Shi Jinhui2
(1.Key Laboratory ofM arine Chemistry Theory and Technology,Ministry of Education,Ocean University of China,Qingdao 266100,China;2.Key Laboratory of M arine Environmental Science and Ecology,Ocean University of China,Ministry of Education of China,Qingdao266010,China)
The scavenging mechanism of dissolved Al by the growth of phytoplankton wasinvestigated through field incubation experiments in the present study.The experiments were allocated into 4 groups:control group,N/P/ Si-enrich ment group,N/P/Si/Al-enrich ment group and dust-enrich ment group.The results showed that the phytoplankton cell's growth rate ofthe control group was 0.48 d-1,the two enrich ment groupsincreased to 0.68 d-1,the growth rate ofthe dust-enrich ment group was between them.Nutrients were decl ining unti l exhausted in each groups during the incubation period.The concentration of dissolved Al decreased slowly in the control group and N/P/Si-enrich ment group.Dissolved Al concentrations decreased 40%during the exponential growth phase ofthe N/P/Si/Al-enrich ment group,and increased during decl ine phase.The concentration of dissolved Al increased steadily with timein the dust-enrich ment group.Total and intra-cellular Al was differentiated using oxalate reagent(Oxalate-ED TA-Citrate).Results showed that the total Al and the intra-cellular Al content in the phytoplankton cells of the control group was(3.6±0.1)mg/g and(2.1±0.3)mg/g,respectively.In the N/P/Si/Al-enrichment group,it was increased to(5.1±0.3)mg/g and(3.2±0.4)mg/g.The growth of phytoplankton can remove dissolved Al in the ocean significantly,and its primary removal mechanism is absorption by phytoplankton cells,supplemented by adsorption by phytoplankton cells.
dissolved Al;phytoplankton bloom;intra-cellular Al;fi led incubation experiments;Yellow Sea
X173
A
0253-4193(2015)02-0085-08
2014-07-01;
2014-08-22。
国家基础研究发展规划(2011CB409801);国家自然科学基金(41176096)。
王召伟(1988—),男,山东省济南市人,博士,主要从事痕量金属元素的海洋生物地球化学循环研究。E-mai l:weida4585@126.com
任景玲,教授,主要从事痕量元素的生物地球化学循环研究。E-mai l:renj ingl@ouc.edu.cn
