太平洋牡蛎中Cg-IL-17和Cg-TGF-β的表达及其免疫作用的研究
2015-10-22董洪亮刘乃国倪娜李彩玉郑静苗双
董洪亮,刘乃国*,倪娜,李彩玉,郑静,苗双
(1.滨州医学院附属医院临床医学实验室,山东滨州256600)
太平洋牡蛎中Cg-IL-17和Cg-TGF-β的表达及其免疫作用的研究
董洪亮1,刘乃国1*,倪娜1,李彩玉1,郑静1,苗双1
(1.滨州医学院附属医院临床医学实验室,山东滨州256600)
目的:探讨Cg-IL-17和Cg-T G E-β在太平洋牡蛎中表达的组织定位、免疫作用及其可能的机制。方法:采用Real-time PC R、原位杂交和图像分析的方法进行研究。结果:实时定量P C R研究表明,Cg-IL-17和Cg-T G E-β在弧菌感染后的太平洋牡蛎的鳃、外套膜、心包液、唇须、消化道和闭壳肌中表达明显增强。原位杂交实验结果表明,Cg-IL-17和Cg-T G E-β在未染菌组牡蛎的消化道、消化腺、鳃、唇须、外套膜中都有表达;染菌组以上各组织中的Cg-IL-17和Cg-T G E-β表达量均有显著增高,而消化道、消化腺中的表达量明显高于其他组织,闭壳肌中也均有微弱表达;感染弧菌前后两种基因在性腺中均未见表达。相关性分析发现这两种基因表达量在唇须和外套膜中具有明显的相关性。结论:Cg-IL-17和Cg-T G E-β具有多种生物学效应,且都参与了太平洋牡蛎的固有免疫反应;消化道可能是牡蛎主要的免疫反应器官之一;Cg-IL-17和Cg-T G E-β在唇须和外套膜中可能存在调控关系或协同作用。
太平洋牡蛎;牡蛎IL-17;牡蛎T G E-β;组织定位;免疫反应
董洪亮,刘乃国,倪娜,等.太平洋牡蛎中Cg-IL-17和Cg-T GE-β的表达及其免疫作用的研究[J].海洋学报,2015,37(2):104—110,doi:10.3969/j.issn.0253-4193.2015.02.011
Dong H ongl iang,Liu Naiguo,Ni Na,et al.Study on the expression and im mune function of Cg-IL-17 and Cg-T GE-βin the Pacific oyster,Crassostrea gigas[J].Haiyang Xuebao,2015,37(2):104—110,doi:10.3969/j.issn.0253-4193.2015.02.011
1 引言
在无脊椎动物的免疫系统中,对病原体的防御机制是固有免疫,涉及细胞防御和体液反应两个方面[1—3]。细胞防御,是指通过细胞吞噬作用,或在血淋巴中释放酶来进行防御[4—5]。体液反应,则是通过合成抗细菌肽或抗真菌肽来进行抵御[6]。这些肽主要有两类:防御肽和调节性细胞因子。IL-17和T GE-β可能就是其中的两种重要的调节性细胞因子[7—8]。
牡蛎有丰富的营养价值和药用价值,牡蛎中已经发现存在IL-17(Cg-IL-17)和T G E-β(Cg-T G E-β)两种基因,并发现细菌感染能够引起太平洋牡蛎中Cg-IL-17和Cg-T G E-β的表达增高,说明这两种基因可能都是牡蛎对抗病原体的早期反应基因[7,9]。但Cg-IL-17和Cg-T G E-β在哪些组织细胞中表达目前仍不清楚,因此研究太平洋牡蛎中Cg-IL-17和Cg-T G E-β基因表达的定位分布对了解太平洋牡蛎免疫反应机制及其免疫系统的进化都具有重要意义。本研究首次应用原位杂交技术研究Cg-IL-17和Cg-T G E-β表达的组织定位,并用Real-time PC R方法进行相互验证,探讨它们在太平洋牡蛎免疫反应中的作用及其可能机制。
2 材料与方法
2.1材料、试剂与引物
新鲜太平洋牡蛎购于水产市场,灿烂弧菌和漫弧菌购于中国海洋大学生命学院微生物实验室,M axima Eirst Strand cD N A Synthesis Kit for R T-qPC R,Maxima SY BR Green/Eluorescein qPCRM aster Mix(2×)购自Thermo公司,M yLabRPC R法DIG标记试剂盒购自北京美莱博医学科技有限公司。
应用Primer(version 5.0)软件,根据太平洋牡蛎细胞因子IL-17及T G E-β的基因序列,分析设计特异性引物。据太平洋牡蛎Actin基因序列,设计内参基因Actin的引物。引物有上海生工技术有限公司合成。引物序列见表1。

表1 本研究中所用引物序列Tab.1 The primer sequence for PCR amplification in this study
2.2太平洋牡蛎弧菌感染实验
取灿烂弧菌和漫弧菌两种新鲜菌液离心,去上清,灭菌的海水重悬菌体,分光光度计测O D550,配成1×108bacteria/100μL混合菌液,用于太平洋牡蛎染菌实验。
购买生长3年大小相近的太平洋牡蛎32只,随机分成两组,每组16只。在15℃灭菌海水中饲养适应24 h后进行实验。采用闭壳肌注射的方法,实验组每只注射1×108bacteria/100μL灿烂弧菌和漫弧菌混合菌液,对照组每只注射100μL灭菌的海水。12 h后,取各组组织进行后续实验。
2.3Real-time PCR法检测细胞因子Cg-IL-17、Cg-TGF-β的转录表达
2.3.1组织总R N A的提取及cD N A的合成
12 h后,从实验组和对照组各随机取8只,解剖剥离出外套膜、鳃、消化道、唇须、闭壳肌,研磨成粉状,按每50~100 mg组织加1 m L Trizol。抽取每只太平洋牡蛎的心包液,放入无R N A酶的离心管中,离心去上清,获得的细胞悬浮加入适量Trizol。按总R N A常规提取方法,提取各组织总R N A。用分光光度计测定R N A的浓度及纯度,琼脂糖凝胶电泳检测R N A完整性。用D NaseⅠ消化去除R N A中的D N A,用D Nase inactivation reagent终止反应后,离心收集无D N A污染的R N A,加入适量的R N A酶抑制剂。用M axima Eirst Strand cD N A Synthesis Kit进行反转录。合成的cD N A保存于-80℃,备用。
2.3.2Real-time PC R定量检测
以Actin作为内参基因,用Real-time PC R法对实验组和对照组各组织细胞因子Cg-IL-17和Cg-T G E-β的表达进行相对定量。反应体系为25μL。扩增反应条件:50℃2 min;95℃10 min;变性95℃15 s、退火55.8℃30 s、延伸72℃30 s,30个循环。所得数据用2-△△CT法进行统计分析。
2.4原位杂交法检测细胞因子(IL-17、TGF-β)的表达水平
2.4.1探针的合成
用引物P-IL-17-E/P-IL-17-R、P-T G E-β-E/PT G E-β-R,根据“PC R法DIG标记试剂盒”合成IL-17探针及T G E-β探针,分光光度计测探针浓度,-70℃保存备用。
2.4.2组织切片的制备
取实验组及对照组各组织,于4%多聚甲醛内固定48 h,常规脱水、透明、包埋、切片,切片厚度为4 μm,所用载玻片经多聚甲醛处理。
2.4.3原位杂交检测
对实验组和对照组每一组织均选取两张切片,一张用于探针杂交,另一张用于空白对照。经二甲苯脱蜡,常规梯度酒精水化,D EPC水平衡。用0.2 mol/L的H Cl处理后,再用蛋白酶K(7.5μg/m L)进行消化,0.2%的甘氨酸终止反应。而后经4%多聚甲醛固定,0.1%PBS洗涤。42℃在湿盒中,探针杂交组加杂交液(探针50 nmol/L),探针空白组加预杂交液(不加探针),用原位杂交专用盖玻片封片,42℃湿盒中杂交16~18 h。杂交后,依次用2×SSC/0.1%SDS、0.1 ×SSC/0.1%SDS进行洗涤。加入连接有碱性磷酸酶的抗地高辛抗体,常温下孵育1~2 h。N BP/BCIP显色液避光显色2~6 h。最后经0.1%核固红复染2 min,酒精梯度脱水后,二甲苯透明,封片。显微镜下观察、拍照,并用北京航空大学研制的M otic Med 6.0数码医学图像分析系统进行图像分析,所得数据用SPSS软件进行分析。
3 结果
3.1实时定量PCR实验结果
细胞因子Cg-IL-17 m R N A表达进行分析,结果显示,实验组鳃、外套膜、唇须、心包液中Cg-IL-17的转录水平增高,分别是对照组相应组织的1.95倍(p<0.05)、3.61倍(p<0.05)、4.69倍(p<0.05)和3.36倍(p<0.05);消化道、闭壳肌中Cg-IL-17的转录水平显著增高分别是对照组的28.44、38.85倍(p<0.01)(图1)。
细胞因子Cg-T G E-βm R N A表达进行分析,结果显示,实验组鳃、外套膜、唇须、心包液中Cg-T GE-β的转录水平增高,分别是对照组相应组织的3.73倍(p<0.01)、3.68倍(p<0.01)、2.06倍(p<0.05)和3.41倍(p<0.01)。消化道、闭壳肌中Cg-T G E-β的转录水平显著增高分别是对照组的6.11、6.54倍(p<0.01)(见图2)。

图1 real-time PC R实验中Cg-IL-17的m R N A表达(*p<0.05,**p<0.01)Eig.1 The m R N A expression of Cg-IL-17 by real-time PC R(*p<0.05,**p<0.01)
3.2原位杂交实验结果
细胞因子Cg-IL-17和Cg-T GE-β原位杂交实验结果表明,实验组和对照组的肠道、鳃、外套膜、唇须中均有阳性信号,且实验组阳性信号强于对照组。闭壳肌在对照组中未见阳性信号,实验组中有微弱的阳性信号。实验组和对照组中性腺均未见阳性表达信号(见图3A、图4A)。空白对照组各组织均未见阳性信号。
对原位杂交实验结果图像进行分析,实验组中细胞因子Cg-IL-17和Cg-T G E-β表达量均明显高于对照组(p<0.01)(见图3B、图4B),其中消化腺和肠道的表达量最高(p<0.01)。相关性分析发现,Cg-IL-17和Cg-T G E-β的表达量之间在唇须(r =0.772 602,p<0.05)和外套膜(r=0.756 731,p<0.05)中具有相关性,在其他组织中没有明显的相关性(p>0.05)。
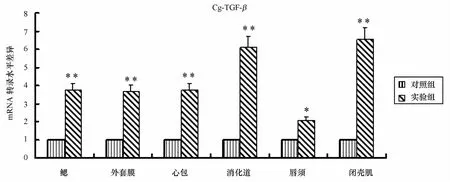
图2 real-time PC R实验中Cg-T GE-β的m R N A表达(*p<0.05,**p<0.01)Eig.2 The m R N A expression of Cg-T GE-βby real-time PC R(*p<0.05,**p<0.01)
4 讨论
本实验研究表明,太平洋牡蛎弧菌感染后Cg-IL-17和Cg-T G E-βm R N A在实验组的鳃、外套膜、唇须、消化道、闭壳肌、心包液中的表达与对照组相应组织相比明显增高,其中以消化道和闭壳肌增高最为明显。这与以往报道细菌感染后Cg-IL-17和Cg-T G E-β表达增高结果相似[7,9]。本研究原位杂交实验表明,Cg-IL-17和Cg-T G E-βm R N A在实验组消化道、消化腺、鳃、唇须、外套膜中的表达明显高于其在对照组相应组织中的表达,对照组闭壳肌未见阳性信号,而实验组闭壳肌中也只有微弱表达,性腺组织在对照组和实验组中均未见阳性信号。闭壳肌中这两种基因的表达在原位杂交和实时定量PCR检测中结果似乎不一致,这是因为实时定量PCR法扩增后比原位杂交方法敏感度要高,并且实时定量PC R方法只是相对定量,所用2-△△CT法反映的是实验组和对照组基因表达的倍数关系,因此结果并不矛盾。
Lelong等报道,T G E-β在太平洋牡蛎中具有广泛表达的模式,但在某种组织(唇须和鳃)表达量较高,说明它可能是具有多种效应的细胞因子,包括细胞生长和分化的调节[7]。本研究发现,细胞因子Cg-IL-17和Cg-T GE-β在牡蛎的多种组织中都表达,这也进一步说明两种细胞因子可能都具有多种生物学效应。染菌后实验组中细胞因子Cg-IL-17和Cg-T GE-β表达明显高于对照组相应组织中的表达,进一步证明这两种细胞因子均参与了牡蛎对抗病原体的固有免疫反应。
相关性分析发现,细胞因子Cg-IL-17和Cg-T G E-β表达量之间在唇须和外套膜中具有明显的相关性,而在其他组织中没有明显的相关性。说明在唇须和外套膜中Cg-IL-17及Cg-T G E-β这两种细胞因子间存在某种联系。W u等报道,珍珠贝中的PfIL-17基因与Cg IL-17基因结构相似,PfIL-17可能涉及激活N E-кB信号通路对抗细胞外病原体的感染[10]。Lelong等研究发现,Cg-T G E-β启动子结构中发现特异的保守基序,如Rel/N EкB基序,Cg-T G E-β及其特定的T G E-β通路,可以刺激一些体液细胞因子基因的表达[7]。Lemaitre等报道在缺乏适应性免疫的无脊椎动物中,Toll和Imd通过N E-кB发挥作用的信号通路被认为是宿主防御的最重要的信号通路[11]。综上所述,我们推测在病原体防御过程中,细胞因子Cg-IL-17和Cg-T G E-β可能通过N E-кB发挥作用的信号通路联系在一起,它们之间可能存在调控关系或协同作用,这需要进一步研究验证。
本研究两种实验方法均证明,染菌后牡蛎消化道中细胞因子Cg-IL-17和Cg-T G E-β表达增高最为明显,而且原位杂交结果提示消化道中两种基因的表达量也高于其他组织,说明消化道可能是牡蛎主要的免疫反应器官之一,其他组织包括鳃、外套膜、唇须,也参与机体的免疫应答。
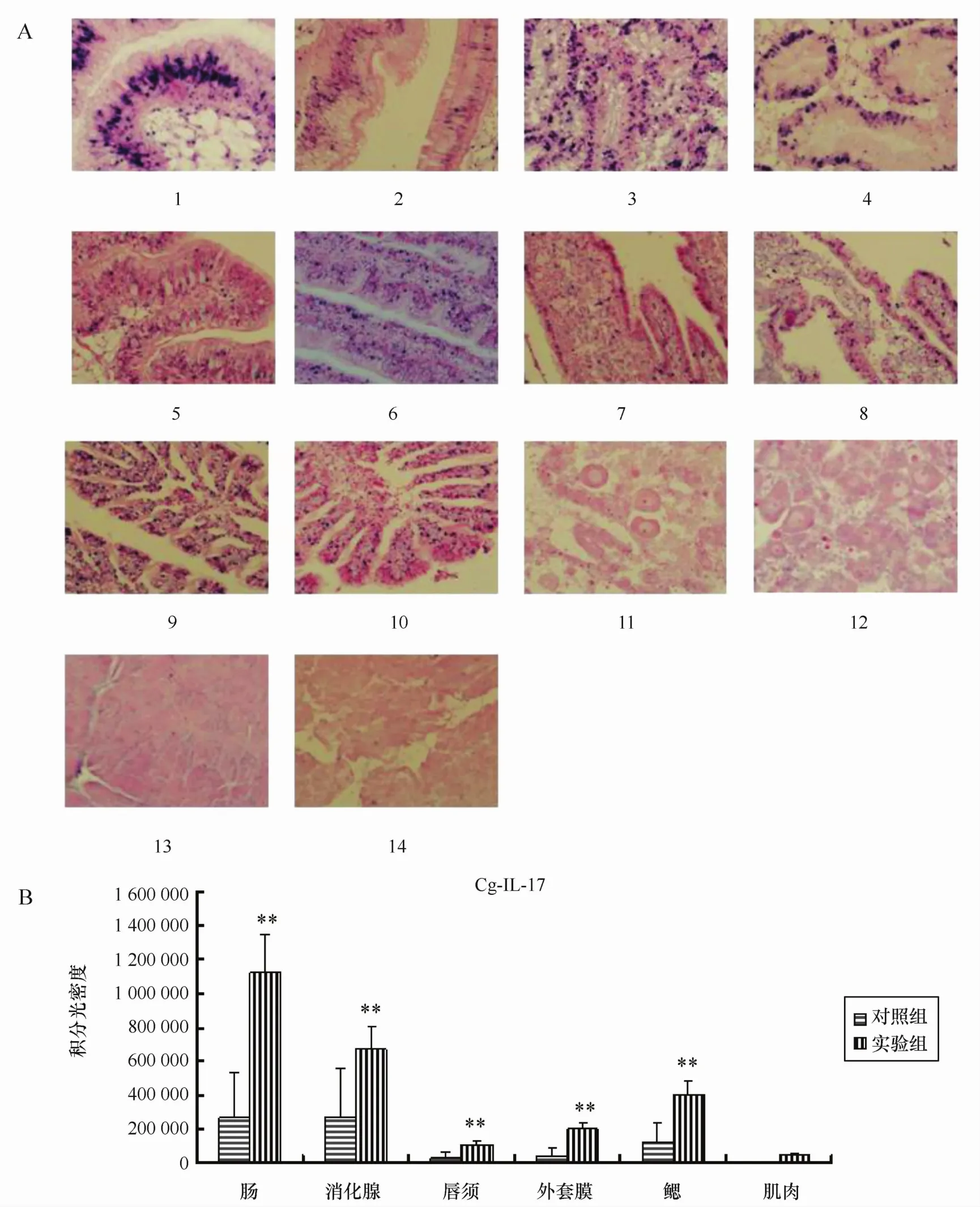
图3 原位杂交实验中Cg-IL-17 m R N A的表达结果Eig.3 The results of Cg-IL-17 m R N A expression by in situ hybridization
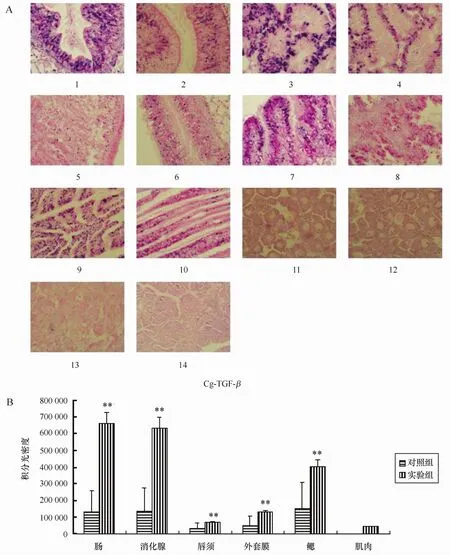
图4 原位杂交实验中Cg-T GE-βm R N A的表达结果Eig.4 The results of Cg-T GE-βm R N A expression by in situ hybridization
[1]Nicholas H R,Hodgkin J.Responsestoinfection and possible recognition strategiesin theinnateim mune system ofCaenorhabditiselegans[J].M ol Im munol,2004,41(5):479-493.
[2]Hoffmann J A,Reichhart J M.Crosophilainnate im munity:an evolutionary perspective[J].Nat Im munol,2002,3(2):121-126.
[3]Mi l let A C M,E wbank J J.Im munity inCaenorhabditiselegans[J].Curr Opin Im munol,2004,16(1):4-9.
[4]Pipe R K.H ydrolytic enzymes associated with the granular haemocytes of the marine musselM ytilusedulis[J].Histochem J,1990,22(11):595 -603.
[5]Cheng T C,Rodrick G E.Lysosomal and other enzymesin the hemolymph ofCrassostrea virginicaandMercenaria mercenaria[J].Comp Biochem Physiol B,1975,52(3):443-447.
[6]Mitta G,Vandenbulcke E,Roch P.Originalinvolvement of antimicrobial peptidesin musselinnate im munity[J].EEBS Lett,2000,486(3):185-190.
[7]Lelong C,Badariotti E,Le Quéré H,et al.Cg-T G E-β,a T G E-β/activein homologuein the Pacific Oyster Crassostrea gigas,isinvolved in im munity against Gram-negative microbialinfection[J].Developmental and Comparative Im munology,2007,31(1):30-38.
[8]Lieber M J,Luckhart S.Transforming growth factor-βs and related gene productsin mosquito vectors of human malaria parasites:signal ing architecture forim munological crosstalk[J].M ol Im munol,2004,41(10):965-977.
[9]Roberts S,Gueguen Y,de Lorgeri l J,et al.Rapid accu mulation of an interleukin 17 homolog transcript inCrassostrea gigashemocytes fol lowing bacterial exposure[J].Dev Comp Im munol,2008,32(9):1099-1104.
[10]W u S Z,H uang X D,Li Q,et al.Interleukin-17 in pearl oyster(Pinctada fucata):M olecular cloning and functional characterization[J].Eish& Shel lfish Im munology,2013,34(5):1050-1056.
[11]Lemaitre B,Hoffmann J.The host defense ofCrosophila melanogaster[J].Annu Rev Im munol,2007,25:697-743.
Study on the expression and im mune function of Cg-IL-17 and Cg-TGF-βin the Pacific oyster,Crassostrea gigas
Dong H ongl iang1,Liu Naiguo1,Ni Na1,Li Caiyu1,Zheng Jing1,Miao Shuang1
(1.Clinical Medicine Laboratory,Einzhou Medical University Affiliated H ospital,Einzhou256600,China)
Objective:to explore the tissue local ization,im mune function and the possible mechanism of Cg-IL-17 and Cg-T G E-βinCrassostrea gigas.Methods:using real-time PC R,in situhybridization and image analysis methods,the expressions of Cg-IL-17 and Cg-T GE-βwere studied.Results:the results ofreal-time PC R showed thatthe expressions of Cg-IL-17 and Cg-T GE-βwere up-regulated in the tissues ofC.gigas,including gi lls,mantle edge,labial palp,digestive tract,adductor muscle after being infected withVibrio,and so did in pericardiacl iquor.The results ofin situhybridization assay indicated that both Cg-IL-17 and Cg-T G E-βexpressed in tissues of uninfected group,including digestive tract,digestive glands,gi lls,labial palp and mantle edge.InVibrioinjected oysters,the expressions of Cg-IL-17 and Cg-T GE-βin above-mentioned tissues increased obviously compared with the same control tissues.The highest expressions of the two genes were found in digestive tract and digestive glands,and the weak expressions were appearedin adductor muscle.But no positive signal wasfound in gonad ofthe two groups.Correlation analysis impl ied that thereis significant correlation between Cg-IL-17 and Cg-T G E-βin labial palp and mantle edge.Conclusion:Cg-IL-17 and Cg-T G E-βpossess a variety of biological effects.Their expressions markedly increased inC.gigasafterVibrio-infection,suggesting that both cytokines take part in the innate im mune response.The digestive tract may be one oftheimportantim mune organs ofCrassostrea gigas,because the strongest signals of the two genes were found in the tissue.There is regulatory or synergistic action between Cg-IL-17 and Cg-T GE-βin labial palp and mantle edge probably.
Pacific oyster;Cg-IL-17;Cg-T GE-β;tissue local ization;im mune response
S917.4
A
0253-4193(2015)02-0104-07
2014-05-05;
2014-06-03。
山东省高等学校科技计划项目:牡蛎药用基因IL-17的体外表达和组织定位研究(J10LC81)。
董洪亮(1987—),男,山东省烟台市人,主要从事细胞分子生物学研究。E-mai l:hongl iang.234@163.com
刘乃国,男,教授,主要从事细胞分子生物学研究。E-mai l:l iunaiguo1966@163.com
