重组瑞替普酶包涵体制备及其体外复性
2015-10-15王俊雄关怡新姚善泾
王俊雄,关怡新,姚善泾
重组瑞替普酶包涵体制备及其体外复性
王俊雄,关怡新,姚善泾
(浙江大学化学工程与生物工程学院,浙江杭州 310027)
将携带重组瑞替普酶(reteplase, rt-PA)的质粒成功转化到大肠杆菌BL21(DE3)后,诱导表达获得包涵体,考察了诱导剂浓度、培养温度和培养时间等条件对目标蛋白表达量的影响。在此基础上,对高效表达的rt-PA包涵体体外复性过程进行了详细研究。首先利用单因素实验考察了复性液pH、GSH浓度、GSH/GSSG比例、蛋白浓度等各种复性条件对复性效果的影响;并结合正交实验设计,进一步研究了高蛋白浓度下复性后rt-PA酶活变化情况。以0.2 mmol·L-1IPTG诱导,在33℃下培养6 h,每升发酵液约可获得1.7 g粗制包涵体。适宜的复性条件为蛋白浓度50mg·ml-1,pH 10.0,GSH浓度1 mmol·L-1,GSH/GSSG比例8,复性收率为87.2%。影响高蛋白浓度下rt-PA复性的关键因素为复性液初始pH及GSH浓度,在800mg·ml-1蛋白浓度下复性后rt-PA比活可达7.54×104IU·mg-1,荧光光谱分析结果表明复性后rt-PA恢复了其天然态结构。
生物分离;蛋白质复性;二硫键;正交实验设计;瑞替普酶
引 言
当前,血栓栓塞类疾病已经成为威胁人类健康的头号杀手,发病率一直居高不下,是当代医学领域研究的热点之一,因而研制生产高效的溶栓药物变得非常迫切[1-2]。瑞替普酶(reteplase, rt-PA)作为第三代溶栓药物代表,是第二代溶栓药物——组织型纤溶酶原激活剂(tissue-type plasminogen activator, t-PA)的缺失变异体,它在t-PA分子原有结构的基础上进行了个别功能域的删除,而仅保留kringle Ⅱ、蛋白酶两个功能域及N端的3个氨基酸[3]。与t-PA相比,rt-PA具有药物半衰期长、溶栓作用强、副作用小等优点,因而引起了人们的广泛关注[4]。从分子结构上看,rt-PA是一条由355个氨基酸残基组成的单链非糖基化蛋白,相对分子质量约39×103,包含9对二硫键[5-6]。众多的自由巯基使其在大肠杆菌中表达时极易发生二硫键的错配,造成目标蛋白错误折叠,以不溶且无活性的包涵体形式存在,需要通过体外重折叠复性来恢复其天然构象[7]。
稀释复性法是一种简单快捷的蛋白质复性方法,也是其他各种复性方法的研究基础。Harris等[8]最早采用稀释复性法对rt-PA进行体外复性研究。此后,研究者们[9-10]通过向复性体系中添加还原型/氧化型谷胱甘肽(GSH/GSSG)、巯基乙醇等折叠助剂,试图通过调节复性环境中的氧化还原电位来提高rt-PA的复性收率,但均在较低蛋白浓度下进行,难以达到工业化要求。一般而言,影响复性过程的因素众多,且各操作条件具有一定的交互作用。针对瑞替普酶的结构特点,本文拟采用单因素实验并结合正交实验设计确定影响rt-PA体外复性的重要因素,并着重对高蛋白浓度条件下的复性过程进行优化,以期获得较高活性的rt-PA,同时为其他复性方法提供基础数据。
1 材料和方法
1.1 材料
重组rt-PA质粒载体为pET-28a,T7启动子,含卡那霉素抗性标记,宿主菌为BL21(DE3),由本实验室保存。人t-PA标准品购自上海飞轩生物科技有限公司,rt-PA标准品购自德国Boehringer-Ingelheim公司,纤维蛋白原与凝血酶购自美国Sigma公司,二硫苏糖醇(DTT)、乙二胺四乙酸(EDTA)购自阿拉丁试剂,蛋白酶抑制剂购自上海罗氏制药有限公司,胰蛋白胨、酵母提取物、三(羟甲基)氨基甲烷(Tris)、尿素、卡那霉素、Triton X-100、还原及氧化型谷胱甘肽(GSH/GSSG)购自上海生工,其余试剂均为国产分析纯。
1.2 重组rt-PA的发酵及诱导表达
将转化了重组质粒pET-28a/rt-PA的BL21(DE3)菌株以0.1%的比例接种至5 ml LB种子培养基(含50mg·ml-1卡那霉素),于37℃摇床中200 r·min-1振摇培养12 h;然后取1%种子液转接至150 ml 2×YT发酵培养基(含50mg·ml-1卡那霉素),继续振摇培养至OD600约为1.0,加入0.3 mmol·L-1IPTG进行诱导,在37℃下培养6 h。并对诱导剂浓度、培养温度和培养时间进行优化。
1.3 重组rt-PA包涵体制备及纯化
发酵液于4℃下6000 r·min-1离心10 min收获菌体,菌体经Buffer A(100 mmol·L-1Tris-HCl,100 mmol·L-1NaCl,10 mmol·L-1EDTA,pH 8.0)洗涤重悬,向每100 ml 菌悬液中加入20 mg蛋白酶抑制剂,冰浴超声破碎14 min(超声3 s,间隔6 s,功率350 W),4℃下8000 r·min-1离心15 min,收获粗包涵体沉淀。沉淀经Buffer B(100 mmol·L-1Tris-HCl,150 mmol·L-1NaCl,2 mol·L-1urea,0.5% Triton X-100,1 mmol·L-1EDTA,pH 8.0)洗涤1~2次后,再经水洗1次,4℃下8000 r·min-1离心15 min,收获的沉淀即为纯化的rt-PA包涵体。
1.4 重组rt-PA包涵体的溶解及重折叠复性
将纯化后包涵体按1:20(质量:体积)的比例用Buffer C (100 mmol·L-1Tris-HCl,8 mol·L-1urea,150 mmol·L-1DTT,1 mmol·L-1EDTA,pH 9.0)溶解,于磁力搅拌器上搅拌5 h后,4℃下10000 r·min-1离心30 min,透析过夜除去DTT,得到rt-PA包涵体变性液。将此变性液以一定稀释倍数加至Buffer D (100 mmol·L-1Tris-HCl,1.5 mol·L-1urea,1 mmol·L-1GSH,0.25 mmol·L-1GSSG,1 mmol·L-1EDTA,pH 10.0)中,于25℃的摇床中120 r·min-1振荡复性24 h,测定复性后蛋白浓度和活性。采用单因素实验并结合正交实验设计对rt-PA体外重折叠复性过程进行优化。
1.5 分析方法
1.5.1 蛋白浓度测定 采用SDS-PAGE[11]对蛋白表达进行分析,其中分离胶浓度为12%,浓缩胶浓度为4%。Gel Doc 2000凝胶图像处理系统对电泳图进行分析,确定目标蛋白含量。以牛血清白蛋白(BSA)为标准品,采用考马斯亮蓝法测定蛋白浓度[12]。
1.5.2 rt-PA活性测定 采用纤维蛋白平板溶圈法(fibrin agarose plate assay, FAPA)测定复性后rt-PA活性[9,13-14]。将0.02 g纤维蛋白原溶于5 ml生理盐水,同时将0.083 mg凝血酶溶于1 ml生理盐水,分别于37℃水浴加热10 min后混匀。另将0.07 g琼脂糖溶于7 ml生理盐水,加热至沸后冷却,与纤维蛋白溶液混匀,缓慢倒入平板。待凝固后,打孔置于4℃备用。首先绘制FAPA法标准曲线,吸取不同比活的人t-PA标准品20ml滴于孔中,将加盖的平板置于37℃培养箱温育16 h后,用游标卡尺分别测量溶圈相互垂直的两直径1与2,以其乘积的对数(lg12)为纵坐标,以人t-PA单位活性的对数为横坐标绘制标准曲线,并线性拟合得式(1),其相关系数为0.9965。
=0.2082+1.5279 (1)
待测rt-PA依上述方法操作,将测得的1与2代入式(1),即得对应的单位活性,再根据测得的蛋白浓度计算得rt-PA比活(IU·mg-1),将测得的比活除以标准品比活定义为rt-PA的复性收率。所有实验均重复3次,实验结果取平均值,并计算误差限。
1.5.3 rt-PA结构分析 以rt-PA标准品作为对照,采用荧光光谱法分析复性后rt-PA结构变化,激发波长为295 nm,发射波长记录范围为280~460 nm。
2 结果与讨论
2.1 rt-PA的发酵条件优化
2.1.1 诱导剂浓度的确定 将种子液接种于发酵培养基中振摇培养至OD600约为1.0后,分别加入不同浓度(0.05、0.1、0.2、0.3、0.5、1 mmol·L-1)的IPTG诱导rt-PA表达,在37℃下培养6 h,收获菌体。所得的全细胞样品经Buffer A重悬,SDS-PAGE分析蛋白表达,对比不同诱导剂浓度对rt-PA表达量的影响,结果如图1所示。结果表明,诱导剂IPTG浓度对rt-PA表达量影响不大,综合蛋白表达量和诱导剂成本,确定合适的诱导剂浓度为0.2~0.3 mmol·L-1。
2.1.2 培养温度的确定 将种子液接种于发酵培养基中摇床培养至OD600约为1.0后,加入终浓为0.3 mmol·L-1的IPTG诱导rt-PA表达,分别于不同温度(20、25、28、30、33、37℃)下培养6 h,收获菌体。对比不同培养温度对蛋白表达量的影响,SDS-PAGE结果如图2所示。结果表明,培养温度对rt-PA的影响较显著,低于28℃的培养温度不利于菌体的生长和目标蛋白的积累,确定合适的培养温度为33~37℃。
2.1.3 培养时间的确定 将种子液接种于发酵培养基中摇床培养至OD600约为1.0后,加入终浓为0.3 mmol·L-1的IPTG,于37℃摇床分别培养不同时间(1、2、3、4、5、6、7、8 h)后收获菌体。对比不同培养时间对蛋白表达量的影响,SDS-PAGE结果如图3所示。结果表明,当培养时间延长至3 h后,rt-PA蛋白表达量明显提高,6 h时达到最大值,之后,随着培养时间的延长rt-PA表达量变化不大,故确定6 h为合适的培养时间。
2.2 rt-PA包涵体的分离纯化
以上述优化的诱导表达条件对rt-PA进行发酵培养,将破胞液、破胞上清与沉淀、包涵体洗涤液上清与沉淀分别用SDS-PAGE进行分析,结果见图4。由图可知,破胞液中表达产物主要位于39×103附近,且离心后大多集中于沉淀中,说明rt-PA主要以包涵体形式存在。经测定,每升发酵液约可获得1.7 g粗制包涵体,其中rt-PA占45%左右(条带3)。一般而言,粗制包涵体中除目标蛋白外,还含有核酸、脂类、脂多糖和杂蛋白等杂质,采用含EDTA、尿素、Triton X-100和NaCl的洗涤液可以在一定程度上提高目标蛋白的纯度。由图4可知,用Buffer B洗涤一次后即可除去大部分杂质,将目标蛋白纯度提高到68%,而二次洗涤及水洗的效果并不明显(条带4~7)。另外,包涵体变性溶解后,纯度将进一步提高到85%以上(条带8)。
2.3 单因素实验考察影响rt-PA体外复性过程的重要参数
为了将溶解后的变性蛋白最大程度地重折叠至天然构象,本文采用稀释法对其进行体外复性,使其逐步消除变性因素,恢复生物活性。在蛋白质复性过程中,不同的目标蛋白对复性环境有特定的要求。鉴于rt-PA含有9对二硫键,在完全还原的状态下,其18个自由巯基[15]理论上存在34459425种二硫键配对可能性,因此其体外复性过程具有巨大的挑战性。据报道[16],在复性体系中加入1~2 mol·L-1的尿素可以提高复性收率,且在一定程度上阻碍变性蛋白的聚集反应。另外,从工业化角度出发,复性过程通常在室温(25℃)下进行[17]。考虑到单因素实验具有简单易行且直观清晰等优点,本研究针对影响复性过程的几个重要因素,包括复性pH、GSH浓度、GSH/GSSG比例、蛋白浓度等进行了详细研究,旨在为后续的正交实验设计提供合理的数据范围。
2.3.1 rt-PA复性动力学 在蛋白质重折叠过程中,酶活总是伴随着分子空间结构的形成而变化,然而对于富含二硫键蛋白而言,其采用何种方式折叠成具有活性的天然态构象的机理仍有待研究。本文首先在初始条件下(蛋白浓度100mg·ml-1,GSH浓度1 mmol·L-1,GSH/GSSG比例4,尿素浓度1.5 mol·L-1,pH 10.0,温度25℃)对rt-PA进行稀释复性,考察其酶活随时间的变化,其中0~5 h期间每隔1 h取样测定活性,而后每隔2 h取样,结果如图5所示。在复性初始时,去折叠多肽链迅速形成具有一定活性、包含二级结构甚至三级结构的折叠中间体,此后蛋白质结构缓慢调整,在分子内疏水作用力推动下进行二硫键的重新配对,促使更多活性中心的形成,但由于分子间疏水聚集的存在,这个过程将需要数小时来完成,表现为复性液酶活随时间缓慢上升,24 h后基本达到平衡。
2.3.2 复性pH对rt-PA复性过程的影响 配制不同pH(pH=9.0,9.5,10.0,10.5)的Buffer D,将脱除DTT的rt-PA包涵体变性液缓慢加入其中,控制蛋白终浓度为100mg·ml-1,复性24 h。复性缓冲液pH对rt-PA稀释复性的影响情况如图6所示。由图可知,当pH增加到10.0~10.5时,蛋白活性显著提高。一般而言,碱性条件有利于二硫键的形成,而酸性条件有利于二硫键的打开。另外,由于rt-PA二硫键对数较多,分子结构较稳定,已经完成正确配对的蛋白分子即便处于较强的碱性条件下也不易变性失活[18]。
2.3.3 GSH浓度对rt-PA复性过程的影响 在其余组分不变的情况下,将Buffer D中的GSH浓度分别改变为0.5、1、2、4和8 mmol·L-1,复性24 h。GSH浓度对rt-PA稀释复性的影响情况如图7所示。由图可知,当GSH浓度为0.5~2 mol·L-1时,复性收率较高;特别地,当GSH浓度为1 mmol·L-1时复性收率近50%,可见一定浓度范围的GSH对富含二硫键蛋白质的正确折叠至关重要。复性过程中,GSH起着催化二硫键异构的作用,可促进二硫键重排,然而过高的GSH浓度往往导致二硫键氧化形成速率减慢,最终降低复性效率[19]。
2.3.4 GSH/GSSG比例对rt-PA复性过程的影响
将Buffer D中GSH/GSSG比例分别调节为1、2、4、8和16,其他条件不变,复性24 h。GSH/GSSG比例对rt-PA稀释复性的影响如图8所示。由图可知,当GSH/GSSG比例位于4~16这一较宽的范围内时,复性后蛋白活性均较高,并在比例为8时达到最大值。这是因为,富含二硫键的蛋白对复性体系中的氧化还原环境要求更为苛刻。GSH/GSSG比例越高,复性体系的还原能力就越强,但过高的比例不仅不利于二硫键形成,且会减慢二硫键的形成速率;相反,GSH/GSSG比例越低,复性体系的氧化能力就越强,二硫键形成速率和蛋白质折叠速率都会加快,但过低的比例将导致二硫键错配概率增加,造成没有活性的蛋白和聚集体的增多,此外强氧化性环境也不利于错配二硫键进行异构以形成有活性的蛋白质[20]。在上述优化条件下,复性后rt-PA的比活与活性收率可分别达到2.94×105IU·mg-1和50.7%,比优化前提高了67%[9]。
2.3.5 蛋白浓度对rt-PA稀释复性的影响 将rt-PA包涵体变性液(初始蛋白浓度2 mg·ml-1)按不同稀释倍数加至Buffer D中,使终浓度分别为50、100、300、500、800、1000和1500mg·ml-1,复性24 h。不同蛋白浓度对复性的影响情况如图9所示。由图可知,当蛋白浓度为50mg·ml-1时,复性收率可达87.2%,而随着蛋白浓度的增加,活性呈现迅速下降趋势。当蛋白浓度提高到800mg·ml-1时,复性样品的活性收率仅为8.6%。这主要是因为随着蛋白折叠的进行,折叠中间体往往会暴露出大量疏水残基,在分子运动的驱使下相互聚集形成沉淀,从而丧失了生物活性,而蛋白浓度的升高加剧了蛋白质聚集程度,因此必须将复性过程蛋白浓度控制在较低水平[21]。但是,过低的蛋白浓度又会造成复性液的大量消耗,增加活性蛋白回收的难度。
2.4 利用正交实验设计考察高蛋白浓度下的rt-PA复性效果
为缩短复性后蛋白的纯化流程,降低生产成本,更好地适应工业化的需求,在初步确定了复性液pH、GSH浓度以及GSH/GSSG比例为复性过程中关键因素的情况下,本文进一步设计了3因素3水平的正交实验[22],对高蛋白浓度(800mg·ml-1)下的复性过程进行了研究。其中,3因素分别为复性液pH(A)、GSH浓度(B)以及GSH/GSSG比例(C),具体见表1。
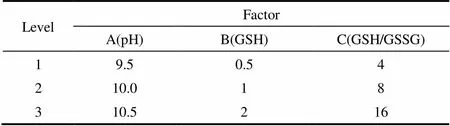
表1 rt-PA复性过程正交实验设计因素与水平Table 1 Factors and levels of orthogonal experimental design in rt-PA refolding
为了避免由于局部蛋白浓度过高引发的聚集沉淀,本研究采用流加操作[23],室温下用恒流泵以0.5 ml·min-1的流速将待复性样品连续流加至复性缓冲液中,同时缓慢搅拌,使变性蛋白浓度始终维持在较低水平,从而减弱了蛋白间的疏水作用,降低了聚集体生成的可能性,提高了复性效率。以复性后酶液比活为指标,采用直观分析方法分析实验结果,优化筛选出各关键因素的最佳水平,以提高高蛋白浓度下的复性效果。将包涵体变性液分别加入按表1所配制的不同复性缓冲液中,使蛋白终浓度控制在800mg·ml-1,流加结束后置于25℃摇床中振荡复性24 h,测定复性后蛋白活性,结果汇总于表2中。
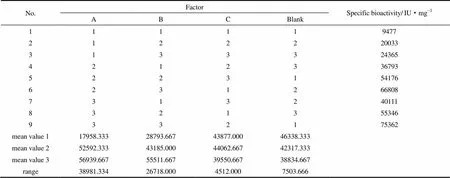
表2 rt-PA复性过程正交实验设计直观分析Table 2 Intuitive analysis of orthogonal experimental design in rt-PA refolding
直观分析结果表明,各复性条件的最佳组合为A3B3C2,即复性液pH为10.5,GSH浓度为2 mmol·L-1,GSH/GSSG比例为8;极差大小为A>B>C,说明各影响因素的主次顺序为pH>GSH浓度> GSH/GSSG比例。复性后rt-PA比活为7.54×104IU·mg-1,复性收率从优化前的8.6%提高到13.0%。方差分析结果见表3。由表3可知,因素A(复性液pH)是rt-PA体外复性过程的关键因素,因素B(GSH浓度)也具有一定的影响,相比之下,因素C(GSH/GSSG比例)并非显著因素。这说明在高蛋白浓度下,复性液pH对rt-PA复性效果的影响要高于氧化还原电势的影响。另外,对800mg·ml-1初始蛋白浓度而言,合适的复性液pH和GSH浓度均略高于低蛋白浓度下的水平,说明高浓度蛋白的重折叠复性需要更为严苛的条件,适当提高pH与氧化还原对浓度更有利于rt-PA分子中二硫键的正确形成,同时降低分子间的疏水作用,提高复性收率。

表3 rt-PA复性过程正交实验设计方差分析Table 3 Variance analysis of orthogonal experimental design in rt-PA refolding
2.5 复性rt-PA的荧光光谱分析
蛋白质的荧光光谱能提供rt-PA中色氨酸残基周围微环境的变化信息,从而反映其复性过程中结构上的变化。当rt-PA分子在295 nm处被激发时,得到的即为色氨酸的发射光谱,变性及复性后的rt-PA荧光光谱分析结果如图10所示。在体外复性过程中,当变性的rt-PA重折叠为天然态时,裸露于溶液中的色氨酸残基逐渐包埋于分子内部疏水区域,其所处的微环境极性降低,从而引起最大发射波长max向短波长移动,荧光强度减弱。由图10可知,变性rt-PA的max为352 nm,而复性后rt-PA的max为340 nm,与天然态rt-PA一致,说明复性后的rt-PA已形成了正确的二硫键配对,恢复其天然态构象。
3 结 论
本文对重组瑞替普酶(rt-PA)包涵体的制备及体外复性过程进行了较为详尽的研究,确定了最优的表达条件以及影响rt-PA体外复性过程的重要参数,并通过正交实验设计对高浓度下rt-PA的体外复性过程进行了优化。本文研究结果表明,通过对复性过程的优化,采用稀释复性法处理如rt-PA等富含二硫键的蛋白是切实可行的,并且可以获得较高的比活,而高蛋白浓度下体外复性由于折叠过程中大量疏水基团的暴露导致产生大量的聚集沉淀,不可避免地面临收率降低的问题。在工业生产过程中,可适当提高pH与氧化还原对浓度,来获得相对较高的复性收率。此外,rt-PA复性收率的进一步提高仍需要进行后续复性方法的探索和深入研究。
References
[1] Nicholas J A. Management of postoperative complications: cardiovascular disease and volume management [J]., 2014, 30(2): 293-301
[2] Gawryszewski V P, de Souza M. Mortality due to cardiovascular diseases in the Americas by region, 2000—2009 [J]., 2014, 132(2): 105-110
[3] Pennica D, Holmes W E, Kohr W J, Harkins R N, Vehar G A, Ward C A, Bennett W F, Yelverton E, Seeburg P H, Heyneker H L, Goeddel D V, Collen D. Cloning and expression of human tissue-type plasminogen activator cDNA in[J]., 1983, 301(5897): 214-221
[4] Kohnert U, Rudolph R, Verheijen J H, Weening-Verhoeff E J, Stern A, Opitz U, Martin U, Lill H, Prinz H, Lechner M, Kresse G B, Buckel P, Fischer S. Biochemical-properties of the kringle 2 and protease domains are maintained in the refolded t-PA deletion variant BM 06.022 [J]., 1992, 5(1): 93-100
[5] Topol E, Califf R, Ohman E. A comparison of reteplase with alteplase for acute myocardial infarction [J]., 1997, 337(16): 1118-1123
[6] Gao L, Zhang C, Li L L, Liang L, Deng X, Wu W T, Su Z G, Yu R. Construction, expression and refolding of a bifunctional fusion protein consisting of C-terminal 12-residue of hirudin-PA and reteplase [J]., 2012, 31(4): 328-336
[7] Obukowicz M G, Gustafson M E, Junger K D, Leimgruber R M, Wittwer A J. Secretion of active kringle-2-serine protease in[J]., 1990, 29(41): 9737-9745
[8] Harris T, Patel T, Marston F, Little S, Emtage J S, Opdenakker G, Volckaert G, Rombauts W, Billiau A, Desomer P. Cloning of cDNA coding for human tissue-type plasminogen-activator and its expression in[J]., 1986, 3(3): 279-292
[9] Feng Changgen(冯长根), Chen Man(陈嫚),Ren Qisheng(任启生),Song Xinrong(宋新荣). Study on expression, renaturation and purification of reteplase [J].(中国药学杂志), 2004(7): 74-76
[10] Khodabakhsh F, Zia M F, Moazen F, Rabbani M, Sadeghi H. Comparison of the cytoplasmic and periplasmic production of reteplase in[J]., 2013, 43(7): 613-623
[11] Sambrook J, Russell D W. Molecular Cloning - A Laboratory Manual [M].3rd ed. New York: Cold Spring Harbor Laboratory Press, 2001
[12] Bradford M M. Rapid and sensitive method for quantitation of microgram quantities of protein utilizing principle of protein-dye binding [J]., 1976, 72(1/2): 248-254
[13] Luo X G, Tian W J, Ni M, Jing X L, Lv L H, Wang N, Jiang Y, Zhang T C. Soluble expression of active recombinant human tissue plasminogen activator derivative (K2S) in[J]., 2011, 49(6): 653-657
[14] Sun Haibo(孙海波), Liang Bufeng(梁布峰), Wang Junyan(王君艳),Ling Jianya(凌建亚), Wang Ge(王革). Comparative study on assay methods for reteplase activity [J].(食品与药品), 2007(9): 4-7
[15] Yu Rong(余蓉), Zhang Guifeng(张贵锋), Gao Ling(高玲), Su Zhiguo(苏志国), Wu Wutong(吴梧桐). Primary structure determination of hirudin and reteplase fusion protein by LC/ESI-MS/MS spectrometry [J].(药学学报), 2008(7): 737-742
[16] Fischer B, Sumner I, Goodenough P. Isolation, renaturation and formation of disulfide bonds of eukaryotic proteins expressed inas inclusion-bodies [J]., 1993, 41(1): 3-13
[17] Guise A D, West S M, Chaudhuri J B. Protein foldingand renaturation of recombinant proteins from inclusion bodies [J]., 1996, 6(1): 53-64
[18] Lin X L, Umetsu T. The high pH and pH-shift refolding technology [J]., 2010, 11(3): 293-299
[19] Luo M, Guan Y X, Yao S J. Statistical optimization and multiple objective programming of lysozyme refolding catalyzed by recombinant DsbA[J]., 2012, 47(8): 1268-1276
[20] Huang Shoukun(黄寿锟), Guan Yixin(关怡新), Yu Hongwei(于洪巍), Yao Shanjing(姚善泾). Refolding of recombinant pig liver esterase inclusion bodiesassisted by thiol-carrying latex particles [J].(化工学报), 2014, 65(1): 305-312
[21] Guan Yixin(关怡新), Fei Zhengzheng(费峥峥), Luo Man(罗曼), Yao Shanjing(姚善泾). Minichaperone(GroEL191~345)-mediatedrefolding of recombinant human interferon-γ inclusion body [J].(生物化学与生物物理进展), 2004(10): 907-911
[22] Chung F, Salehi J A, Wei V K. Optical orthogonal codes - design, analysis and applications [J]., 1989, 35(3): 595-604
[23] Li Lin(李琳), Dong Xiaoyan(董晓燕), Sun Yan(孙彦). Dynamic fed-batch refolding behavior of denatured-reduced lysozyme at high concentration [J].()(化工学报), 2003, 54(12): 1719-1723
Preparation of recombinant reteplase inclusion bodies inand its refolding
WANG Junxiong, GUAN Yixin, YAO Shanjing
(College of Chemical and Biological Engineering, Zhejiang University, Hangzhou 310027, Zhejiang, China)
The vector with the gene of recombinant reteplase (rt-PA) was cloned intoBL21(DE3) cells. Over-expression of rt-PA as inclusion bodies was obtained, and renaturation of rt-PAwas investigated. Firstly, single factor experiments were conducted to optimize refolding conditions, including refolding buffer pH, GSH concentration, ratio of GSH to GSSG, rt-PA concentration. On this basis, high concentration protein refolding was further investigated by orthogonal experimental design. Fermentation broth with 1.7 g crude inclusion bodies per liter was obtained after using 0.2 mmol·L-1IPTG as inducer and culturing at 33℃ for 6 h. The refolding yield of rt-PA was up to 87.2% under optimal condition: 50mg·ml-1denatured rt-PA, pH 10.0, 1 mmol·L-1GSH and ratio of GSH to GSSG 8. The key factors affecting refolding of high concentration protein were initial pH and GSH concentration, and specific bioactivity of rt-PA could reach 7.54×104IU·mg-1after refolding at protein concentration of 800mg·ml-1. Fluorescence spectra indicated that structural conformation of refolded reteplase was identical with its native state.
bio-separation; protein refolding; disulfide bond; orthogonal experimental design; reteplase
2014-07-29.
GUAN Yixin, guanyx@zju.edu.cn
10. 11949/j.issn.0438-1157.20141141
TQ 028.8
A
0438—1157(2015)02—0709—08
国家自然科学基金项目(21036005)。
2014-07-29收到初稿,2014-10-08收到修改稿。
联系人:关怡新。第一作者:王俊雄(1989—),男,硕士研究生。
supported by the National Natural Science Foundation of China(21036005).
