新型N-取代苯基-9-烷基-3-咔唑磺酰脲类化合物的合成及其抗肿瘤活性
2015-03-26常霄巍巴俊杰
钱 宇,田 静,常霄巍,巴俊杰
(内蒙古医科大学药学院,内蒙古呼和浩特 010110)
磺酰脲类化合物具有生物活性高、毒性小等优点,在医药和农药领域具有广泛应用,主要被用于降糖药和除草剂。此外,一些磺酰脲类化合物还具有利尿、抗血栓、降血脂和抗中风等生物活性[1-2]。近年来研究发现芳基磺酰脲类化合物具有较强的抗肿瘤活性,尤其用于治疗结肠癌、卵巢癌、肺癌等实体肿瘤,已经被确定为对实体肿瘤有显著性作用的一类新型化疗药物[3-6]。
细胞周期分裂蛋白25B(Cdc25B)有促进细胞有丝分裂作用,对G2-M期的待修复检验点有重要作用,是一种潜在的癌基因,在人类肿瘤(乳腺癌、肺癌、大肠癌、胃癌、前列腺癌、卵巢癌、淋巴瘤和黑素瘤等)细胞系中过度表达[7],因此,寻找Cdc25B抑制剂是发现抗肿瘤药物的重要途径。
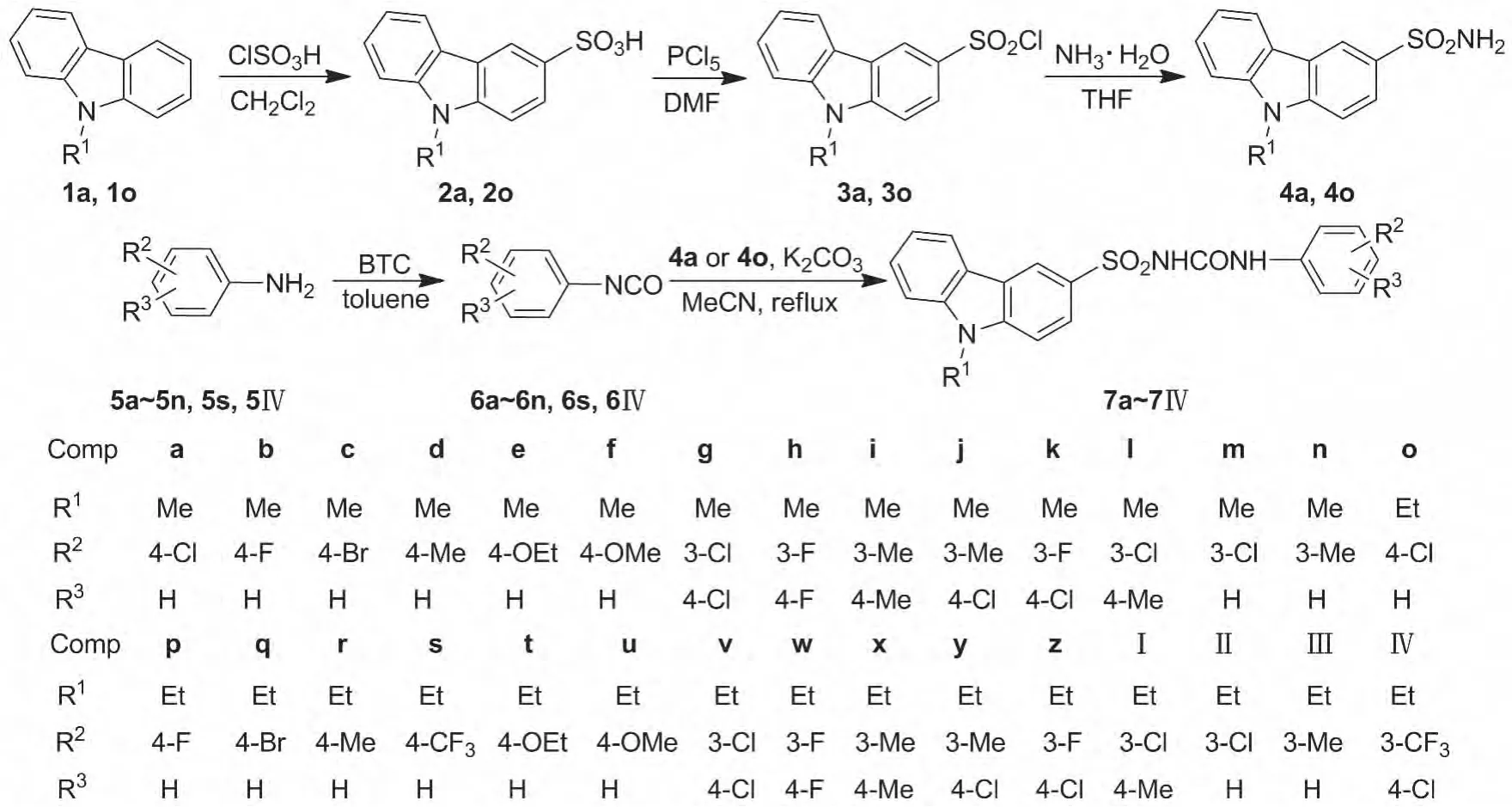
Scheme 1
本文根据芳基磺酰脲类化合物与芳基磺酰胺类化合物化学结构相似和抗肿瘤作用机制均为抑制细胞有丝分裂的原理[8-9],以具有抗肿瘤活性的二芳基磺酰胺类化合物CA-4系列咔唑磺酰胺类化合物为参照[10],将其磺酰氨基换成磺酰脲基,根据在二芳基磺酰脲另一个芳环上连接中性、亲脂性及体积较小的基团能增强抗肿瘤活性的原理[11-12],设计并合成了30个新型的N-取代苯基-9-烷基-3-咔唑磺酰脲类化合物(7a~7Ⅳ)。以9-烷基咔唑为原料,经磺化、氯化和氨化反应制得9-烷基咔唑-3-磺酰胺(4a和4o);取代苯胺(5a~5n,5s,5Ⅳ)与三光气反应制得取代苯基异氰酸酯(6a~6n,6s,6Ⅳ);4分别与6经缩合反应合成了7a~7Ⅳ,其结构经1H NMR,IR和ESI-MS表征。并对其进行了Cdc25B抑制活性的筛选。
1 实验部分
1.1 仪器与试剂
XT4A型数字显微熔点仪(温度未校正);ZF-1型紫外分析仪;Bruker AvanceⅢ500型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Affinity-1型红外光谱分析仪(KBr压片);Finnigan Lcq Advantage Max型质谱仪。
所用试剂均为分析纯。
1.2 合成
(1)2a和2o的合成通法[13]
冰盐浴冷却下,在反应瓶中依次加入1 11.04 mmol和二氯甲烷35 mL,降温至-15℃以下,滴加氯磺酸1.29 g(11.15 mmol),滴毕,于 -10 ℃以下反应30 min;于室温反应3 h(TLC检测)。抽滤,滤饼用二氯甲烷洗涤,真空干燥得灰绿色固体9-甲基-3-咔唑磺酸(2a,收率 69.4%)和 9-乙基-3-咔唑磺酸(2o,收率 80.1%)。
(2)3a和3o的合成通法[14]
冰盐浴冷却下,在反应瓶中依次加入五氯化磷1.59 g(7.66 mmol),2 3.83 mmol和 DMF 10 mL,于-10℃以下反应30 min;于室温反应2.5 h(TLC检测)。倒入冰水中,抽滤,滤饼用蒸馏水洗涤至中性,真空干燥得淡黄色固体9-甲基-3-咔唑磺酰氯(3a,收率 83.2%,m.p.142 ℃ ~145℃)和 9-乙基-3-咔唑磺酰氯(3o,收率 84.3%,m.p.132 ℃ ~135 ℃)。
(3)4a和4o的合成通法[15]
冰盐浴冷却下,在反应瓶中加入氨水5 mL,搅拌下缓慢滴加3 3.58 mmol的THF(10 mL)溶液,滴毕,于0℃以下反应20 min;于室温反应1 h(TLC检测)。倒入冰水中,用稀盐酸调至pH≈6,抽滤,滤饼真空干燥得灰白色固体9-甲基-3-咔唑磺酰胺(4a,收率 82.1%,m.p.223 ℃ ~226℃)和 9-乙基-3-咔唑磺酰胺(4o,收率 85.2%,m.p.182 ℃ ~185 ℃)。
(4)6a~6n,6s,6Ⅳ的合成通法
在三口烧瓶中加入固体光气(BTC)6.00 g(0.02 mol)和甲苯30 mL,搅拌使其溶解;冰水浴冷却下缓慢滴加5(0.04 mol)的甲苯(15 mL)溶液和三乙胺5~7滴的混合溶液,滴毕(1 h),于室温反应1 h;回流反应至澄清(TLC检测)。常压蒸出甲苯,剩余液减压蒸馏得取代苯基异氰酸酯(6a~6n,6s,6Ⅳ)。
6a:白色晶体,收率 65.2%,b.p.100 ℃/4.0 KPa。6b:无色透明液体,收率56.0%,b.p.84 ℃ /6.0 KPa。6c:白色晶体,收率54.0%,b.p.120℃/5.3 KPa。6d:无色透明液体,收率55.9%,b.p.110 ℃ /4.7 KPa。6e:无色透明液体,收率57.5%,b.p.80 ℃ /4.7 KPa。6f:无色透明液体,收率 41.8%,b.p.152 ℃ /6.7 KPa。6g:无色透明液体,收率45.4%,b.p.114℃/3.3 KPa。6h:白色晶体,收率 59.6%,b.p.125℃/6.0 KPa。6i:无色透明液体,收率 54.2%,b.p.125 ℃/6.0 KPa。6j:无色透明液体,收率52.1%,b.p.145 ℃/4.0 KPa。6k:无色透明液体,收率20.5%,b.p.118 ℃ /3.3 KPa。6l:白色晶体,收率 40.5%,b.p.102 ℃ /4.0 KPa。6m:白色晶体,收率 46.6%,b.p.110 ℃ /2.7 KPa。6n:无色透明液体,收率58.5%,b.p.103℃/6.0 KPa。6s:无色透明液体,收率30.0%,b.p.75℃/2.0 KPa。6Ⅳ:白色晶体,收率 56.6%,b.p.123 ℃ /8.0 KPa。
(5)7a ~7Ⅳ的合成(以7a 为例)[16]
在三口烧瓶中加入4a 1.00 g(3.85 mmol)和乙腈30 mL,搅拌下于室温反应1 h。加入K2CO31.59 g(11.54 mmol),回流反应 1 h。滴加 6a 0.89 g(5.78 mmol)的乙腈(10 mL)溶液,滴毕(0.5 h);回流反应6 h(TLC检测)。冷却,抽滤,滤饼分别用蒸馏水和乙醇洗涤,真空干燥得白色粉末 7a 1.01 g。
用类似方法合成白色粉末7b~7Ⅳ。
7a:收率 63.3%,m.p.298℃ ~300℃;1H NMR δ:8.52(s,1H),8.47(s,1H),8.19(d,J=8.0 Hz,1H),7.93 ~ 7.90(m,1H),7.61(d,J=8.5 Hz,1H),7.54(d,J=8.5 Hz,1H),7.50 ~ 7.46(m,1H),7.44 ~ 7.42(m,2H),7.24(t,J=7.0 Hz,1H),7.07 ~7.05(m,2H),3.89(s,3H);IR ν:3 352,2 934,1 641,1 589,1 522,1 494,1 396,1 130,1 061 cm-1;ESI-MSm/z:412.21{[M -H]-}。
7b:收率 65.5%,m.p.282℃ ~284℃;1H NMR δ:8.51(s,1H),8.33(s,1H),8.19(d,J=7.5 Hz,1H),7.93 ~ 7.90(m,1H),7.61(d,J=8.0 Hz,1H),7.54(d,J=8.5 Hz,1H),7.49 ~7.46(m,1H),7.41 ~7.39(m,2H),7.24(t,J=7.5 Hz,1H),6.88 ~6.84(m,2H),3.86(s,3H);IR ν:3 350,2 936,1 636,1 595,1 526,1 476,1 404,1 128,1 063 cm-1;ESI-MSm/z:396.23{[M -H]-}。
7c:收率 56.9%,m.p.283 ℃ ~285℃;1H NMR δ:8.51(s,1H),8.47(s,1H),8.18(d,J=7.5 Hz,1H),7.92(d,J=8.5 Hz,1H),7.61(d,J=8.0 Hz,1H),7.54(d,J=8.5 Hz,1H),7.49(t,J=7.5 Hz,1H),7.39 ~7.37(m,2H),7.24(t,J=7.5 Hz,1H),7.18 ~7.16(m,2H),3.89(s,3H);IR ν:3 352,2 934,1 643,1 587,1 524,1 492,1 392,1 124,1 061 cm-1;ESI-MSm/z:457.99{[M -H]-}。
7d:收率 52.1%,m.p.264℃ ~266℃;1H NMR δ:8.51(s,1H),8.19 ~8.14(m,2H),7.91(d,J=8.5 Hz,1H),7.61(d,J=8.5 Hz,1H),7.54(d,J=8.5 Hz,1H),7.48(t,J=7.0 Hz,1H),7.29 ~7.27(m,2H),7.23(t,J=7.0 Hz,1H),6.86 ~6.84(m,2H),3.84(s,3H),2.12(s,3H);IR ν:3 352,2 924,1 628,1 591,1 514,1 476,1 358,1 128,1 063 cm-1;ESI-MSm/z:392.12{[M -H]-}。
7e:收率 59.1%,m.p.136 ℃ ~137℃;1H NMR δ:10.57(s,1H),8.76(s,1H),8.67(s,1H),8.33(d,J=8.0 Hz,1H),8.04 ~8.02(m,1H),7.79(d,J=8.5 Hz,1H),7.71(d,J=8.5 Hz,1H),7.58 ~7.55(m,1H),7.32(t,J=7.5 Hz,1H),7.21 ~7.18(m,2H),6.78 ~6.75(m,2H),3.95 ~ 3.89(m,5H),1.27(t,J=7.50 Hz,3H);IR ν:3 347,2 980,1 689,1 593,1 514,1 477,1 248,1 157,1 038 cm-1;ESI-MSm/z:422.17{[M -H]-}。
7f:收率 75.2%,m.p.273℃ ~275 ℃;1H NMR δ:8.53(s,1H),8.20 ~8.18(m,1H),8.13(s,1H),7.94 ~ 7.92(m,1H),7.62(d,J=8.0 Hz,1H),7.56(d,J=8.5 Hz,1H),7.49(t,J=8.0 Hz,1H),7.34 ~7.29(m,2H),7.24(t,J=8.0 Hz,1H),6.67 ~6.65(m,2H),3.89(s,3H),3.62(s,3H);IR ν:3 345,2 938,1 634,1 597,1 526,1 475,1 409,1 125,1 065 cm-1;ESI-MSm/z:408.37{[M -H]-}。
7g:收率 40.6%,m.p.263 ℃ ~265 ℃;1H NMR δ:8.70(s,1H),8.51(s,1H),8.19(d,J=8.0 Hz,1H),7.92 ~ 7.90(m,1H),7.84(s,1H),7.62(d,J=8.5 Hz,1H),7.56(t,J=8.5 Hz,1H),7.50(t,J=7.5 Hz,1H),7.25 ~ 7.22(m,3H),3.89(s,3H);IR ν:3 339,2 932,1 632,1 584,1 518,1 477,1 285,1 115,1 063 cm-1;ESI-MSm/z:446.21{[M -H]-}。
7h:收率 43.8%,m.p.283 ℃ ~285 ℃;1H NMR δ:8.58(s,1H),8.52(s,1H),8.20(d,J=7.5 Hz,1H),7.93 ~ 7.90(m,1H),7.67 ~7.61(m,2H),7.55(d,J=8.5 Hz,1H),7.50 ~7.47(m,1H),7.25(t,J=7.5 Hz,1H),7.11 ~7.01(m,2H),3.89(s,3H);IR ν:3 341,2 932,1 639,1 618,1 516,1 476,1 431,1 115,1 063 cm-1;ESI-MSm/z:414.17{[M -H]-}。
7i:收率 51.1%,m.p.209℃ ~211 ℃;1H NMR δ:8.53(s,1H),8.19(d,J=7.5 Hz,1H),8.13(s,1H),7.93 ~ 7.91(m,1H),7.63 ~7.55(m,2H),7.50(t,J=7.0 Hz,1H),7.26 ~ 7.18(m,2H),7.09 ~ 7.07(m,1H),6.80(d,J=8.0 Hz,1H),3.89(s,3H),2.06 ~2.04(m,6H);IR ν:3 518,3 284,2 920,1 618,1 593,1 506,1 477,1 387,1 130,1 067 cm-1;ESI-MSm/z:406.44{[M -H]-}。
7j:收率 71.7%,m.p.262 ℃ ~264 ℃;1H NMR δ:8.53(s,1H),8.43(s,1H),8.20(d,J=7.5 Hz,1H),7.93 ~ 7.91(m,1H),7.63 ~7.55(m,2H),7.50(t,J=8.0 Hz,1H),7.41(d,J=6.0 Hz,1H),7.26 ~7.21(m,2H),7.06 ~ 7.03(m,1H),3.89(s,3H),2.16(s,3H);IR ν:3 348,2 930,1 630,1 587,1 528,1 476,1 404,1 321,1 128,1 065 cm-1;ESI-MSm/z:426.52{[M -H]-}。
7k:收率 72.1%,m.p.276℃ ~278℃;1H NMR δ:8.72(s,1H),8.52(s,1H),8.20(d,J=8.0 Hz,1H),7.93 ~7.91(m,1H),7.66 ~7.60(m,2H),7.56(d,J=8.5 Hz,1H),7.49(t,J=7.0 Hz,1H),7.25 ~7.17(m,2H),7.10 ~7.07(m,1H),3.89(s,3H);IR ν:3 350,2 931,1 645,1 592,1 521,1 477,1 415,1 325,1 125,1 065 cm-1;ESI-MSm/z:430.69{[M -H]-}。
7l:收率 71.4%,m.p.193℃ ~195 ℃;1H NMR δ:8.52(s,1H),8.44(s,1H),8.20(d,J=7.5 Hz,1H),7.92(d,J=8.5 Hz,1H),7.63 ~7.60(m,2H),7.56(d,J=8.5 Hz,1H),7.50 ~7.47(m,1H),7.25(t,J=7.5 Hz,1H),7.15 ~ 7.12(m,1H),6.70 ~ 6.98(m,1H),3.89(s,3H),2.14(s,3H);IR ν:3 335,2 926,1 622,1 595,1 503,1 477,1 377,1 126,1 065 cm-1;ESI-MSm/z:426.22{[M -H]-}。
7m:收率 34.5%,m.p.136℃ ~138℃;1H NMR δ:10.79(s,1H),9.06 ~9.03(m,1H),8.77(s,1H),8.34(d,J=7.5 Hz,1H),8.06 ~8.03(m,1H),7.90 ~7.79(m,1H),7.70(d,J=7.5 Hz,1H),7.59 ~7.50(m,2H),7.32(t,J=7.5 Hz,1H),7.26 ~7.19(m,2H),7.03 ~6.99(m,1H),3.95(s,3H);IR ν:3 339,2 936,1 717,1 589,1 541,1 477,1 327,1 161,1 078 cm-1;ESI-MSm/z:412.27{[M -H]-}。
7n:收率 62.3%,m.p.241℃ ~243℃;1H NMR δ:8.52(s,1H),8.20 ~8.17(m,2H),7.93 ~7.91(m,1H),7.61(d,J=8.0 Hz,1H),7.54(d,J=8.5 Hz,1H),7.49(t,J=7.5 Hz,1H),7.26 ~7.21(m,2H),7.17(d,J=8.5 Hz,1H),6.93 ~6.89(m,1H),6.49(d,J=7.5 Hz,1H),3.95(s,3H),2.13(s,3H);IR ν:3 341,2 922,1 626,1 591,1 533,1 476,1 427,1 119,1 063 cm-1;ESI-MSm/z:392.18{[M -H]-}。
7o:收率 69.9%,m.p.264 ℃ ~266 ℃;1H NMR δ:8.51(s,1H),8.48(s,1H),8.19(d,J=7.5 Hz,1H),7.90(d,J=8.5 Hz,1H),7.62(d,J=8.5 Hz,1H),7.56(d,J=8.5 Hz,1H),7.49 ~7.43(m,3H),7.24 ~7.21(m,1H),7.05(d,J=8.0 Hz,2H),4.47 ~4.43(m,2H),1.31(t,J=6.0 Hz,3H);IR ν:3 353,2 983,1 651,1 592,1 538,1 492,1 316,1 125,1 090 cm-1;ESI-MSm/z:426.33{[M -H]-}。
7p:收率 56.5%,m.p.292 ℃ ~294 ℃;1H NMR δ:8.55(s,1H),8.40(s,1H),8.20(d,J=7.5 Hz,1H),7.92(d,J=8.0 Hz,1H),7.63 ~7.55(m,2H),7.49 ~7.41(m,3H),7.23(t,J=7.5 Hz,1H),6.90 ~6.86(m,2H),4.49 ~4.43(m,2H),1.31(t,J=6.0 Hz,3H);IR ν:3 355,1 632,1 605,1 560,1 510,1 325,1 125,1 085 cm-1;ESI-MSm/z:410.37{[M -H]-}。
7q:收率 80.1%,m.p.258℃ ~260℃;1H NMR δ:8.51(s,1H),8.49(s,1H),8.18(d,J=7.5 Hz,1H),7.90(d,J=8.0 Hz,1H),7.62(d,J=8.0 Hz,1H),7.56(d,J=8.5 Hz,1H),7.47(t,J=7.5 Hz,1H),7.40 ~7.38(m,2H),7.23(t,J=7.5 Hz,1H),7.19 ~ 7.17(m,2H),4.47 ~4.43(m,2H),1.31(t,J=6.0 Hz,3H);IR ν:3 350,2 980,1 624,1 593,1 533,1 496,1 321,1 126,1 093 cm-1;ESI-MSm/z:470.52{[M-H]-}。
7r:收率 44.3%,m.p.265℃ ~267 ℃;1H NMR δ:8.51(s,1H),8.19 ~8.16(m,2H),7.91 ~7.89(m,1H),7.62(d,J=8.0 Hz,1H),7.55(d,J=8.5 Hz,1H),7.47(t,J=8.0 Hz,1H),7.29(d,J=8.5 Hz,2H),7.22(t,J=7.5 Hz,1H),6.85(d,J=8.0 Hz,2H),4.47 ~4.29(m,2H),2.13(s,3H),1.31(t,J=6.0 Hz,3H);IR ν:3 352,2 985,1 645,1 595,1 537,1 470,1 315,1 140,1 065 cm-1;ESI-MSm/z:406.14{[M -H]-}。
7s:收率 45.3%,m.p.292 ℃ ~294 ℃;1H NMR δ:8.77(s,1H),8.53(s,1H),8.19(d,J=7.5 Hz,1H),7.92(d,J=7.5 Hz,1H),7.64 ~7.56(m,4H),7.50 ~7.46(m,1H),7.37(d,J=8.0 Hz,2H),7.24 ~7.21(m,1H),4.48 ~4.43(m,2H),1.32(t,J=6.0 Hz,3H);IR ν:3 327,2 980,1 652,1 589,1 535,1 471,1 346,1 114,1 051 cm-1;ESI-MSm/z:460.13{[M -H]-}。
7t:收率 50.3%,m.p.122 ℃ ~124 ℃;1H NMR δ:10.55(s,1H),8.76(s,1H),8.63(s,1H),8.33(d,J=7.5 Hz,1H),8.04 ~8.01(m,1H),7.82(d,J=8.0 Hz,1H),7.72(d,J=8.5 Hz,1H),7.57(t,J=7.5 Hz,1H),7.32(t,J=7.5 Hz,1H),7.21 ~ 7.18(m,2H),6.79 ~6.76(m,2H),4.54 ~4.49(m,2H),3.94 ~3.89(m,2H),1.35(t,J=6.0 Hz,3H),1.26(t,J=6.0 Hz,3H);IR ν:3 344,2 978,1 683,1 591,1 541,1 450,1 334,1 149,1 076 cm-1;ESI-MSm/z:436.19{[M -H]-}。
7u:收率 78.7%,m.p.240℃ ~243℃;1H NMR δ:8.56(s,1H),8.20(d,J=8.0 Hz,2H),7.93 ~7.91(m,1H),7.65 ~7.59(m,2H),7.50 ~ 7.47(m,1H),7.32 ~ 7.22(m,3H),6.68 ~6.66(m,2H),4.48 ~4.44(m,2H),3.63(s,3H),1.32(t,J=7.0 Hz,3H);IR ν:3 331,2 974,1 624,1 593,1 523,1 477,1 325,1 130,1 064 cm-1;ESI-MSm/z:422.43{[M -H]-}。
7v:收率 64.3%,m.p.259℃ ~261℃;1H NMR δ:8.72(s,1H),8.51(s,1H),8.19(d,J=7.5Hz,1H),7.90(d,J=8.5 Hz,1H),7.84(s,1H),7.63(d,J=8.0 Hz,1H),7.57(d,J=8.5 Hz,1H),7.48(t,J=7.5 Hz,1H),7.26 ~ 7.22(m,3H),4.48 ~ 4.44(m,2H),1.31(t,J=7.0 Hz,3H);IR ν:3 340,2 980,1 637,1 593,1 508,1 475,1 377,1 116,1 062 cm-1;ESI-MSm/z:460.16{[M -H]-}。
7w:收率 49.4%,m.p.265℃ ~267℃;1H NMR δ:8.59(s,1H),8.52(s,1H),8.19(d,J=8.0 Hz,1H),7.91 ~ 7.89(m,1H),7.67 ~7.62(m,2H),7.57(d,J=7.5 Hz,1H),7.48(t,J=6.0 Hz,1H),7.24(t,J=7.5 Hz,1H),7.11 ~7.01(m,2H),4.48 ~4.44(m,2H),1.31(t,J=7.0 Hz,3H);IR ν:3 350,2 976,1 620,1 593,1 539,1 475,1 384,1 125,1 089 cm-1;ESI-MSm/z:428.18{[M -H]-}。
7x:收率 69.7%,m.p.159℃ ~161℃;1H NMR δ:8.51(s,1H),8.19(d,J=8.0 Hz,1H),8.09(s,1H),7.91 ~7.89(m,1H),7.63(d,J=8.5 Hz,1H),7.57(d,J=8.5 Hz,1H),7.48(t,J=7.5 Hz,2H),7.24 ~7.20(m,2H),7.10 ~7.08(m,1H),6.79(d,J=8.0 Hz,1H),4.48 ~ 4.43(m,2H),2.05(s,6H),1.31(t,J=6.0 Hz,3H);IR ν:3 321,2 974,1 627,1 593,1 506,1 475,1 384,1 130,1 066 cm-1;ESI-MSm/z:420.44{[M -H]-}。
7y:收率 65.9%,m.p.241 ℃ ~243 ℃;1H NMR δ:8.52(s,1H),8.43(s,1H),8.19(d,J=8.0 Hz,1H),7.92 ~7.9(m,1H),7.64(d,J=8.0 Hz,1H),7.57(d,J=9.0 Hz,1H),7.49 ~7.46(m,1H),7.42(s,1H),7.25 ~7.21(m,2H),7.05 ~7.03(m,1H),4.47 ~4.45(m,2H),2.16(s,3H),1.32(t,J=7.0 Hz,3H);IR ν:3 336,2 976,1 625,1 593,1 485,1 475,1 381,1 128,1 067 cm-1;ESI-MSm/z:440.63{[M -H]-}。
7z:收率 81.0%,m.p.263℃ ~265 ℃;1H NMR δ:8.72(s,1H),8.52(s,1H),8.19(d,J=8.0 Hz,1H),7.91 ~7.89(m,1H),7.66 ~7.62(m,2H),7.57(d,J=8.5 Hz,1H),7.48(t,J=7.5 Hz,1H),7.25 ~7.17(m,2H),7.09 ~7.08(m,1H),4.48 ~4.45(m,2H),1.32(t,J=7.5 Hz,3H);IR ν:3 354,2 972,1 631,1 593,1 514,1 475,1 417,1 325,1 128,1 091 cm-1;ESI-MSm/z:446.81{[M -H]-}。
7Ⅰ:收率 81.7%,m.p.202℃ ~204℃;1H NMR δ:8.51(s,1H),8.43(s,1H),8.19(d,J=8.0 Hz,1H),7.90(d,J=8.5 Hz,1H),7.64 ~7.62(m,2H),7.57(d,J=8.5 Hz,2H),7.48(t,J=7.5 Hz,1H),7.24(t,J=7.5 Hz,1H),7.15 ~ 7.13(m,1H),6.99 ~ 6.97(m,1H),4.48 ~4.43(m,2H),2.14(s,3H),1.32(t,J=7.0 Hz,3H);IR ν:3 337,2 974,1 633,1 593,1 506,1 475,1 377,1 124,1 065 cm-1;ESI-MSm/z:440.25{[M -H]-}。
7Ⅱ:收率 51.3%,m.p.175℃ ~177℃;1H NMR δ:8.57(s,1H),8.52(s,1H),8.19(d,J=7.5 Hz,1H),7.91(d,J=8.5 Hz,1H),7.66(s,1H),7.63(d,J=8.5 Hz,1H),7.57(d,J=8.5 Hz,1H),7.48(t,J=7.0 Hz,1H),7.25 ~7.22(m,2H),7.05(t,J=8.0 Hz,1H),6.70 ~ 6.68(m,1H),4.48 ~ 4.44(m,2H),1.32(t,J=7.0 Hz,3H);IR ν:3 337,2 978,1 636,1 585,1 519,1 476,1 325,1 121,1 061 cm-1;ESI-MSm/z:426.25{[M -H]-}。
7Ⅲ:收率 67.1%,m.p.156℃ ~158℃;1H NMR δ:8.51(s,1H),8.19 ~8.17(m,2H),7.91 ~7.89(m,1H),7.63(d,J=8.0 Hz,1H),7.55(d,J=8.5 Hz,1H),7.47(t,J=7.5 Hz,1H),7.27 ~7.21(m,2H),7.16(d,J=8.0 Hz,1H),6.91(t,J=8.0 Hz,1H),6.49(d,J=7.5 Hz,1H),4.47 ~4.43(m,2H),2.13(s,3H),1.32(t,J=7.0 Hz,3H);IR ν:3 354,2 978,1 638,1 593,1 531,1 481,1 327,1 129,1 063 cm-1;ESI-MSm/z:406.19{[M -H]-}。
7Ⅳ:收率 33.0%,m.p.234℃ ~235℃;1H NMR δ:8.87(s,1H),8.51(s,1H),8.20 ~8.18(m,1H),8.09(d,J=5.0 Hz,1H),7.91 ~7.89(m,1H),7.63(d,J=8.0 Hz,1H),7.59 ~7.56(m,2H),7.48(t,J=7.5 Hz,1H),7.36 ~ 7.34(m,1H),7.25 ~ 7.21(m,1H),4.47 ~4.45(m,2H),1.32(t,J=7.0 Hz,3H);IR ν:3 331,2 980,2 937,1 626,1 593,1 518,1 491,1 476,1 327,1 128,1 065 cm-1;ESI-MSm/z:494.57{[M -H]-}。
1.3 抗肿瘤活性测试
采用荧光底物OMFP考察7a~7Ⅳ对Cdc25B的抑制活性。OMFP经Cdc25B去磷酸化后得产物OMF,OMF被485 nm激发光激发后可发射出波长为535 nm的可检测的荧光信号,从而观察Cdc25B的活性变化以及7a~7Ⅳ对其抑制情况。
2 结果与讨论
2.1 合成
在制备2时,控制氯磺酸的加入量至关重要,其量过大时容易在1的其它位置进行取代;量少时则反应不完全,实验发现氯磺酸过量0.1 mmol较为合适。
在3的合成中,尝试了多种氯化试剂。(1)以二氯亚砜为氯化剂时,得粘稠产物,且副产物多。(2)以三氯氧磷为氯化剂时,反应强烈,条件不易控制,后处理危险,且收率低。(3)以五氯化磷为氯化剂,即本文所采用的方法,收率均在80%以上,且后处理简单,只需水洗至中性,干燥即可。五氯化磷用量为2 eq.,需分批加入,以控制温度在-10℃以下。后处理时要将反应液缓慢滴加入冰水中,防止由于未反应的五氯化磷遇水放出大量热而发生副反应。
在4的合成中,滴液方式有两种:一种是将氨水滴入3中;另一种则相反。按前者操作,易发生3与产物4的氨化反应,生成大量副产物。因此,本实验采用后一种滴液方式,保证氨化反应中3始终在氨水过量状态下参与反应,从而减少副产物,提高收率。
2.2 抗肿瘤活性
7a~7Ⅳ的抗肿瘤活性结果见表1。由表1可见,在用药浓度为 20 μg·mL-1时,以 Na3VO4(IC50=1.51 ±0.23 μmol·L-1)为阳性对照,7b,7g,7h,7j,7k,7l,7n,7s,7v,7y,7Ⅰ和7Ⅳ 的抑制率大于90%,对Cdc25B具有良好的抑制活性。
整体看来,N-甲基咔唑系列磺酰脲类化合物比N-乙基咔唑系列的抑制活性高。苯环为单取代时,对位取代比邻、间位抑制活性较高;对位上连有氟、氯和三氟甲基时抑制活性较高。苯环为二取代时,抑制活性较单取代高;间、对位上连氟、氯、三氟甲基和甲基的抑制活性高。
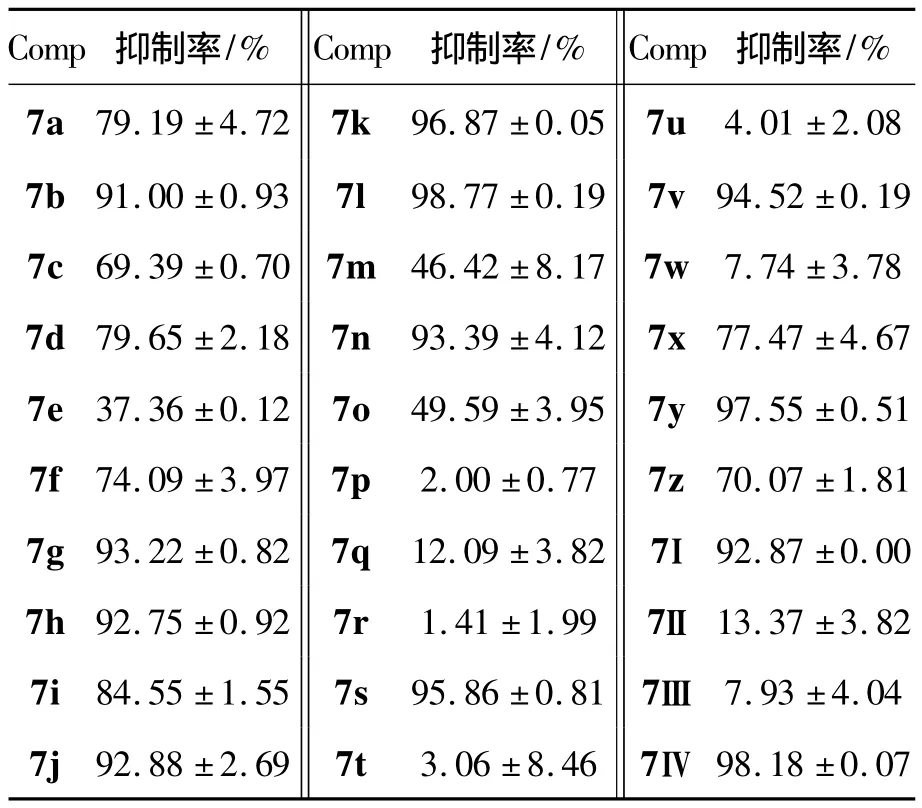
表1 7a~7Ⅳ对Cdc25B的抑制活性Table 1 Inhibition of 7a~7Ⅳ to Cdc25B
3 结论
合成了30个新型的N-取代苯基-9-烷基-3-咔唑磺酰脲类化合物。初步的体外活性测试结果表明:7b,7g,7h,7j,7k,7l,7n,7s,7v,7y,7Ⅰ和7Ⅳ对Cdc25B具有良好的抑制作用,可能成为潜在的具有抗肿瘤活性的Cdc25B抑制剂。目标化合物的结构优化和进一步的抗肿瘤活性研究正在进行中。
致谢:活性筛选实验由国家新药筛选中心协助测定,在此表示诚挚的谢意。
[1]Simard J M,Woo1 S K,Schwartzbauer G T.Sulfonylurea receptor 1 in central nervous system injury:A focused review[J].Journal of Cerebral Blood Flow &Metabolism,2012,32:1699 -1717.
[2]Kim S,Park J H,Koo S Y,et al.Novel diarylsulfonylurea derivatives as potent antimitotic agents[J].Bioorganic & Medicinal Chemistry Letters,2004,14:6075-6078.
[3]Houghton P J,Houghton J A.Antitumor diarylsulfonylureas:Novel agents with unfulfilled promise[J].Invest New Drugs,1996,14:271 -280.
[4]Neeraj M,Jing-Ping L,Jang-Yang C,et al.Antitubulin agents for the treatment of cancer a medicinal chemistry update[J].Exp Opin Ther,2006,16:647 -691.
[5]Li H Q,Lv P C,Yan T.Urea derivatives as anticancer agents[J].Anti-Cancer Agents in Medicinal Chemistry,2009,9(4):471 -480.
[6]Giulia P,Loredana U,Pierfranco C,et al.Effects of sulfonylureas on tumor growth:A review of the literature[J].The Oncologist,2013,18:1118 -1125.
[7]Park H,Bahn Y J,Jung S K,et al.Discovery of novel Cdc25 phosphatase inhibitors with micromolar activity based on the structure-based virtual screening[J].J Med Chem,2008,51(18):5533 -5541.
[8]Piao W,Yoo J,Lee D K,et al.Induction of G(2)/M phase arrest and apoptosis by a new synthetic anticancer agent,DW2282,in promyelocytic leukemia(HL-60)cells[J].Biochemical pharmacology,2001,62(11):1439-1447.
[9]Kim D M,Won M,Chung C S.JNK-mediated transcriptional upregulation of RhoB is critical for apoptosis of HCT-116 colon cancer cells by a novel diarylsulfonylurea derivative[J].Apoptosis,2010,15(12):1540-1548.
[10]Hu L X,Li Zh R,Li Y,et al.Synthesis and structure-activity relationships of carbazole sulfonamides as a novel class of antimitotic agents against solid tumors[J].J Med Chem,2006,49:6273 - 6282.
[11]Sharma V K,Lee K C,Venkateswararao E.Structure-activity relationship study of arylsulfon-ylimidazolidinones as anticancer agents[J].Bioorganic &Medicinal Chemistry Letters,2011,21:6829 -6832.
[12]Jeffry H J,Sue G C,Thomas A,et al.Novel agents effectiveagainstsolid tumors:Thediarylsulfonylureas:Synthesis,activities,and analysis of quantitative structure-activity relationships[J].J Med Chem,1990,33(9):2393 -2407.
[13]Susumu M,Tatsuo T,Tsunetoshi H,et al.Synthesis and biological activity of various derivatives of a novel class of potent,Selective,and orally active prostaglandin D2 receptor antagonists bicyclo[2.2.1]heptane derivatives[J].J Med Chem,2003,46:2436 -2445.
[14]Jatinder P B,Richard J C,Swinbourne J F.Chlorosulfonation of some polynuclear heterocyclic compounds[J].Phosphorus Sulfur and Silicon,1992,72:157-170.
[15]Christopher A L,Millichip I,Parker B,et al.A convenient synthesis of sulfonylureas from carboxylic acids and sulfonamides via an insitu Curtius rearrangement[J].Tetrahedron Letters,2007,48:8878 -8882.
[16]Sun L Q,Zhu L,Qian K D,et al.Design,synthesis,and preclinical evaluations of novel 4-substituted 1,5-diarylanilines as potent HIV-1 non-nucleoside reverse transcriptase inhibitor(NNRTI)drug candidates[J].J Med Chem,2012,55:7219 -7229.
