毕赤酵母-表面活性剂协同作用制备Au纳米线
2015-08-22景孝廉黄登坡黄加乐孙道华李清彪
景孝廉,黄登坡,黄加乐,孙道华,李清彪,3
(1厦门大学化学化工学院化学工程与生物工程系,醇醚酯化工清洁生产国家工程实验室,福建 厦门 361005; 2厦门大学环境与生态学院,福建 厦门 361005;3泉州师范学院化学与生命科学学院,福建 泉州 362000)
引 言
Au纳米线在光学、催化、分离、生物传感器等领域有着广泛的应用[1-5],开发简单实用的Au纳米线制备方法非常重要。目前Au纳米线制备的主要方法是模板法和晶种诱导生长法。碳纳米管、多孔阳极氧化铝、介孔沸石及生物大分子等均可作为模板用于制备Au纳米线[6-7]。晶种诱导生长法是另一类重要的Au 纳米线制备方法,2001年美国学者Murphy等[8]首次利用晶种诱导法制备了一维结构Au纳米线:利用NaBH4快速还原HAuCl4制得Au纳米晶种,将该晶种引入含有 HAuCl4、保护剂的混合溶液中,最后加入弱还原剂控制条件使晶种生长成Au纳米线。之后许多研究者利用这种方法成功制备了Au纳米线[9-13]。
由于生物法具有简单有效、成本低、环保无污染等特性,利用生物法制备Au纳米材料,近年来逐渐受到纳米科技工作者的重视[14]。研究发现[15-16],向毕赤酵母和大肠杆菌从酸性体系中吸附[AuCl4]-的体系加入一定量的十六烷基三甲基溴化铵(CTAB)后,利用抗坏血酸(AA)还原,室温下短时间内在菌体表面可以生成大量一维金纳米材料,通过对菌体用量,CTAB、氯金酸和AA浓度等因素的考察,确定了利用该法获得Au纳米线的最佳条件,并将所得的Au纳米线/毕赤酵母菌复合材料用作表面增强拉曼光谱(SERS)的基底;借助这个过程,能够实现水溶液中金的快速回收,菌体周围形成紧密堆积的金纳米线,使得金/菌体自动快速沉淀至溶液底部[17]。在前期工作的基础上,本研究针对在毕赤酵母-CTAB协同作用下利用AA还原制备Au纳米线过程,对所获产物的结构进行进一步的表征,考察该过程中菌体与氯金酸的相互作用对后续Au纳米线生成的影响,并对AA加入后不同阶段的溶液体系以及Au产物进行研究,进一步获得Au纳米线的生长机制。
1 实验部分
1.1 主要试剂
氯金酸(HAuCl4)、十六烷基三甲基溴化铵(CTAB)购于国药集团化学试剂有限公司。YPD培养基购于上海中科昆虫生物技术开发有限公司。毕赤酵母(Pichia pastoris)菌种由厦门大学生命科学学院提供,本实验室保存。
1.2 Au纳米线的制备
毕赤酵母(Pichia pastoris)菌粉的制备:培养基的主要成分为:酵母粉10 g·L-1,大豆蛋白胨20 g·L-1,葡萄糖20 g·L-1。30℃下培养箱中48 h后,离心分离上清液,菌泥用超纯水洗涤3次后于60℃下烘干后研磨,过筛(0.15 mm),干燥保存备用。
Au纳米线的制备:将一定量的菌粉、HAuCl4溶液(48.56 mmol·L-1)和CTAB混合一定时间后,向体系加入抗坏血酸(AA,0.1 mol·L-1),置于恒温水浴摇床(30℃,150 r·min-1)反应一定时间。
1.3 表征方法
透射电镜(TEM)、高分辨透射电镜(HRTEM)和选区电子衍射(SAED)分析在Philips公司的FEI Tecnai 30型透射电子显微镜上进行。扫描电镜(SEM)分析在LEO-1530扫描电子显微镜系统上进行。X射线光电子能谱(XPS)在Physical Electronics公司的Quantum-2000 Scaning ESCA Microprobe型光谱仪上进行,以C1s结合能(284.8 eV)作为内标。溶液体系的紫外可见吸收光谱(UV-Vis)在Thermo Scientific公司的紫外-可见分光光度计(Evolution 220)上进行,以去离子水作为参比。
2 结果与讨论
2.1 Au纳米线的表征
图1为利用毕赤酵母-CTAB协同作用下AA还原氯金酸所获金纳米线的SEM和TEM表征结果。由图1(a)知,所获Au产物为紧密堆积的带有分支的纳米线,Au纳米线是弯曲的,表面并不是光滑的[图1(b)]。对图1(b)中纳米线的局部区域进行分析,HRTEM结果[图1(c)]表明图中纳米线的晶格间距为0.23 nm,是面心立方Au{111}晶面的晶格间距,选区电子衍射(SAED)出现{111},{200},{220}和{311} 4个布拉格衍射环[图1(d)],表明纳米线是多晶的。

图1 Au纳米线的SEM图片,TEM图片,HRTEM图片 和SAED图片 Fig.1 SEM image (a), TEM image (b), HRTEM image (c) and SAED image (d) of Au nanowires
为了进一步研究所获Au纳米线的结构特点,利用TEM和HRTEM对单根Au纳米线上的不同位置进行观察。图2为单根Au纳米线上不同位置[(a)~(d)]的TEM图像、HRTEM及傅里叶变换图像。由图可知,(a)~(d)4个位置的晶格间距除了0.236 nm还有0.204 nm,这分别对应于在面心立方Au的{111}和{200}晶面。(a)和(c)两个 位置同时拥有两种不同的晶格间距,表现出多晶的结构;而(b)和(d)两个位置则只有单一的晶格,表现出单晶的特征,但(b)和(d)位置的晶格间距不同,分别为面心立方Au{111}和{200}晶面的晶格间距。图2(i)和(k)的傅里叶变换图像表明(a)和(c)两个位置是面心立方Au{111}和{200}两个晶面的叠加,是多晶结构。而图(j)和(l)则是单一的面心立方Au{111}和{200}晶面的图像,是单晶结构。
利用HRTEM和SAED进一步对所获Au纳米线的不同分支结构进行表征,结果如图3所示。图3(a)和(d)分别为具有不同分支结构特点的Au纳米线。对于图3(a)中所示结构进行HRTEM表征,发现(b)分叉处纳米线有0.236 nm和0.204 nm两种晶格间距,这分别对应于面心立方Au的{111}和{220}晶面,此处表现出来多晶的结构,且晶格是连续的。而(c)分叉处只有0.236 nm一种晶格间距,对应面心立方Au的{111}面,具有单晶性质,且晶格也是连续的。图3(d)为另一个分支结构的Au纳米线的TEM照片, HRTEM图像[图3(e)]和对应的傅里叶变换图案[图3(f)]也清楚地表明了Au纳米线支链是多晶结构。
2.2 HAuCl4与菌体相互作用的影响


图2 Au纳米线上不同位置的TEM图像及其对应的HRTEM图像和傅里叶变换图像 Fig.2 TEM images [(a)~(d)] and its corresponding HRTEM images [(e)~(h)] and Fourier transform images [(i)~(l)] of different positions on Au nanowire

图3 不同分支结构Au纳米线的TEM图像,(a)中分支结构的HRTEM图像,(d)中分支结构Au纳米线 HRTEM图像和傅里叶变换图像 Fig.3 (a), (d) TEM image of Au nanowires with different branched structure feature, (b), (c) HRTEM images of Au nanowire in (a), (e) HRTEM images of Au nanowire in (d), (f) Fourier transform image of Au nanowire in (d)
为了进一步研究HAuCl4与毕赤酵母菌粉的相互作用,将0.23 mmol·L-1的HAuCl4溶液与0.005 g毕赤酵母菌粉混合后分别反应15、30和60 min,低速离心将固体产物分离,用去离子水洗涤3次后冷冻干燥。将干燥后的样品研磨成粉末,压片,用XPS表征菌体表面的Au的价态,结果如图4所示。HAuCl4与PPCs作用15 min后,图4(a)中XPS结果显示菌体表面的Au 4f7/2电子轨道的谱图可以拟合出3个峰,83.8、84.5 和86.9 eV。根据文献,结合能83.8 eV的是Au(0)物种[18-19]。金的氧化态越高,则其4f电子轨道的结合越大,84.5 和86.9 eV则归属为Auδ+物种,其中前者可归属为Au+物种,后者则为Au3+[19-20]。延长HAuCl4与PPCs作用时间 到30 min,菌体表面检测到的是位于83.8 和84.5 eV的峰,如前文所述,可分别归属为Au(0)和Au+。而当两者相互作用60 min后,XPS只检测到了归属于Au(0)物种的峰(83.7 eV)。Lin等[21]的研究发现,毕赤酵母对[AuCl4]-的生物还原经历了Au(Ⅲ)→Au(Ⅰ)→Au(0)的过程,菌体表面包括 NH2, OH等在内的还原性基团可将Au(Ⅲ)还原。XPS结果表明毕赤酵母对氯金酸具有一定的还原性,其表面的基团在温和条件下经过较短的时间即可将Au(Ⅲ)成功地还原为Au(0)。但是由于在该过程中,毕赤酵母相对用量较低,其吸附和还原能力有限,HAuCl4溶液中只有很小的一部分Au(Ⅲ)被菌体吸附还原,实际上大部分的Au(Ⅲ)还存在于溶液体系中,为后续纳米线的生成提供金源。前期的研究也发现[8-9],前驱体HAuCl4用量一定的条件下,如果菌体用量过多,大量的Au(Ⅲ)将被菌体吸附还原,溶液体系中Au(Ⅲ)浓度过低,造成后续纳米线生长所需的Au不足,不利于纳米线的生成。
接下来考察了在CTAB存在条件下菌体和HAuCl4作用不同时间后,加入AA还原所获Au产物的形貌,具体过程如下:将HAuCl4(0.23 mmol·L-1)与CTAB(5.0 mmol·L-1)的溶液与0.005 g的毕赤酵母菌粉在30℃摇床中分别振荡0、15、30、60、120、180、240、300和360 min后,再加入50 μl AA溶液(0.1 mol·L-1)。结果如图5所示,反应前期在CTAB的存在下HAuCl4与菌体相互作用不同时间(15~300 min)后,加入还原剂AA均可获得Au纳米线产物。而菌体和氯金酸相互作用时间为0(CTAB存在下HAuCl4与菌体混合后立即加入AA)和360 min后无法得到Au纳米线,说明HAuCl4与菌体相互作用时间过短或过长均会对反应产生较大影响,导致无法生成Au纳米线。HAuCl4与毕赤酵母相互作用时间过短,没有在菌体表面生成后续生长所需的晶种,因此无法生成Au纳米线。而HAuCl4与毕赤酵母相互作用时间过长, 菌体表面生成的Au纳米晶种会进一步长大成稳定Au纳米颗粒,不再具有继续生长能力,无法长成Au纳米线。Lin等的研究也发现HAuCl4与PPCs经长时间相互作用后在菌体表面获得的是较大尺寸的稳定的Au纳米颗粒[21]。综合考虑,选择15 min作为前期HAuCl4与PPCs之间最佳的相互作用时间。
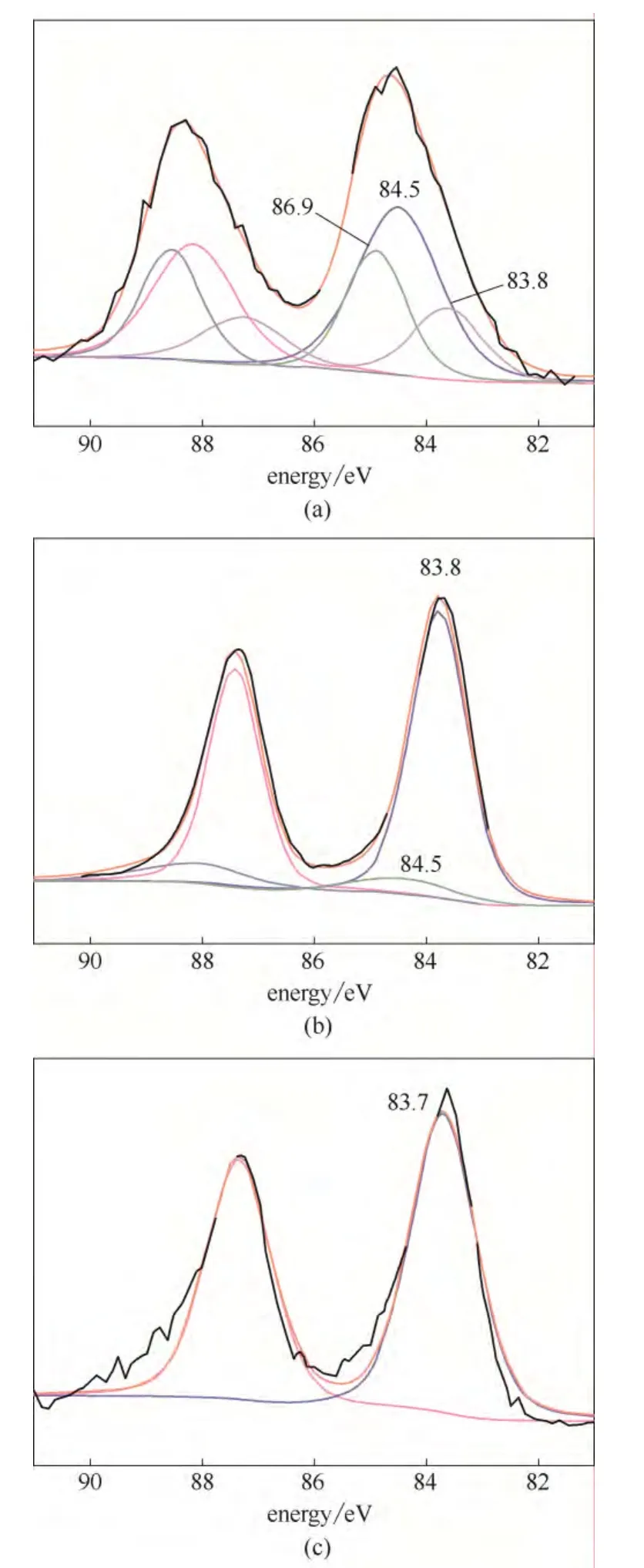
图4 HAuCl4与PPCs作用15 min,30 min,60 min后 Au的XPS谱图 Fig.4 XPS spectra of Au adsorbed by PPCs with 15 min (a), 30 min (b), 60 min (c)
为了进一步证实前期通过菌体吸附还原过程生成的Au(0)在后续Au纳米线生成过程中的作用, 在HAuCl4溶液中加入0.005 g的毕赤酵母菌粉,经过15min的吸附还原后,将溶液进行低速离心分离,保留固体。向经过不同时间的吸附还原后分离的固体分别加入10 ml 去离子水或者10 ml 不同浓度(0.12和0.23 mmol·L-1)的HAuCl4溶液,再加入CTAB(5.0 mmol·L-1)和50 μl AA溶液(0.1 mol·L-1),所获产物的电镜表征如图6所示。HAuCl4与毕赤酵母相互作用后,再进行分离的菌体表面吸附还原了少量的Au纳米颗粒,后续反应中如果添加HAuCl4则反应依然可以生成Au纳米线。而后续反应如果没有添加HAuCl4则只能观察到菌体表面细小的Au纳米颗粒,无Au纳米线生成。说明在反应前期HAuCl4与毕赤酵母之间的相互作用下,菌体表面生成的Au(0)对后续纳米线的生成起到了晶种的作用,菌体只是吸附并还原了少部分HAuCl4,当AA加入后,溶液中游离的HAuCl4被还原为Au(0),为纳米线的生长提供Au源。
2.3 Au纳米线的生长过程
在对菌体-HAuCl4相互作用过程的研究基础上,进一步对体系加入AA后的金纳米线的生成过程进行了考察。首先,利用紫外-可见分光光度计分析AA加入体系后不同时间溶液体系,如图7所示。AA加入后0 min,即反应刚开始时,溶液的UV-Vis吸收曲线是一条光滑的上升曲线,并没有任何明显的吸收峰。AA加入10 min后,550 nm处开始出现较弱的特征吸收峰,这是球形Au纳米颗粒的SPR特征吸收峰,表明此时溶液中有少量的球形Au纳米颗粒生成。随着反应时间的延长,AA加入30 min后550 nm处的吸收峰强度明显增强,同时吸收峰位置出现小幅红移,表明溶液中球形Au纳米颗粒进一步增多,且颗粒粒径增大。当反应进行到180 min后,反应基本完成,550 nm处的吸收峰又消失了,表明此时溶液中已经没有球形Au纳米颗粒了。
为了进一步研究AA还原过程中Au纳米颗粒形貌的变化过程,从溶液加入AA后不同时间(0、10、30和180 min)分别取样,用TEM观察溶液中的Au纳米粒子的结构,结果如图8所示。未加入AA的体系[图8(a)],观察到的是菌体吸附还原氯金酸后生成的粒径极小(2.9 nm左右)的球形Au纳米颗粒,这些Au纳米颗粒即为后续Au纳米线结构生长的晶种和优先成核位点。在加入AA后10 min[图8(b)],溶液中开始出现一些颗粒较大的Au纳米颗粒,这是因为随着AA的加入,溶液中游离的HAuCl4被AA快速还原,吸附阶段生成的Au纳米晶种[图8(a)]开始进一步生长,所以溶液中的Au纳米颗粒变大。该阶段的Au由原先的球形小颗粒演变为五边形孪晶晶种,在这种五边形孪晶晶面约束下,有梭子形的Au纳米颗粒的生成[图8(b)]。随着还原过程的进行,在AA加入30 min后,更多HAuCl4被还原,小的纳米颗粒会开始团聚,经过一 段时间的Ostwald 粗化,大颗粒变大,小颗粒变小,这些Au纳米颗粒在CTAB的软模板作用下,开始出现线性排列,逐渐形成串珠状结构[图8(c)]。CTAB吸附在Au纳米颗粒的高能晶面上,使Au纳米颗粒只沿着轴向一维生长,由于吸附过程的Au(0)产生在菌体表面,Au纳米线在CTAB软模板的作用下生长的过程同时受到了来自毕赤酵母的空间效应影响,在二者的协同作用下最后的结果是倾向于生成如图8(d)所示的带有分支的Au纳米线。
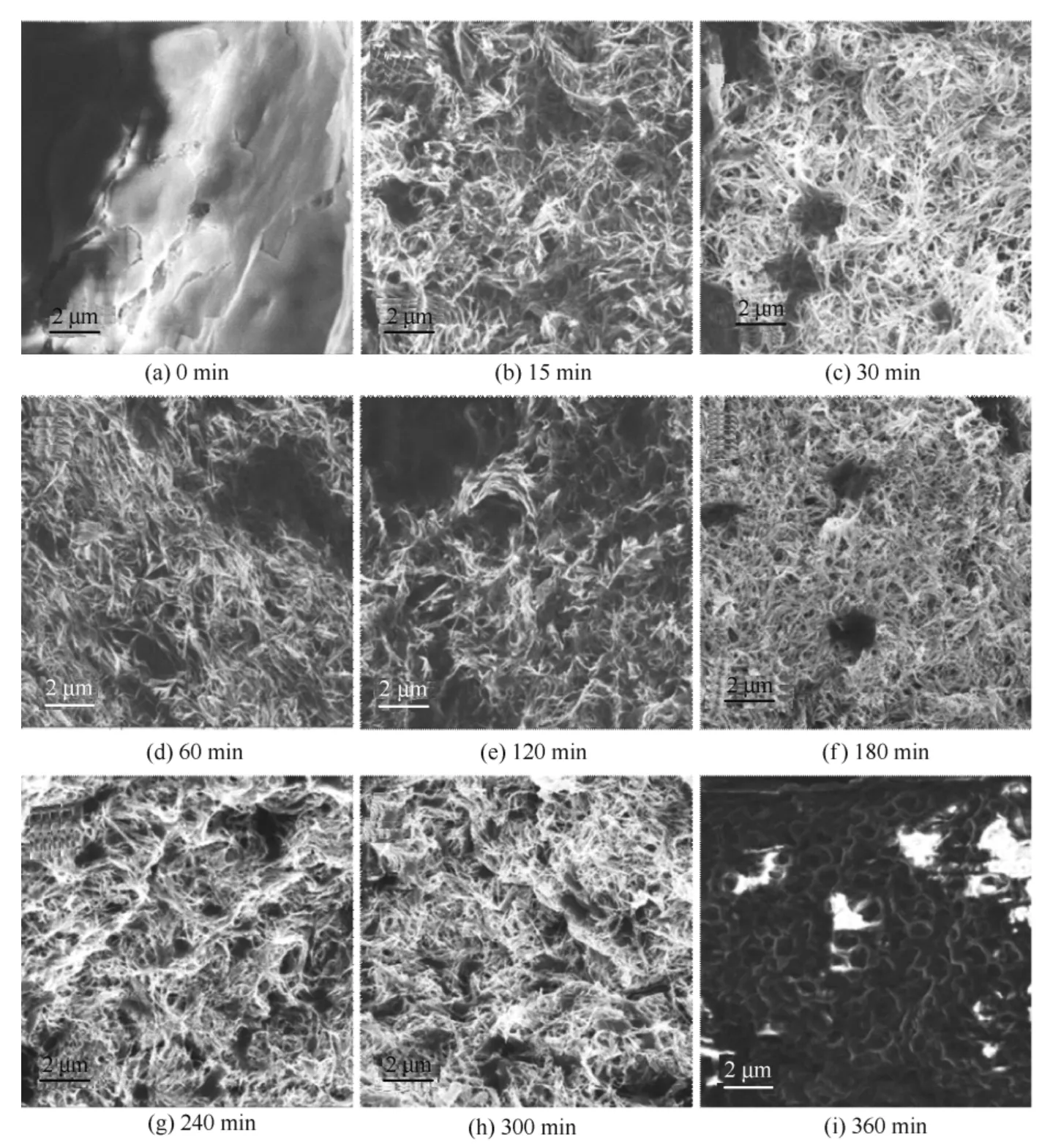
图5 CTAB存在下HAuCl4与PPCs相互作用不同时间后反应生成的Au纳米线的SEM图像 Fig.5 SEM images of Au nanowires with HAuCl4interacting with PPCs for different time

图6 将与HAuCl4作用15 min后的PPCs分别加入到10 ml去离子水或者10 ml不同浓度的HAuCl4(0.12 mmol·L-1, 0.23 mmol·L-1)后,再引入CTAB(5.0 mmol·L-1)和AA(0.1 mol·L-1)反应得到的Au纳米线SEM图 Fig.6 SEM images of Au nanowires by using separated PPCs with 10 ml H2O (a), 10 ml HAuCl4(0.12 mmol·L-1) (b) and 10 ml HAuCl4(0.23 mmol·L-1) (c) under the presence of CTAB (5.0 mmol·L-1) and AA (0.1 mol·L-1) (The separated PPCs was obtained by centrifugalization from the solution after a 15min-interacting with HAuCl4)
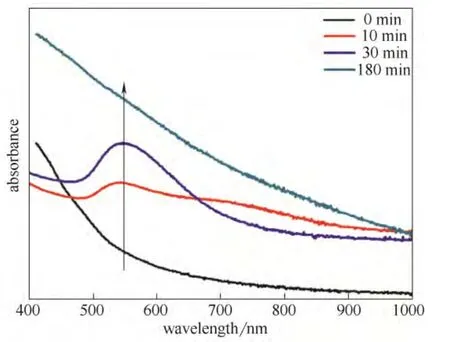
图7 AA加入后不同时间溶液体系的紫外-可见吸收光谱 Fig.7 UV-Vis spectra of reaction solution after AA addition at different time
3 结 论
本文在毕赤酵母-CTAB的协同作用下利用AA还原制备Au纳米线,并通过SEM、TEM、HRTEM及SAED等手段对所获产物进行表征,发现产物为带有分支的Au纳米线,纳米线在分叉处的晶型是连续的,具有多晶结构的特征。通过研究HAuCl4和菌体间的相互作用过程发现,菌体可吸附并还原Au(Ⅲ)生成Au纳米颗粒,XPS结果证实了二者经过短时间相互作用(15 min)后菌体表面即有Au(0)的生成。表面带有Au(0)的菌体经分离后再引入一定浓度的HAuCl4和CTAB,加入AA后有Au纳米线的生成,说明这些分布在菌体表面的Au(0)在后续Au纳米线的生成过程中直接起到了晶种的作用。HAuCl4和菌体间的相互作用时间对于后续纳米线的生成过程也至关重要,如果没有前期二者的吸附作用,就没有可供纳米线进一步生长的晶种的存在,获得的是大量的纳米颗粒。在HAuCl4浓度一定的情况下,过长的作用时间导致菌体表面生成的Au(0)趋于稳定,不利于进一步的生长。菌体表面Au(0)晶种生成后,溶液体系中还必须同时有一定量的Au(Ⅲ),为AA加入后Au纳米线的生成提供足够的Au源。菌体-表面活性剂的协同作用导致分支结构的多晶Au纳米线的生成。

图8 AA加入后不同时间取样的TEM表征 Fig.8 TEM images of Au nanostructures synthesized through reduction of AA for different time
[1] Cherevko S, Chung C H.Gold nanowire array electrode for non-enzymatic voltammetric and amperometric glucose detection [J].Sensors and Actuators B:Chemical, 2009, 142 (1): 216-223.
[2] Guo S J, Wen D, Dong S J, Wang E K.Gold nanowire assembling architecture for H2O2electrochemical sensor [J].Talanta, 2009, 77 (4): 1510-1517.
[3] Chirea M, Freitas A, Vasile B S, Ghitulica C, Carlos M, Pereira C M, Silva F.Gold Nanowire networks: synthesis, characterization, and catalytic activity [J].Langmuir, 2011, 27 (7): 3906-3913.
[4] Basu M, Seggerson S, Henshaw J, Jiang J, Cordona R A, Lefave C, Boyle P J, Miller A, Pugia M, Basu S.Nano-biosensor development for bacterial detection during human kidney infection: use of glycoconjugate-specific antibody-bound gold nanowire arrays (GNWA) [J].Glycoconjugate Journal, 2004, 21 (8/9): 487-496.
[5] Liu Z, Searson P C.Single nanoporous gold nanowire sensors [J].The Journal of Physical Chemistry B, 2006, 110 (9): 4318-4322.
[6] Sainsbury T, Fitzmaurice D.Carbon-nanotube-templated and pseudorotaxane-formation-driven gold nanowire self-assembly [J].Chemistry of Materials, 2004, 16 (11): 2174-2179.
[7] Djalali R, Chen Y F, Matsui H.Au nanowire fabrication from sequenced histidine-rich peptide [J].Journal of the American Chemical Society, 2002, 124 (46): 13660-13661.
[8] Jana N R, Gearheart L, Murphy C J.Wet chemical synthesis of high aspect ratio cylindrical gold nanorods [J].The Journal of Physical Chemistry B, 2001, 105 (19): 4065-4067.
[9] Gao J, Bender C M, Murphy C J.Dependence of the gold nanorod aspect ratio on the nature of the directing surfactant in aqueous solution [J].Langmuir, 2003, 19 (21): 9065-9070.
[10] Singh G, van Helvoort A T J, Bandyopadhyay S, Voldena S, Andreassena J P, Glomma W R.Synthesis of Au nanowires with controlled morphological and structural characteristics [J].Applied Surface Science, 2014, 311: 780-788.
[11] Halder A, Ravishankar N.Ultrafine single-crystalline gold nanowire arrays by oriented attachment [J].Advanced Materials, 2007, 19 (14): 1854-1858.
[12] Taub N, Krichevski O, Markovich G.Growth of gold nanorods on surfaces [J].The Journal of Physical Chemistry B, 2003, 107 (42): 11579-11582.
[13] Oshima Y, Onga A, Takayanagi K.Helical gold nanotube synthesized at 150 K [J].Physical Review Letters, 2003, 91 (20): 205503.
[14] Huang J L, Lin L Q, Sun D H, Chen H M, Yang D P, Li Q B.Bio-inspired synthesis of metal nanomaterials and applications [J].Chemical Society Reviews, 2015, DOI: 10.1039/c5cs00133a.
[15] Wang M, Kong T, Jing X L, Hung Y K, Sun D H, Lin L Q, Zheng Y M, Huang J L, Li Q B.Fabrication of Au nanowire/Pichia pastoriscell composites with hexadecyltrimethylammonium bromides as a platform for SERS detection: a microorganism-mediated approach [J].Industrial & Engineering Chemistry Research, 2012, 51 (51): 16651-16659.
[16] Yang H X, Du M M, Odoom-Wubah T, Wang J, Sun D H, Huang J L, Li Q B.Microorganism-mediated, CTAB-directed synthesis of hierarchically branched Au-nanowire/Escherichia colinanocomposites with strong near-infrared absorbance [J].Journal of Chemical Technology & Biotechnology, 2014, 89 (9): 1410-1418.
[17] Yang H X, Lin L Q, Odoom-Wubah T, Huang D P, Sun D H, Huang J L, Li Q B.Microorganism-mediated, CTAB-directed aggregation of Au nanostructures around Escherichia colicells: Towards enhanced Au recovery through coordination of cell-CTAB–ascorbic acid [J].Separation and Purification Technology, 2014, 133 (8): 380-387.
[18] Zhan G W, Huang J L, Du M M, Sun D H, Abdul-Rauf I, Lin W S, Hong Y L, Li Q B.Liquid phase oxidation of benzyl alcohol to benzaldehyde with novel uncalcined bioreduction Au catalysts: High activity and durability [J].Chemical Engineering Journal, 2012, 187: 232-238.
[19] Li Q L, Zhang Y H, Chen G X, Fan J Q, Lan H Q, Yang Y Q.Ultra-low-gold loading Au/CeO2catalysts for ambient temperature CO oxidation: Effect of preparation conditions on surface composition and activity [J].Journal of Catalysis, 2010, 273 (2): 167-176.
[20] Park E D, Lee J S.Effects of pretreatment conditions on CO oxidation over supported Au catalysts [J].Journal of Catalysis, 1999, 186 (1): 1-11.
[21] Lin L Q, Wu W W, Huang J L, Sun D H, Waithera N M, Zhou Y, Wang H T, Li Q B.Catalytic gold nanoparticles immobilized on yeast: From biosorption to bioreduction [J].Chemical Engineering Journal, 2013, 225: 857-864.
