视神经脊髓炎及多发性硬化患者脑部氢质子磁共振波谱分析
2015-08-14肖丽邱伟陆正齐陈少琼胡学强
肖丽 邱伟 陆正齐 陈少琼 胡学强
多发性硬化(multiple sclerosis,MS)是一种中枢神经系统的慢性、持续性炎性脱髓鞘疾病。视神经脊髓炎(neuromyelitis optica,NMO)是视神经和脊髓同时或相继受累的急性或亚急性炎性脱髓鞘疾病,是不同于MS的一种疾病[1]。氢质子磁共振波谱成像技术(1H magnetic resonance spectroscopy,1H-MRS)是目前唯一能无创性观察活体组织代谢及生化变化的技术。1H-MRS能够检测到脑组织细胞代谢过程中产生的N-乙酰门冬氨酸(N-accetyl aspartate,NAA)、胆碱化合物 (choline,Cho)、肌醇(myo-inositol,mI)、肌酸(Creatine,Cr)。本研究通过1H-MRS分析 MS、NMO患者脑部病变代谢化合物改变情况,期望对进一步探讨MS及NMO的病理生理学机制有所帮助。
1 对象和方法
1.1 观察对象 回顾性收集2009-01-2015-05中山大学附属第三医院神经病学科住院的MS患者26例,男10例、女16例,年龄14~57岁,平均(31.38±10.72)岁,病程23(0.3~156)个月,其中17例患者为急性期、9例患者为慢性期,均符合McDonald诊断标准(2010修订)[2]。所有 MS患者脑MRI均存在侧脑室旁T2液体衰减反转恢复(T2-fluid attenuated inversion recovery,T2-FLAIR)序列高信号病变。其中,14例患者病灶位于右侧侧脑室旁,12例患者病灶位于左侧侧脑室旁,病灶面积(105.0~270.0)mm2,平均(180.0±47.9)mm2。
NMO患者24例,男3例、女21例,年龄9.5~55岁,平均(35.0±13.3)岁,病程18.5(1~156)个月,其中16例患者为急性期、8例患者为慢性期,均符合2007Wingerchuk诊断标准[3]。NMO患者中,13例患者病灶位于右侧侧脑室旁,11例患者病灶位于左侧侧脑室旁,病灶面积(120.0~300.0)mm2,平均(202.0±58.3)mm2。
8例MS患者、5例NMO患者有侧脑室旁MRI T1增强序列强化病灶。2例MS患者、3例NMO患者脑MRI检查前曾用甲泼尼龙冲击治疗,16例MS患者在脑MRI检查前曾长期使用β干扰素。所有患者经临床和脑磁共振成像(magnetic resonance imaging,MRI)检查排除酗酒、药物滥用、癫痫、脑中风、脑肿瘤、脑炎、脑外伤、脑手术史、帕金森病、高血压、糖尿病等情况。
1.2 方法 影像学检查采用美国GE SignaTw inspeed 1.5T磁共振机、标准头线圈。扫描序列:常规MRI扫描包括横断位T1加权(重复时间TR 300~600ms,回波时间 TE 17ms)、T2加权(TR 3000~4000ms,TE 100ms)、T2FLAIR(TR 5020 ms,TE 99.7ms,反转时间 TI 2200ms)和矢状位T2FLAIR,扫描野(FOV)24cm×18cm,层厚5 mm,间距1mm,矩阵320×224,激励次数2次。所有病例均做Gd-DTPA增强扫描,剂量为0.2 mmol/kg体重,注射流率20mL/s,注射完毕后立即扫描。
1H-MRS采用 PROBE-CSI序列,成像参数TR/TE=1000ms/144ms,FOV 24cm×24cm,多体素相位矩阵18×18。匀场和水抑制均自动进行,要求FMNH小于10Hz,NEX=1。相位校正、基线调整、ppm(10-6)转换均自动进行。选用横断位T2加权序列作为1H-MRS的定位图像。在NMO及MS患者脑内病灶、对侧NAWM分别选取感兴趣区域(region of interest,ROI)。脑内病灶ROI定义为MS或NMO患者侧脑室旁脑实质内非对称性的一处T2高信号病变,即其对侧脑实质各MRI序列均无异常信号,面积>100mm2。NAWM的ROI定义为同一横断面上病灶对侧与其对称的NAWM区,其所分析面积与对侧病灶相同。将1H-MRS原始数据传输到GE AW4.1工作站,应用functoolⅡ 软件获得主要代谢物波谱,得到NAA、Cho、mI、Cr等代谢物的相对浓度,并计算出NAA/Cr、Cho/Cr及 mI/Cr的比值。
1.3 统计学处理 运用SPSS 16.0for windows软件进行分析。数据不符合正态分布者以中位数(范围)表示,符合正态分布者以均数±标准差表示。病灶及对侧 NAWM 的 NAA/Cr、Cho/Cr、mI/Cr比较采用配对t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 MS患者脑内病灶与对侧NAWM各项1HMRS指标比较 与对侧NAWM比较,MS患者脑内病灶 NAA/Cr减低(P<0.05);Cho/Cr及mI/Cr升高,但差异无统计学意义(均P>0.05)(表1、图1)。
表1 MS患者颅内病灶与其对侧NAWM的1 H-MRS指标比较(n=26,)
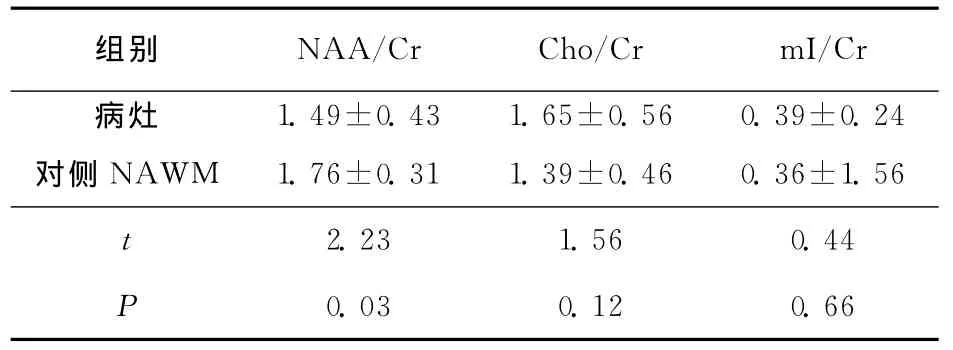
表1 MS患者颅内病灶与其对侧NAWM的1 H-MRS指标比较(n=26,)
组别 NAA/Cr Cho/Cr mI/1.49±0.43 1.65±0.56 0.39±0.24对侧 NAWM 1.76±0.31 1.39±0.46 0.36±1.56 t Cr病灶2.23 1.56 0.44 P 0.03 0.12 0.66
2.2 NMO患者脑内病灶与对侧NAWM各项指标比较 与对侧NAWM比较,NMO患者脑室旁病灶 NAA/Cr、Cho/Cr及 mI/Cr均减低,但差异无统计学意义(均P>0.05)(表2、图2)。
表2 NMO患者颅内病灶与其对侧NAWM的1 H-MRS指标比较(n=24,)

表2 NMO患者颅内病灶与其对侧NAWM的1 H-MRS指标比较(n=24,)
组别 NAA/Cr Cho/Cr mI/1.78±0.58 1.55±0.55 0.30±0.12对侧 NAWM 2.15±1.05 1.74±0.78 0.46±0.40 t Cr病灶1.024 0.643 1.267 P 0.32 0.52 0.23
3 讨论

A:脑横断面上T2-FLAIR高信号病灶;B:病灶的1 H-MRS谱线;C:同一横断面上病灶对侧T2-FLAIR NAWM;D:病灶对侧NAWM的1 H-MRS谱线图1 1例32岁女性MS患者的1 H-MRS表现:左侧脑室旁病灶(图1A中箭头所示),对应1 H-MRS示脑内病灶(图1C中箭头所示)NAA/Cr降低,Cho/Cr、mI/Cr升高(图B与D比较)。A:脑横断面上T2-FLAIR高信号病灶;B:病灶的1 H-MRS谱线;C:同一横断面上病灶对侧T2-FLAIR NAWM;D:病灶对侧NAWM的1 H-MRS谱线图2 1例41岁女性NMO患者的1 H-MRS表现:左侧脑室旁病灶(图2A中箭头所示),对应1 H-MRS示脑内病灶(图2C中箭头所示)NAA/Cr、Cho/Cr、mI/Cr减低(图B与D比较)
传统MRI技术,如T2加权序列、钆增强T 1加权序列及T2-FLAIR序列,对发现脑内病变敏感性高,能够提供病变的部位、大小、形态、是否急性期强化病灶等信息,对MS、NMO的诊断至关重要,同时也是监测疾病治疗效果的有效手段。然而,传统的MRI不能够解释疾病发生及发展过程。1H-MRS是目前唯一能无创性观察活体组织代谢及生化变化的技术,通常用两种或两种以上的代谢产物含量比来反映组织的代谢变化。脑组织细胞代谢过程中产生多种化合物,其中1H-MRS能够测得的脑中常见的化合物为NAA、Cho、mI、Cr。NAA在成熟脑组织仅存在于神经元胞体和轴突的活性线粒体中,是神经元完整性的标志,在神经元和轴突损伤时会明显下降[4-5]。Cho反映脑内细胞膜磷脂含量,其变化与髓鞘脱失有关[5],在白质中其含量高于灰质;mI被认为仅存在于神经胶质细胞中,因此上述指标的变化反映脑组织中非神经元细胞损伤及修复情况[5]。Cr反映肌酸和磷酸肌酸的总和,一般不会随病理变化而变化,所以临床上通常用它作为参考值,对代谢信号强度进行标准化,即通常计算 NAA/Cr、Cho/Cr等比值。研究表明上述比值仅与年龄有关,而与脑内部位、性别无关[6]。为了减少误差和控制非处理因素,本研究中对MS及NMO患者病灶及病灶对侧NAWM进行1H-MRS对比分析,进而研究MS、NMO患者脑部病变代谢化合物改变情况,期望对进一步探讨MS及NMO的病理生理学机制有所帮助。
MS是一种中枢神经系统的慢性、持续性炎性脱髓鞘疾病,MS患者脑内具有典型的白质病灶[7],病变常累及视神经、脑干、脊髓、小脑及脑室旁白质,亦可累及皮层及皮层下灰质[8]。MS患者常有脑萎缩及脑功能损害表现,包括认知障碍、疲劳等。MS的脑内病灶急性期病理改变为轴突损害、髓鞘脱失及胶质细胞增生,疾病恢复期时,脱髓鞘及胶质细胞增生仍存在。过去学者认为MS仅有脱髓鞘病变,神经元轴突相对完整。本研究中发现,MS患者脑内病灶的NAA/Cr较对侧下降,提示MS脑部病变有神经元轴突损害或缺失。MS患者急性期病灶有髓鞘溶解,髓鞘溶解对应Cho/Cr升高[5];但本研究中Cho/Cr与对侧NAWM 差异无统计学意义,可能与本研究中急性活动病灶较少有关。综上所述,MS脑内病变有严重的神经元轴突损害,这可能是MS患者神经功能缺损的主要原因。
NMO是一种选择性累及视神经和脊髓的中枢神经系统炎性疾病[9],患者脑内无异常或者仅有非特异性白质改变。NMO患者在第一次复发后,约60%头颅MRI检查可发现病灶[10],大多数病灶(约80%)是非特异性的,并且无相关临床表现。有研究发现,给予NMO患者糖皮质激素或血浆置换后,一些NMO患者脊髓和颅内病灶有可逆性的改变,因此该研究者认为NMO的病理生理学变化为血管源性水肿伴急性炎性反应[11-13]。Jeantroux等[14]对25例 NMO患者进行DTI研究发现,NMO患者脑内病变局限在视放射及皮质脊髓束,而这些区域之外的纤维束则正常。本研究中,NMO患者脑内病灶NAA/Cr较对侧差异无统计学意义,提示NMO病灶无明显神经元轴突损害或髓鞘脱失。
1H-MRS由于技术要求高、图像采集时间长、费用高等因素,使其在临床工作中受到限制,所以本研究病例数不多,且目前国内外1H-MRS研究尚无标准化的采集及分析方法,所以尚不能得出统一的结论,有待于进一步深入研究。近年来MRI成像技术及数据分析技术的发展,有利于搜集更多病例资料,充分运用无创的1H-MRS技术对NMO、MS病理生理学机制等进行研究,以更好的支持临床诊疗工作。
[1]Lennon VA,Wingerchuk DM,Kryzer TJ,et al.A serum autoantibody marker of neuromyelitis optica:distinction from multiple sclerosis[J].Lancet,2004,364(9451):2106-2112.
[2]Mathiesen HK,Sorensen PS.Diagnosis of multiple sclerosis——the 2010revision of the McDonald criteria[J].Ugeskr Laeger,2012,174(13):862-865.
[3]Jarius S,Paul F,Franciotta D,et al.Revised diagnostic criteria for neuromyelitis optica——incorporation of NMO-IgG status[J].Nat Clin Pract Neurol,2007,3(5):E1.
[4]Rigotti DJ,Inglese M,Gonen O.Whole-brain N-acetylaspar-tate as a surrogate marker of neuronal damage in diffuse neurologic disorders[J].AJNR Am J Neuroradiol,2007,28(10):1843-1849.
[5]Bitsch A,Bruhn H,Vougioukas V,et al.Inflammatory CNS demyelination:histopathologic correlation with in vivo quantitative proton MR spectroscopy[J].AJNR Am J Neuroradiol,1999,20(9):1619-1627.
[6]郭世萍,鱼博浪,孙亲利,等.正常人脑氢质子磁共振波谱的研究[J].西安交通大学学报(医学版),2005(05):83-85,103.
[7]Mandler RN,Davis LE,Jeffery DR,et al.Devic’s neuromyelitis optica:a clinicopathological study of 8patients[J].Ann Neurol,1993,34(2):162-168.
[8]Pirko I,Lucchinetti CF,Sriram S,et al.Gray matter involvement in multiple sclerosis[J].Neurology,2007,68(9):634-642.
[9]Kira J.Neuromyelitis optica and opticospinal multiple sclerosis:Mechanisms and pathogenesis[J].Pathophysiology.2011,18(1):69-79.
[10]Cabrera-Gomez JA,Quevedo-Sotolongo L,Gonzalez-Quevedo A,et al.Brain magnetic resonance imaging findings in relapsing neuromyelitis optica[J].Mult Scler,2007,13(2):186-192.
[11]Matsushita T,Isobe N,Piao H,et al.Reappraisal of brain MRI features in patients with multiple sclerosis and neuromyelitis optica according to anti-aquaporin-4antibody status[J].J Neurol Sci,2010,291(1-2):37-43.
[12]Roemer SF,Parisi JE,Lennon VA,et al.Pattern-specific loss of aquaporin-4immunoreactivity distinguishes neuromyelitis optica from multiple sclerosis[J].Brain,2007 :1194-1205.
[13]Ito S,Mori M,Makino T,et al.“Cloud-like enhancement”is a magnetic resonance imaging abnormality specific to neuromyelitis optica[J].Ann Neurol,2009,66(3):425-428.
[14]Jeantroux J,Kremer S,Lin XZ,et al.Diffusion tensor imaging of normal-appearing white matter in neuromyelitis optica[J].J Neuroradiol,2012,39(5):295-300.
