全细胞催化法生产N-乙酰神经氨酸的研究进展
2015-07-19张丛丛陈彩霞陈笑温雅晏礼明陶勇
张丛丛 陈彩霞 陈笑 温雅 晏礼明 陶勇
(中国科学院微生物研究所,北京 100101)
全细胞催化法生产N-乙酰神经氨酸的研究进展
张丛丛 陈彩霞 陈笑 温雅 晏礼明 陶勇
(中国科学院微生物研究所,北京 100101)
N-乙酰神经氨酸(N-acetyl-D-neuraminic acid,Neu5Ac)及其衍生物不仅在人体内发挥重要的生理生化功能,且已经应用到流感的预防和治疗。但已有的N-乙酰神经氨酸生产方法产量低、成本高,限制了其大规模生产和广泛应用。随着分子生物学技术及糖组学研究的发展与成熟,一种新型的生物技术即全细胞催化法生产N-乙酰神经氨酸正成为研究的热点。旨在介绍全细胞催化技术合成N-乙酰神经氨酸的研究进展。
N-乙酰神经氨酸;唾液酸;全细胞催化法;生物转化
唾液酸(Sialic acid,SA)是一类Neu5Ac的O-乙酰基衍生物[1],在微生物及哺乳动物体内大量存在[2]。迄今,分离鉴定的唾液酸类化合物已有40多种[3],其中Neu5Ac约占整个唾液酸家族的99%以上[4,5]。少以游离形式存在,多连接在细胞膜表面的糖蛋白、糖脂或寡糖末端[6]。Neu5Ac是细胞信息传递的第一接触位点[7],且其分子结构具有多样性,因此Neu5Ac参与细胞识别、信号转导、肿瘤发生、受精等多个生理过程[8-12]。此外,Neu5Ac能调节IgG的抗炎活性,增强婴儿免疫力,影响神经细胞的完整性、渗透性及活性,促进婴儿大脑的发育[13-16]。以唾液酸为主体结构的一系列药物已被用于癌症、炎症及流感的治疗[17,18]。但现有生产方法产量低、成本高,难以满足市场需求,因而建立经济高效的生产方法成为研究热点。
目前制备Neu5Ac的方法主要有:天然原料提取法、化学合成法、酶促合成法、生物转化法及微生物发酵法等。19世纪60年代以来,研究者相继从牛初乳、卵黄、酪蛋白和燕窝等SA含量相对丰富的天然材料中提取Neu5Ac[19-22]。但SA在天然原料中总含量低、分离提纯过程复杂,导致其收率低、成本高、产物立体选择性较差,难以实现工业化生产。化学合成法多是在碱性或酸性条件下,由多种底物在催化剂的催化下合成,整个过程既需高温、高压等严苛的反应条件、复杂的生产工艺,还涉及复杂的基团保护、去保护问题;且反应过程中生成较多的中间产物及异构体,使产物后处理极其繁琐,不能满足工业化生产的要求[23-27]。此外,Neu5Ac还可通过水解微生物发酵的聚唾液酸得到。但此法产物浓度低,生长周期长,多伴有副产物,仅限于小规模试验。生物合成法反应条件温和、转化率高、后处理简单、专一性好、产品纯度高,已逐渐取代传统工艺成为新型“绿色”生产技术。随着代谢工程、基因工程手段的发展,与基因工程技术相结合的全细胞催化法(whole-cell biocatalysis),已成为大规模生产Neu5Ac的最理想途径。因此,本文将重点介绍近年来全细胞催化法生产Neu5Ac的研究进展。
1 全细胞催化法生产N-乙酰神经氨酸
全细胞催化法的基本原理是利用完整的生物有机体作为催化剂进行化学转化,将某种前体分子转化成特定产物,其实质是利用生物体系中酶的催化作用[28]。该方法主要是利用代谢工程原理,结合基因工程手段,对Neu5Ac代谢途径进行改造进而实现产物的大量合成。主要手段包括在宿主细胞中过表达合成途径中的相关酶蛋白,或敲除其降解途径的相关酶基因,解除产物的反馈抑制。而该方法的主要依据是Neu5Ac在生物体内的多种合成途径(图1)。
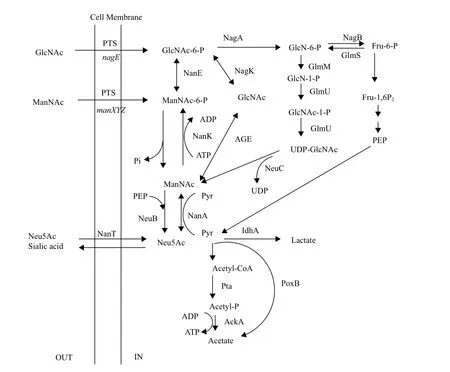
图1 Neu5Ac的生物合成途径[29-32]
全细胞催化法合成Neu5Ac得以实现首先归功于1986年Aisaka等的工作,他们首次从E.coli中克隆并表达出N-乙酰神经氨酸醛缩酶(N-Acetylneuraminic acid aldolase,NanA),揭开了全细胞催化法生产Neu5Ac的序幕。随后,研究者相继从多杀巴斯德杆菌病(Pasteurella multocida)、Bacteroides ovatus ATCC 8483中分别克隆出NanA、N-乙酰葡萄糖胺异构酶(GlcNAc 2-epimerase)[33-36],并对其酶学性质进行了较全面的研究,促使全细胞催化技术不断发展并日益成熟。迄今,全细胞催化技术经历了多细胞偶联和单细胞合成两个阶段。
1.1 双细胞及多细胞偶联系统
Tabata等[37]创造性地将全细胞催化法应用于Neu5Ac的合成。他们以E. coli NM522为宿主菌,分别克隆并过表达单细胞集胞藻(Synechocystis sp. PCC6803)的N-乙酰葡萄糖胺异构酶基因(slr1975)、大肠杆菌(E.coli K-1)的Neu5Ac合酶基因(neuB),同时偶联产氨棒杆菌(Corynebacterium ammoniagenes)并利用其代谢过程中产生的磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP),共同合成Neu5Ac,构建了一个新型的微生物转化系统(图2)。该方法以800 mmol/L N-乙酰葡萄糖胺(N-acetyl-D-glucosamine,GlcNAc)和360 mmol/L葡萄糖作为起始反应体系,反应22 h后产生39.7 mmol/L(12.3 g/L) Neu5Ac,GlcNAc转化率为5%。
虽然产物的产量较低,但这是首次在原核生物中克隆并表达出slr1975,为日后的研究工作提供了新思路。这种方法最大优点是利用工程菌的胞内酶,使整个反应在细胞内完成,前体物质GlcNAc经异源表达的专一性酶催化生成目标产物,实现了酶的级联反应。该方法有效提高了合成效率,避免了繁琐的酶纯化过程,简化了生产工艺,节省了ATP的添加成本,为工业化生产Neu5Ac提供了新的实验依据。
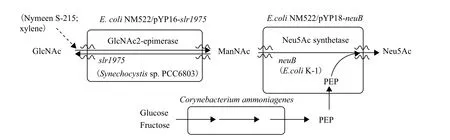
图2 多细胞偶联催化合成Neu5Ac[37]
2007年,Xu等[38]提出了化学合成法与生物转化法相结合的新方法。该方法综合了细菌氧化乳酸生成丙酮酸的反应专一性与化学异构化合成ManNAc的高效性,建立了一种高效、经济的复合式转化系统。其利用E.coli K-12 的N-乙酰神经氨酸醛缩酶基因(nanA)与E. coli BL21构建了重组菌E. coli BL21(DE3)/pET15b-nanA,并与施氏假单胞菌(Pseudomonas stutzeri SDM)相偶联,形成双细胞偶联系统。施氏假单胞菌的乳酸氧化酶复合物(lactate oxidase,LOX)专一性地催化乳酸生成丙酮酸[39],与化学异构化得到的ManNAc在重组细胞内协同合成Neu5Ac(图3)。结果显示,223.18 g/L GlcNAc及65.61 g/L乳酸生成18.32 g/L Neu5Ac,产量比Tabata等的研究结果提高了约50%,同时提高了GlcNAc的转化效率,达到6%。
该方法的优点在于将化学合成与生物转化相结合,一方面利用化学合成法高效快速地异构化GlcNAc产生高浓度的ManNAc,促使可逆反应向生成Neu5Ac的方向进行,提高了GlcNAc的转化效率;另一方面,在重组菌中表达的NanA比E.coli K-12中的活性高约56倍,极大地提高了酶活性,有效提高了生物合成效率。而且生物转化法能够减少副产物的产生,使反应易于控制与操作。对于工业化生产,用低价的乳酸取代丙酮酸作为底物,极大地降低了生产成本。
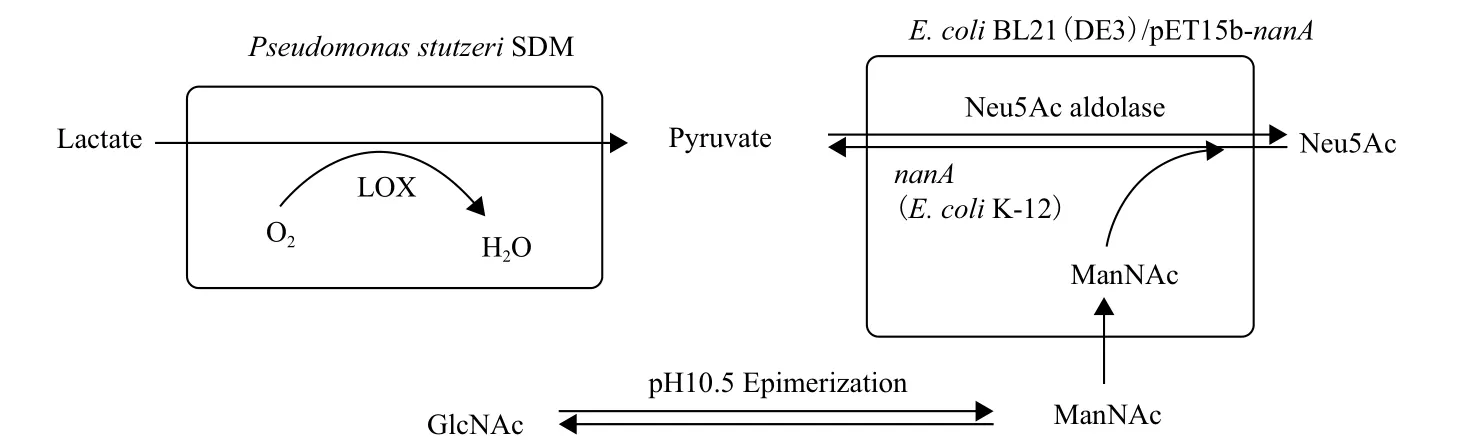
图3 化学合成法与双细胞偶联法相结合生成Neu5Ac[38]
同年,Lee等[40]研究发现鱼腥藻属(Anabaena sp. CH1)的N-乙酰葡糖胺异构酶(bGlcNAc 2-epimerase,bage)活性比猪肾的N-乙酰葡糖胺异构酶(pGlcNAc 2-epimerase,page)高11.5倍。因此构建工程菌时,他们将bage和E. coli K-1的nanA,分别导入宿主菌E. coli BL21,构建了两株重组 菌E. coli BL21(DE3)/pET-bage及E. coli BL21(DE3)/pET-nanA,形成双细胞偶联的微生物转化系统(图4)[41]。由1 200 mmol/L GlcNAc和1 200 mmol/L丙酮酸作为初始反应体系,转化12 h后,产物Neu5Ac终浓度高达122.3 g/L,生成速率为10.2 g/L/h,GlcNAc转化效率达到33%。该方法的产量及转化效率均较同期的全细胞催化法有大幅度的提高。该方法的另一个创新之处为该系统的工程菌细胞能循环使用8次,并且每个循环中Neu5Ac生成速率均维持在8.0 g/L/h以上。
该方法比较了不同的异构酶基因活性,运用高活性的异构酶促进了Neu5Ac产量显著提高。同时,目标产物的生成速率提高了近5倍。这为后期提高Neu5Ac产量,实现大规模生产提供了新的实验思路。更值得一提的是,该方法首次提出多次循环利用工程菌,缩短了生产周期,简化了操作工艺,降低了发酵成本,使工程菌得到了最大程度的利用。但该方法仍存在需改进的工艺,其要求的底物浓度较高,较高的成本限制了工业化生产。
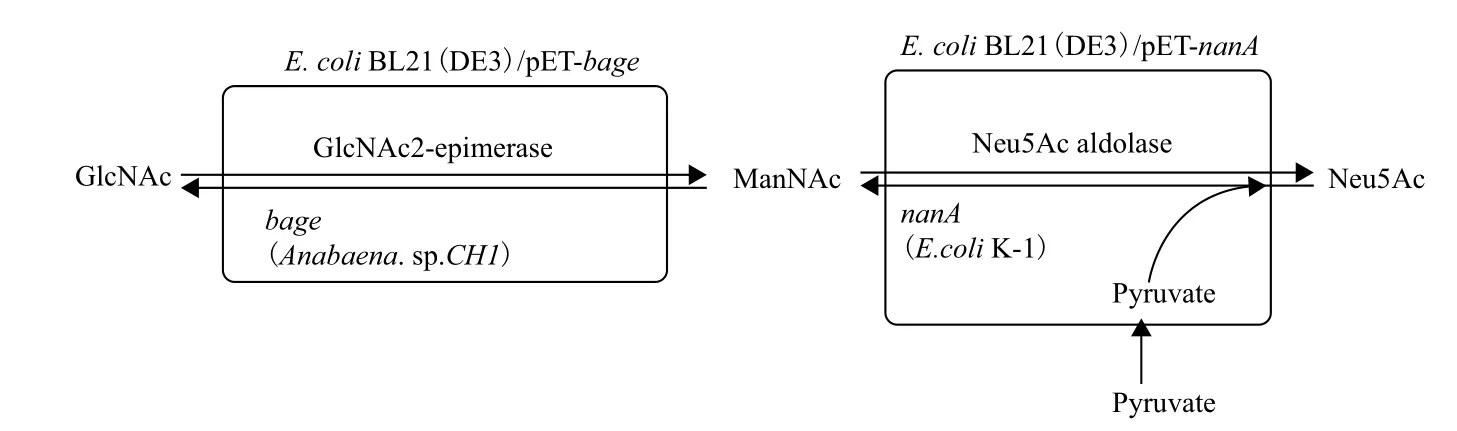
图4 双细胞偶联法催化合成Neu5Ac[41]
2010年,Zhang等[42]在双细胞偶联法的基础上,首次使用温度诱导系统取代化学诱导系统。以E. coli K12作为宿主菌,分别用温度诱导载体pBV220克隆表达Synechocystis sp. PCC 6803的slr1975以及E. coli K-1的nanA,以丙酮酸和GlcNAc为前体物质合成Neu5Ac。转化36 h后,由200 mmol/L GlcNAc生成61.9 mmol/L(19.1 g/ L) Neu5Ac,转化率达到30.95%(图5)。虽然该方法的产量没有明显提高,但仅通过简单地提高温度来诱导表达相比于有毒性的异丙基-β-D-硫代半乳糖苷(IPTG)诱导更安全高效。该方法不仅保证了底物的高转化率,也创新性提出了一种简便安全、经济有效的生产工艺,为安全化工业生产提供了有力的保障。
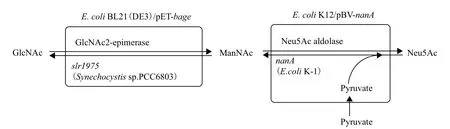
图5 温度诱导系统为特征的双细胞偶联法合成Neu5Ac[42]
微生物多细胞及双细胞偶联转化系统的提出与发展,使得产量显著提高,极大地推动了实现Neu5Ac工业化生产的进程。在此基础上,不断有人对Neu5Ac的合成,包括宿主菌、诱导系统、催化酶及供体基因进行研究和优化,使该工艺日臻完善,操作流程更简单,反应条件更温和,生产工艺更环保,生产成本更低廉。但由于多细胞及双细胞偶联系统常需两种及两种以上细胞作为载体,一方面难以维持系统的平衡以及细胞间的协调;另一方面细胞间传质阻力会阻碍中间产物的转运,降低了底物利用率。此外,系统中的副反应也在一定程度上降低Neu5Ac的产量。因此,为了克服细胞间的传质阻力、解决系统间的协调与平衡、提高底物利用率,尝试将整个合成过程在单细胞内实现成为研究者追求的目标。
1.2 单细胞合成系统
2010年Ishikawa等[43]在前期工作的基础上,首次实现了单细胞合成Neu5Ac技术(图6)。将slr1975、neuB基因导入E.coli构建重组菌E.coli N18-14/pLT4K,使其具备异构酶及合酶活性,从而在单细胞内完成整个合成过程。这有效地避免了传质阻力引起的底物利用率降低。同时,敲除了nanA,使菌体丧失醛缩酶活性,防止Neu5Ac裂解。并且将工程菌用表面活性剂Nymeen S-215和甲苯处理,使之获得高通透性,利于底物跟产物的胞内外转运从而促进反应向合成方向进行。在GlcNAc用量为540 mmol/L(120 g/L)的体系反应22 h,产物浓度达172 mmol/L(53 g/L),产物生成速率为2.41 g/L/h,转化率达32%。这是利用单细胞系统生产Neu5Ac的首创。
该技术与多细胞偶联系统相比具有明显优势:首先,该体系仅由一种工程菌组成,更利于系统内的平衡与协调,也简化了工艺过程;其次,减少了底物及中间产物在细胞间的传递步骤,提高了底物利用率;三是,随着底物利用率的增加,Neu5Ac的产量明显提高;四是,代谢途径的进一步优化,减少了合成过程中的副反应,进一步促进了产物的积累;五是,应用单细胞体系,便于菌体的分离及循环利用,简化了Neu5Ac的分离纯化流程。另外,在反应体系中添加表面活性剂以增强细胞膜通透性,促进物质转运,为后期研究提供了新思路,但寻求更加安全合适的表面活性剂将是研究者进一步探究的方向。
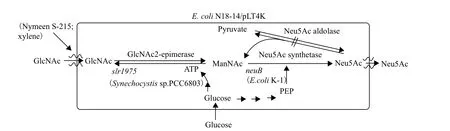
图6 单细胞催化合成Neu5Ac[43]
2011年,Tao等[44]在前期工作基础上结合单细胞合成法,进一步优化改造宿主菌的代谢途径,建立了“one-pot”反应系统。首先敲除编码葡萄糖特异PTS转运体的基因(nagE),使磷酸转移酶活性丧失,因此GlcNAc能够直接进入Neu5Ac合成途径。然后用温度诱导载体pBV220将slr1975转化到突变体E.coli K-12中,与nanA共表达,组成“one-pot”转化系统(图7)。该方法以溴化十六烷三甲基铵(cetyl trimethyl ammonium bromide,CTAB)作为表面活性剂,使Neu5Ac产量提高了一倍多。结果显示,该系统36 h 能产生191 mmol/L(59 g/L)的Neu5Ac,产物生成速率约1.64 g/L/h。
该方法在保障高产高转化率的前提下,以温度诱导型质粒作为载体,以CTAB取代二甲苯作为表面活性剂,保证了生产过程的安全性。而且,由于大肠杆菌对CTAB的较高耐受性,能在一定程度上提高菌体效率,从而提高了整个系统的生产效率。
2012年,Kang等[45]在E. coli中 设计了一条以葡萄糖为唯一底物、以N-乙酰葡糖胺六磷酸(GlcNAc-6-P)为中间产物的Neu5Ac合成通路(图8)。首先将Saccharomyces cerevisiae EBY100的葡萄糖-6-磷酸乙酰转移酶基因(GNA1)、slr1975及nanA导入受体菌E. coli DH5α中共表达。同时过表达葡萄糖-6-磷酸合酶基因(glmS)解除其反馈抑制,并敲除nanE、nanK、nagA等基因以增加GlcNAc及ManNAc的积累;敲除丙酮酸在其他代谢途径中的相关酶基因以保证丙酮酸完全进入Neu5Ac合成途径而不被降解;敲除Neu5Ac向胞内转运的基因nanT保证产物充分运输到细胞外,促进反应向合成方向进行。最初该工程菌直接利用葡萄糖可产生1.62 g/L Neu5Ac,后经分批补料发酵产量可达7.85 g/L。

图7 “one-pot”反应系统[44]
该方法利用菌体自身的代谢途径并加以改造,实现了以葡萄糖为唯一底物合成Neu5Ac的愿景。虽然产量较低但用葡萄糖取代了GlcNAc、丙酮酸等高价的底物,极大地降低了生产成本,为开发更加简洁高效的Neu5Ac合成途径奠定了基础。
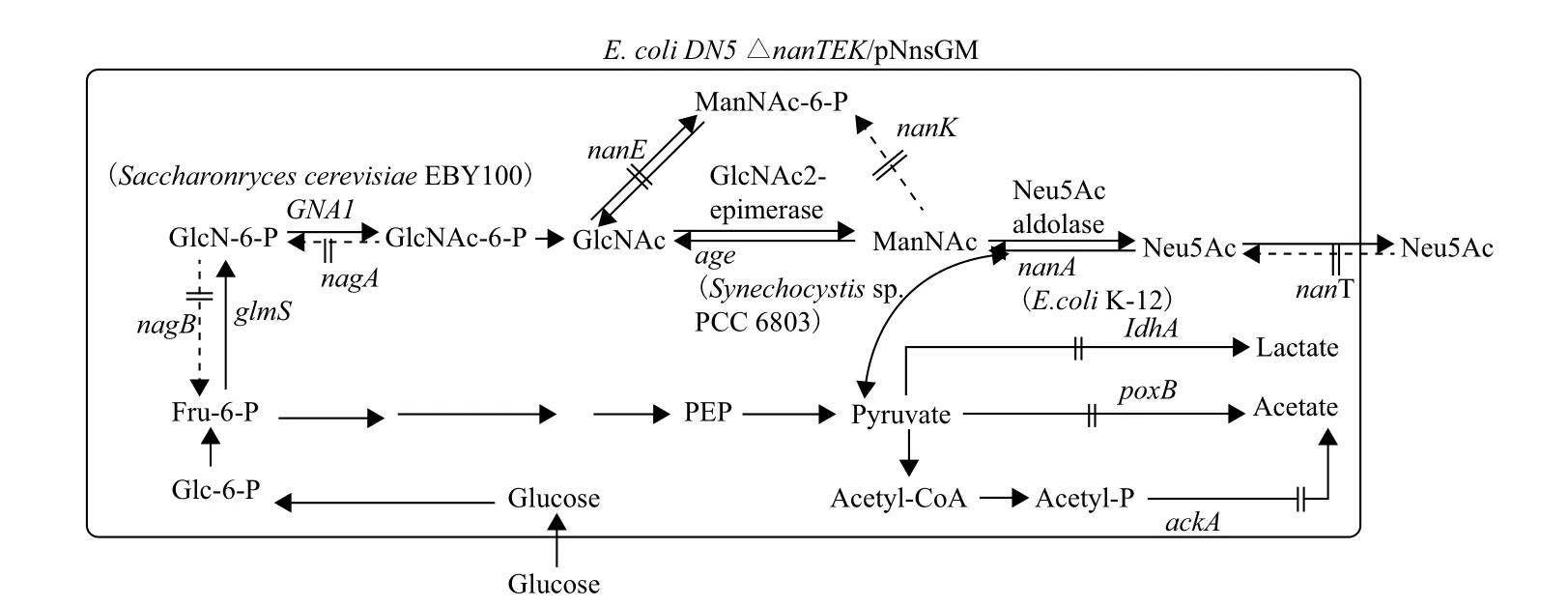
图8 以葡萄糖为底物的Neu5Ac合成途径[45]
2013年,Sun等[32]研究了多顺反子质粒上Nal与anAGE基因顺序对Neu5Ac产量的影响。结果表明重组菌E. coli Rosetta(DE3) pLysS:pET-28a-Nal-anAGE合成的Neu5Ac产量最高。含0.8 mol/L GlcNAc与1.2 mol/L丙酮酸的反应体系产生了61.3 g/L Neu5Ac。该研究创造性的提出了基因顺序对Neu5Ac产量有影响并得到证实,为进一步优化合成途径提供了一定理论依据。
关于全细胞催化法合成Neu5Ac的最新报道是本研究组在大量前期研究的基础上提出的一个更简单高效的转化系统(图9)[46]。该系统以E. coli K-12为宿主菌,敲除nanTEK,导入age及nanA共表达,获得重组菌E. coliΔ nanTEK/pNA。在此菌株中阻断了Neu5Ac合成的竞争反应,保证ManNAc充分进入Neu5Ac合成途径,同时使Neu5Ac不断运出细胞促使反应向合成方向进行,结果0.6 mol/L GlcNAc 及0.8 mol/L丙酮酸的反应体系生成74.2 g/L Neu5Ac,产物生成速率达到6.2 g/L/h,转化率高达40%。并且菌体可以回收循环利用5次。
该系统Neu5Ac的产量及产物生产速率均是目前报道的单细胞合成法最高值。其利用较低的底物浓度,获得较高的产物生成速率,成为目前合成Neu5Ac最为理想的方式,进一步推动了全细胞催化法合成Neu5Ac实现工业化生产的进程。
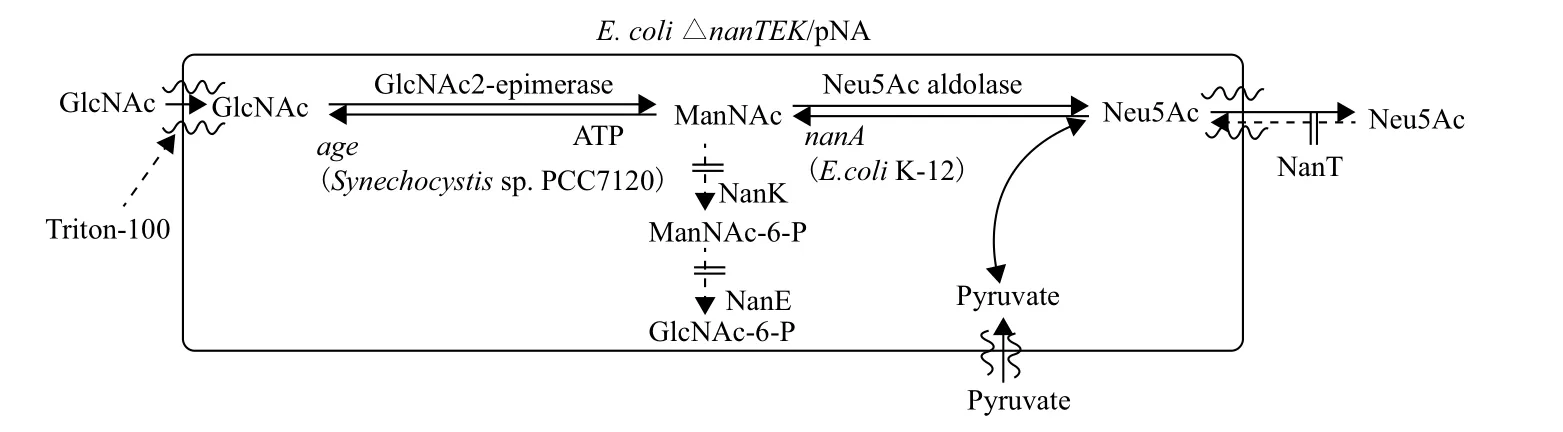
图9 优化后的Neu5Ac单细胞合成系统[46]
2 展望
在最近10多年中,依赖于基因工程与分子生物学技术的发展,Neu5Ac的全细胞催化合成与应用取得了引人瞩目的成绩和进步,已成为合成Neu5Ac的最理想方式。全细胞催化法作为对环境友好,低投资的前瞻性工艺路线,与化学合成法相比,全细胞催化法应用专一性的酶对前体物质进行专一性地酶促反应,副产物少,且反应条件温和、污染低;与微生物发酵法相比,全细胞催化法生产周期更短,操作条件更容易控制,细胞或酶易再生、可循环使用,更适合大规模生产;与酶法合成相比,全细胞催化法在细胞内进行催化合成,能够激活异构酶,还可省去繁琐耗时的酶纯化过程,并且生产过程中的反应是通过生命体自动调节方式进行,可充分利用微生物代谢产生的ATP,避免了添加昂贵的ATP,从而使反应过程更高效率、低成本、绿色环保。
迄今,Neu5Ac的合成工艺已日趋完善,但仍存在一定的改进空间。例如,寻找更高活性的合成酶,从而提高全细胞催化速率;设计更高效的合成途径,构建更加稳定耐受的工程菌,最大程度上解除反馈抑制与竞争性反应,尽量减少副产物积累,提高工程菌的利用率;寻找更廉价的底物代替常用底物,降低生产成本;优化反应条件,进行工业化放大,建立一条简便、安全、环保的生产工艺路线。因此,运用代谢工程、基因手段改造及筛选更合适的微生物催化剂仍是重要的研究课题。
[1] Chen X, Varki A. Advances in the biology and chemistry of sialic acids[J]. ACS Chemical Biology, 2009, 5(2):163-176.
[2] Schauer R. Biochemistry and role of sialic acids[M]// Rosenberg A. Biology of the Sialic Acids. New York:Plenum Publishing Corporation, 1995:57-67.
[3] Tao F, Zhang Y, Ma C, et al. Biotechnological production and applications of N-acetyl-D-neuraminic acid:current state and perspectives[J]. Applied Microbiology and Biotechnology, 2010, 87(4):1281-1289.
[4] Yu R, Ledeen R. Configuration of the ketosidic bond of sialic acid[J]. Journal of Biological Chemistry, 1969, 244(5):1306-1313.
[5] Rosenberg A, Schengrund CL. Biological roles of sialic acid[M]. New York:Plenum Publishing Corporation, 1976.
[6] Varki A. Diversity in the sialic acids[J]. Glycobiology, 1992, 2(1):25-40.
[7] Reuter G, Gabius HJ. Sialic acids structure analysis metabolism occurrence recognition[J]. Biological Chemistry Hoppe-Seyler, 1996, 377(6):325-342.
[8] Schauer R. Sialic acids as regulators of molecular and cellular interactions[J]. Current Opinion in Structural Biology, 2009, 19(5):507-514.
[9] Schauer R. Achievements and challenges of sialic acid research[J]. Glycoconjugate Journal, 2000, 17(7-9):485-499.
[10] Hu S, Chen J, Yang Z, et al. Coupled bioconversion for preparation of N-acetyl-D-neuraminic acid using immobilized N-acetyl-D-glucosamine-2-epimerase and N-acetyl-D-neuraminic acid lyase[J]. Applied Microbiology and Biotechnology, 2010, 85(5):1383-1391.
[11] Kelm S, Schauer R, Crocker P. The Sialoadhesins—a family of sialic acid-dependent cellular recognition molecules within the immunoglobulin superfamily[J]. Glycoconjugate Journal, 1996, 13(6):913-926.
[12] Kelm S, Schauer R. Sialic acids in molecular and cellularinteractions[J]. International Review of Cytology, 1997, 175:137-240.
[13] Böhm S, Schwab I, Lux A, et al. The role of sialic acid as a modulator of the anti-inflammatory activity of IgG[J]. Seminars in Immunopathology, 2012, 34(3):443-453.
[14] Oriquat GA, Saleem TH, Abdullah, ST, et al. Soluble CD14, sialic acid and L-fucose in breast milk and their role in increasing the immunity of breast-fed infants[J]. American Journal of Biochemistry and Biotechnology, 2011, 7(1):21-28.
[15] Wielga P, Braszko JJ. The participation of sialic acids in microglia neuron interactions[J]. Cellular Immunology, 2012, 273(1):17-22.
[16] Sprenger N, Julita M, Donnicola D, et al. Sialic acid feeding aged rats rejuvenates stimulated salivation and colon enteric neuron chemotypes[J]. Glycobiology, 2009, 19(12):1492-1502.
[17] Varki NM, Varki A. Diversity in cell surface sialic acid presentations:implications for biology and disease[J]. Laboratory Investigation, 2007, 87(9):851-857.
[18] Bondioli L, Ruozi B, Belletti D, et al. Sialic acid as a potential approach for the protection and targeting of nanocarriers[J]. Expert Oopinion on Drug Delivery, 2011, 8(7):921-937.
[19] Blix F, Gottschalk A, Klenk E. Proposed nomenclature in the field of neuraminic and sialic acids[J]. Nature, 1957, 179:1088.
[20] Juneja LR, Koketsu M, Nishimoto K, et al. Large-scale preparation of sialic-acid from chalaza and egg-yolk membrane[J]. Carbohydrate Research, 1991, 214(1):179-186.
[21] Schaue R, Stoll S, Reuter G. Differences in the amount of N-acetyland N-glycoloyl-neuraminic acid, as well as O-acylated sialic acids, of fetal and adult bovine tissues[J]. Carbohydrate Research, 1991, 213:353-359.
[22] Koketsu M, Juneja LR, Kawanami H, et al. Preparation of N-acetylneuraminic acid from delipidated egg yolk[J]. Glycoconjugate Journal, 1992, 9(2):70-74.
[23] Furuhata K. Chemistry of N-acetylneuraminic acid(Neu5Ac)[J]. Trends Glycosci Glycotechnol, 2004, 16:143-169.
[24] Cornforth J, Firth M, Gottschalk A. The synthesis of N-acetylneuraminic acid[J]. Biochemical J, 1958, 68(1):57.
[25] Chan TH, Lee MC. Indium-mediated coupling of α-(Bromomethyl)acrylic acid with carbonyl compounds in aqueous media. concise syntheses of(+)-3-Deoxy-D-glycero-D-galacto- nonulosonic acid and N-acetylneuraminic acid[J]. The Journal of Organic Chemistry, 1995, 60(13):4228-4232.
[26] Danishefsky SJ, DeNinno MP, Chen SH. Stereoselective total syntheses of the naturally occurring enantiomers of N-acetylneuraminic acid and 3-deoxy-D-manno-2-octulosonic acid. A new and stereospecific approach to sialo and 3-deoxy-D-manno-2-octulosonic acid conjugates[J]. Journal of the American Chemical Society, 1988, 110(12):3929-3940.
[27] Haag-Zeino B, Schmidt RR. De novo synthesis of carbohydrates and related natural products, 34. Synthesis of N-acetyl-β-D-neuraminic acid derivatives via inverse-type hetero-Diels-Alder reaction[J]. Liebigs Annalen der Chemie, 1990, 1990(12):1197-1203.
[28] 郭明, 胡昌华. 生物转化—从全细胞催化到代谢工程[J]. 中国生物工程杂志, 2010, 30:110-115.
[29] Plumbridge J, Vimr E. Convergent pathways for utilization of the amino sugars N-acetylglucosamine, N-acetylmannosamine, and N-acetylneuraminic acid by Escherichia coli[J]. Journal of bacteriology, 1999, 181(1):47-54.
[30 Vimr ER, Kalivoda KA, Deszo EL, et al. Diversity of microbial sialic acid metabolism[J]. Microbiology and Molecular Biology Reviews, 2004, 68(1):132-153.
[31] Ferrero MÁ, Aparicio LR. Biosynthesis and production of polysialic acids in bacteria[J]. Applied Microbiology and Biotechnology, 2010, 86(6):1621-1635.
[32] Sun W, Ji W, Li N, et al. Construction and expression of a polycistronic plasmid encoding N-acetylglucosamine 2-epimerase and N-acetylneuraminic acid lyase simultaneously for production of N-acetylneuraminic acid[J]. Bioresource Technology, 2013, 130:23-29.
[33] Li Y, Yu H, Cao H, et al. Pasteurella multocida sialic acid aldolase:a promising biocatalyst[J]. Applied Microbiology and Biotechnology, 2008, 79(6):963-970.
[34] North RA, Kessans SA, Atkinson SC, et al. Cloning, expression, purification, crystallization and preliminary X-ray diffraction studies of N-acetylneuraminate lyase from methicillin-resistant Staphylococcus aureus[J]. Acta Crystallogr Sect F, 2013, 69(3):306-312.
[35] Maru I, Ohta Y, Murata K, et al. Molecular cloning and identification of N-acyl-D-glucosamine 2-epimerase from porcine kidney as a renin-binding protein[J]. Journal of BiologicalChemistry, 1996, 271(27):16294-16299.
[36] Sola-Carvajal A, Sánchez-Carrón G, García-García MI, et al. Properties of BoAGE2, a second N-acetyl-D-glucosamine 2-epimerase from Bacteroides ovatus ATCC 8483[J]. Biochimie, 2012, 94(1):222-230.
[37] Tabata K, Koizumi S, Endo T, et al. Production of N-acetyl-D-neuraminic acid by coupling bacteria expressing N-acetyl-D-glucosamine 2-epimerase and N-acetyl-D-neuraminic acid synthetase[J]. Enzyme and Microbial Technology, 2002, 30(3):327-333.
[38] Xu P, Qiu JH, Zhang YN, et al. Efficient whole-cell biocatalytic synthesis of N-acetyl-D- neuraminic acid[J]. Advanced Synthesis & Catalysis, 2007, 349(10):1614-1618.
[39] Hao J, Ma C, Gao C, et al. Pseudomonas stutzeri as a novel biocatalyst for pyruvate production from DL-lactate[J]. Biotechnology Letters, 2007, 29(1):105-110.
[40] Lee YC, Wu HM, Wang WC, et al. The central cavity from the(α/α)6 barrel structure of Anabaena sp. CH1 N-acetyl-D- glucosamine 2-epimerase contains two key histidine residues for reversible conversion[J]. Journal of Molecular Biology, 2007, 367(3):895-908.
[41] Lee YC, Chien HC, Hsu WH. Production of N-acetyl-D-neuraminic acid by recombinant whole cells expressing Anabaena sp. CH1 N-acetyl-D-glucosamine 2-epimerase and Escherichia coli N-acetyl-D-neuraminic acid lyase[J]. Journal of Biotechnology, 2007, 129(3):453-460.
[42] Zhang YN, Tao F, Du MF, et al. An efficient method for N-acetyl-D-neuraminic acid production using coupled bacterial cells with a safe temperature-induced system[J]. Applied Microbiology and Biotechnology, 2010, 86(2):481-489.
[43] Ishikawa M, Koizumi S. Microbial production of N-acetylneuraminic acid by genetically engineered Escherichia coli[J]. Carbohydrate Research, 2010, 345(18):2605-2609.
[44] Tao F, Zhang YN, Ma CQ, et al. One-pot bio-synthesis:N-acetyl-D-neuraminic acid production by a powerful engineered whole-cell catalyst[J]. Scientific Reports, 2011, 1:142.
[45] Kang J, Gu P, Wang Y, et al. Engineering of an N-acetylneuraminic acid synthetic pathway in Escherichia coli[J]. Metabolic Engineering, 2012, 14(6):623-629.
[46] Lin BX, Zhang ZJ, Liu WF, et al. Enhanced production of N-acetyl-D-neuraminic acid by multi-approach whole-cell biocatalyst[J]. Applied Microbiology and Biotechnology, 2013, 97(11):4775-4784.
Advances in Production of N-acetyl-D-neuraminic Acid by Whole-cell Biocatalysis
Zhang Congcong Chen Caixia Chen Xiao Wen Ya Yan Liming Tao Yong
(Institute of Microbiology,Chinese Academy of Sciences,Beijing 100101)
N-acetyl-D-neuraminic acid and its derivatives have versatile biological functions and considerable contribution in the therapeutics field. But the production and wide applications of Neu5Ac are limited by the low yield and high cost. With the development of Molecular Biology and the research of Glycomics, the production Neu5Ac by whole-cell biocatalysis, a novel type of biocatalysis, has attracted researchers’ attention. In this paper, we report that the advances in production of Neu5Ac by whole-cell biocatalysis, and also propose some guidelines for future studies.
N-acetyl-D-neuraminic acid;sialic acid;whole-cell biocatalysis;biotransformation
10.13560/j.cnki.biotech.bull.1985.2015.03.020
2014-11-17
张丛丛,女,硕士研究生,研究方向:生物工程;E-mail:andrea718098@163.com
晏礼明,男,副研究员,硕士生导师,研究方向:生物工程;E-mail:yanlm@im.ac.cn
陶勇,男,研究员,博士生导师,研究方向:以代谢工程为基础的新型生物催化剂开发与利用;E-mail:taoyong@im.ac.cn
