我国诱导多能干细胞研究进展
2015-07-19许锴陈霞高绍荣
许锴 陈霞 高绍荣
(同济大学生命科学与技术学院,上海 200092)
我国诱导多能干细胞研究进展
许锴 陈霞 高绍荣
(同济大学生命科学与技术学院,上海 200092)
关于细胞重编程问题的探讨可以追溯至20世纪30年代。从汉斯·斯佩曼提出“胚胎诱导”概念开始,到20世纪60年代,约翰·戈登成功获得了经过体细胞核移植发育而来的爪蟾,再到1996年世界首例克隆哺乳动物克隆羊“多莉”的诞生,生物学家终于证实了高等动物的体细胞核能够通过核移植的方式重新建立多能性,但这一方法面临着很多社会伦理学问题,无法应用于医学实践。直到2006年Yamanaka小组诱导多能干细胞(Induced pluripotent stem cells,iPS 细胞),成功地绕过了这些伦理问题,诱导重编程才成为了当今干细胞生物学最为热门的研究方向。在诱导多能干细胞领域,我国一直位居世界前列,近年来更是在iPS技术的优化、机制研究和应用研究等方面作出了令世界瞩目的贡献,就这几方面做一综述。
诱导性多能干细胞;体细胞重编程;表观遗传学;机制;重编程临床应用
从2006年Yamanaka课题组利用导入转录因子成功地将小鼠成纤维细胞诱导为多能性细胞[1]开始,我国的体细胞重编程领域就一直紧跟国际一流水平,取得了很多富有价值的研究成果。自2008年以来,我国科学家建立了多种哺乳动物iPS细胞系。例如,邓宏魁实验室建立了恒河猴的iPS细胞系[2],肖磊实验室建立了大鼠和绵羊的iPS细胞系[3],肖磊与裴端卿实验室相继报道建立了猪的iPS细胞系[4,5]等。在人类体细胞诱导重编程方面同样取得了一系列重大成果。例如,金颖实验室以人成纤维细胞作为滋养层细胞,在无LIF条件下建立了神经前体细胞诱导的iPS细胞[6];我们实验室建立了β-地中海贫血患者的iPS细胞系[7]等。在验证iPS细胞全能性方面,我们实验室[8]与中国科学院动物研究所周琪研究员[9]同时报道利用四倍体囊胚互补技术得到了完全由iPS细胞发育而来的小鼠,首次证明了iPS细胞具有真正的全能性;该研究成果被评选为《时代周刊》2009年十大医学突破之一。在iPS细胞分化为成体细胞的研究领域中,邓宏魁课题组将人的iPS细胞成功诱导为胰岛β细胞和肝细胞[10,11]。这些工作为我国的iPS领域的发展奠定了坚实的基础,目前的研究主要集中在iPS诱导体系的优化、iPS机制研究和iPS技术的临床应用研究三方面,本文将着重从这几个角度介绍近几年我国在iPS领域的研究进展。
1 iPS细胞的诱导体系及方法优化
在iPS技术的发展过程中,iPS细胞的诱导产生效率和产生的细胞克隆质量曾一度是该领域的热点问题。要解决iPS技术的应用难题就要能够高效率地获得高质量的iPS细胞克隆。这种高质量主要体现在分化为各种成体组织与器官的多能性,以及无致癌性和无衰老倾向的安全性方面。
1.1 Yamanaka四因子的经典iPS细胞诱导体系
在iPS技术出现初期,Yamanaka诱导因子Oct4、Sox2、Klf4、c-Myc(OSKM)是诱导重编程领域的明星因子。随着研究的深入,人们发现OSKM四因子诱导出的iPS克隆分化能力有限,在裸鼠体内形成畸胎瘤的能力较差,且只有极少数的iPS细胞克隆能够通过四倍体囊胚互补试验得到完全由iPS细胞发育而来的小鼠(又称all-iPS小鼠)。值得注意的是得到的all-iPS小鼠及其子代小鼠更容易罹患肿瘤。现在认为,造成这一问题的主要原因在于导入的两个原癌基因c-Myc和Klf4在重编程完成后仍有少量表达[8,9,12]。针对这一问题,生物学家主要应用两种策略对这种传统iPS细胞诱导方法进行优化,一种策略是将c-Myc基因从诱导体系中去掉,仅利用OSK三因子进行iPS细胞的诱导;另一种策略则是放弃病毒载体,应用非整合型载体等方法进行iPS细胞的诱导。这两种方案虽然在一定程度上提高了应用Yamanaka因子诱导产生的iPS细胞的安全性,但是仍然未能解决这种因子组合产生的iPS细胞的多能性较差的问题。因此,很多课题组将注意力放在如何优化iPS细胞的诱导体系或方法上来。其中具有代表性的方法是用不同的转录因子部分或全部替代Yamanaka的四因子诱导体系;另一种方法则是运用小分子化合物减少转录因子的使用,从而避免外源转录因子错位的时空性表达对iPS细胞质量的影响。
1.2 替代OSKM四因子的研究进展
从理论上讲,转入体细胞的转录因子能够激活一些特定基因的表达,并通过复杂的调控最终建立细胞的多能性状态,而这些转入的外源因子会逐渐沉默,这说明转录因子在体细胞重编程过程中的作用实际上是通过启动特定基因群实现的。鉴于此,人们开始考虑是否能够通过替换OSKM四因子中的一个或多个得到更多更好的iPS细胞。
一开始,生物学家将注意力主要放在如何替换原癌基因Klf4上,研究发现骨形成蛋白家族(Bone morphogenetic proteins,BMPs)能够替代Klf4[13],其作用机制主要是促进体细胞诱导重编程过程中体细胞从间充质样状态到上皮样状态的转变,而这种转换被认为是体细胞诱导重编程起始的标志性事件。
随着替代研究的深入,科学家发现Oct4在诱导体细胞重编程过程中起到中心的作用,虽然Nr5a2能够替代Oct4而与其他Yamanaka因子诱导体细胞重编程,但是Nr5a2的作用仍然是作为Oct4的上游调控因子启动Oct4的表达[14]。然而,有趣的是Oct4缺失的卵子能够将成纤维细胞重编程为多能性细胞[15],这表明Oct4在体细胞重编程过程中并不是必须的,因此推测应当存在不依赖于Oct4的重编程因子组合。随后,这些因子组合逐渐被发现。例如,本实验室建立的Tet1替代Oct4的体细胞重编程体系能较高效地对体细胞进行重编程[16],并且获得的iPS克隆能够高效地形成四倍体囊胚互补小鼠,这表明这种因子组合大大提高了iPS细胞的多能性。这种iPS细胞质量的提升主要依赖于Tet1这种双加氧酶,它能够把5-甲基化胞嘧啶氧化为5-羟甲基化胞嘧啶,从而使起始体细胞重编程过程中的DNA主动去甲基化过程,建立起多能性细胞所特有的基因组低甲基化的特征。进一步的研究发现,仅利用Oct4和Tet两个转录因子也能够使体细胞发生重编程,并且这种组合产生的iPS细胞具有非常高的四倍体囊胚互补小鼠的产生效率[17],随后对小鼠的跟踪观察发现这种完全由Oct4/Tet1 iPS细胞形成的小鼠肿瘤发生率极低,且寿命与对照组小鼠无明显差异。这表明这种iPS细胞的多能性以及安全性较经典Yamanaka因子都有明显的提高,同时也印证了DNA的去甲基化与iPS细胞的质量具有很高的相关性。
1.3 降低iPS技术基因整合风险的研究
对于转录因子随机整合的不安全性,科学家提出了多种解决方案。2008年,Konrad Hochedlinger小组利用非整合性的腺病毒载体导入经典的Yamanaka因子,成功得到了iPS细胞[18]。同年,Yamanaka小组也通过多次瞬时转染的方法得到了iPS细胞[19]。2009年,两个团队同时报道使用piggyBAC转座子系统能够成功对小鼠和人类的成纤维细胞进行重编程[20,21]。同年,两个实验室报道了直接向细胞中转入重编程蛋白质因子使其获得多能性的工作,其中丁胜课题组在添加丙戊酸的条件下将融合了穿膜信号肽11R的OSKM四因子或OSK三因子导入小鼠的成纤维细胞使其成功重编程[22];而Kim课题组使用的是带有穿膜信号肽9R的OSKM四因子,成功地将新生儿的成纤维细胞诱导为多能细胞[23]。2010年,Yakubov等[24]成功将Oct4、Sox2、Lin28和Naong成熟mRNA导入人类的成纤维细胞,得到了iPS细胞。2011年,Mori小组运用成熟双链microRNA成功将小鼠和人类的体细胞诱导为iPS细胞[25]。2014年,中国农业大学的吴森教授与美国犹他大学的科研人员合作首次获得了高质量的无外源基因整合的小鼠iPS细胞,吴教授[26]通 过 将Oct4、Sox2、Klf4、c-Myc、Nanog、Lin28、Nr5a2、microRNA302/367和正负筛选标记基因构建到一个非整合型质粒上,在获得iPS细胞后通过负筛选标记去除残留有该质粒的细胞以达到确保无外源基因插入。虽然这些方法能够在极大限度上降低外源基因随机整合的几率,但这些方法或多或少都会存在一些问题。例如,运用腺病毒载体或转座子系统并不能确保完全没有外源基因的整合;转录因子蛋白直接诱导的方法往往存在效率极低、需要不断补充外源蛋白因子等问题。
1.4 体细胞核移植技术对iPS技术的启示
自iPS诞生以来,iPS技术与体细胞核移植(somatic cell nuclear transfer,SCNT)技术的孰优孰劣的问题就一直萦绕在科学家的头脑中,根据以往的研究来看,应用减数分裂中期次级卵母细胞(metaphase II,MII)作为体细胞核受体的SCNT技术产生的多能性细胞可能比通过iPS技术得到的多能性细胞具有更好的性质。最近,本实验室发表在《Cell Stem Cell》杂志上的文章报道了核移植技术在增长端粒长度方面比iPS技术更有优势[27]。我们通过建立端粒酶敲除小鼠的核移植胚胎干细胞系(NTESC)和iPS细胞系来模拟建立人类衰老病人的多能性细胞系。对两种多能性细胞系的端粒长度进行测定发现NT-ESC的端粒长度明显增长,而iPS细胞系的端粒长度增长不明显,这就提示了利用传统iPS技术诱导产生的多能性细胞可能存在端粒长度过短的风险。而人类的端粒长度要明显短于小鼠的,因而端粒长度过短对人类的影响可能更加严重。这些问题的存在促使生物学家寻找卵母细胞中存在的更优质的iPS因子[28-32],例如,今年发表在《Science》杂志的一篇文章就指出,在人类MII细胞中特异性高表达的组蛋白伴侣蛋白ASF1A对人类iPS细胞的诱导是必要的;而且通过向人类皮肤成纤维细胞中导入ASF1A和OCT4能够在添加卵细胞特异性旁分泌因子GDF9的培养条件下得到iPS细胞[33]。这一研究提醒人们,除了在胚胎干细胞中高表达的因子能够对体细胞进行重编程外,未受精的MII细胞中高表达的因子也能应用于iPS技术,并可能取得更加优化的iPS细胞系。实际上,我们实验室对这一问题也开展了进一步的研究,我们通过对受精卵进行3次显微操作对比了受精卵的雌雄原核的重编程能力[34]。首先,将处于间期的受精卵去掉雄原核或雌原核,将单倍体的受精卵继续培养,阻滞在有丝分裂的中期并去除纺锤体及染色体,再把供体细胞的核物质注入到去核的受精卵中继续培养或移植到代孕母鼠体内。研究结果表明,去除雌原核的单倍体小鼠受精卵可以获得由胚胎干细胞作为核供体的克隆小鼠,并且支持体细胞核移植克隆胚胎发育至囊胚,并建立具有多能性的核移植胚胎干细胞系;而去除雄原核的受精卵则无法支持体细胞克隆胚胎发育到囊胚。对这两种克隆胚胎的表观遗传标记检测表明,雌雄原核表现出对体细胞的不同表观遗传重编程能力,去除雄原核的受精卵不能正确重编程体细胞。而通过在受精卵中融合入一个额外的雄原核显著提高了核移植的效率,这进一步证明了雄原核中确实存在对体细胞重编程至关重要的效应因子,并且提示我们可以从雄原核中寻找促进体细胞重编程的因子。
1.5 化学小分子iPS细胞的建立
基于转录因子的iPS技术主要存在两个关键的安全性问题,其一为随机整合的外源DNA片段会影响基因组的自有结构,并可能影响相关基因的表达情况,而且这种影响具有可遗传性和永久性,这一问题仅针对病毒载体而言;其二为不正常的基因表达水平和不同细胞间的基因表达差异可能会导致细胞基因表达上的紊乱及增加细胞之间的异质性。而小分子化合物组合诱导体细胞重编程,因其无需转入转录因子的特点而成功避开了iPS技术安全性的两个关键问题,并因此得到了全世界的瞩目。
在获得并培养小鼠或人类的胚胎干细胞的尝试中,生物学家发现添加一些小分子化合物能够提高胚胎干细胞的建系效率,并提升其生长状态,进一步研究发现这些小分子物质主要参与了调控胚胎干细胞的多能性的细胞信号通路。因此,相同的思路可以用来提高iPS细胞产生效率和质量甚至优化iPS技术。例如,对胚胎干细胞的多能性维持具有重要作用的Gsk3β的抑制剂CHIR-99021和MEK抑制剂PD-0325901能够提高重编程效率[35]。另一种寻找有利于重编程的化学小分子的路径,是对多能性相关的细胞信号通路进行研究并筛选,这类小分子物质包括上述两种激酶抑制剂、TGFβ抑制剂[36,37]、GSK3、周期蛋白激酶抑制剂Kenpaullone[38]和mTOR细胞信号通路的抑制剂雷帕霉素[39]等。因为表观遗传学在重编程过程中的重要作用,生物学家同样筛选到了一系列与表观遗传学修饰相关的化学小分子,如组蛋白去乙酰化酶(histone deacetylases,HDACs)的抑制剂丙戊酸(valproic acid,VPA)和著名抗癌药物——辛二酰苯胺异羟肟酸(suberoyla nilide hydroxamic acid,SAHA)[40,41]、组蛋白去甲基化酶LSD1的激活剂反苯环丙胺[42]等。在这些发现的基础上北京大学邓宏魁教授成功建立了只添加6种小分子化合物的诱导体细胞重编程体系,这一发现也被认为是重编程领域发展的里程碑事件[43]。邓教授首先得到了只转入Oct4,同时添加丙戊酸、GSK3-β信号通路的抑制剂、TGF-β信号通路的抑制剂和H3K4 的去甲基化抑制剂强内心百乐明(tranylcypromine)4种小分子诱导出的iPS细胞[44]。同年,另一个研究团队也报道了相似的研究成果[45]。接下来邓教授利用转入SKM三因子的小鼠成纤维细胞筛选能够替代Oct4的小分子化合物,经过对上万种小分子进行筛选,最终确定弗斯可林(forskolin,FSK)、2-甲基-5-羟色胺(2-Me-5HT)和D4476s能作为Oct4的替代化合物。综合两个工作的成果,邓教授经过一系列试验得到6种小分子,分别为丙戊酸、Repsox、强内心百乐明、佛司可林、DZNep和CHIR-99021。进一步的研究表明,仅用其中的4种小分子CHIR-99021、FSK、616452(即Repsox)和DZNep就能完成体细胞重编程。其中CHIR、FSK和Repsox能够激活Sall4、Sox2的表达,而DZNep能激活Oct4的表达,从而使体细胞发生重编程(图1)。但是目前这种诱导体系仍然存在着诱导效率低(0.05%)、诱导周期长(6周以上)和诱导出的细胞多能性较差(虽然这种重编程细胞能够形成畸胎瘤和嵌合体小鼠,但是至今没有报道其能够通过最为严格的四倍体囊胚互补试验验证其多能性)等问题,因而对化学小分子iPS技术的研究还将继续下去,相信在不久的将来一定能够获得具有应用价值的小分子iPS细胞。
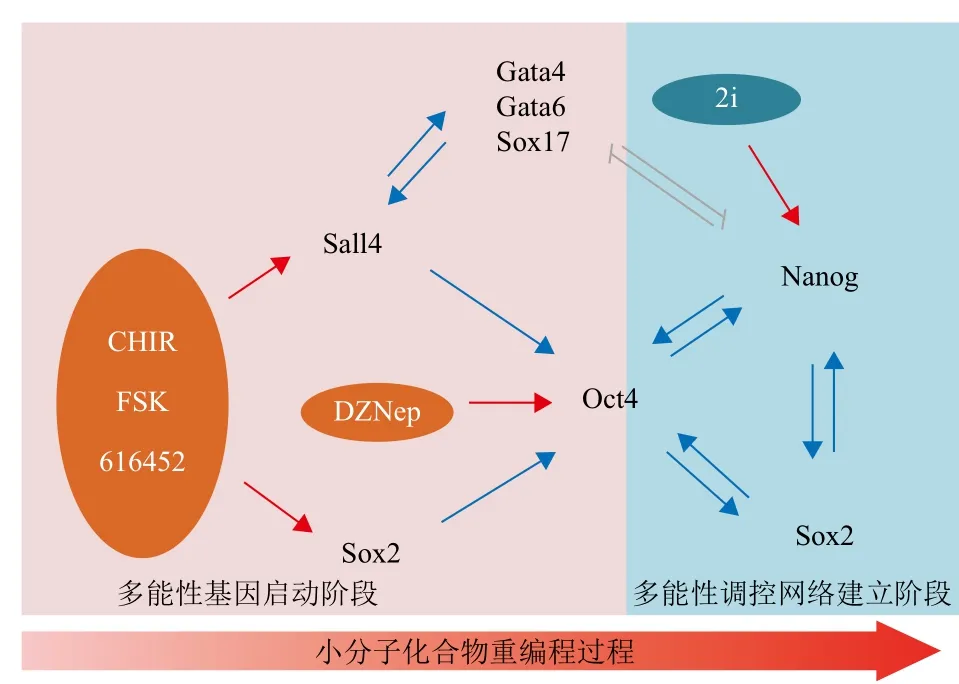
图1 小分子化合物重编程机制示意图[43]
2 iPS细胞的机制研究
若使得iPS技术能够应用就必须对其机制进行深入研究,之前对iPS技术机制的研究主要集中在转录因子相关的转录组水平、蛋白质组水平,而现在表观遗传学水平的研究无疑是最中心的问题,因为无论转录组还是蛋白组的改变最终都要归因于表观遗传学性质的改变。本文将主要从我国科学家最近发现的影响重编程过程中表观遗传特征入手对诱导重编程的机制进行阐述。
2.1 表观遗传重编程概述
根据目前的研究,表观遗传修饰主要包括染色体上的DNA的甲基化和羟甲基化修饰、组蛋白变体、组蛋白修饰、核小体重构和染色质高级结构,以及非编码RNA(又分为microRNA和lncRNA)和RNA的甲基化[46-48]。这些表观遗传特征都与iPS技术息息相关,细胞重编程最终反映为体细胞表观遗传学性质改变为多能性细胞的状态,即无论体细胞在外源的转录因子、蛋白因子还是化学小分子刺激下如何转变形态和性质,只要其本身的表观遗传特征未变或变化不到位都会导致这种“多能性细胞”在外源刺激被撤掉或抑制后迅速丧失多能性;并且外源重编程因子的异常刺激可能会使细胞形成错误的表观遗传特征,从而导致细胞类型的转换甚至死亡。因此表观遗传特征的重编程才是iPS技术的核心和内在机制。在这一领域,我国科学家也同样作出了突出的贡献。
2.2 染色质重构
染色质重构蛋白是重编程因子起作用的关键靶点之一,有研究表明重要的胚胎干细胞特异性染色质重构复合体BAF中的两个组分Smarca4(Brg1)和Smarcc1(BAF155)能够协同OSK三因子对成纤维细胞进行重编程[49]。这些染色质重构蛋白一方面增强了Oct4蛋白结合Sall4、Tcf3和Dppa4基因启动子区的能力;另一方面增加了Oct4结合区域组蛋白H3上4号赖氨酸发生三甲基化修饰(H3K4me3)和组蛋白H3上9号赖氨酸发生乙酰化修饰(H3K9ac),而这两种组蛋白修饰能够使基因组上该区域呈现开放的状态,从而有利于Oct4因子对其下游基因的调控[50]。2013年6月,《Cell Stem Cell》杂志上发表了吉林大学第一医院胡继繁、上海交通大学医学院范先群等研究团队[51]的研究成果:黏结蛋白复合物基因SMC1所支配的染色质内袢环(intrachromosomal looping)是细胞重编程过程中激活内源性多能基因的必要条件,从而揭示了体细胞重编程诱导多能性一个新的关键性的表观遗传路障。该研究团队发现iPS细胞与未重编程细胞中病毒载体表达的诱导因子结合靶基因启动子程度一样,但仅在iPS细胞中观察到内源性多能基因的表达。通过比较Oct4基因位点的局部染色质结构,研究人员发现有一个黏结蛋白复合物(cohesin complex)介导的染色质内袢环存在于一个下游增强子与基因启动子之间,促使激活了内源干性基因。而在未重编程细胞中则没有观察到这样的远程相互作用。当研究人员利用RNAi抑制黏结蛋白复合物基因SMC1时发现,其可破坏染色质内相互作用,影响多能性。2014年,王利博士及其同事发现重要的重编程因子,如Oct4能够招募染色质重构ATP酶INO80,而INO80能够进一步稳定核小体缺乏区(nucleosomedepleted regions,NDRs)并招募中介因子(Mediator)和RNA聚合酶II(RNA polymerase II,Pol II)启动基因的表达。这一工作解释了一些重编程的主宰转录因子(master transcription factor)能够选择性地抑制分化基因而启动多能性基因的现象[52]。
2.3 DNA主动去甲基化
在对表观重编程的研究中,我国科学家贡献最大的领域当属DNA主动去甲基化领域。相比于组蛋白修饰重建,多能性相关基因启动子去甲基化发生于重编程的末期[53],而这种低甲基化状态对iPS细胞的多能性又具有决定性的作用[54],因此,DNA去甲基化可能是体细胞重编程过程中的一个障碍,只有跨越这一障碍,细胞才能够获得多能性。目前的研究认为在重编程过程中主要存在两种DNA去甲基化机制,一类是依赖于DNA复制的被动去甲基化,这种去甲基化过程相对缓慢;另一种DNA去甲基化机制是依赖于激活诱导型胞嘧啶核苷脱氨酶(activation-induced cytidine deaminase,AID)[55]或Tet蛋白家族(ten-eleven translocation family)的主动去甲基化。主动去甲基化机制能够快速并特异性地进行DNA的去甲基化,因而也更为重要。我们实验室的研究表明,Tet1可以催化Oct4 R-DMRs区域的5hmC的产生,促进该区域的DNA去甲基化,进而促进重编程中Oct4的转录激活。进一步利用Tet1取代Oct4用以实现体细胞的诱导重编程。在证明TSKM-iPS细胞完全多能性的同时,建立了TSKM的二次重编程系统。在这一诱导体系中发现TSKM诱导的重编程可以被明显的分为两个阶段。第一个阶段是从TSKM诱导第0天(TSKM 0D)到第3天(TSKM 3D)。这一阶段最重要的变化在于体细胞特异表观修饰的解构。在这一阶段,Tet家族蛋白催化5mC氧化而产生5hmC,并随后引发基因组上5mC与5hmC的共同上升。在诱导中间阶段基因表达与5mC和5hmC修饰状态的关系表明,基因组上DNA的甲基化和羟甲基化的修饰改变可能参与推动了整体表达谱的扭转。而诱导的第二个阶段,即TSKM 3D到iPS细胞建立,细胞内最重要的变化在于ES样表观修饰的建立。而在这一阶段,基因组上已经升高的5mC需要被去除,而5hmC有的继续上升,有的则会回落,最终形成类似于ES细胞的修饰模式(图2)。
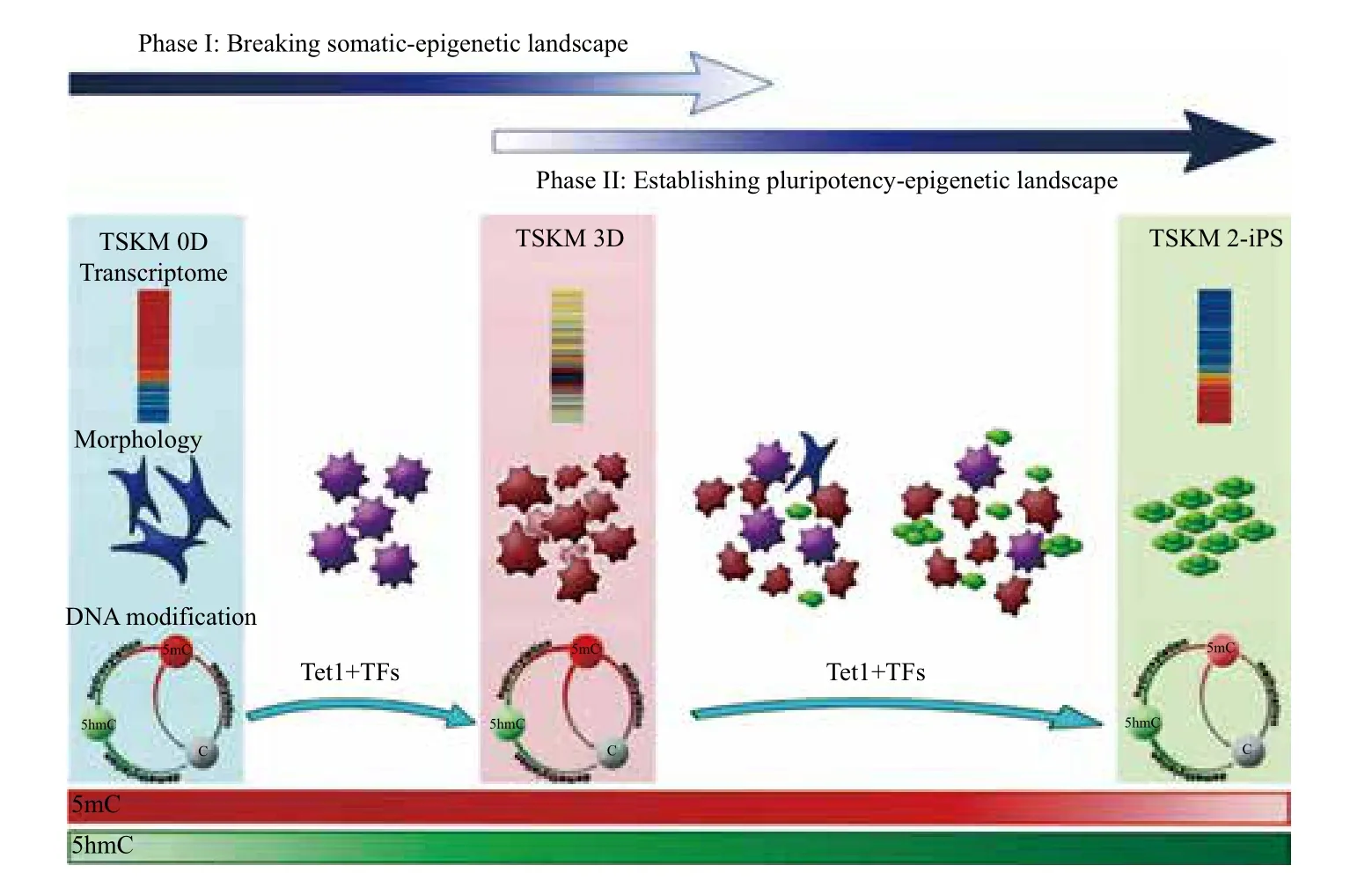
图2 Tet1参与的细胞重编程过程与机制[16]
基因组水平的综合分析表明,DNA的甲基化与羟甲基化参与了基因转录活性的调节和整个表达谱的改变。5mC的氧化不仅参与了重编程中的多能性基因激活,更可能在ES细胞中的活性调节区域去甲基化与表观修饰重塑中具有重要作用。随后徐国良课题组[56]得到了Tet蛋白家族的Tet1、Tet2和Tet3及Tdg基因敲除的小鼠成纤维细胞,并试图对其进行重编程,结果发现这种丧失了主动去甲基化能力的细胞无法启动MET过程,因而造成了细胞重编程的失败。进一步的研究表明,Tet或TDG的缺失主要影响了microRNA-200基因家族启动子区的去甲基化而导致细胞无法进入MET过程。
2.4 组蛋白变体研究
华人科学家Xiao等[57]发现组蛋白变体H2A.X的分布与iPS细胞的多能性关系密切,分化能力出众的iPS细胞中H2A.X在染色质上呈现出相对集中且规则的分布,而在多能性较差的iPS细胞中则呈现散乱无规则的分布特点。这项研究也为评价iPS细胞的质量提供了一个重要的标准。
2.5 H3K9me3的研究
裴端卿课题组最近的研究发现H3K9的甲基化是小鼠体细胞重编程的主要障碍之一,裴教授课题组在进行重编程实验时发现了一类外形、增殖等方面酷似多能性细胞但却没有相应的基因表达谱改变和干细胞表观遗传特性建立的细胞,这类细胞被称为前iPS(pre-iPSC)细胞。通过进一步分析发现,H3K9甲基化的存留是产生这种重编程不完全细胞的原因。通过激活维生素C依赖的H3K9去甲基化酶能够将这些pre-iPS细胞几乎全部转化为真正的iPS细胞[58]。
在iPS技术高速发展的当下,只有不断加深对其内在机制的认识才能更好地指导人们不断优化iPS的诱导体系,相信在不久的将来,人们终将得到符合临床标准的iPS细胞诱导方式并尽快服务于临床诊断和治疗。
3 展望
在iPS技术蓬勃发展的今天,再生医学的大门渐渐开启,尤其是2014年,科学界在iPS技术应用的研究领域取得了长足进步。日本理化所(RIKEN)发育生物学中心的眼科学家高桥雅代(Masayo Takahashi)为一位罹患退行性眼病的日本患者实施了世界首例基于iPS技术的细胞移植手术。他们利用一名70多岁的老年黄斑变性女患者的皮肤细胞诱导产生了iPS细胞,并将其定向分化得到了视网膜色素上皮细胞,然后用外科手术的方式将其移植到该患者的受损视网膜区域,从而达到治疗的目的。另外,来自波士顿儿童医院的研究人员将8种转录因子导入小鼠成熟血细胞并获得了性质类似造血干细胞的细胞群,研究人员将这些细胞命名为诱导造血干细胞(Induced hematopoietic stem cells,iHSCs),这种细胞能够分化成血液系统的所有细胞类型[59]。这无疑为治疗白血病等恶性血液疾病提出了新的思路。另一项振奋人心的消息来自爱丁堡大学,科学家们将体外培养的细胞移植到小鼠体内成功得到了具有完全功能的胸腺,胸腺是T细胞的成熟场所,对获得性免疫具有非常重要的作用,研究人员也希望运用这种技术造福于那些严重免疫缺陷的患者。这一成果标志着体外培养替代性器官的重大突破。最近,我国科学家也在转化医学领域取得了重要突破,2014年2月《Cell Stem Cell》杂志发表了我国两个课题组在建立高效制备功能成熟人类肝脏细胞方法上的突破性进展。邓宏魁课题组[60]通过将肝脏实质细胞特异性表达的命运决定因子与功能性成熟相关的因子转入人类的成纤维细胞,获得了人类诱导性肝脏实质细胞(hiHepCs),这种细胞能够在发生严重肝损伤的小鼠体内高效重建肝功能,并能够通过药物代谢测试。而中国科学院上海生物化学与细胞生物学研究所的惠利健课题组[61]则通过在人类的成纤维细胞中高表达3个特异的肝脏转录因子,同样获得了可增殖的、功能成熟的hiHepCs。这两个研究团队在体外诱导产生肝脏实质细胞的成果将极大地促进针对肝脏疾病患者的肝细胞替代治疗。这些振奋人心的成果一经发表立即引起了全世界生命科学工作者的关注,但是应该指出的是对iPS技术的安全性和疗效的担忧仍然存在,iPS要真正走上应用的道路还有很多工作要做。
最近出现的CRISPR/Cas9基因组修饰系统[62]因其高效性被认为可以用于进行基因治疗,尤其对于那些由基因突变造成的严重血液系统疾病,如β地中海贫血症、镰刀型细胞贫血症等。可以结合iPS技术建立患者的iPS细胞系或造血干细胞系,再运用CRISPR/Cas9系统修复其基因组序列,从而得到具有治疗价值的造细胞系,再将这种细胞系进行体外培养得到的相应组织或器官移植到患者体内从而达到治疗遗传病的目的。相信iPS技术能够通过不断结合新的技术得到长足的发展并最终造福于人类。
[1] Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126:663-676.
[2] Liu HS, Zhu FF, Yonge J, et al. Generation of induced pluripotent stem cells from adult rhesus monkey fibroblasts[J]. Cell Stem Cell, 2008, 3(6):587-590.
[3] Li WL, Wei W, Zhu SY, et al. Generation of rat and human induced pluripotent stem cells by combining genetic reprogramming and chemical inhibitors[J]. Cell Stem Cell, 2009, 4(1):16-19.
[4] Wu Z, Chen JJ, Ren JT, et al. Generation of pig induced pluripotent stem cells with a drug-inducible system[J]. J Mol Cell Biol, 2009, 1(1):46-54.
[5] Esteban MA, Xu JY, Yang JY, et al. Generation of induced pluripotent stem cell lines from Tibetan miniature pig[J]. J BiolChem, 2009, 284(26):17634-17640.
[6] Li CL, Yu HY, Ma Y, et al. Germline-competent mouse-induced pluripotent stem cell lines generated on human fibroblasts without exogenous leukemia inhibitory factor[J]. PLoS One, 2009, 4(8):e6724.
[7] Wang YX, Jiang YH, Liu S, et al. Generation of induced pluripotent stem cells from human β-thalassemia fibroblast cells[J]. Cell Res, 2009, 19(9):1120-1123.
[8] Kang L, Wang JL, Zhang Y, et al. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos[J]. Cell Stem Cell, 2009, 5(2):135-138.
[9] Zhao XY, Li W, Lv Z, et al. iPS cells produce viable mice through tetraploid complementation[J]. Nature, 2009, 461(7260):86-90.
[10] Zhang DH, Jiang W, Liu M, et al. Highly efficient differentiation of human ES cells and iPS cells into mature pancreatic insulinproducing cells[J]. Cell Res, 2009, 19(4):429-438.
[11] Song ZH, Cai J, Liu YX, et al. Efficient generation of hepatocytelike cells from human induced pluripotent stem cells[J]. Cell Res, 2009, 19(11):1233-1242.
[12] Stadtfeld M, Apostolou E, Akutsu H, et al. Aberrant silencing of imprinted genes on chromosome 12qF1 in mouse induced pluripotent stem cells[J]. Nature, 2010, 465(7295):175-181.
[13] Chen J, Liu J, Yang J, et al. BMPs functionally replace Klf4 and support efficient reprogramming of mouse fibroblasts by Oct4 alone[J]. Cell Res, 2011, 21(1):205-212.
[14] Heng JC, Feng B, Han J, et al. The nuclear receptor Nr5a2 can replace Oct4 in the reprogramming of murine somatic cells to pluripotent cells[J]. Cell Stem Cell, 2010, 6(2):167-174.
[15] Wu G, Han D, Gong Y, et al. Establishment of totipotency does not depend on Oct4A[J]. Nat Cell Biol, 2013, 15(9):1089-1097.
[16] Gao Y, Chen J, Li K, et al. Replacement of Oct4 by Tet1 during iPSC induction reveals an important role of DNA methylation and hydroxymethylation in reprogramming[J]. Cell Stem Cell, 2013, 12(4):453-469.
[17] Chen J, Gao Y, Huang H, et al. The combination of Tet1 with Oct4 generates high-quality mouse induced pluripotent stem cells(iPSCs)[J]. Stem Cells, 2015, 33(3):686-698.
[18] Stadtfeld M, Nagaya M, Utikal J, et al. Induced pluripotent stem cells generated without viral integration[J].Science, 2008, 322(5903):945-949.
[19] Okita K, Nakagawa M, Hyenjong H, et al. Generation of mouse induced pluripotent stem cells without viral vectors[J]. Science, 2008, 322(5903):949-953.
[20] Kaji K, Norrby K, Paca A, et al. Virus-free induction of pluripotency and subsequent excision of reprogramming factors[J]. Nature, 2009, 458(7239):771-775.
[21] Woltjen K, Michael IP, Mohseni P, et al. PiggyBac transposition reprograms fibroblasts to induced pluripotent stem cells[J]. Nature, 2009, 458(7239):766-770.
[22] Zhou H, Wu S, Joo JY, et al. Generation of induced pluripotent stem cells using recombinant proteins[J].Cell Stem Cell, 2009, 4(5):381-384.
[23] Kim D, Kim C, Moon J, et al. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins[J]. Cell Stem Cell, 2009, 4(6):472-476.
[24] Yakubov E, Rechavi G, Rozenblatt S, et al. Reprogramming of human fibroblasts to pluripotent stem cells using mRNA of four transcription factors[J]. Biochem Biophys Res Commun, 2010, 394:189-193.
[25] Miyoshi N, Ishii H, Nagano H, et al. Reprogramming of mouse and human cells to pluripotency using mature microRNAs[J]. Cell Stem Cell, 2011, 8(6):633-638.
[26] Wu S, Wu Y, Zhang X, Capecchi MR. Efficient germ-line transmission obtained with transgene-free induced pluripotent stem cells[J]. Proc Natl Acad Sci USA, 2014, 111(29):10678-10683.
[27] Le R, Kou Z, Jiang Y, et al. Enhanced telomere rejuvenation in pluripotent cells reprogrammed via nuclear transfer relative to induced pluripotent stem cells[J]. Cell Stem Cell, 2014, 14(1):27-39.
[28] Wakayama S, Jakt ML, Suzuki M, et al. Equivalency of nuclear transfer-derived embryonic stem cells to those derived from fertilized mouse blastocysts[J]. Stem Cells, 2006, 24:2023-2033.
[29] Hanna J, Saha K, Pando B, et al. Direct cell reprogramming is a stochastic process amenable to acceleration[J]. Nature, 2009, 462:595-601.
[30] Assou S, Cerecedo D, Tondeur S, et al. A gene expression signature shared by human mature oocytes and embryonic stem cells[J].BMC Genomics, 2009, 10:10.
[31] Kim K, Doi A, Wen B, et al. Epigenetic memory in induced pluripotent stem cells[J]. Nature, 2010, 467:285-290.
[32] Miyamoto K, Teperek M, Yusa K, et al. Nuclear Wave1 is required for reprogramming transcription in oocytes and for normal development[J]. Science, 2013, 341:1002-1005.
[33] Gonzalez-Muñoz E, Arboleda-Estudillo Y, Otu HH, et al. Histone chaperone ASF1A is required for maintenance of pluripotency and cellular reprogramming[J]. Science, 2014, 345(6198):822-825.
[34] Liu W, Yin J, Kou X, et al. Asymmetric reprogramming capacity of parental pronuclei in mouse zygotes[J]. Cell Rep, 2014, 6(6):1008-1016.
[35] Silva J, Barrandon O, Nichols J, et al. Promotion of reprogramming to ground state pluripotency by signal inhibition[J]. PLoS Biol, 2008, 6:e253.
[36] Ichida J, Blanchard J, Lam K, et al. A small-molecule inhibitor of TGF-beta signaling replaces Sox2 in reprogramming by inducing Nanog[J]. Cell Stem Cell, 2009, 5(5):491-503.
[37] Maherali N, Hochedlinger K. TGFbeta signal inhibition cooperates in the induction of iPSCs and replaces Sox2 and cMyc[J]. Curr Biol, 2009, 19:1718-1723.
[38] Lyssiotis C, Foreman RK, Staerk J, et al. Reprogramming of murine fibroblasts to induced pluripotent stem cells with chemical complementation of Klf4[J]. Proc Natl Acad Sci USA, 2009, 106:8912-8917.
[39] Chen T, Shen L, Yu J, et al. Rapamycin and other longevitypromoting compounds enhance the generation of mouse induced pluripotent stem cells[J]. Aging Cell, 2011, 10:908-911.
[40] Huangfu D, Maehr R, Guo W, et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds[J]. Nat Biotechnol, 2008, 26:795-797.
[41] Huangfu D, Osafune K, Maehr R, et al. Induction of pluripotent stem cells from primary human fibroblasts with only Oct4 and Sox2[J]. Nat Biotechnol, 2008, 26:1269-1275.
[42] Li W, Zhou H, Abujarour R, et al. Generation of human-induced pluripotent stem cells in the absence of exogenous Sox2[J]. Stem Cells, 2009, 27:2992-3000.
[43] Hou P, Li Y, Zhang X, et al. Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds[J]. Science, 2013, 341:651-654.
[44] Li Y, Zhang Q, Yin X, et al. Generation of iPSCs from mouse fibroblasts with a single gene, Oct4, and small molecules[J]. Cell Res, 2011, 21(1):196-204.
[45] Yuan X, Wan H, Zhao X, et al. Combined chemical treatment enables Oct4-induced reprogramming from mouse embryonic fibroblasts[J]. Stem Cells, 2011, 29(3):549-553.
[46] Allis CD, Jenuwein T, Reinberg D. Epigenetics[M]. New York:Cold Spring Harbor Laboratory Press, 2007:502-510.
[47] Sasaki H, Matsui Y. Epigenetic events in mammalian germ-cell development:reprogramming and beyond[J]. Nat Rev Genet, 2008, 9(2):129-140.
[48] Meyer KD, Saletore Y, Zumbo P, et al. Comprehensive analysis of mRNA methylation reveals enrichment in 3’ UTRs and near stop codons[J]. Cell, 2012, 149(7):1635-1646.
[49] Singhal N, Graumann, J, Wu G, et al. Chromatin-remodeling components of the BAF complex facilitate reprogramming[J]. Cell, 2010, 141:943-955.
[50] Ding J, Xu H, Faiola F, et al. Oct4 links multiple epigenetic pathways to the pluripotency network[J]. Cell Res, 2012, 22:155-167.
[51] Zhang H, Jiao W, Sun L, et al. Intrachromosomal looping is required for activation of endogenous pluripotency genes during reprogramming[J]. Cell Stem Cell, 2013, 13(1):30-35.
[52] Wang L, Du Y, Ward JM, et al. INO80 facilitates pluripotency gene activation in embryonic stem cell self-renewal, reprogramming, and blastocyst development[J]. Cell Stem Cell, 2014, 14(5):575-591.
[53] Polo JM, Anderssen E, Walsh RM, et al. A molecular roadmap of reprogramming somatic cells into iPS cells[J]. Cell, 2012, 151:1617-1632.
[54] Mikkelsen TS, Hanna J, Zhang X, et al. Dissecting direct reprogramming through integrative genomic analysis[J]. Nature, 2008, 454:49-55.
[55] Bhutani N, Brady JJ, Damian M, et al. Reprogramming towards pluripotency requires AID-dependent DNA demethylation[J]. Nature, 2010, 463:1042-1047.
[56] Hu X, Zhang L, Mao SQ, et al. Tet and TDG mediate DNA demethylation essential for mesenchymal-to-epithelial transition in somatic cell reprogramming[J]. Cell Stem Cell, 2014, 14(4):512-522.
[57] Wu T, Liu Y, Wen D, et al. Histone variant H2A. X deposition pattern serves as a functional epigenetic mark for distinguishing the developmental potentials of iPSCs[J]. Cell Stem Cell, 2014, 15(3):281-294.
[58] Chen J, Guo L, Zhang L, et al. Vitamin C modulates TET1 function during somatic cell reprogramming[J]. Nat Genet, 2013, 45:1504-1509.
[59] Riddell J, Gazit R, Garrison BS, et al. Reprogramming committed murine blood cells to induced hematopoietic stem cells with defined factors[J]. Cell, 2014, 157(3):549-564.
[60] Du Y, Wang J, Jia J, et al. Human hepatocytes with drug metabolic function induced from fibroblasts by lineage reprogramming[J]. Cell Stem Cell, 2014, 14(3):394-403.
[61] Huang P, Zhang L, Gao Y, et al. Direct reprogramming of human fibroblasts to functional and expandable hepatocytes[J]. Cell Stem Cell, 2014, 14(3):370-384.
[62] Mali P, Yang L, Esvelt KM, et al. RNA-guided human genome engineering via Cas9[J]. Science, 2013, 339:823-826.
The Progress of Induced Pluripotent Stem Cells Research in China
Xu Kai Chen Xia Gao Shaorong
(School of Life Sciences and Technology,Tongji University,Shanghai 200092)
The research on somatic cell reprogramming can trace back to 1930s when Hans Spemann firstly proposed the concept of embryos induction. 30 years later, John Gurdon successfully obtained cloned Xenopus laevis through somatic cell nuclear transfer(SCNT). Finally in 1996, the first cloned sheep Dolly was created through SCNT. This achievement clearly demonstrated that the mammalian somatic cell fates can be reprogrammed to totipotent state by SCNT. However, SCNT technology faced with both ethics issues and therapeutic application challenges. It is until the year of 2006 when Yamanaka group built up the iPS(induced pluripotent stem cells, iPS cells)technology which can bypass the ethical problems. Subsequently, the iPS technology has become the most popular research topic in stem cell field. In this particular research field, the scientists in China has made great contributions especially in the optimization iPS technology, mechanism studies and the application of iPS technology in translational medical research. In this review, the major progresses made by our countries’ scientists in iPS field are summarized.
induced pluripotent stem cell;reprogramming;epigenetics reprogramming;mechanism;clinical application
10.13560/j.cnki.biotech.bull.1985.2015.03.006
2015-01-03
许锴,男,硕士研究生,研究方向:干细胞与表观遗传学;E-mail:xukai_0925@163.com
陈霞,女,硕士研究生,研究方向:干细胞与表观遗传学;E-mail:chenxia_925@163.com
高绍荣,博士,教授,研究方向:干细胞与表观遗传学;E-mail:gaoshaorong@tongji.edu.cn
