死亡相关蛋白(DAP-5)在庆大霉素诱导的人肾小管上皮细胞凋亡过程中的表达变化及机制
2015-06-28高建军谷昭艳许永星梁勃然韦加美高月花那宇
高建军,谷昭艳,许永星,梁勃然,韦加美,高月花,那宇
死亡相关蛋白(DAP-5)在庆大霉素诱导的人肾小管上皮细胞凋亡过程中的表达变化及机制
高建军,谷昭艳,许永星,梁勃然,韦加美,高月花,那宇
目的建立庆大霉素诱导人肾小管上皮细胞(HK2)凋亡模型;观察死亡相关蛋白5(DAP5)在HK2凋亡过程中的表达变化,并探讨其与PI3K/Akt/mTOR通路之间的关系。方法以3.2mg/ml庆大霉素作用于HK2,应用琼脂糖凝胶电泳观察凋亡细胞DNA条带,流式细胞仪测定细胞凋亡率。采用Western blotting法观察DAP5与Akt、p-Akt表达的改变,应用雷帕霉素阻断PI3K/Akt/mTOR通路后观察DAP5的表达变化。结果庆大霉素作用24h后HK2细胞即出现凋亡,凋亡率随时间延长而增加,24、36、72h的凋亡率分别为5.9%,23.0%,49.9%(P<0.05)。与此同时,细胞DAP5活化裂解生成DAP5/p86,且表达逐渐增加(P<0.05)。在凋亡的同时p-Akt蛋白的表达水平也逐渐增加(P<0.05),应用雷帕霉素阻断PI3K/Akt/mTOR通路后,裂解产生的DAP5/p86减少(P<0.05)。结论庆大霉素可诱导HK2细胞发生细胞凋亡,凋亡率随时间的延长而增加。在诱导HK2细胞凋亡过程中DAP5裂解活化产生DAP5/p86,且这一过程可能是经过PI3K/ Akt/mTOR途径来完成的。
庆大霉素;凋亡;死亡相关蛋白;肾小管上皮细胞
氨基糖甙类抗生素的肾毒性已为临床所证实,其临床表现主要为急性肾小球坏死和急性肾衰竭,表现为组织及功能上的近端小管毒性损伤[1-2]。氨基糖甙类抗生素进入肾小管上皮细胞(尤其是近端小管上皮细胞)后,可造成溶酶体酶大量漏出。继而损害线粒体等细胞内结构,细胞出现变性、坏死[3]。庆大霉素作为氨基糖甙类的代表性药物,除了造成溶酶体的改变,致细胞变性、坏死之外,同时也可使肾脏近端小管上皮细胞表现出凋亡特征,但庆大霉素诱导肾小管上皮细胞凋亡的具体机制尚不完全清楚。
死亡相关蛋白5(death-associated protein 5,DAP5)是一真核细胞翻译调节因子,其在调控蛋白质翻译及细胞凋亡方面均有重要作用[4-5]。在各种应激状态下DAP5的表达增加,通过调控部分凋亡相关蛋白的翻译来发挥其抑制凋亡的作用[6-8],以维持细胞正常的生理功能。在庆大霉素诱导的肾小管上皮细胞凋亡过程中DAP5所发生的变化至今未见报道。本实验在体外观察庆大霉素诱导的人肾小管上皮细胞凋亡模型中DAP5表达的变化,以期进一步阐明庆大霉素的肾毒性机制,并寻找有效的对抗肾毒性的治疗手段。
1 材料与方法
1.1 实验材料及仪器 人肾小管上皮细胞(HK2)购于美国菌种保藏中心(ATCC)。培养条件为45% DMEM+45% F12+10%胎牛血清,37℃,5%CO2。硫酸庆大霉素(gentamicin)溶液购于美国Sigma公司;DMEM、F12培养基购于美国Gibco公司,胎牛血清、Mede1.680型Mic130platereader(美国Bio Rad公司);DU800型Speetropho.tometer(美国Beckman Coulter公司)。
1.2 凋亡细胞DNA片段的检测 将庆大霉素溶液(终浓度3.2mg/ml)与处于对数生长期的HK2细胞分别共同培养12、24、48、72h,以不加庆大霉素溶液进行培养24h的细胞作为阴性对照。经胰蛋白酶消化细胞后收集细胞,按天根生化科技(北京)有限公司基因组DAN提取试剂盒说明书提取细胞DNA,在加有EB的1.2%的琼脂糖凝胶上电泳后,在紫外灯下观察并摄影。
1.3 流式细胞仪检测细胞凋亡率 收集3×105个细胞,加入6孔板中,培养24h细胞贴壁后,弃去培养液,用无血清的培养集同步培养12h后,分别加入正常培养液及3.2mg/ml庆大霉素溶液的培养液,继续培养24、48、72h后终止培养。收集细胞用PBS清洗2遍,以70%乙醇溶液固定4h以上,离心弃去固定液,3ml PBS重悬5min,500~1000r/min离心5min,弃去PBS,加入FITC标记的Annexin-V,室温4℃避光30min,再加入PI,避光反应5min,加入适量Buffer,上流式细胞仪测定10 000个细胞的细胞凋亡率。实验重复3次。
1.4 Western blotting法检测Akt、p-Akt及DAP5的表达 细胞接种于6孔板中培养24h后,移去原有培养液,加入含3.2mg/ml庆大霉素的培养液,分别培养12、24、48、72h后终止培养。以不加庆大霉素培养24h作为空白对照。经胰蛋白酶消化后收集细胞,加入RIPA裂解液(1ml 1×RIPA+1μl leupeptin+1μl aprotinin+10μl PMSF)裂解细胞,冰浴30min,在4℃下12 000r/min离心30min。用BCA法测定细胞蛋白浓度后加入RIPA配成等浓度等体积,加入等体积2×SDS,100℃煮沸5min蛋白变性,冰浴10min。经聚丙烯酰胺凝胶电泳,100V电泳4h后转移至醋酸纤维素膜,转膜电流50mA,时间2h。以脱脂奶粉封闭1h,分别加入DAP5(1:200)、Akt(1:800)、p-Akt(1:300)及β-actin(1:1000)一抗,4℃过夜,TBST充分洗膜,加入对应二抗,室温下孵育1h,TBST洗膜,加荧光液后于暗室显影。
1.5 Western blotting检测雷帕霉素(rapamicin)作用后DAP5的表达 细胞接种于6孔板中培养24h后,移去原有培养液,分别设立正常对照组、庆大霉素组(3.2mg/ml gentamicin)、庆大霉素+雷帕霉素组(3.2mg/ml gentamicin+1ng/ml rapamicin),培养72h后终止培养。余消化细胞,提取蛋白,Western blotting法检测DAP5,方法同1.4。
1.6 统计学处理 采用SPSS 17.0 软件进行分析。所有数据均用表示,多组间比较采用单因素方差分析检验,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 琼脂糖凝胶电泳检测结果 对照组细胞基因组DNA经琼脂糖电泳后未见不同大小片段的DNA梯形条带,仅见距离加样孔不远的一条大分子基因组DNA条带;而以3.2mg/ml的庆大霉素干预24h后细胞DNA电泳均呈现出特征性梯形条带,大小为180~200bp的不同条带,其中48~72h时的细胞DNA条带较多,也较为清晰。表明凋亡细胞随时间而增加(图1)。
2.2 细胞凋亡检测结果 应用流式细胞仪分析庆大霉素干预后的HK2细胞的凋亡率,可观察到随时间的延长,Annexin V染色阳性细胞增多,表明凋亡率增加(P<0.05,图2),24、36、72h的凋亡率分别为5.9%、23.0%和49.9%。
2.3 Western blotting法检测DAP5及Akt的表达 用3.2mg/ml庆大霉素干预HK2细胞后,细胞中p-Akt及DAP5蛋白表达的检测如图3A,应用β-actin作为内参照,对两者的比值进行统计分析,结果表明随时间延长,p-Akt表达增加,DAP5/p97表达下降。同时发现,随时间的延长,DAP5/p86逐渐出现且表达增加,证实在庆大霉素的作用下,DAP5/p97裂解为DAP5/p86,且随时间的延长而增加(图3B)。
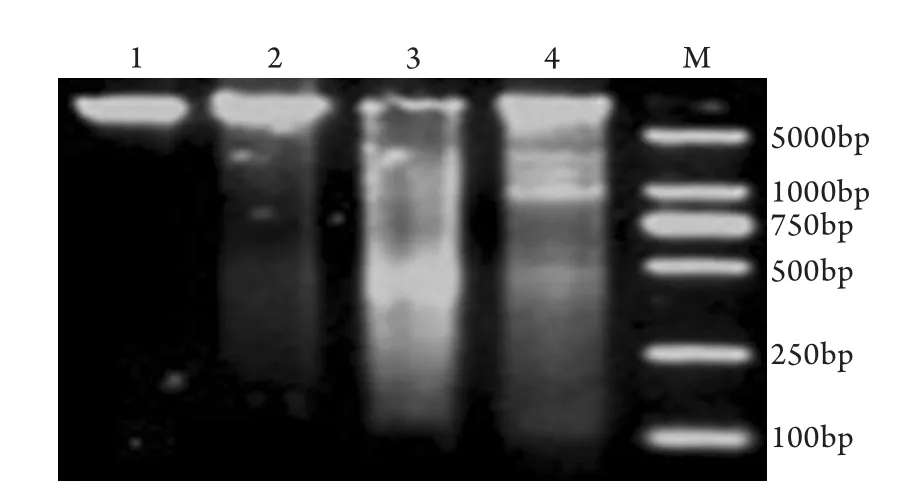
图1 DNA琼脂糖凝胶电泳检测HK2细胞凋亡Fig.1 Detection of HK2 apoptosis by DNA agarose gel electrophoresis1. Control; 2. 24h; 3. 48h; 4. 72h; M. Molecule marker
2.4 雷帕霉素对DAP5蛋白表达的影响 雷帕霉素+庆大霉素组与庆大霉素组比较,DAP5/p97表达明显增加(P<0.05),DAP5/p86表达明显下降(P<0.05)。雷帕霉素+庆大霉素组与正常组比较差异无统计学意义(图4)。
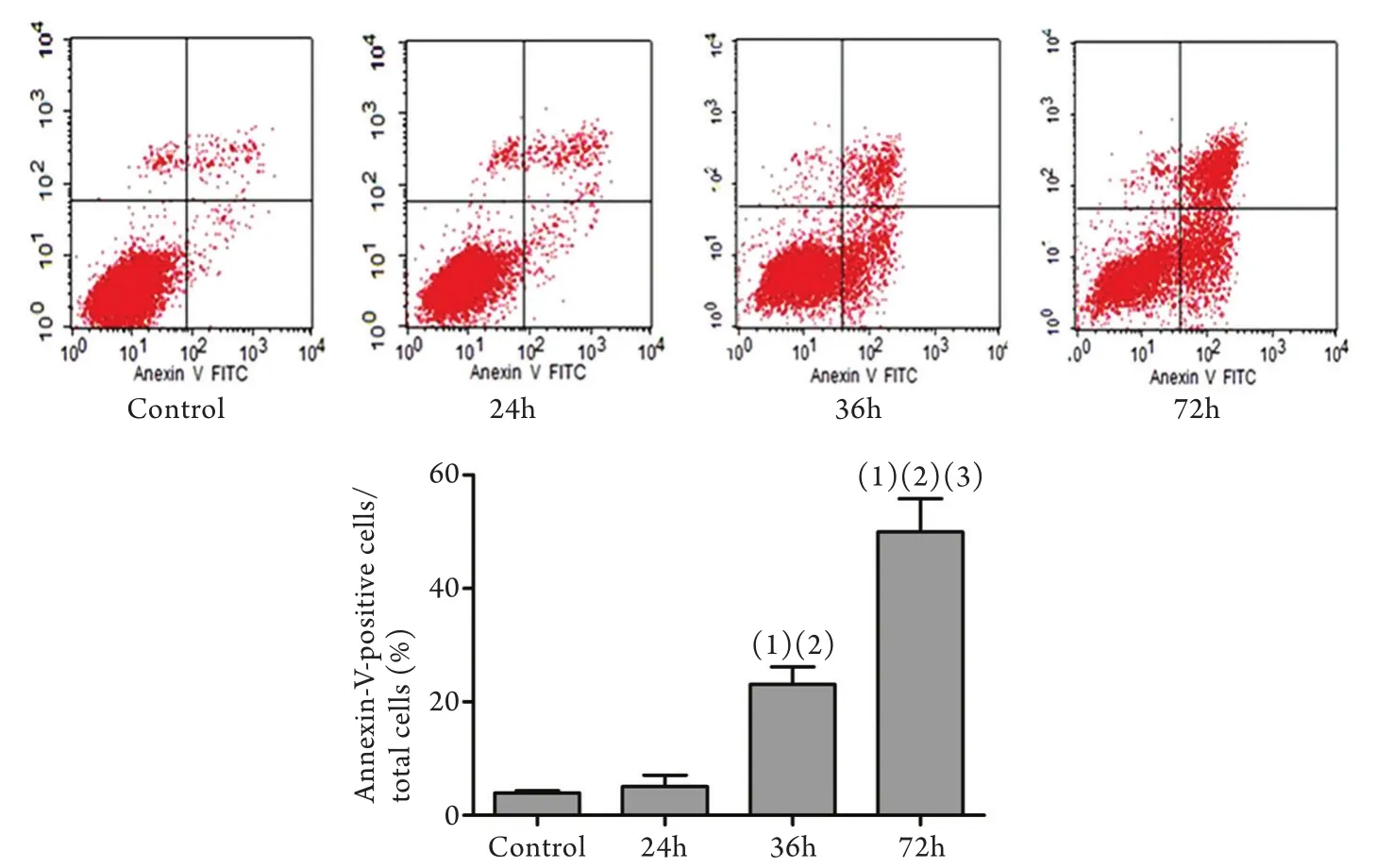
图2 庆大霉素处理不同时间细胞凋亡的变化Fig.2 HK2 apoptosis after gentamicin treatment (flow cytometry)(1)P<0.05 compared with control group; (2)P<0.05 compared with 24h group; (3)P<0.05 compared with 36h group
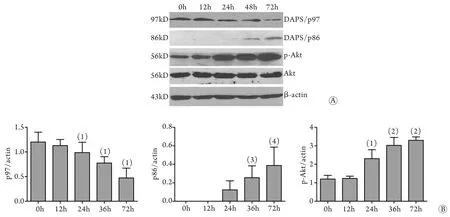
图3 庆大霉素处理不同时间DAP5及Akt的表达变化Fig.3 Expressions of DAP5 and Akt after gentamicin treatment (Western blotting)A. Western blotting; B. Quantitative analysis; (1)P<0.05, (2)P<0.01 compared with 0h group; (3)P<0.05 compared with 24h group; (4)P<0.01 compared with 24h group
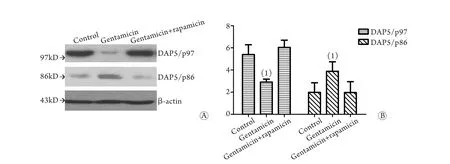
图4 雷帕霉素作用后各组DAP5蛋白表达的Western blotting检测结果Fig.4 Expression of DAP5 after rapamycin treatment (Western blotting)A. Western blotting; B. Quantitative analysis; (1)P<0.05 compared with control group
3 讨 论
庆大霉素的肾毒性已受到广泛关注,但其机制尚未完全阐明,目前有线粒体损伤、溶酶体损伤和氧自由基损伤等学说。有研究证实,肾小管上皮细胞在应激状态下可通过多条途径发生凋亡[9]。接受小剂量庆大霉素治疗的大鼠近曲小管上皮细胞可发生明显的凋亡而无坏死的发生,且凋亡程度与用药剂量间呈线性关系[10]。
本研究以人近端肾小管上皮细胞HK2为研究对象,将庆大霉素刺激后的细胞DNA行琼脂糖凝胶电泳可观察到细胞凋亡的特异性“梯形”DNA条带,反映了细胞核内核酸内切酶作用的结果。流式细胞仪检测发现凋亡率随庆大霉素作用时间的延长而增加。上述结果证实庆大霉素的肾毒性是部分通过诱导小管上皮细胞凋亡而实现的。
DAP5为eIF4G翻译起始因子家族中的一员,分子量为97kD,故又名p97。真核生物蛋白质的翻译起始有赖于eIF4G结合eIF4A和eIF4E形成起始复合物eIF4F。其中eIF4A的结合位点位于eIF4G的中部及C末端;eIF4E的结合位点在eIF4G的N末端;eIF4G中部还包涵一个eIF3结合位点,eIF4G和eIF3的相互作用能募集40S核糖体亚单位。因DAP5拥有类似于eIF4G羧基端的eIF4A及eIF3结合位点,因此能竞争性抑制eIF4G与eIF4A和eIF3的结合;但又不能与eIF4E结合,因此无法使eIF4E与mRNA帽状结构结合,因此,其可抑制起始翻译复合物的形成,阻断蛋白质的翻译。另一方面,除经典的依赖帽子结构的翻译途径外,真核生物中同时也存在另一条称为经内部核糖体进入位点(Internal Ribosome Entry Site,IRES)的翻译途径。这一途径在IRES反式作用因子的协助下能够直接启动翻译,而不需要翻译起始复合物的形成。目前发现的IRES反式作用因子有DAP5、PTB、hnRNPK等[11]。这一翻译途径在正常情况下受到严密的调控,而在辐射、缺氧、凋亡、休克及氨基酸饥饿等对生存不利的条件下,即使依赖帽状结构的翻译途径受阻甚至关闭,经IRES途径介导的翻译仍能进行,从而维系细胞的基本生理功能[12-13]。
随着研究的不断深入,人们发现在凋亡环境中DAP5/p97可裂解掉C末端成为86kD的蛋白DAP5/ p86,这一过程是由Caspase对p97氨基酸790位点进行裂解来完成的[14]。DAP5/p86可与某些特殊mRNA的IRES元件结合,使其可在经典翻译途径受抑的情况下,仍可通过IRES途径翻译合成,因此这一IRES元件被称为“death IRESes”。这类mRNA目前发现的有:Apaf-1、c-myc、XIAP及HIAP2 mRNAs[13,15-16]。这些作用元件在凋亡过程中发挥着不同的作用。另外,DAP5也可经IRES途径促进自身mRNA的翻译,形成正反馈环路,扩大其在IRES途径中的作用。全长的DAP5/p97对IRES翻译途径却无调控作用,这进一步证实DAP5在凋亡因素的作用下,裂解后形成有功能的翻译调控因子DAP5/ p86,进而增强IRES翻译途径的效率[17]。这与我们的研究结果是相同的。
本研究观察了在庆大霉素诱导的肾小管上皮细胞凋亡过程中,DAP5/p97裂解成为DAP5/p86,并随时间的延长生成量逐渐增加。通过本研究推测DAP5/p86可能是作为一种代偿机制来抑制庆大霉素诱导的凋亡。有研究证实DAP5在三氧化二砷(ATO)诱导的急性粒细胞白血病细胞凋亡时表达增加,用雷帕霉素抑制Akt/mTOR途径可使DAP5的表达增加,故而认为PI3K/Akt/mTOR途径可抑制DAP5的活性[18]。本研究结果也发现在庆大霉素诱导的HK2凋亡中p-Akt表达增加,p-Akt作为PI3K/ Akt/mTOR通路的代表之一,其表达增加可表明PI3K/Akt/mTOR通路激活。PI3K/Akt/mTOR通路是调控细胞内蛋白总量合成的主要信号通路,其激活与DAP5的裂解相似,可抑制凋亡过程中的蛋白合成下降,从而发挥抑制凋亡的作用。本研究还发现应用雷帕霉素抑制PI3K/Akt/mTOR通路后,DAP5/ p97裂解为DAP5/p86减少。表明DAP5的活化裂解功能是通过PI3K/Akt/mTOR途径调控的,两者可共同发挥抑制凋亡的作用。
综上所述,本结果表明,在庆大霉素诱导的细胞凋亡过程中,DAP5/p97可代偿性激活而发挥抑制凋亡的作用,这一作用可能是通过PI3K/Akt/ mTOR途径来完成的。
[1]Appel GB, Neu HC. Gentamicin in 1978[J]. Ann Intern Med, 1978, 89(4): 528-538.
[2]Zhu QZ. Gentamicin nephrotoxicity and its induced acute renal failure[J]. Med J Chin PLA, 1986, 11(3): 178-183.[朱起之. 庆大霉素的肾毒性及其所致的急性肾功能衰竭[J]. 解放军医学杂志, 1986, 11(3): 178-183.]
[3]Nagai J, Takano M. Entry of aminoglycosides into renal tubular epithelial cellsviaendocytosis-dependent and endocytosisindependent pathways[J]. Biochem Pharmacol, 2014, 90(4): 331-337.
[4]Ma YY, Zhou SJ, Chen FY,et al. Induction effects of decitabine in combination with valproic acid sodium on apoptosis of myeloma cells and its underlying mechanism[J]. Med J Chin PLA, 2013, 38(10): 837-841.[马泳泳, 周淑娟, 陈枫煜, 等. 地西他滨联合丙戊酸钠诱导的骨髓瘤细胞凋亡及其机制研究[J]. 解放军医学杂志, 2013, 38(10): 837-841.]
[5]Zhang HT, Wang YJ, Fan DH,et al. Inhibition of glutamate induced apoptosis of SH-SY5Y cells by C-terminal tail of DAPK[J]. Med J Chin PLA, 2010, 35(7): 839-844.[张海涛, 汪亚君, 范大华, 等. 死亡相关蛋白激酶C末端对谷氨酸诱导的SH-SY5Y细胞凋亡的抑制作用研究[J]. 解放军医学杂志, 2010, 35(7): 839-844.]
[6]Nevins TA, Harder ZM, Korneluk RG,et al. Distinct regulation of internal ribosome entry site-mediated translation following cellular stress is mediated by apoptotic fragments of eIF4G translation initiation factor family members eIF4GI and p97/ DAP5/NAT1[J]. J Biol Chem, 2003, 278(6): 3572-3579.
[7]Liberman N, Gandin V, Svitkin YV,et al. DAP5 associates with eIF2beta and eIF4AI to promote Internal Ribosome Entry Site driven translation[J]. Nucleic Acids Res, 2015, 43(7): 3764-3775.
[8]Gao JJ, Cai GY, Ning YC,et al. DAP5 ameliorates cisplatininduced apoptosis of renal tubular cells[J]. Am J Nephrol, 2012, 35(5): 456-465.
[9]Wang YD. Hong Q, Lv Y,et al. Role of endoplasmic reticulum stress-induced apoptosis of renal tubular epithelial cells in rhabdomyolysis-associated acute kidney injury[J]. Med J Chin PLA, 2013, 40(3): 194-199.[王远大, 洪权, 吕杨, 等. 内质网应激途径诱导肾小管上皮细胞凋亡在横纹肌溶解肾损伤过程中的作用[J]. 解放军医学杂志, 2015,40(3): 194-199.]
[10] El Mouedden M, Laurent G, Mingeot-Leclercq MP,et al. Apoptosis in renal proximal tubules of rats treated with low doses of aminoglycosides[J]. Antimicrob Agents Chemother, 2000, 44(3): 665-675.
[11] Lewis SM, Holcik M. For IRES trans-acting factors, it is all about location[J]. Oncogene, 2008, 27(8): 1033-1035.
[12] Lopez-Lastra M, Rivas A, Barria MI. Protein synthesis in eukaryotes: the growing biological relevance of cap-independent translation initiation[J]. Biol Res, 2005, 38(2-3): 121-146.
[13] Gilbert WV, Zhou K, Butler TK,et al. Cap-independent translation is required for starvation-induced differentiation in yeast[J]. Science, 2007, 317(5842): 1224-1227.
[14] Henis-Korenblit S, Strumpf NL, Goldstaub D,et al. A novel form of DAP5 protein accumulates in apoptotic cells as a result of caspase cleavage and internal ribosome entry site-mediated translation[J]. Mol Cell Biol, 2000, 20(2): 496-506.
[15] Warnakulasuriyarachchi D, Cerquozzi S, Cheung HH,et al. Translational induction of the inhibitor of apoptosis protein HIAP2 during endoplasmic reticulum stress attenuates cell death and is mediatedviaan inducible internal ribosome entry site element[J]. J Biol Chem, 2004, 279(17): 17148-17157.
[16] Henis-Korenblit S, Shani G, Sines T,et al. The caspase-cleaved DAP5 protein supports internal ribosome entry site-mediated translation of death proteins[J]. Proc Natl Acad Sci U S A, 2002, 99(8): 5400-5405.
[17] Liberman N, Marash L, Kimchi A. The translation initiation factor DAP5 is a regulator of cell survival during mitosis[J]. Cell Cycle, 2009, 8(2): 204-209.
[18] Ozpolat B, Akar U, Zorrilla-Calancha I,et al. Death-associated protein 5 (DAP5/p97/NAT1) contributes to retinoic acidinduced granulocytic differentiation and arsenic trioxide-induced apoptosis in acute promyelocytic leukemia[J]. Apoptosis, 2008, 13(7): 915-928.
Expression of DAP-5 in HK2 cell apoptosis induced by gentamicin
GAO Jian-jun1, GU Zhao-yan2, XU Yong-xing1, LIANG Bo-ran1, WEI Jia-mei1, GAO Yue-hua1, NA Yu1*1Department of Nephrology, 306 Hospital of Chinese PLA, Beijing 100101, China
2Healthcare Department, Hainan Branch of Chinese PLA General Hospital, Sanya, Hainan 572000, China
*< class="emphasis_italic">Corresponding author, E-mail: nayu306@163.com
, E-mail: nayu306@163.com
This work was supported by the National Natural Science Foundation of China (81300265), and Army Medical Science Youth Development Project (13QNP088)
ObjectiveTo reproduce a model of gentamicin induced apoptosis of human kidney epithelial cell (HK2), to observe the expression of death-associated protein 5 (DAP5) in HK2 cells, and to explore the relationship between PI3K/Akt/ mTOR signal pathway and DAP5.MethodsHK2 cells were cultured with 3.2mg/ml gentamicin. Cell apoptosis was determined by DNA agarose gel electrophoresis, the apoptotic rate was determined with flow cytometry. Protein expressions of DAP5, Akt and p-Akt were assessed with Western blotting. Rapamycin was used to block PI3K/Akt/mTOR signal pathway in HK2 cell apoptosis model, and the change in DAP5 expression was observed.ResultsHK2 apoptosis appeared 24h after gentamicin treatment, and the apoptotic rate was found to be increased with the prolongation of gentamicin treatment. The apoptotic rates were 5.9%, 23.0% and 49.9%, respectively, at 24h, 36h and 72h after gentamicin treatment (P<0.05). At the same time, lysis of DAP5 protein occurred to form DAP5/p86, and the expressions of DAP5/p86 and p-Akt protein were also upregulated gradually in the process (P<0.05). However, generation of DAP5/p86 was reduced when PI3K/Akt/mTOR signal pathway was blocked by rapamycin during this period (P<0.05).ConclusionGentamicin may induce apoptosis of HK2 cell in time-dependent manner. During the process of apoptosis of HK2 cells, lysis of DAP5 may occur to form DAP5/p86, and PI3K/Akt/mTOR signal pathway may positively regulate the expression of DAP5.
gentamicin; apoptosis; death-associated protein 5; kidney epithelial cell
R595.3
A
0577-7402(2015)11-0906-05
10.11855/j.issn.0577-7402.2015.11.10
2015-03-10;
2015-08-14)
(责任编辑:张小利)
国家自然科学基金(81300265);全军医学科技青年培育项目(13QNP088)
高建军,医学硕士,主治医师。主要从事药物性肾损害方面的研究
100101 北京 解放军306医院肾内科(高建军、许永星、梁勃然、韦加美、高月花、那宇);572000 海南三亚 解放军总医院海南分院保健科(谷昭艳)
那宇,E-mail:nayu306@163.com
