琼脂糖以及高分辨率琼脂糖制备方法研究进展*
2016-09-02王江林林福娣贺煌煌熊仁杰
王江林,林福娣,贺煌煌,熊仁杰,赵 鹏
(华侨大学化工学院,福建 厦门 361021)
琼脂糖以及高分辨率琼脂糖制备方法研究进展*
王江林,林福娣,贺煌煌,熊仁杰,赵鹏
(华侨大学化工学院,福建厦门361021)
琼脂糖作为电泳介质应用广泛,本文综述了琼脂糖和高分辨率琼脂糖的制备方法。琼脂糖的制备方法有乙酰化法、离子交换法、沉淀法、络合法、盐析法以及离子液体法,高分辨率琼脂糖的衍生化制备方法有引入低分子量基团、高分子量基团法以及琼脂糖与琼脂糖衍生物组合法。对上述制备方法的原理、工艺优劣以及产品质量进行初步总结和比较,为琼脂糖及高分辨率琼脂糖的生产提供参考。
琼脂糖;高分辨率琼脂糖;分离;制备
琼脂是从江蓠、石花菜等海洋红藻中提取得到的一种具有凝胶特性的多糖。1956年,Araki[1]从琼脂中分离出具有凝胶能力的中性组分,命名为琼脂糖(Agarose),而将凝胶能力差的组分命名为琼胶酯(Agaropectin)。琼脂糖是由1,3-β-D-吡喃半乳糖和1,4-3,6-脱水-α-L-吡喃半乳糖交替连接的共聚物[2](图1),琼胶酯的基本骨架与其相同,但连接有不同的残基如:羧基、硫酸基等负电基团。
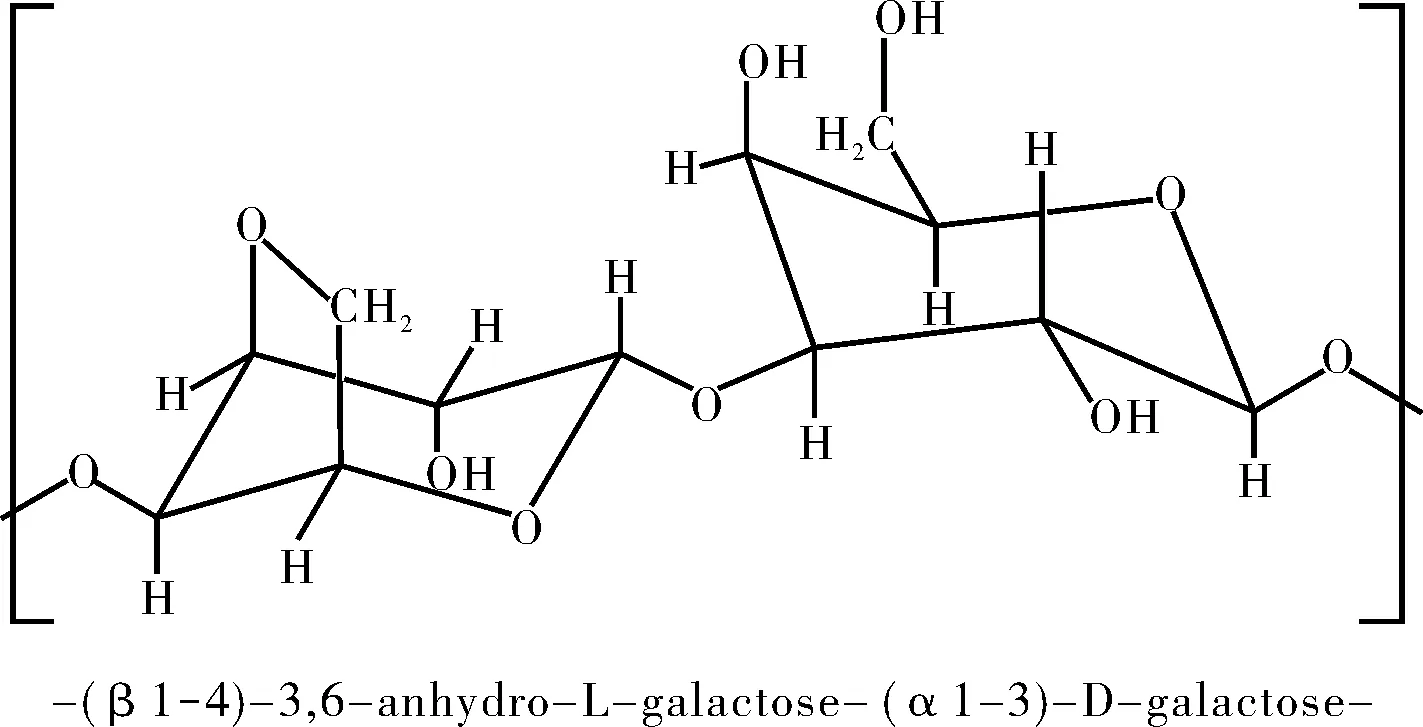
图1 琼脂糖的结构单元
琼脂糖具有物理和化学稳定性,呈电中性,对生物大分子极少引起生物大分子变性和吸附,是一种理想的生物惰性载体,广泛用于凝胶电泳和亲和色谱[3-4]。琼脂糖凝胶具有一定孔径[5](图2),具有分子筛功能可以对生物大分子(如蛋白质、核酸)进行分离纯化,高分辨率琼脂糖由于具有更强的筛分能力,可应用于差别不大PCR片段的分离纯化。
目前制备琼脂糖的方法有离子交换法、沉淀法、络合法、盐析法和离子液体法,高分辨率琼脂糖制备方法主要有引入低分子量基团、高分子量基团法以及琼脂糖与琼脂糖衍生物组合法,本文将对各种方法的原理、工艺以及产品性能进行对比和总结,为琼脂糖的制备工艺开发提供参考和借鉴。
1 琼脂糖的制备方法
1.1乙酰化法
乙酰化法制备琼脂糖是利用乙酰化后的琼脂糖与琼胶酯在氯仿中的溶解度差异进行分离的,该方法是由Araki[8]提出,以江蓠琼脂为原料进行乙酰化反应,得到乙酰化琼脂糖和琼胶酯,加入氯仿沉淀乙酰化琼胶酯,滤液进一步采用石油醚沉淀得到乙酰化琼脂糖,接着进行去乙酰化反应即得再生琼脂糖。该法琼脂糖产率为67%,硫酸根含量为0.02%~0.04%,凝胶强度小于1000 g/cm2。该工艺操作繁杂,所需试剂种类多且量大,导致生产成本较高,Rees等[9]认为乙酰化方法会引起琼脂糖的降解,导致凝胶强度急剧下降,不利于工业放大,得到琼脂糖纯度较高,但是色泽较差,呈棕色。
1.2离子交换法
由于琼胶酯的基本骨架上连接有带电基团如:硫酸基、羧基,利用带电基团对离子交换剂具有较强的结合力,因此可以采用阴离子交换树脂实现琼脂的分级。Izumi等[10]以石花菜琼脂为原料,用Dowex 1×2(200~400目)阴离子交换树脂进行分离,水、甲酸铵溶液和水杨酸铵溶液依次洗脱得到四个多糖级分。水洗脱级分不含硫酸根,丙酮酸含量较低,基本上为中性琼脂糖。随着洗脱电解质浓度增高,洗脱的级分中丙酮酸、硫酸基等含量也逐渐增加。也有采用DEAE Sephadex A-50 (氯型)离子交换柱,NaCl溶液梯度洗脱,将琼脂进行色谱分级[12-13]。Duckworth等[14]以采用DEAE-Sephadex A50 (氯型) 离子交换,得到几乎为中性的琼脂糖。Zabin、柯庆勇等[15-16]采用DEAE-纤维素(乙酸型或柠檬酸型)离子交换,分级得到琼脂糖。该法产率为60%~70%,白度为60~70,硫酸根含量为0.15%~0.25%,凝胶强度大于1000 g/cm2,电内渗在0.15~0.30。离子交换法工艺耗时短,操作简单,产品质量较好,但该法所用树脂需再生。
1.3沉淀法
沉淀法主要有乙醇分步沉淀法、PEG沉淀法、DMSO法、碘化钠法、尿素法。PEG与乙醇分步沉淀法原理相似,都是亲水性的有机溶剂加入琼脂溶液后降低介质的介电常数或者是溶剂自身的水合作用,使琼脂糖分子之间静电引力增加,聚集形成沉淀。DMSO、碘化钠法主要利用琼胶酯能溶解在DMSO溶剂或含有碘化钠溶剂中与琼脂糖进行分离。尿素法主要原理为在尿素(加柠檬酸使pH=6.2)作为溶剂的条件下,采用乙醇作为沉淀剂,可以实现使琼脂糖和琼胶酯的分离。Polson和肖笛等[17-18]进行了PEG沉淀法制备琼脂糖,向琼脂溶液中,加入 PEG,静置,离心分离,最后以丙酮脱水,干燥得到琼脂糖。纪明侯等[19]采用不同浓度的乙醇进行分步沉淀。Jeon和Brasch等[20-21]采用DMSO为沉淀剂,对琼胶酯进行沉淀,离心,再用乙醇或丙酮对离心液进行沉淀,可以得到琼脂糖。许加超等[22]将以尿素为尿素为溶剂,加柠檬酸使溶剂pH为6.2,琼脂溶解该溶剂中,加入乙醇使琼脂糖沉淀,离心,得到琼脂糖。沉淀法共同特点是工艺耗时较长,试剂用量多,操作步骤较多,沉淀较为完全,因此产率较高,一般在60.0%~93.0%左右。PEG沉淀法,白度为80左右,硫酸根含量为0.12%~0.25%,凝胶强度大于1000 g/cm2,电内渗为0.10~0.20。尿素法制得的产品硫酸根含量较高达0.76%,而且凝胶强度小于300 g/cm2,无法测得该法的电内渗。
1.4络合法
络合法主要有季铵盐络合法和 EDTA钠盐螯合法。季铵盐络合法的主要原理为琼胶酯的聚阴离子与某些表面活性剂,如:季铵盐,形成络合物,在低离子强度的条件下形成沉淀,可以对酸性琼胶酯进行分离,从而实现琼脂糖的分级制备。EDTA钠盐螯合法主要原理为EDTA钠盐与琼胶酯螯合,使其溶于缓冲液,而琼脂糖不溶,从而实现两者分离。Hjerten[23]采用十六烷基氯化吡啶将琼胶酯沉淀,离心,离心液再采用乙醇沉淀,分离出琼脂糖。Ble-then[24]将季铵盐法进行改进,季铵盐与高度硫酸化的多糖如:卡拉胶,使琼胶酯沉淀,离心,离心液采用醇沉得到琼脂糖。李龙等[25]采用龙须菜琼脂为原料,加入EDTA-Na2溶液进行提取,然后离心,干燥,得到琼脂糖。络合法中EDTA钠盐螯合法,产率为60%~70%,白度为60~70,硫酸根含量为0.40%~0.50%,电内渗为0.30~0.40,凝胶强度为700~900 g/cm2,工艺耗时较短,试剂用量较少,操作简单,季铵盐络合法产率为60%~70%,硫酸根含量为0.45%,凝胶强度大于1000 g/cm2,工艺耗时较短,试剂用量大,操作复杂。
1.5盐析法
在琼脂溶液中,加入一定量盐,使其达到一定的浓度或者饱和状态,促使琼脂糖的溶解度降低从而析出,与水溶性较大的琼胶酯进行分离。Azhitskiǐ等[26]采用硫酸铵对琼脂糖溶液盐析,琼脂糖形成沉淀,进而从琼脂中分离。硫酸铵法的产率为60%左右,白度为60~70,硫酸根为0.2%~0.4%,凝胶强度大于1000 g/cm2,电内渗为0.15~0.30。该法工艺耗时较长,操作工艺简单。
1.6离子液体法
离子液体仅由阴离子和阳离子组成,在室温或者低温条件下呈液态的盐,阳离子作为电子接受体,阴离子作为电子给予体,通过阴阳离子与琼脂糖-OH中O与H的相互作用破坏琼脂糖大分子之间的氢键,从而使琼脂糖溶解。Trivedi等[27]直接以海藻为原料,加入离子液体,80℃微波辅助,过滤除去滤渣,滤液加入甲醇进行沉淀,过滤,洗涤,干燥得到琼脂糖。
该法产率为17%~39%,硫酸盐含量小于1.95%~2.75%,凝胶强度为570~600 g/cm2。离子液体法工艺耗时较短,试剂用量较少,操作较为简单,但是离子液体比较昂贵。
此外,琼脂糖的制备方法还有二甲基甲酰胺(DMF)法、壳多糖法、Acnnol法、雷万诺法、碱处理等方法[1]。比较上述几种分级制备琼脂糖的方法,除了目前使用的DEAE-纤维素、PEG沉淀法和EDTA沉淀等常用方法外,其他的几种方法基本上都存在收率较低、凝胶强度较低、色泽较差、成本较高等问题。虽然DEAE-纤维素工艺研究比较成熟,但是DEAE-纤维素价格昂贵,成本太高,限制其制备琼脂糖的产量。考虑到生产成本以及产品的性能,可以认为PEG和EDTA钠盐沉淀法最为经济,而且便于工业化生产。乙酰化为琼脂糖的改性提供新的思路。离子液体法是上述方法中最为绿色的工艺,离子液体可以回收循环使用,虽然制备的产品参数不佳,但是为琼脂糖的直接制备提供了一个新的方法。
2 高分辨率型琼脂糖的衍生化制备
普通琼脂糖用来分离大片段核酸,但是对于相差很小碱基对的小片核酸却很难将其分开,因为核酸分子有效直径小于凝胶孔径,很难将小片段的核酸进行电泳分离。PCR技术的广泛应用,对于分离小片段核酸的要求也越来越高[28],然而普通的琼脂糖无法满足这些要求,因此通过引入低分子、高分子基团以及琼脂糖衍生物进行组合等手段制备高分辨率琼脂糖,目的是减小琼脂糖凝胶的孔径,对核酸的筛分能力更强,分辨率更高。
2.1引入低分子量基团
引入低分子量的基团主要有烷基、羟烷基、酰基以及链烯基等小分子基团,基团的引入使琼脂糖凝胶过程中链与链之间的作用力减弱,从而使凝固温度、融化温度以及凝胶强度降低,形成凝胶孔径变小。通过凝固温度的高低来表征取代程度的高低,同时也反映凝胶孔径的大小。Guiseley[29]采用williamson醚合成,酰化反应等将低分子基团引入琼脂糖分子中。琼脂糖首先溶解在水中,加入NaBH4还原,在碱性条件下加入改性试剂如硫酸二甲酯,低链卤代烷烃、环氧化合物等类似物。反应完成后,反应液采用酸进行中和,采用醇或丙酮沉淀、过滤、洗涤和干燥。酰化反应是在N,N-二甲基酰胺,吡啶或者类似的溶剂中反应,如采用乙酰氯或丙酰氯进行酰化反应。Dumais等[30]对改性后琼脂糖进行纯化,制备出低电内渗高分辨率琼脂糖。卢灿辉等[31]采用缩水甘油醚进行改性,但是凝胶强度太低。刘力等[32]对硫酸二甲酯的制备工艺进行优化。吴钢等[33]对上述改性方法进行比较,以融化温度为指标,并采用响应面对环氧丙烷、二氯乙醇法进行优化,但是碱浓度对融化温度的影响未考虑。张秋俊等[34]以江蓠琼脂糖为原料,以融化温度和凝胶强度为指标,并优化制备羟乙基琼脂糖的工艺条件,但环氧乙烷在高温下易发生自聚,而且在高温下反应不利于工业化生产。
引入低分子基团的琼脂糖具有较低的凝固温度、融化温度以及一定的凝胶强度,对于但对于小片段核酸(大于50 bp DNA Ladder)有较好的分离效果[35]。Guiseley为制备低凝固温度琼脂糖改性提供了一系列的方法,得出了凝胶温度与改性程度的线性关系,对于制备工艺条件没有进行优化,所以该制备工艺参数有待进一步研究。但是分子相差更小的核酸却无法分离。如果继续增加取代程度,可以达到分离效果,但是凝胶强度却急剧下降,不足以作为电泳介质。
2.2引入高分子量基团
通过引入高分子基团而达到降低凝胶孔径,琼脂糖与双官能团化合物进行反应,为其他基团的引入提供一个活性位点,从而使其它不饱和基团可以引入至琼脂分子,通过逐步反应,低分子量的中间体在琼脂糖上形成高分子量,凝胶孔径变小,从而使筛分能力更强。Cook等[36]采用与不饱和基团的单体如:丙烯腈,丙烯酰胺,α,β-不饱和羧酸等类似共聚物进行接枝。此法在引入低分子基团的基础上,从而引入更大的基团。
该法有效地避免了采用一步反应所形成的高分子量溶解性和反应性限制,制备出的琼脂糖衍生物凝胶不仅与聚丙烯酰胺凝胶一样具有较强的筛分性质,而且清晰度也相当,这是引入小分子基团无法达到的效果。同时,该法制备的琼脂糖对于复杂的生物化合物有较好的分离效果,类似应用在筛分或疏水性,离子交换,生物亲和作用。高分子量基团改性的琼脂糖较未改性的的琼脂糖凝胶,有较强的筛分功能,在分离核酸和蛋白质都有较好的效果[37]。
2.3琼脂糖与琼脂糖衍生物组合法
琼脂糖与琼脂糖衍生物组合法的主要原理为高度衍生化的琼脂糖具有极小的凝胶孔径,具有很强的筛分性能,但是其凝胶强度很小。然而普通琼脂糖具有很高的凝胶强度,筛分能力不如高度衍生化的琼脂糖,因此采用两种琼脂糖进行组合。Dumais等[38]发现电泳分离凝胶组合物,主要由堆积凝胶和分离凝胶组成,即两者的比例为4:6。Nochumson等[39]认为堆积凝胶必须具备三个条件:①可以进行电泳;②保持自身结构的完整;③提供最小的膨胀;尤其是凝胶强度必须达到500 g/cm2,主要通过降解法制备。
琼脂糖与琼脂糖衍生物组合法,该组合物不仅比未改性的琼脂糖和引入低分子量琼脂糖具有更强的筛分能力,对于分离1~10 bp DNA Ladder有很好的效果,甚至对DNA同分异构体也有很好的分离效果,而且分辨率与聚丙烯酰胺相当,不仅可以分离核酸,而且蛋白也可以分离[40]。
国外对高分辨率方法的工艺研究比较成熟,如MetaPhorTM、NuSieve 3:1 Agarose等产品[39],国内目前没有生产该类琼脂糖。本文将生产高分辨率琼脂糖方法工艺进行总结,比较上述几种方法,由于嫁接的方法很难控制单体的聚合度,而且操作复杂,不利于工业化生产,因此采用琼脂糖与琼脂糖衍生物组合法最为理想,不仅具有较高的筛分能力,而且生产成本相比其他几种方法最为经济,生产出的琼脂糖产品,性能更优。
3 展 望
琼脂糖作为一种电中性多糖,以其凝胶的稳定性和滞后特性,已成为生物技术领域中不可缺少的凝胶基质。随着现代生物技术的发展,琼脂糖的需求量不断加大,同时琼脂糖以及琼脂糖衍生物的品质提出了新的要求。国外琼脂糖的研究远早于国内,已形成琼脂糖的系列产品(如Sigma与Lonza等公司生产的高分辨琼脂糖、低凝固温度琼脂糖、超低凝胶温度琼脂糖和脉冲电泳琼脂糖等几十个品种),且性能明显优于国内产品,所以国内生物工程、医学和药学等领域科研院所所用的琼脂糖主要依靠进口,价格昂贵。因此,研制高分辨率琼脂糖产品,优化其生产工艺,可以弥补国内不足,为琼脂糖产品的生产提供借鉴或参考。
[1]Araki C.Structure of the agarose constituent of agar-agar[J].Bulletin of the Chemical Society of Japan,1956,29(4):543-544.
[2]纪明侯.海藻化学[M].北京:科学出版社,1997:100-125.
[3]陈鸿琪,袁兆岭.生化分析中常用的惰性载体——琼脂糖[J].临沂师范学院学报,2000,22(6):33-35.
[4]Brody J R,Calhoun E S,Gallmeier E,et al.Ultra-fast high-resolution agarose electrophoresis of DNA and RNA using low-molarity conductive media[J].Biotechniques,2004,37(4):598-602.
[5]Arnott S,Fulmer A,Scott W E,et al.The agarose double helix and its function in agarose gel structure[J].Journal of molecular biology,1974,90(2):269-284.
[6]Laurell C B.Quantitative estimation of proteins by electrophoresis in agarose gel containing antibodies[J].Analytical biochemistry,1966,15(1):45-52.
[7]Wahl G M,Stern M,Stark G R.Efficient transfer of large DNA fragments from agarose gels to diazobenzy-loxymethyl paper and rapid hybridization by using dextran sulfate[J].Proceedings of the National Academy of Sciences,1979,76(8):3683-3687.
[8]Araki C .Acetylation of agar like substance of Gelidium amansii[J].J.Chem.Soc,1937,58:1338-1350.
[9]Rees D A.1022.Estimation of the relative amounts of isomeric sulphate esters in some sulphated polysacch-arides[J].Journal of the Chemical Society (Resumed),1961:5168-5171.
[10]Izumi K.Chemical heterogeneity of the agar from Gelidium amansii[J].Carbohydrate Research,1971,17(1):227-230.
[11]Izumi K.Chemical heterogeneity of the agar from Gracilaria verrucosa[J].Journal of biochem istry,1972,72(1):135-140.
[12]Young K,Duckworth M,Yaphe W.The structure of agar:Part III.Pyruvic acid,a common feature of agars fromdifferent agarophytes[J].Carbohydrate Research,1971,16(2):446-448.
[13]刘力.琼脂分级产物的研究[D].青岛:中国科学院海洋研究所,2001.
[14]Duckworth M,Yaphe W.Preparation of agarose by fractionation from the spectrum of polysaccharides in agar[J].Analytical Biochemistry,1971,44(2):636-641.
[15]Zabin B A.Method of making agarose[P].US,US3423396,1969-02-21.
[16]柯庆勇,黄雅燕,叶静,等.DEAE-纤维素法从琼脂中分离制备琼脂糖工艺研究[J].离子交换与吸附,2015(1):21-31.
[17]Russell B,Mead T H,Polson A.A method of preparing agarose[J].Biochimica et Biophysica Acta (BBA) -General Subjects,1964,86(1):169-174.
[18]肖笛,肖美添,叶静.聚乙二醇沉淀法从琼脂中分离精制琼脂糖工艺研究[J].农业机械,2011 (12):156-159.
[19]Ji Minghou,M.Lahaye,W.Yaphe.Structural studies on agar fractions extracted sequentially from chinese red sea weeds:Gracilaria sjeostedtii,G.textorii and G.salicornia using13C-NMR and IR spectroscopy[J].Chinese Journal of Oceanology & Limnology,1988,6(6):87-103.
[20]Jeon Y J,Athukorala Y,Lee J H.Characterization of Agarose Product from Agar Using DMSO[J].Choryu-Hakhoe-chi/The Korean Journal of Phycology,2005,20(1):61-67.
[21]Brasch,DJ,Chuah,C,Melton,LD.The commercial agar from New Zealand Pterocladia species[J].Australian Journal of Chemistry,1984,37(37):183-190.
[22]许加超.海藻化学与工艺学[M].青岛:中国海洋大学出版社,2014:87-91.
[23]Hjertén S.A new method for preparation of agaraose for gel electrophoresis.[J].BiochimicaEt Biophysica Acta,1962,62(3):445-449.
[24]Blethen J.Method for the separation of agaropectin from agarose[P].U.S.Patent 3,281,409,1966-10-25.
[25]李龙,苏永昌,吴成业.响应面优化琼脂糖的EDTA-Na2法提取工艺[J].福建农业学报,2013,28(2):158-165.
[26]Azhitski GIu,Kobozev GV.A simple method for obtaining of agarose from agar[J].Laboratornoe Delo,1967(3):143-145.
[27]Trivedi T J,Kumar A.Efficient Extraction of Agarose from Red Algae Using Ionic Liquids[J].Green and Sustainable Chemistry,2014,4(04):190-201.
[28]Sell A M,Visentainer J E L.Blood Grouping Based on PCR Methods and Agarose Gel Electrophoresis[J].Molecular Typing of Blood Cell Antigens,2015,1310:37-49.
[29]Guiseley K B.Modified agarose and agar and method of making same[P].US,US3956273,1976-05-11.
[30]Dumais M M,Guiseley K B.Fractions of derivatized agarose and processes therefor[P].EP,EP0591181,2000-08-03.
[31]卢灿辉,甘景镐,陈文定,等.低温胶凝琼脂糖衍生物的合成及其性质研究[J].福建师范大学学报:自然科学版,1989(3):57-63.
[32]刘力,李智恩,徐祖洪.低凝固温度琼脂糖的制备方法研究[J].海洋科学,2003,27(12):71-74.
[33]吴钢.低熔点琼脂糖的改性与制备技术研究[D].福州:福建农林大学,2014.
[34]张秋俊,倪辉,孙宁,等.羟乙基琼脂糖的制备工艺研究[A].中国食品科学技术学会第十一届年会[C].2014:43-56.
[35]Wieslander L.A simple method to recover intact high molecular weight RNA and DNA after electrophoretic separation in low gelling temperature agarose gels[J].Analytical biochemistry,1979,98(2):305-309.
[37]Cook R B.Derivatized agarose and method of making and using same[P].US,US4319975,1982-3-16.
[38]Katzmann J A.Detection of M Proteins[M].Springer New York,2014:85-92.
[39]Dumais M,Kusukawa N,White H.Highly derivatized agarose conformational nucleic acid separation[P].EP,US5641626,1997-05-24.
[40]Nochumson S,Curtis F P,Morgan J H,et al.Polysaccharide resolving gels and gel systems for stacking electrophoresis:U.S.Patent 5,143,646[P].1992-9-1.
[41]Asif M,Mirza J I,Zafar Y.High resolution metaphor agarose gel electrophoresis for genotyping with micro-satellite markers[J].Pakistan Journal of Agricultural Sciences,2008,45(1):75-79.
Research Progress on Preparation of Agarose and High Sieving Agarose*
WANG Jiang-lin,LIN Fu-di,HE Huang-huang,XIONG Ren-jie,ZHAO Peng
(School of Chemical Engineering,Huaqiao University,Fujian Xiamen 361021,China)
Agarose is widely used as medium in electrophoresis.Preparation of agarose and high sieving agarose was reviewed.Methods of agarose preparations included acetylation,ion exchange,precipitation,complexation,salting and ionic liquid method,and so on.Methods for producing high sieving agarose introduced a low or high molecular weight group and mixing agarose with its derivatives.The principles,the merits?and?demerits of technology and the product quality of different methods were summarized and compared,which can provide references for the production of agarose and high sieving agarose.
agarose; electrophoresis; high sieving; separation; preparation
华侨大学研究生科研创新能力培育计划资助项目;泉州科技项目(2013Z13)。
王江林(1989-),男,硕士研究生在读.主要从事海洋资源高值化利用。
赵鹏(1975-),男,硕士,副教授,主要从事天然产物的提取、分离和精制。
TQ95
A
1001-9677(2016)011-0019-04
