miR-155对HBV蛋白表达的抑制作用及机制
2015-06-28蔡启茵任广立张卫云冯宇鹏马恒颢
蔡启茵,任广立,张卫云,冯宇鹏,马恒颢
miR-155对HBV蛋白表达的抑制作用及机制
蔡启茵,任广立,张卫云,冯宇鹏,马恒颢
目的观察miR-155对SOCS1 mRNA及蛋白水平的影响,探究miR-155对HBsAg、HBeAg表达的抑制作用。方法从HepG2.2.15细胞中提取基因组,经PCR扩增得到miR-155前体序列,纯化并连接入pmR-mCherry载体,构建重组质粒pmiR-155,经去内毒素后转染至HepG2.2.15细胞。将细胞分为重组组(转染pmiR-155质粒)、空载组(转染pmR-mCherry质粒)、转染试剂组、空白组。采用荧光实时定量PCR检测各组细胞内miR-155的表达,RT-PCR检测各组细胞SOCS1 mRNA的表达,Western blotting检测各组细胞SOCS1 蛋白的表达,ELISA检测各组细胞HBsAg、HBeAg的表达。结果荧光实时定量PCR结果显示,以空白组细胞内miR-155的表达量为基准,重组组miR-155表达量(519.43±52.10)明显高于空载组(24.24±16.70)及转染试剂组(35.04±26.09,P<0.05);RT-PCR结果显示,重组组SOCS1 mRNA表达量(0.63±0.91)显著低于空白组(P<0.05);Western blotting结果显示,重组组SOCS1蛋白表达量显著低于空白组。以空白组的表达量为基准,重组组HBsAg和HBeAg蛋白表达的抑制率分别为55.62%±3.77%和47.87%±2.46%(P<0.01)。结论过表达的miR-155可抑制细胞内SOCS1和HBV蛋白的表达。
乙型肝炎,慢性;微RNAs;乙型肝炎表面抗原;乙型肝炎核心抗原
乙型肝炎病毒(hepatitis B virus,HBV)呈全球性流行,每年约100万人死于HBV相关的肝衰竭或原发性肝癌。干扰素和核苷类似物是目前抗HBV的主要药物[1],可在一定程度上抑制HBV的复制,减轻肝损害,但无法彻底清除体内的病毒[2]。最近研究发现,miRNAs不仅可干扰病毒聚合酶或相关蛋白合成,而且可改变抗原提呈,从而达到抑制病毒复制的作用[3]。miR-155被认为是新兴的炎症因子,可调控免疫系统发育和应答、抗病毒感染等生物进程[4]。研究指出,miR-155通过抑制细胞因子信号转导抑制因子1(suppressor of cytokine signaling1,SOCS1)调节体内的干扰素信号通路,增强抗病毒效应[5]。然而,目前尚无证据证明特定的miRNA可通过调控信号通路来达到干扰HBV表达的作用。本研究通过构建miR-155真核过表达载体,体外转染HepG2.2.15细胞,从蛋白和基因水平评估miR-155 对SO CS1表达的影响,同时观察细胞所分泌HBsAg、HBeAg水平的改变,为进一步研究miR-155 在HBV慢性感染中抗病毒作用提供线索。
1 材料与方法
1.1 主要材料及试剂 pmR-mCherry质粒由美国Dr. Keith Peden惠赠。大肠埃希菌菌株DH5α及肝癌细胞株HepG2.2.15细胞由本院医学实验科保存。PCRTaq、QuickCutEcoR Ⅰ、QuickCutBamH Ⅰ、T4DNA连接酶及DNA切胶回收试剂盒均购自TaKaRa公司;去内毒素质粒小提中量试剂盒购自Omega公司;Trizol总RNA提取试剂盒、脂质体Lipofectamine 2000及M-MLV 1st strand Kit购自Invitrogen公司;抗SOCS1多克隆抗体购自Cell Signaling公司;辣根过氧化物酶标记的山羊抗兔IgG(二抗,1:4 000)购自北京中杉金桥科技有限公司;乙型肝炎病毒表面抗原诊断试剂盒、乙型肝炎病毒e抗原诊断试剂盒购自深圳华康生物医学有限公司;用于荧光定量PCR检测的miR-155及U6特异性引物均为广州锐博生物科技有限公司产品。
1.2 载体构建 根据miRBase及GenBank数据库查找得到成熟miR-155茎环序列及miR-155前体侧翼序列,利用Primer 5.0及Oligo 7设计引物(表1)。以HepG2.2.15细胞基因组为模板PCR扩增得到miR-155前体序列,经EcoRⅠ和BamHⅠ双酶切,退火连接到pmR-mCherry载体,克隆转化、摇菌、测序鉴定后,得到重构质粒pmiR-155。去内毒素提取重组质粒用于转染实验[6]。
1.3 HepG2.2.15细胞培养及转染 将HepG2.2.15细胞培养于含200mg/L G418、100g/L FBS、10万U/L青链霉素、10g/L L-谷氨酰胺的高糖DMEM培养液中,于37℃、5%CO2培养箱中培养。细胞传代培养3次后消化接种至6孔板,4.8×105个细胞/孔,培养24h后待细胞融合度达80%时转染(转染时不加双抗)[7]。设重组组(转染pmiR-155质粒)、空载组(转染pmR-mCherry质粒)、转染试剂组、空白组。转染试剂Lipofectamine 2000(μl)与质粒(μg)的比例为3:1。

表1 引物序列Tab.1 Primer sequence
1.4 荧光实时定量PCR检测各组miR-155表达 应用Trizol法提取各组细胞中总RNA,经紫外分光光度法测定浓度及纯度后,采用茎环法[8]反转录得到cDNA,进行荧光实时定量PCR反应。反应程序为95℃ 10s,60℃ 20s,70℃ 10s,循环40次。所得数据采用2-ΔΔCt表示,并评估样本间差异。
1.5 RT-PCR检测各组SOCS1 mRNA表达 应用Trizol法提取各组总RNA,反转录得到cDNA,行RT-PCR。反应程序:94℃ 30s,57℃ 30s, 72℃30s,循环30次。GAPDH序列的PCR反应程序除退火温度改为56℃外,其余与SOCS1相同。所得产物经凝胶电泳及测序鉴定。应用Gel-pro Analyzer分析各组mRNA的相对表达量。
1.6 Western blotting检测各组SOCS1蛋白表达转染72h后收集各组细胞,用预冷PBS冲洗3遍,每孔加入100μl裂解液,冰上放置30min后移入离心管,4℃、12 000r/min离心30min,收集上清液。BCA法测定蛋白浓度。加入50μl 2×上样缓冲液混匀,99℃煮10min,取50μg样品行12% SDS-PAGE凝胶电泳。电泳结束后用半转移仪将蛋白从凝胶转移到PVF膜,封闭液封闭,先后与抗SOCS1多克隆抗体(1:1 000稀释)和辣根过氧化物酶标记的山羊抗兔IgG(1:4 000稀释)孵育,洗膜,加入化学发光剂ECL,在Sage Creation凝胶成像仪中曝光显影。
1.7 HBsAg和HBeAg蛋白的检测 收集细胞转染24、48h和72h的培养上清液,1000r/min离心5min,吸取上清,应用ELISA法检测各组细胞HBsAg和HBeAg的分泌量。严格按试剂盒说明操作,结果用吸光度(A)值表示。
1.8 统计学处理 采用SPSS 17.0软件进行统计分析,所有数据均以表示,组间均数比较采用One-Way ANOVA法,P<0.05为差异有统计学意义。
2 结 果
2.1 miR-155真核过表达载体的构建及鉴定 经测序鉴定,PCR扩增的人miR-155前体序列连入pmR-mCherry真核过表达载体,序列正确,没有碱基丢失、替换等,重组质粒构建成功(图1)。
2.2 miR-155在转染细胞中的表达 经荧光实时定量PCR检测,以空白组细胞内miR-155的表达量为基准,重组组miR-155表达量(519.43±52.10)明显高于空载组(24.24±16.7)及转染试剂组(35.04±26.09,P<0.05)。
2.3 miR-155对SOCS1 mRNA表达的抑制作用RT-PCR检测结果表明,以GAPDH表达为参照,空载组(0.95±0.79)、转染试剂组(0.94±0.52)与空白组SOCS1 mRNA的表达量无明显差异,重组组SOCS1 mRNA的表达量(0.63±0.91)显著低于空白组(P<0.05,图2)。
2.4 miR-155对SOCS1蛋白表达的抑制作用Western blotting检测表明,以β-actin表达为参照,转染72h后,空载组、转染试剂组与空白组SOCS1蛋白表达量均无明显差异,而重组组SOCS1蛋白表达量显著低于空白组(P<0.05,图3)。
2.5 miR-155对HBsAg和HBeAg蛋白表达的抑制作用 ELISA检测结果表明,转染后重组组培养上清液的HBsAg、HBeAg表达量明显受到抑制,尤其是转染后48h。空载组、转染试剂组对蛋白的表达几乎没有影响。转染48h时,重组组HBsAg和HBeAg蛋白表达的抑制率分别为55.62%±3.77%和47.87%±2.46%,与其他3组相比差异均有统计学意义(P<0.05,图4)。
图1 重组质粒pmiR-155部分核酸序列测序结果Fig.1 Sequencing results of partial nucleic acid of recombinant plasmid pmiR-155
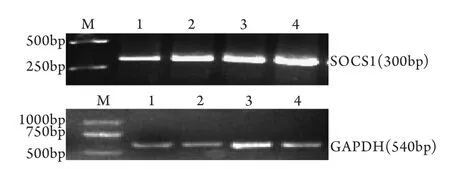
图2 RT-PCR检测转染后各组细胞内SOCS1 mRNA表达Fig.2 Expression of SOCS1 mRNA in each group (RT-PCR) M. DL2000; 1. pmiR-155 plasmid group; 2. pmR-mCherry plasmid group; 3. Reagent group; 4. Blank group
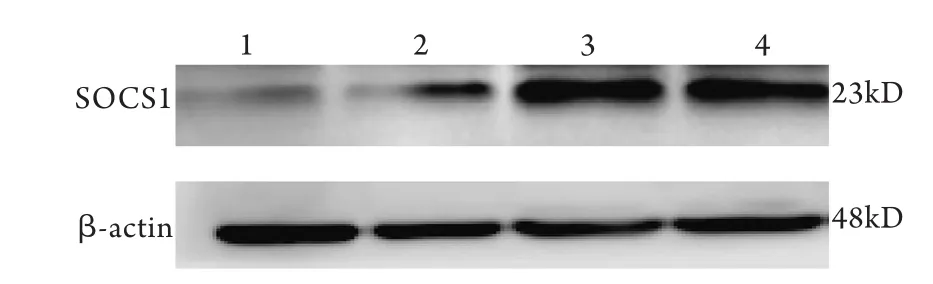
图3 Western blotting检测转染后各组细胞SOCS1蛋白表达Fig.3 Expression of SOCS1 proteins in each group (Western blotting)1. pmiR-155 plasmid group; 2. pmR-mCherry plasmid group; 3. Reagent group; 4. Blank group
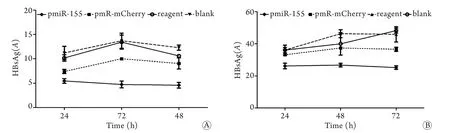
图4 ELISA检测转染后各组细胞HBsAg(A)和HBeAg(B)蛋白表达Fig.4 Expression of HBsAg (A) and HBeAg (B) proteins in each group (ELISA)
3 讨 论
miRNA可通过降解靶细胞mRNAs或抑制蛋白翻译来调控转录后期的基因表达[9-10]。miR-155是21nt的小分子RNA,在抗病毒感染、抗肿瘤和免疫调节中发挥重要作用[11-13]。Banerjee等[14]研究发现,miR-155通过激活IFN-γ信号通路诱导Th1细胞分化,活化CD4+T细胞来调节免疫系统稳定。Rodriguez等[15]证实miR-155可作用于IL-2信号途径,抑制SOCS1的表达,从而影响调节性T细胞的分化能力。此外,研究已证实了SOCS1是miR-155的靶位点,可负反馈性阻断细胞因子信号转导过程(如干扰素、IL-10、IL-12等信号通路)[16]。miR-155抑制SOCS1表达后可削弱其对相关细胞因子的负反馈调节,促进细胞因子的分泌,增强抗病毒作用。然而,在HBV慢性感染中,miR-155对SOCS1的抑制及干扰HBV蛋白分泌的作用及机制尚未明确。
本研究所选用的H BV慢性感染细胞模型HepG2.2.15细胞能持续分泌HBV蛋白及表达HBV DNA,是探讨miR-155在HBV慢性感染中所发挥作用的较佳细胞模型。目前尚未见在HepG2.2.15细胞中研究miR-155对SOCS1表达影响的报道。本研究成功构建了人miR-155真核过表达载体,并转染至HepG2.2.15细胞,结果显示,SOCS1的mRNA和蛋白表达量随着细胞内的miR-155表达上调而下降,且转染了人miR-155过表达载体的HepG2.2.15细胞HBsAg、HBeAg分泌量也明显降低。
综上,本研究证实了在HBV慢性感染中,过表达miR-155可抑制SOCS1及HBV蛋白的表达,其作用机制很有可能是由于过表达的miR-155下调了SOCS1的表达,削弱了其负反馈调节,增强了机体的抗病毒作用,从而抑制HBsAg、HBeAg的表达。本研究结果为进一步探讨miR-155在HBV慢性感染中的免疫调节及抗病毒作用奠定了基础,并为miRNAs治疗HBV提供了实验证据。
[1]Yang HY, Chen GM, Cui YM,et al. Clinical study on safety and immunogenicity of therapeutic dual-plasmid HBV DNA vaccine mediated byin vivoelectroporation[J]. Med J Chin PLA, 2013, 38(3): 204-209.[杨海燕, 陈光明, 崔一民, 等. 电脉冲介导的治疗性双质粒HBV DNA疫苗的临床安全性及免疫原性研究[J]. 解放军医学杂志, 2013, 38(3): 204-209.]
[2]Hadziyannis SJ, Vassilopoulos D, Hadziyannis E. The natural course of chronic hepatitis B virus infection and its management[J]. Adv Pharmacol, 2013, 67: 247-291.
[3]Gambari R, Fabbri E, Borgatti M,et al. Targeting microRNAs involved in human diseases: a novel approach for modification of gene expression and drug development[J]. Biochem Pharmacol, 2011, 82(10): 1416-1429.
[4]Vigorito E, Kohlhaas S, Lu D. MiR-155: an ancient regulator of the immune system[J]. Immunol Rev, 2013, 253(1): 146-157.
[5]Lu LF, Thai TH, Calado DP,et al. Foxp3-dependent microRNA155 confers competitive fitness to regulatory T cells by targeting SOCS1 protein[J]. Immunity, 2009, 30(1): 80-91.
[6]Cai QY, Ren GL, Zhang WY,et al. Construction of eukaryotic overexpression vector of human miR-155 and its expression of HBeAg in HepG 2.2.15 hepatoma cells[J]. World Chin J Digest, 2014, 22(28): 4217-4222.[蔡启茵, 任广立, 张卫云,等. 人miR-155真核过表达载体的构建及其对HepG2.2.15细胞中HBeAg的抑制效应[J]. 世界华人消化杂志, 2014, 22(28): 4217-4222.]
[7]Sells MA, Chen ML, Acs G. Production of hepatitis B virus particles in Hep G2 cells transfected with cloned hepatitis B virus DNA[J]. Pro Natl Acad Sci USA, 1987, 84(4): 1005-1009.
[8]Chen C, Ridon DA, Broomer AJ,et al. Real-time quantification of microRNAs by stem-loop RT-PCR[J]. Nucleic Acids Res, 2005, 33(20): e179.
[9]Wen LJ, Wu JH, Song SJ,et al. Effect of simulated null gravity on the secretion of adrenomedullary hormones and miRNA-375 expression in rats[J]. Med J Chin PLA, 2015, 40(4): 322-326.[温丽君, 吴继华, 宋淑军, 等. 失重对大鼠肾上腺髓质激素分泌及miRNA-375表达的影响[J]. 解放军医学杂志, 2015, 40(4): 322-326.]
[10] Tan H, Chen RM, Li XY,et al. Differences of CD4+ T lymphocyte miRNA gene expression in acute coronary artery syndrome (ACS) patients and the effects of rosuvastatin on its expressions[J]. Med J Chin PLA, 2014, 39(2): 99-104.[谈红, 陈瑞敏, 李晓燕, 等. 瑞舒伐他汀对急性冠脉综合征患者CD4+ T淋巴细胞miRNA表达的影响[J]. 解放军医学杂志, 2014, 39(2): 99-104.]
[11] Tili E, Croce CM, Michaille JJ. miR-155: on the crosstalk between inflammation and cancer[J]. Int Rev Immunol, 2009, 28(5): 264-284.
[12] Pareek S, Roy S, Kumari B,et al. MiR-155 induction in microglial cells suppresses Japanese encephalitis virus replication and negatively modulates innate immune responses[J]. J Neuroinflammation, 2014, 11: 97.
[13] Czyzyk-krzeska MF, Zhang X. MiR-155 at the heart of oncogenic pathways[J]. Oncogene, 2014, 33(6): 677-678.
[14] Banerjee A, Schambach F, DeJong CS,et al. Micro-RNA-155 inhibits IFN-gamma signaling in CD4+T cells[J]. Eur J Immunol, 2010, 40(1): 225-231.
[15] Rodriguez A, Vigorito E, Clare S,et al. Requirement of bic/ microRNA-155 for normal immune function[J]. Science, 2007, 316(5824): 608-611.
[16] Cornish AL, Chong MM, Davey GM,et al. Suppressor of cytokine signaling-1 regulates signaling in response to interleukin-2 and other gamma c-dependent cytokines in peripheral T cells[J]. J Biol Chem, 2003, 278(25): 22755-22761.
Inhibitory effect of miR-155 on expression of hepatitis B virus and its mechanism
CAI Qi-yin, REN Guang-li*, ZHANG Wei-yun, FENG Yu-peng, MA Heng-hao
Department of Pediatrics, General Hospital of Guangzhou Command, Guangzhou 510010, China
*< class="emphasis_italic">Corresponding author, E-mail: guangliren@hotmail.com
, E-mail: guangliren@hotmail.com
This work was supported by the Science and Technology Foundation of Guangzhou (2013J4100116)
ObjectiveTo investigate the mechanism of miR-155 regulating SOCS1 in the inhibition of HBsAg and HBeAg.MethodsThe pre-miR-155 was amplified from total DNA of HepG2.2.15 by PCR. The target gene fragment was digested and cloned into the pmR-mCherry plasmid. PmiR-155 was transfected into HepG2.2.15 cells (recombinant group) by liposome-mediated method. The empty plasmid, the reagent group and untreated cells were set as control. Firstly the expression of miR-155 was detected by the real-time quantitative PCR. Secondly, the expression of SOCS1 mRNA was detected by RT-PCR, and then the expression of SOCS1 protein was determined by Western blotting. Finally, the expression of HBsAg and HBeAg was determined by ELISA.ResultsThe pmiR-155 eukaryotic over-expression vector was successfully constructed. MiR-155 level of HepG2.2.15 cells which was transfected with the recombinant plasmid (519.43±52.10) was obviously higher than those of the empty plasmid (24.24±16.70) and reagent groups (35.04±26.09,P<0.05). RT-PCR showed the expression of SOCS1 mRNA was lower in recombinant group than in untreated group. The expression of SOCS1 protein markedly decreased as shown with Western blotting. Over-expression of miR-155 could inhibit the expressions of HBsAg and HBeAg (55.62±3.77)% and (47.87±2.46)% (P<0.01) respectively.ConclusionsOver-expression of miR-155 can down regulate the expression of SOCS1, and inhibit the expressions of HBsAg and HBeAg.
hepatitis B, chronic; microRNAs; hepatitis B surface antigens; hepatitis B core antigens
R512.6
A
0577-7402(2015)11-0902-04
10.11855/j.issn.0577-7402.2015.11.09
2015-05-18;
2015-07-29)
(责任编辑:熊晓然)
广州市科技计划项目(2013J4100116)
蔡启茵,医学硕士。主要从事儿科病毒感染性疾病的研究
510010 广州 广州军区广州总医院儿科(蔡启茵、任广立、张卫云、冯宇鹏、马恒颢)
任广立,E-mail: guangliren@hotmail.com
