多模态磁共振技术在胶质瘤复发与放射性脑损伤鉴别诊断中的应用价值
2015-06-28葛光治杨艺张强
葛光治,杨艺,张强
多模态磁共振技术在胶质瘤复发与放射性脑损伤鉴别诊断中的应用价值
葛光治,杨艺,张强
目的探讨联合应用弥散加权成像(DWI)、灌注加权成像(PWI)、磁共振波谱成像(MRS)等磁共振成像技术对胶质瘤复发与放射性脑损伤的鉴别诊断价值。方法回顾性分析2011年1月-2013年12月32例在北京军区总医院就诊的胶质瘤术后放疗患者的临床及影像学资料,其中胶质瘤复发15例,放射性脑损伤17例。分析32例患者的DWI、PWI、MRS等磁共振影像学资料,比较异常强化区与对侧正常区的磁共振表观扩散系数(ADC)、自动生成脑血容量(CBV)、脑血流量(CBF)、平均通过时间(MTT)、胆碱(Cho)/磷酸肌酸(Cr)比值及Cho/N-乙酰天门冬氨酸(NAA)比值。结果胶质瘤复发组ADC值与放射性脑损伤组比较差异无统计学意义(P>0.05)。胶质瘤复发组相对脑血流量(rCBF)、相对脑血容量(rCBV)的最大值和平均值明显高于放射性脑损伤组(P<0.05),相对平均通过时间(rMTT)的最大值和平均值与放射性脑损伤组比较差异无统计学意义(P>0.05)。胶质瘤复发组的Cho/Cr和Cho/NAA比值均明显高于放射性脑损伤组(P<0.05)。对胶质瘤复发的诊断灵敏度,单用PWI为80%,单用MRS为73.3%,PWI联合MRS为93.3%。对放射性脑损伤的诊断灵敏度,单用PWI为82.4%,单用MRS为70.6%,PWI联合MRS为88.2%。结论联合应用多模态磁共振成像技术可提高胶质瘤复发及放射性脑损伤的诊断准确性,为临床治疗提供良好的指导。
神经胶质瘤;肿瘤复发,局部;脑损伤,放射性;弥散加权成像;灌注加权成像;磁共振波谱成像
胶质瘤是颅内最常见的原发性肿瘤,其生长具有浸润性,因而手术切除后常辅以放疗及靶向化疗。术后常规放疗可以杀死肿瘤细胞或抑制肿瘤细胞的生长,增强手术治疗效果,延长患者生存期,但同时也会引起脑组织的放射性损伤。临床上及常规影像检查很难分辨胶质瘤复发与放射性脑损伤[1],而正确诊断对于临床医师选择治疗方案以及改善患者预后均有重要意义。本文通过对磁共振技术包括弥散加权成像(diffusion weighted imaging,DWI)、灌注加权成像(perfusion weighted imaging,PWI)及磁共振波谱成像(magnetic resonance spectroscopy,MRS)等相关参数的研究,探讨DWI、PWI及MRS多模态磁共振技术在胶质瘤复发与放射性脑损伤临床鉴别诊断中的价值。
1 资料与方法
1.1 一般资料 2011年1月-2013年12月在北京军区总医院就诊的胶质瘤术后行放疗的患者32例,其中男24例,女8例,年龄41.0±7.3(18~67)岁。胶质瘤复发组15例,放射性脑损伤组17例,均通过二次手术病理结果及随诊观察证实。纳入标准:①患者均有脑肿瘤手术切除史,术后病理证实为Ⅱ-Ⅳ级胶质瘤;②手术切除后均行总剂量为50~65Gy的放射治疗;③在隔3~6个月进行MR随访复查中出现异常强化病灶。10例患者行二次手术、9例行穿刺活检,病理结果证实其中6例为放射性脑损伤坏死,13例为胶质瘤复发;13例患者经MR随诊观察6个月~ 1年后,11例病灶减小、占位效应减轻,考虑为放射性脑损伤,2例病灶强化范围增大,水肿范围增加,征象恶化,考虑为胶质瘤复发。
1.2 检查方法 所有患者均采用磁共振扫描仪(GE公司,Signa 3.0T HDxt)及相控阵8通道头颅线圈行MR常规及DWI平扫,然后再行PWI灌注扫描及常规增强扫描,在强化病灶的基础上行MRS扫描。患者及家属在检查前均签署知情同意书,检查前嘱患者尽量保持头部不动,工作人员用柔软物体填充患者头部两侧,防止不自主运动。
32例患者的常规及增强扫描包括:T2WI TR/ TE 5000ms/119.4ms,T1WI TR/TE 1750ms/24ms,FOV 22cm×22cm,矩阵384×224;DWI检查序列b值为1000s/mm2,TR/TE 5000ms/75.1ms,层厚6.0mm,层间距1.0mm,FOV 22cm×22cm,矩阵320×224。PWI序列应用高压注射器肘前静脉团注Gd-DTPA 20ml(0.2~0.4ml/kg),注射流率5ml/s,采用多层采集方式(GRE-EPI)进行图像采集,TR 1600ms,TE 40ms,FOV 24cm×24cm,矩阵128×128,层厚6.0mm,层间距1.0mm,每层面采集两组图像后团注对比剂,再注入等量生理盐水冲洗导管,每层面采集50幅图像。灌注成像结束后,重复横轴面、矢状面及冠状面T1WI常规增强扫描,并以MR增强扫描图像为基础进行MRS测量区域的定位,选取强化最明显的区域和对侧正常脑组织为感兴趣区(region of interest,ROI),MRS采用点解析波谱序列(point-resolved spectroscopy sequence,PRESS)以及激励回波序列(stimulated echo acquision mode,STEAM)进行信号采集,TR 2000ms,TE 144ms,集次数512次。采集数据时为提高敏感性,尽量应用饱和带避免来自邻近组织的干扰,尽量减少脑脊液的部分容积效应,为避免头皮脂肪污染,ROI离颅骨至少5~10mm,邻近静脉窦也需排除。检查结束后,DWI、PWI及MRS的原始数据图像传至GE ADW 4.4工作站进行后处理分析。
1.3 数据采集 表观扩散系数(apparent diffusion coefficient,ADC)数据采集:DWI原始数据传至GE ADW 4.4工作站进行后处理,利用Functool软件自动重建生成磁共振ADC图,结合T1WI增强图像,在增强明显的病灶区及对侧镜像区内手工绘制ROI,大小为20~40mm2,获得强化区/对侧区ADC比值,即rADC。所选ROI的ADC值由Functool软件自动计算得出。每例患者测量强化病灶内3个不同ROI的ADC比值,取其平均值,从而减少主观测量误差。
PWI血流动力学数据处理:将原始图像导入工作站,采用去卷积灌注软件进行分析,自动生成脑血容量(cerebral blood volume,CBV)、脑血流量(cerebral blood flow,CBF)、平均通过时间(mean transit time,MTT)伪彩图,ROI在强化最明显区域和对侧镜像区相对正常的脑白质内选择,计算强化区/对侧CBV比值(rCBV)。在ROI内测量3次取平均值以尽可能减少人为因素影响。相同方法计算rCBF、rMTT。
MRS图像处理:将原始图像导入ADW 4.4后处理工作站,由Functool软件自动完成信号平均、基线校正、代谢物识别及峰值计算,观察代谢物N-乙酰天门冬氨酸(N-acetylaspartate,NAA)、胆碱(choline,Cho)、肌酸/磷酸肌酸(creatine,Cr)、乳酸(Lactate,Lac)、脂质(Lipids,Lip)的波峰值,获得病变区域Cho/Cr、Cho/NAA比值。
1.4 统计学处理 采用SPSS 13.0软件进行统计分析。计量资料以表示,采用独立样本t检验比较胶质瘤复发和放射性脑损伤区的最大和平均rADC、rCBF、rCBV、rMTT以及Cho/Cr、Cho/ NAA比值。P<0.05为差异有统计学意义。
2 结 果
在T1WI增强图像中,胶质瘤复发(图1A,右侧)及放射性脑损伤(图2A,左侧)均表现为不均匀的异常强化信号,周围可见不同程度的占位效应,无法鉴别胶质瘤复发与放射性脑损伤。胶质瘤复发(图1C)及放射性脑损伤(图2C)强化区域DWI弥散均受限,ADC明显增高。胶质瘤复发病例右侧病灶区ADC(图1D)为1.25,对侧正常组织ADC为0.691,rADC为1.81。放射性脑损伤病例左侧病灶区ADC(图2D)为1.31,对侧正常组织ADC为0.758,rADC为1.73。
胶质瘤复发病例病灶区CBF(图1E)及CBV(图1F)与对侧比较均明显增高,而MTT(图1G)与对侧比较变化不明显;灌注时间-信号强度曲线(图1H)也提示病灶区灌注明显高于对侧区,而灌注时间变化不显著。放射性脑损伤病例病灶区CBF(图2E)及CBV(图2F)与对侧比较均明显减低,而MTT(图2G)与对侧比较变化不明显;灌注时间-信号强度曲线(图2H)提示左侧放射性脑损伤区灌注明显低于对侧区,而灌注时间变化不显著。定量分析显示,胶质瘤复发组中rCBF、rCBV均明显增高,放射性脑损伤组rCBF、rCBV均明显减低,rMTT变化不明显(表1)。
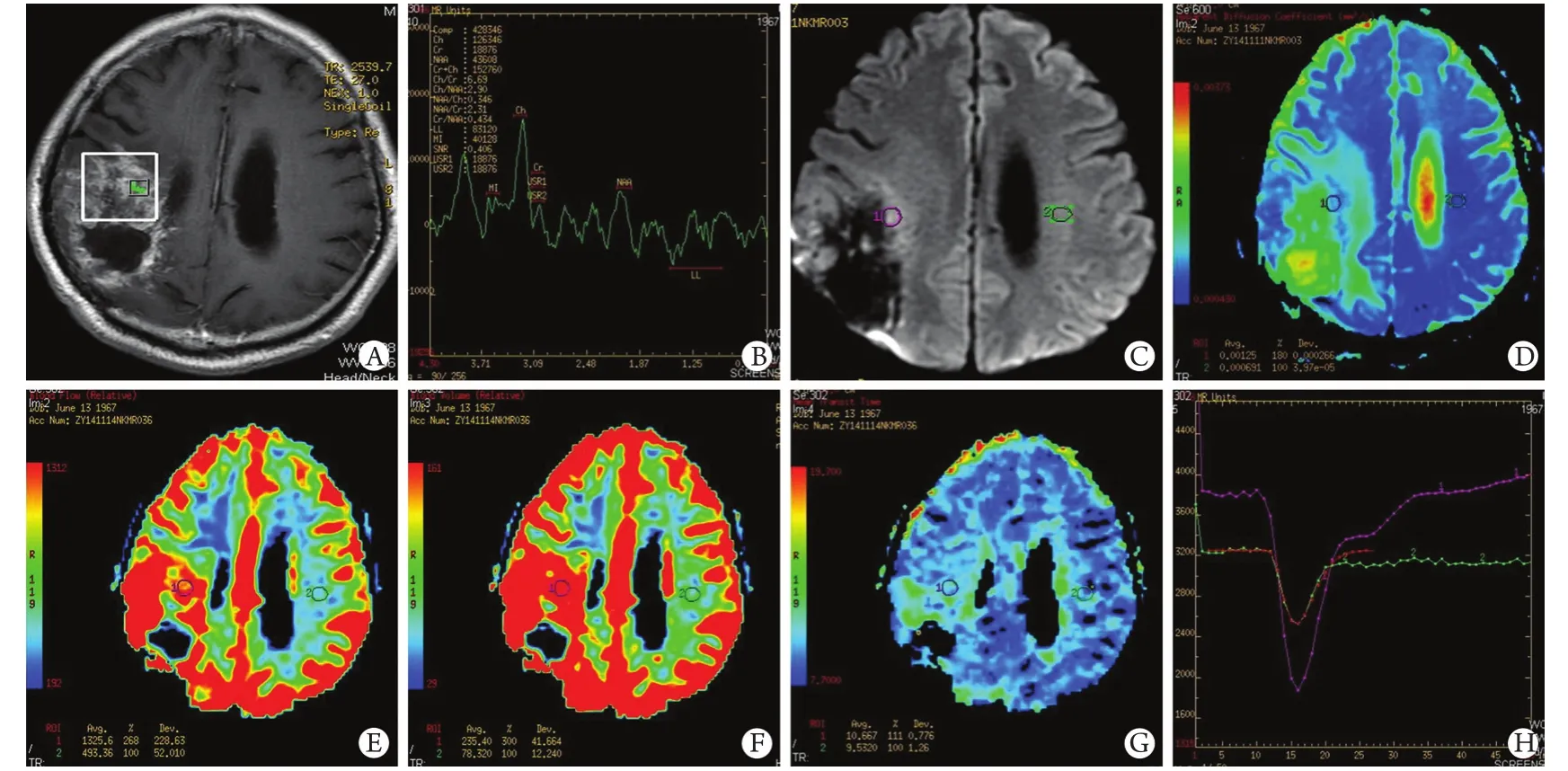
图1 胶质瘤复发病例的T1WI增强、MRS、DWI、ADC、CBF、CBV、MTT及灌注时间-信号强度曲线Fig. 1 T1WI enhancement, MRS, DWI, ADC, CBF, CBV, MTT and perfusion time - signal intensity curve of glioma recurrence patientA. T1WI enhancement; B. MRS; C. DWI; D. ADC; E. CBF; F. CBV; G. MTT; H. Perfusion time-signal intensity curve
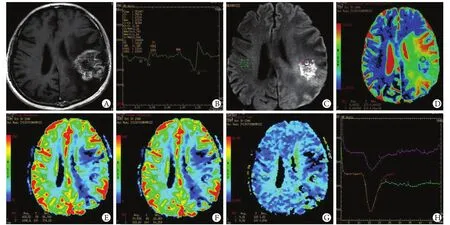
图2 放射性脑损伤病例的T1WI增强、MRS、DWI、ADC、CBF、CBV、MTT及灌注时间-信号强度曲线Fig. 2 T1WI enhancement, MRS, DWI, ADC, CBF, CBV, MTT and perfusion time-signal intensity curve of radiation brain injury patientA. T1WI enhancement; B. MRS; C. DWI; D. ADC; E. CBF; F. CBV; G. MTT; H. Perfusion time-signal intensity curve
胶质瘤复发病例MRS(图1B)谱线显示Cho峰增高,Cr、NAA峰减低,Cho/Cr比值为6.69,Cho/ NAA比值为2.90。胶质瘤复发组中2例患者出现高耸的Lip峰,2例患者出现增高或倒置的Lac峰。放射性脑损伤病例MRS(图2B)谱线显示Cho峰减低,Cr、NAA峰低平,见明显Lip峰及Lac峰,Cho/Cr比值为1.94,Cho/NAA比值为1.26。放射性脑损伤组中3例患者仅见高大的Lip峰,2例患者Cho、Cr、NAA、Lac、Lip均未测出,为一较平坦的曲线。与放射性脑损伤组比较,胶质瘤复发组Cho/Cr、Cho/NAA比值均明显升高(表1)。
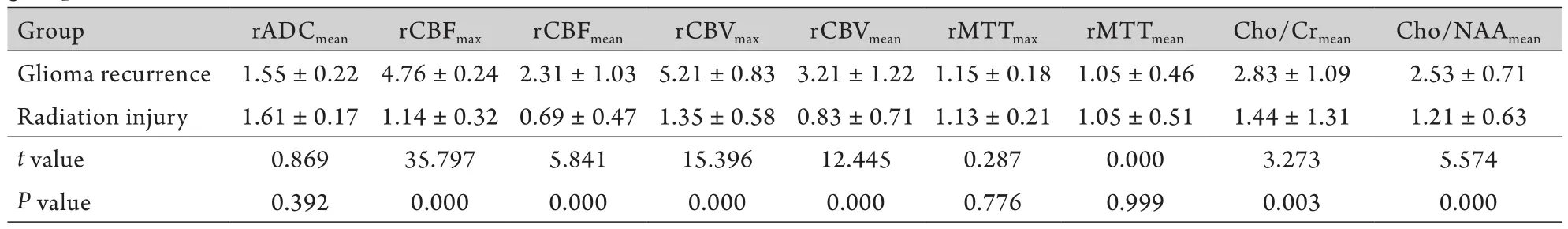
表1 胶质瘤复发组及放射性脑损伤组rADC、rCBF、rCBV、rMTT、Cho/Cr比值、Cho/NAA比值比较Tab. 1 Comparisons of rADC, rCBF, rCBV, rMTT, Cho/Cr and Cho/NAA between glioma recurrence group and radiation injury group
与放射性脑损伤组比较,胶质瘤复发组rCBF、rCBV、Cho/Cr和Cho/NAA比值差异有统计学意义(P<0.05),但两组rMTT、rADC比较差异无统计学意义(P>0.05,表1)。
胶质瘤复发组(1 5例)采用P W I、M R S、PWI+MRS检测出的阳性例数分别为12、11、14例,放射脑损伤组(17例)采用PWI、MRS、PWI+MRS检测出的阳性例数分别为14、12、15例。单用PWI的诊断灵敏度胶质瘤复发组为80.0%(12/15),放射性脑损伤组为82.4%(14/17)。单用M R S的诊断灵敏度胶质瘤复发组为73.3%(11/15),放射性脑损伤组为70.6%(12/17)。联合应用PWI和MRS诊断胶质瘤复发的灵敏度为93.3%(14/15),诊断放射性脑损伤的灵敏度为88.2%(15/17),明显高于单用PWI或MRS。
3 讨 论
脑胶质瘤是成人最常见的颅内原发性肿瘤,占全部脑肿瘤的35%~60%。由于其生长具有浸润性,外科手术难以彻底切除,所以临床治疗常以外科手术为主,术后辅以放射治疗及靶向化疗[2]。放射线对神经组织有直接损伤作用,可引起神经胶质细胞脱髓鞘、变性甚至死亡,对大血管的损害则是使其退变硬化[3]。约20%的胶质瘤患者脑部放疗后会出现不同程度的放射性脑损伤,在放射性脑损伤的早期,组织周围会出现血管内皮细胞坏死,血管壁纤维蛋白变性,弹性降低,后期血管腔狭窄闭塞,管壁玻璃样变,瘢痕形成及毛细血管扩张等,引起脑水肿、缺血性退行性改变甚至液化坏死[4]。放射剂量越大,放射性脑损伤出现地越早,脑组织水肿及临床症状越明显。放射性脑损伤可导致血脑屏障破坏,因而在常规影像上难以区分手术切除区、放疗区内新出现的强化病灶是胶质瘤复发还是放射性脑损伤。随着磁共振的分子影像学技术DWI、PWI、MRS等越来越多地运用于临床诊断中,为胶质瘤复发及放射性脑损伤的鉴别诊断提供了可靠的影像学依据。
3.1 DWI在鉴别胶质瘤复发与放射性脑损伤中的应用 DWI通过观察水分子的弥散运动反映组织的结构功能特征,DWI图像呈低信号时,表明水分子弥散运动增强,其定量分析图显示ADC值增大,反之表明水分子弥散受限,ADC值减小。目前已广泛应用于急性脑缺血、脑肿瘤和脓肿等的鉴别诊断。DWI可通过测定ADC对胶质瘤复发和放射性脑损伤进行定量分析。放射性脑损伤时的脑组织水肿、神经胶质增生、脱髓鞘、坏死、囊变及异常强化灶均影响水分子的扩散运动,使其ADC值显著低于正常脑组织。在进行性或永久性放射性脑损伤中,ADC值减低,而且ADC值减低程度与脑组织损伤明显相关,即ADC值越低其永久性损伤的可能性越大[5]。肿瘤复发时肿瘤细胞密集、细胞间隙小,肿瘤细胞核/质比值大,以及细胞毒性水肿会导致ADC减低,但肿瘤的新生血管会导致ADC值增加[6]。Zeng 等[7]的研究结果显示,胶质瘤复发部位ADC值低于非复发组,Hein等[8]研究发现胶质瘤复发组织ADC值低于放射性脑损伤组织。
本研究结果显示,胶质瘤复发组和放射性脑损伤组rADCmean分别为1.55±0.22和1.61±0.17,差异无统计学意义。ADC检测的影响因素较多,肿瘤的微血管再生可能会使ADC值升高,而放疗后组织内部的成分不是单一的,不同成分对ADC值的影响不同,组织胶质增生以及巨噬细胞吞噬浸润可使ADC值减低,出血、坏死、钙化等也会对ADC值产生较大影响,同一病变在不同病理阶段其水分子弥散情况也不尽相同,且本组患者例数较少,可能偏向集中于某一阶段,故胶质瘤复发和放射性脑损伤时ADC值有无差异尚需通过更大样本研究进行探索。
3.2 PWI在鉴别胶质瘤复发与放射性脑损伤中的应用 PWI是通过增强对比剂在脑组织中的首过效应反映组织的毛细血管微循环,提供脑组织血流动力学变化情况的磁共振成像方法。PWI图像经过后处理,绘制出时间-信号强度变化曲线,利用曲线可计算出脑相对血流量(rCBF)、相对血容积(rCBV)及相对平均通过时间(rMTT)等多种相关参数。肿瘤细胞的生长及新陈代谢加快,导致肿瘤组织局部处于低糖、低氧状态,刺激血管异常增生,故新生血管丰富程度是判断肿瘤良恶性程度、WHO分级及肿瘤放化疗后复发与否的重要指标[9]。Hu等[10]的研究表明,肿瘤的新生血管发育不完善,相对于正常组织的血管,其走行迂曲密集、血管壁通透性增加,而放射性脑损伤区由于缺乏新生血管以及血管内皮细胞坏死,血管腔狭窄,局部呈缺血低灌注改变。PWI参数很容易量化这种血管状态。在脑肿瘤灌注的定量描述中,最常用的参数为CBV,而CBF、MTT等应用较少。CBV能反映局部组织微血管分布及灌注情况,与肿瘤血管再生和微血管密度呈正相关[11-12]。
本研究结果显示,15例放疗后胶质瘤复发患者,rCBVmean为3.21±1.22,rCBFmean为2.31±1.03,均明显大于放射性脑损伤患者(r C B Vm e a n为0.83±0.71,rCBFmean为0.69±0.47),而rMTT两组比较无明显差异。Bobek-Billewicz等[13]通过患侧CBV/健侧CBV计算脑内CBV镜像相对比值,即rCBV,以rCBVmax>1.7或rCBVmean>1.25判定为肿瘤复发,rCBVmax<1.0或rCBVmean<0.5判定为放射性脑损伤。本组研究中,胶质瘤复发组rCBVmax及rCBVmean均符合该标准,放射性脑损伤组rCBVmax为1.35±0.58,rCBVmean为0.83±0.71,均大于该标准,这可能是由于放射性脑损伤处于急性期及亚急性期时,炎性因子刺激导致血管反应性增生或者局部组织尚未完全损伤坏死,表现为组织灌注轻度增高,但又低于正常的脑组织所致。单纯的放射性脑损伤表现为明显的低灌注,但胶质瘤术后患者的放射性脑损伤与胶质瘤复发不是简单的有或无的关系,可能会出现二者并存的情况,但尚有待于大样本研究及进一步临床病理分析证实。
3.3 MRS在鉴别胶质瘤复发与放射性脑损伤中的应用 MRS可通过无创的形式检测组织生化特征和体内代谢产物的变化。在胶质瘤患者中肿瘤细胞增殖异常,呈浸润性生长,侵犯正常神经元胞体及轴突,导致其功能损害,使局部NAA峰值显著下降。Cho是细胞膜磷脂代谢的成分之一,参与细胞膜的合成与代谢,反映了细胞膜的合成和分解水平,提示了肿瘤细胞增生和分裂的旺盛程度。肿瘤细胞增殖明显,细胞分裂旺盛时,Cho明显增高[14]。本研究结果显示,胶质瘤复发病灶Cho明显增高,Cr、 NAA下降或消失,Cho/Cr比值升高,Cho/NAA比值增高,而放射性脑损伤表现为Cho、NAA峰下降或消失,Lip增高。Yoshino等[15]认为可能是放射线损伤细胞引起细胞膜崩解、代谢降低,细胞膜中的磷脂分解成中性脂肪所致。当放射线剂量过高导致脑组织永久性损伤时,MRS参数仅表现为一较平坦曲线。Weybright等[16]对29例脑胶质瘤复发和放射性脑损伤患者的研究显示,胶质瘤复发的Cho/Cr、Cho/NAA比值高于放射性脑损伤及对侧正常组织,Cho明显升高,NAA明显降低,而Cho/ Cr>2和(或)Cho/NAA>2.5则高度提示肿瘤复发。本研究中,胶质瘤复发时Cho峰增高,Cho/Cr、Cho/NAA比值明显高于放射性脑损伤,Cho/Cr为2.83±1.09,Cho/NAA为2.53±0.71,符合上述标准,且差异有统计学意义。
本研究中,胶质瘤复发组有4例患者Cho、Cr、NAA峰均减低,但Cho/Cr、Cho/NAA高于对侧正常脑组织,在随访中胶质瘤明显复发。胶质瘤复发组中2例出现高耸Lip峰,2例出现Lac峰。放射性脑损伤组中2例患者Cho、Cr、NAA、Lac、Lip均未测出,呈一平坦的曲线,1例仅见高大的Lip峰。胶质瘤复发组及放射性脑损伤组都有病例显示Lip峰升高,Lip升高提示髓鞘坏死或中断,其中放射性脑损伤中出现Lip峰提示细胞膜分解,组织坏死,肿瘤内出现Lip信号常提示为恶性肿瘤。Lac在脑组织内升高主要因为脑组织缺血无氧酵解和炎性吞噬细胞产生的大量乳酸。因此单纯的Lip、Lac峰在MRS分析仅有提示作用,在放射性脑损伤时提示脑组织明显坏死,在胶质瘤复发时提示恶性肿瘤及部分组织坏死,无明显鉴别意义,必须结合其他参数一起分析。
3.4 DWI、PWI、MRS在鉴别胶质瘤复发与放射性脑损伤中的联合应用 由于胶质瘤切除术后及放疗后局部脑组织成分复杂,有手术及放疗所致的局部脑组织损伤、胶质细胞增生、瘢痕形成以及部分复发的肿瘤组织,因此单纯利用一种磁共振功能成像技术对手术放疗后组织的病变性质进行鉴别存在明显的局限性。由于PWI参数采集应用的是病变侧与对侧的比值,当病灶呈浸润性生长越过中线时,所测灌注参数比值的准确性会减低;另外,如果病灶过于接近颅底层面,由于成像序列(EPI)的磁敏感特性,加上目前灌注成像还只能停留在轴面显示的水平,使接近颅板的病灶或者出血后含铁血黄素沉着明显的病灶灌注图像出现明显的伪影,进而影响到所采集数据的可信度及比值的准确性。MRS中多种代谢产物的波谱重叠,组织出血、坏死、含铁血黄素沉着对磁场均匀性的影响,颅底部位病变,一些具有特别诊断意义的代谢物不能明确分辨等均使其应用受到限制。
在本研究中,单用PWI诊断出胶质瘤复发12例,放射性脑损伤14例,对胶质瘤复发的诊断灵敏度为80.0%;单用MRS诊断出胶质瘤复发为11例,放射性脑损伤为4例,对胶质瘤复发的诊断灵敏度为73.3%。联合应用PWI和MRS诊断出胶质瘤复发14例,放射脑损伤15例,对胶质瘤复发的诊断灵敏度为93.3%,明显高于单用PWI或MRS。DWI的应用文献报道差异较大,而本研究中ADC值在两组间差异无统计学意义,笔者认为其仅可起辅助参考作用。
综上所述,胶质瘤放疗后出现常规影像上无法明确诊断的强化病灶及占位效应时,可应用多模态的磁共振成像技术加以鉴别。对于胶质瘤复发和放射性脑损伤,PWI可通过rCBF、rCBV值的高低来鉴别,MRS可通过Cho/Cr及Cho/NAA等参数加以鉴别,DWI中的ADC值可以辅助PWI及MRS确定胶质瘤复发与放射性脑损伤的诊断。与常规单一的影像学技术相比,综合多模态、多参数的磁共振成像技术可以从分子影像学角度进行临床诊断,在血流动力学和组织代谢产物的水平指导临床诊断和治疗。
[1]Du FZ, Gu M, He C,et al. Image analysis of intracranial high perfusion lesion by whole brain one-stop imaging technique with 320 detector rows CT[J]. Med J Chin PLA, 2014, 39(3): 217-221.[杜飞舟, 顾明, 何次, 等. 320排CT全脑一站式成像技术对颅内高灌注病灶的诊断价值分析[J]. 解放军医学杂志, 2014, 39(3): 217-221.]
[2]Beaucbesne PD, Taillandier L. Concurrent radiotherapy: fotemustine combination for newly diagnosed malignant glioma patients, a phase Ⅱ study[J]. Cancer Chemother Pharmacol, 2009, 64(11): 74-76.
[3]Wu KF, Xu PK, Wu Y,et al. Six cases of patients with gliomas radiation encephalopathy misdiagnosed as recurrent glioma clinical analysis[J]. Chin J Minim Invasive Surg, 2012, 12(2): 138.[吴开福, 徐培坤, 吴运, 等. 6例胶质瘤术后放射性脑病误诊为胶质瘤复发的临床分析[J]. 中国微创外科杂志, 2012, 12(2): 138.]
[4]Wang YL, Liu MY, Li JF,et al. Value of apparent diffusion coefficient value in differential diagnosis of glioma recurrence and radiation brain injury[J]. Acta Acad Med Sinic, 2012, 16(4): 396-400.[王玉林, 刘梦雨, 李金锋, 等. 表观弥散系数值在鉴别胶质瘤复发与放射性脑损伤中的价值[J]. 中国医学科学院学报, 2012, 16(4): 396-400.]
[5]Chan YL, Yeung DK, Leung SF,et al. Diffusion-weighted magnetic resonance imaging in radiation-induced cerebral necrosis. Apparent diffusion coefficient in lesion components[J]. J Comput Assist Tomogr, 2003, 27(5): 674-680.
[6]Sundgren PC, Fan X, Weybright P,et al. Differentiation of recurrent brain tumor versus radiation injury using diffusion tensor imaging in patients with new contrast-enhancing lesions[J]. Magn Reson Imaging, 2006, 24(9): 1131-1142.
[7]Zeng QS, Li CF, Liu H,et al. Distinction between recurrent glioma and radiation injury using magnetic resonance spectroscopy in combination with diffusion-weighted imaging[J]. Int J Radiat Oncol Biol Phys, 2007, 68(1): 151-158.
[8]Hein PA, Eskey CJ. Diffusion-weighted imaging in the follow-up of treated high-grade gliomas: tumor recurrence versus radiation injury[J]. AJNR Am J Neuroradiol, 2004, 25(2): 201-209.
[9]Wong JC, Provenzale JM, Petrella JR. Perfusion MR imaging of brain neoplasms[J]. AJR Am J Roentqenol, 2000, 174(4): 1147-1157.
[10] Hu LS, Baxter LC, Smith KA,et al. Relative cerebral blood volume values to differentiate highgrade glioma recurrence from posttreatment radiation effect: direct correlation between image-guided tissue histopathology and localized dynamic susceptibility-weighted contrast enhanced perfusion MR imaging measurements[J]. AJNR Am J Neuroradiol, 2009, 30(4): 552-558.
[11] Hoefnagels FWA, Lagerwaard FJ, Sanchez E,et al. Radiological progression of cerebral metastases after radiosurgery: assessment of perfusion MRI for differentiating between necrosis and recurrence[J]. J Neurol, 2009, 256(6): 878-887.
[12] Barajas R, Chang J, Sneed P,et al. Distinguishing recurrent intraaxial metastatic tumor from radiation necrosis following gamma knife radiosurgery using dynamic susceptibility-weighted contrast-enhanced perfusion MR imaging[J]. AJNR Am J Neuroradiol, 2009, 30(2): 367-372.
[13] Bobek-Billewicz B, Stasik-Pres G, Majchrzak H,et al. Differentiation between brain tumor recurrence and radiation injury using perfusion, diffusion-weighted imaging and MR spectroscopy[J]. Foila Neuropathol, 2010, 48(2): 81-92.
[14] Wang Y, Ma L. MRI research progress in early radiation-induced brain injury[J]. Chin J Med Imaging, 2012, 20(4): 315-316. [王岩, 马林. 早期放射性脑损伤MRI研究进展[J]. 中国医学影像学杂志, 2012, 20(4): 315-316.]
[15] Yoshino E, Ohmori Y, Imahori Y,et al. Irradiation effects on the metabrolism of metastation brain tumors: anaysis by position emission tomography and1H-magnetic resonance spectroscopy[J]. Stereotact Funct Neurosurg, 1996, 66(Suppl 1): 240-259.
[16] Weybright P, Sundgren PC, Maly P,et al. Differentiation between brain tumor recurrence and radiation injury using MR spectroscopy[J]. AJR Am J Roentgenol, 2005, 185(6): 1471-1476.
The value of multimodal magnetic resonance imaging in the differential diagnosis of glioma recurrence and radiation brain injury
GE Guang-zhi, YANG Yi, ZHANG Qiang*
Department of Neuroimaging, Bayi Brain Hospital Affiliated to the General Hospital of Beijing Command, Beijing 100700, China
*< class="emphasis_italic">Corresponding author, E-mail: zhangq1964@sina.com
, E-mail: zhangq1964@sina.com
ObjectiveTo explore the application of a combination of diffusion weighted imaging (DWI), perfusion weighted imaging (PWI) and magnetic resonance spectroscopy (MRS) in the differential diagnosis of glioma recurrence and radiation brain injury.MethodsThe clinical and imaging data of 32 patients were retrospectively analyzed, including 15 cases of glioma recurrence and 17 cases of radiation brain injury, admitted from Jan. 2011 to Dec. 2013 in General Hospital of Beijing Command. The DWI, PWI and MRS data of the 32 patients were retrospectively analyzed. The following values were compared between abnormal enhancement area and contralateral normal area: magnetic resonance apparent diffusion coefficient (ADC), relative cerebral blood flow (rCBF), relative cerebral blood volume (rCBV), relative mean transit time (rMTT), choline/creatine (Cho/Cr) and choline/N-acetyl aspartate (Cho/ NAA) ratio.ResultsNo statistical significance of ADC and rMTT values was found between glioma recurrence group and radiation brain injury group (P>0.05); The maximum and average rCBF and rCBV values were significantly higher in glioma recurrence group than in radiation brain injury group (P<0.05), but no statistical difference was found between the two groups on maximum and average rMTT value (P>0.05). The ratios of Cho/Cr and Cho/NAA were higher in glioma recurrence group than in radiation brain injury group (P<0.05). The diagnostic sensitivity of PWI to glioma recurrence was 80.0%, of MRS was 73.3%, and of PWI combined with MRS was 93.3%. The diagnostic sensitivity of PWI to radiation brain injury was 82.4%, of MRS was 70.6%, and of PWI combined with MRS was 88.2%.ConclusionCombined application of multimodal magnetic resonance imaging technology may improve the diagnostic accuracy to glioma recurrence and radiation brain injury, thus provide a good guidance for clinical treatment.
glioma; neoplasm recurrence, local; brain injuries, radioactive; diffusion weighted imaging; perfusion weighted imaging; magnetic resonance imaging
R739.41
A
0577-7402(2015)11-0921-06
10.11855/j.issn.0577-7402.2015.11.13
2015-03-11;
2015-09-23)
(责任编辑:李恩江)
葛光治,主治医师。主要从事神经系统的影像诊断与研究工作
100700 北京 北京军区总医院附属八一脑科医院神经影像科(葛光治、杨艺、张强)
张强,E-mail:zhangq1964@sina.com
