SDS-PAGE电泳法测定蒜头果蛋白的相对分子质量
2015-06-24王红斌BARROWColin杨文荣
袁 燕,王红斌,BARROW Colin J,杨文荣
(1.云南民族大学 民族药资源化学国家民委-教育部重点实验室,云南 昆明 650500; 2.云南民族大学 云南省生物高分子功能材料工程技术研究中心,云南 昆明 650500; 3.澳大利亚迪肯大学 生命与环境科学学院化学与生物技术中心,澳大利亚 吉朗 VIC3216)
SDS-PAGE电泳法测定蒜头果蛋白的相对分子质量
袁 燕1,2,王红斌1,2,BARROW Colin J3,杨文荣3
(1.云南民族大学 民族药资源化学国家民委-教育部重点实验室,云南 昆明 650500; 2.云南民族大学 云南省生物高分子功能材料工程技术研究中心,云南 昆明 650500; 3.澳大利亚迪肯大学 生命与环境科学学院化学与生物技术中心,澳大利亚 吉朗 VIC3216)
蒜头果蛋白(malanin)是从广西、云南特有植物蒜头果中分离、纯化出的一种新的、具有抗肿瘤活性的植物蛋白质.采用变性十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)测定malanin的相对分子质量.结果表明,malanin是一种双链蛋白质,由A、B 2条肽链通过二硫键连接而成,其相对分子质量约为65.94×103.方法具有简单、快速、直观的特点.
蒜头果蛋白;SDS-PAGE;相对分子质量
蒜头果(malaniaoleiferachun et S.Lee)属于铁青树科(Olacaceae)蒜头果属[1],是中国特有单种属稀有植物,国家二级保护树种[2],广西重点保护野生植物,仅分布于云南东南部和广西西部的狭窄地带[3].
蒜头果蛋白(malanin)是通过粉碎、抽提、硫酸铵沉淀、疏水色谱层析等方法从广西、云南特有植物蒜头果(malaniaoleifera)中分离纯化出一种新的、具有抗肿瘤活性的糖蛋白[4].体外抗肿瘤活性表明malanin具有明显抑制人宫颈癌(HeLa)、人白血病(K562) 、人乳腺癌(MCF-7)和神经瘤(PC-12)等肿瘤细胞体外增殖的能力,其半致死浓度IC50值分别为1.54× 10-10、1.58×10-8、1.12×10-8和7.71×10-9mol·L-1[4],说明malanin具有非常强的抗肿瘤活性,可作为抗癌药物的先导分子,具有用于免疫毒素治疗癌症的应用前景.
聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)是以聚丙烯酰胺凝胶作为支持介质的一种常用电泳技术,由于其机械强度好,透明有弹性,有较好的化学稳定性和热稳定性,没有吸附作用和电渗作用,可通过改变丙烯酰胺的浓度和交联度而制成不同孔径的凝胶等优点,故被广泛应用于生物大分子的分离[5-6].
1967年Shapiro等发现,在聚丙烯酰胺凝胶系统中加入十二烷基硫酸钠(sodium dodecyl sulfate,SDS)后,则蛋白质分子的电泳迁移率主要取决于其相对分子质量,而与它的形状及所带电荷无关.因此,要测定某一蛋白质分子的相对分子质量,只需比较该蛋白质与其他已知相对分子质量的蛋白质在SDS-PAGE凝胶电泳上的迁移率即可[7-8].本文通过变性SDS-PAGE凝胶电泳,以相对分子质量的对数为纵坐标,迁移率为横坐标作回归方程,计算malanin的相对分子量,为malanin的基本理化性质提供参考数据.
1 实验材料与方法
1.1 实验材料
丙烯酰胺/亚甲基双丙烯酰胺(Pharmacia公司);十二烷基硫基钠(SDS)、考马斯亮蓝G-250(Biom公司);β-疏基乙醇、N,N,N′,N′-四甲基乙二胺(TEMED)(Amresco公司);蛋白质分子量标准(Protein Molecular Weight Markers)(Promega公司);其余试剂均为国产分析纯.
1.2 仪器
蛋白质电泳系统(Hoefer SE260)(Amersham公司);Milli-Q纯水机(MILLIRORE公司);万分之一天平(Sartorius,BP110S).
1.3 实验方法
1.3.1 Malanin样品的处理
取少量溶液或冻干的样品分别置于1.5 mL eppendorf 管中,加入等体积比的1×样品缓冲液.震荡后置于沸水浴中煮沸5 min.冷却,离心机离心10 s,冷却后备用.
1.3.2 不连续SDS-PAGE电泳
按Laemmli[9]方法进行,分离胶浓度为12%,浓缩胶浓度为3%[10].
1) 铸分离胶.将玻璃板、梳子和隔条用蒸馏水冲洗净,凉干后,装好模具,用移液器将12%分离胶溶液加入模具中,液面距顶端1/3~1/4处,加满去离子水,自然聚合30~60 min[11].
2) 铸压缩胶.待分离胶聚合后,将上层去离子水倒掉,用滤纸吸干去离子水后注入3%的浓缩胶,同时插入10孔样品梳,待其自然聚合30 min左右[12].
3) 上样.将制好的凝胶装进电泳槽,加入电泳缓冲液(1×),取出梳子,每孔加15 μL样品.
4) 电泳测定.接通电泳仪电源进行电泳分析,待溴酚蓝到达凝胶的底部时,关闭电源,停止电泳.
5) 染色与固定.电泳完毕后,将分离胶小心地从玻璃板上取下,放入装有考马斯亮蓝G-250染色液的表面皿中,用摇床染色30 min左右[13].
6) 脱色.染色与固定后的凝胶浸于脱色液中脱色,30 min左右换一次脱色液,直至无蛋白质处无色透明为止.
7) 保存.脱色后凝胶用数码相机照相保存.
1.3.3 Malanin相对分子质量的测定
分子量测定按Fairbanks[14]方法,以相对分子质量的对数为纵坐标,迁移率为横坐标作直线回归图,以回归方程计算出相对分子质量.
2 结果与分析
2.1 不连续SDS-PAGE电泳
图1中第3孔可以看到只有一条带,说明malanin纯度比较高,用β-巯基乙醇处理后的malanin被裂解成2个条带,分子量小的下面那条带命名为A链,分子量大的上面那条带命名为B链(图1的第4个孔道).此结果说明malanin是一种双链蛋白质,由A、B 2条肽链通过二硫键连接而成的.
2.2 Malanin相对分子质量的测定
由于蛋白质的迁移率与分子质量成正比,因而可以用SDS-PAGE电泳来测定蛋白质的分子质量.通过已知蛋白质的分子质量常用对数与相对迁移率(Rf)绘制出标准曲线,未知蛋白质的分子则可由标准曲线上查出.Rf=蛋白质的迁移距离/示踪染料距离.蛋白质的迁移距离是指从分离胶的起始位到蛋白质条带的前沿[15].

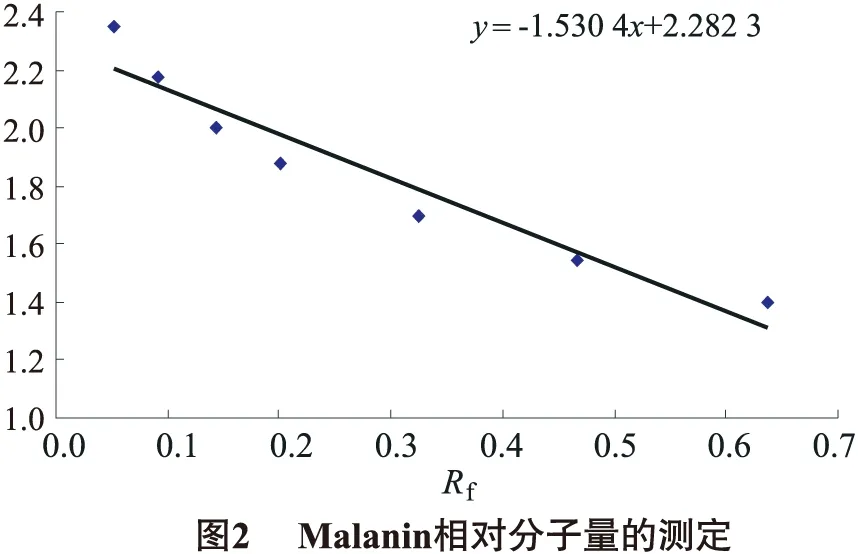
按Fairbanks方法,以标准蛋白质分子质量的对数与相对迁移率(Rf)作直线回归图,由回归方程即可算出malanin及其A、B链的相对分子质量.图2得出的直线方程为:y=-1.530 4x+2.282 3,根据malanin及A、B链的Rf值可以算出malanin及A、B链的相对分子质量分别为65.94×103、30.05×103和20.94×103.
3 结果与讨论
采用不连续变性SDS-PAGE凝胶电泳法,以相对分子质量的对数为纵坐标,迁移率为横坐标作回归方程,得到malanin的相对分子量65.94×103,由于加入β-巯基乙醇处理后,蒜头果蛋白被裂解成二条链,其相对分子质量分别为30.05×103和20.94×103,说明malanin是由A、B 2条肽链通过二硫键连接而成,此结果为malanin的基本理化性质提供较好的参考数据.SDS-PAGE电泳法测定蛋白质的分子质量具有简便、快速、重复性好的优点,是目前鉴定蛋白质纯度及测定分子质量比较好的方法.但由于电泳方法测定的蛋白质分子质量误差较大,一般在5%~10%之间.近几年出现的基质辅助激光解吸电离质谱和电喷雾电离质谱能实现相对分子质量在几万以上大分子蛋白质的精确测定,成为质谱学家和生化学家的一个研究热点.本文采用基质辅助激光解吸飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF-MS)测定malanin相对分子质量为61.875×103,其误差为6.63%,结果令人满意.
[1] 丘华兴,林有润.中国植物志(24卷)[M].北京:科学出版社,1988.
[2] 傅立国.中国植物红皮书—稀有濒危植物(第一册)[M].北京:科学出版社,1992.
[3] 广西林业局保护站.广西壮族自治区重点保护野生植物资源调查报告[R].南宁,2001.
[4] YUAN Y,DAI X C,WANG D B,et al.Purification,characterization and cytotoxicity of malanin,a novel plant toxin from the seeds of Malania oleifera[J].Toxicon,2009,54:121-127.
[5] 张瑶,刘芳,张页.一种改良的蛋白质电泳考马斯亮蓝G-250染色方法[J].基础医学与临床,2012(8):953-955.
[6] 李慧,吴恩应,张运佳.低毒高效的SDS-PAGE考马斯亮蓝染色方法比较[J].生物技术通讯,2011(2):261-263.
[7] 马歇克 D R,门永 J T.蛋白质纯化与鉴定实验指南[M].北京:科学出版社,1999.
[8] 郭勇.现代生化技术[M].2版.北京:科学出版社,2008.
[9] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[10] 孙波,迟玉杰,徐宁,等.Tricine-SDS-PAGE电泳检测蛋清肽分子量的研究[J].食品科学,2008,29(5):385-388.
[11] 邸瑶,张丽萍,夏红梅.十二烷基硫酸钠-聚丙烯酰胺凝胶电泳的实验教学改进[J].实验室科学,2011(1):58-59.
[12] 林方养,杨耀东,万婕,等.不同染色剂对SDS-PAGE染色体系的影响[J].安徽农业科学,2014(9):2562-2563.
[13] 吴远双,宋玉竹.一种考马斯亮蓝G-250快速染色法在SDS-PAGE中的应用[J].光谱实验室,2013,30(6):3109-3113.
[14] FAIRBABNKS G,THEODORE L S,WALLACH D F H.Electrophoresis analysis of the major polypeptides of the human erythrocyte membrane[J].Biochemistry,1971,10(13):2606-2617.
[15] 汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2004.
(责任编辑 王 琳)
Determination of the relative molecular mass of malanin with SDS-PAGE
YUAN Yan1,2,WANG Hong-bin1,2,BARROW Colin J3,YANG Wen-rong3
(1. Key Laboratory of Chemistry in Ethnic Medicinal Resources,State Ethnic Affairs Commission and Ministry of Education of China, Yunnan Minzu University,Kunming 650031,China; 2.Engineering Research Center of Biopolymer Functional Materials of Yunnan, Yunnan Minzu University,Kunming 650500,China; 3.Center for Chemistry and Biotechnology,School of Life and Environmental Sciences,Deakin University,Geelong,VIC 3216,Australia)
Malanin,a novel plant protein with anti-tumor activities,was isolated and purified from an endemic plant ofmalaniaoleiferain Guangxi and Yunnan provinces. The relative molecular mass of malanin was determined by the denaturing sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE). The result has showed that malanin is a protein with two chains,chain-A and chain-B,which are cross-linked by one or two disulfide bonds,and its relative molecular mass is about 65 94×103. SDS-PAGE gel electrophoresis is a simple,fast,direct-viewing method to determine the relative molecular mass of malanin.
malanin; SDS-PAGE; relative molecular mass weight
2014-11-25.
国家自然科学基金(81260500);教育国际化平台建设项目(218-02001001002129);云南省“无机化学精品课程”资助项目(2012HX08,2012HX12).
袁燕(1975-),女,博士,副教授,硕士生导师.主要研究方向:生物有机化学.
Q516
A
1672-8513(2015)02-0123-03
