杂色曲霉转化孕酮的研究
2015-06-24杨海英李忠孝沈广剑张振宇李淑娟
杨海英,李忠孝,沈广剑,张振宇,李淑娟,杜 刚
(云南民族大学 民族药资源化学国家民族事务委员会-教育部重点实验室,云南 昆明 650500)
杂色曲霉转化孕酮的研究
杨海英,李忠孝,沈广剑,张振宇,李淑娟,杜 刚
(云南民族大学 民族药资源化学国家民族事务委员会-教育部重点实验室,云南 昆明 650500)
利用杂色曲霉对孕酮进行生物转化,通过HPLC对转化产物进行检测,硅胶柱层析分离纯化转化产物,得到3个转化产物.运用NMR、MS、IR等波谱数据对转化产物进行结构鉴定,确定转化产物结构为:雄烯二酮(AD);睾酮;雄二烯二酮(ADD).研究结果表明,杂色曲霉菌株能够裂解孕酮C-17位的侧链,生成19个碳的转化产物,并对裂解产物进行结构修饰.
生物转化;杂色曲霉;孕酮;结构鉴定
筛选优良菌株、发掘新的生物催化剂是发展甾体药物工业的重要课题.1952年美国普强公司的Murray和Peterson利用黑根霉转化孕酮11位羟基化,并实现了工业化生产,这一工作使可的松的合成步骤减少到十一步,大大降低了生产成本,到1967年可的松的生产成本已降到1美元/g[1-3].这是第一个成功的生物转化工业化项目,证明了微生物技术可以应用于大规模的甾体药物生产.自此以后,微生物转化甾体化合物的研究被广泛开展,微生物转化甾体类药物成为生物转化在大规模工业应用中最成功的范例之一,在甾体药物生产中具有高选择性、高转化率、条件温和及低化学污染等优点[4].
孕酮是一种孕激素,是合成皮质激素的重要中间体,也是最早进行微生物转化研究的甾体化合物,雄烯二酮(AD)和雄二烯二酮(ADD)为最具市场价值的甾体药物中间体,市场容量达每年10亿美元[5].本研究以实验室保藏杂色曲霉菌株对孕酮进行生物转化初步研究,为该菌株在甾体药物研发中的应用提供依据.
1 仪器试剂
1.1 材料
孕酮购自江苏省盐城信谊医药化工有限公司,经NMR及HPLC检测纯度>98%.
1.2 微生物菌株
杂色曲霉分离自滇重楼根状茎,为本实验室保藏菌株,实验室编号YNCA0098.
1.3 转化过程及粗提物制备
发酵培养基含3 g/L NaNO3,1 g/L K2PO4,0.5 g/L MgSO4·7H2O,0.5 g/L KCl,0.01 g/L FeSO4·7H2O,30 g/L蔗糖,pH 6.5,孕酮1.0 g/L,孕酮加少量乙酸乙酯溶解,再加4 g/L吐温80混匀,加水形成乳浊液加入1 L培养基,进行放大培养发酵.250 mL锥形瓶装入100 mL发酵液,共发酵8 L.置于28 ℃,220 r/min振荡培养7 d.发酵液用乙酸乙酯萃取,菌丝体用甲醇浸泡超声提取,真空浓缩合并得到粗提物浸膏.
1.4 HPLC分析
色谱柱:Agilent ZORAX SB-C18柱/4.6×150 mm,5 μm;检测器:二级管陈列检测器(DAD);流动相(体积比):甲醇/水=60/40;流速:1.0 mL/min;检测波长:245 nm;柱温:40 ℃;进样量:5 μL.取0.05 g粗提物,加入1 mL甲醇溶解,用0.45 μm过滤膜过滤,进行HPLC分析.
1.5 孕酮传化产物的分离纯化
正相硅胶(200~300 目):样品=10∶1(V/V)装柱上样,以V(石油醚)∶V(乙酸乙酯)为10∶1~1∶5逐级梯度洗脱,初步分离划段.通过TLC检测,含转化产物组分再次用正相硅胶柱进行分离,以V(氯仿)∶V(甲醇)为100∶1~60∶1梯度洗脱.
2 实验结果
2.1 转化结果HPLC分析
杂色曲霉YNCA0098转化底物孕酮后发酵液的HPLC图见图1.

由HPLC图可以看出,杂色曲霉YNCA0098转化孕酮不完全,转化产物极性变大.添加的底物孕酮出现在10.160 min,转化反应新出现3个峰,分别为5.324 min,4.406 min和2.417 min,经后期分离及结构鉴定,确定5.324 min峰为睾酮峰,4.406 min峰为雄烯二酮峰,2.417 min峰为雄二烯二酮峰.
2.2 孕酮转化产物结构鉴定
杂色曲霉转化孕酮(1)得到的3个转化产物,经核磁共振、红外光谱、质谱、熔点检测,结构鉴定分别为:雄烯二酮(AD)(2);睾酮(3);雄二烯二酮(ADD)(4).
化合物的理化鉴定结果如下:
雄烯二酮(AD)(2),白色粉末,m.p.171~172 ℃;IR(KBr)νmax:3 449,2 952,2 919,2 849,1 735,1 663,1 128 cm-1;1H NMR(CDCl3,400 MHz)δ:5.69(1H,s,H-4),0.86(3H,s,H-18),1.16(3H,s,H-19);13C NMR(CDCl3,100 MHz)δ:35.6(t,C-1),34.9(t,C-2),199.3(C=O,C-3), 124.1(d,C-4),170.4(s,C-5),32.5(t,C-6),30.7(t,C-7),35.1(d,C-8),54.7(d,C-9),38.6(s,C-10),20.3(t,C-11),35.7(t,C-12),47.5(s,C-13),50.8(d,C-14),21.7(t,C-15),31.2(t,C-16),220(C=O,C-17),14.7(q,C-18),17.3(q,C-19).ESI-MS(m/z):285.2[M-H]-;309.2[M+Na]+.分子式:C19H26O2.与文献[6-8]对照一致.
睾酮(3),白色针状结晶,m.p.142~144 ℃;IR(KBr)νmax:3 398,2 929,1 654,1 131,1 066 cm-1.1H NMR(CDCl3,400 MHz)δ:5.70(1H,s,H-4),0.76(3H,s,H-18),1.16(3H,s,H-19);13C NMR(CDCl3,100 MHz,δ):36.8(t,C-1),37.4(t,C-2),202.0(C=O,C-3), 124.1(d,C-4),175.1(s,C-5),34.9(t,C-6),32.9(t,C-7),36.8(d,C-8),55.5(d,C-9),40.0(s,C-10),21.7(t,C-11),37.7(t,C-12),44.9(s,C-13),51.8(d,C-14),24.2(t,C-15),30.6(t,C-16),220(C=O,C-17),11.6(q,C-18),17.7(q,C-19);ESI-MS(m/z)311.2[M+Na]+,327.2 [M+K]+.分子式:C19H28O2.与文献[6]对照一致.
雄二烯二酮(ADD)(4),白色粉末.m.p.139~141 ℃,IR(KBr)νmax:3 455,2 936,2 845,1 739,1 657,1 129,1 064 cm-1;1H NMR(CDCl3,400 MHz)δ:7.01(1H,m,H-2),6.21(1H,m,H-2),6.03(1H,m,H-4),0.92(3H,s,H-18),1.22(3H,s,H-19);13C NMR(CDCl3,100 MHz)δ:155.4(d,C-1),127.6(d,C-2),186.1(C=O,C-3), 124.0(d,C-4),168.4(s,C-5),32.3(t,C-6),31.1(t,C-7),35.0(d,C-8),52.2(d,C-9),44.4(s,C-10),22.0(t,C-11),32.5(t,C-12),47.6(s,C-13),50.3(d,C-14),21.9(t,C-15),35.6(t,C-16),219.6(C=O,C-17),14.8(q,C-18),18.7(q,C-19);ESI-MS(m/z):284.2[M-H]-,307.2[M+Na]+.分子式:C19H24O2.与文献[7,9]对照一致.
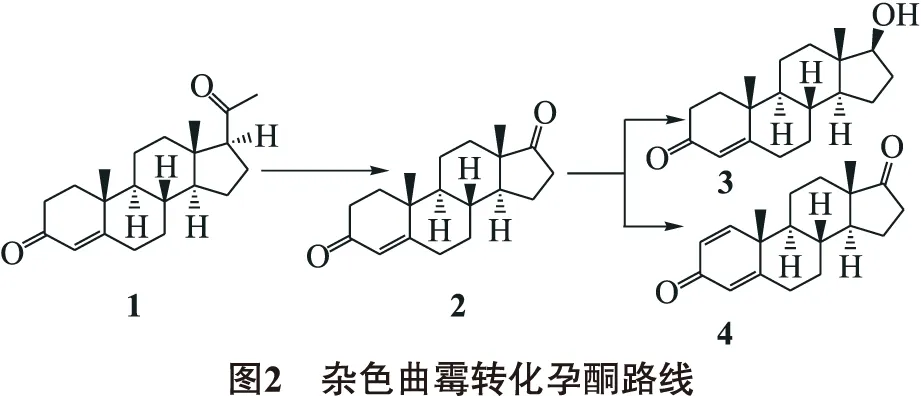
2.3 转化途径推测
根据化合物在转化过程中出现顺序及结构特点,推测孕酮首先裂解为AD,17位羰基被还原为羟基,得到睾酮,C-1和C-2之间脱氢得到ADD.孕酮生物转化路线推测如图2.
3 结语
杂色曲霉YNCA0098转化孕酮得到3个转化产物,通过NMR、MS、IR等波谱数据对转化产物进行结构鉴定,确定为AD、ADD和睾酮,推测转化过程为孕酮首先裂解为AD,17位羰基被还原为羟基,得到睾酮,C-1和C-2之间脱氢得到ADD.由YNCA0098转化孕酮发酵液的HPLC分析图谱上可以看出,底物孕酮转化不完全,经分离得到三个转化产物.转化过程为AD、ADD和睾酮的生产提供了新的可能途径,在下一步工作中还需优化转化条件,提高孕酮的转化率,同时提高转化的专一性.
[1] DONOVA M,EGOROVA O.Microbial steroid transformations:current state and prospects[J].Appl Microbiol Biotechnol,2012,94(6):1423-1447.
[2] 诸有义.生物合成药物学[M].北京:化学工业出版社,2000:649.
[3] 诸秉根.甾体激素和其作用机制发现的历史回顾[J].医学与哲学,1997,18(4):193-195.
[4] CARBALLEIRA J D,QUEZADA M A,HOYOS P,et al.Microbial cells as catalysts for stereoselective red-ox reactions[J].Biotechnol Adv,2009,27(6):686-714.
[5] CARBALLEIRA J D,QUEZADA M A,HOYOS P,et al.Microbial cells as catalysts for stereoselective red-ox reactions[J]. Biotechnol Adv,2009,27(6):686-714.
[6] BLUNT J W,STOTHERS J B.13C n.m.r.spectra of steroids —a survey and commentary[J].Organic Magnetic Resonance,1977,9(8):439-464.
[7] KIRK D N,MILLER B W,LATIF S A,et al.18-substituted steroids .16.synthesis of 6-beta-hydroxy-aldosterone and 6-alpha-hydroxy-aldosterone and their 17-alpha-isomers[J].J Chem Res-S,1989,6 :164-165.
[8] FARAMARZI M A,YAZDI M T,AMINI M.Microbial production of testosterone and testololactone in the culture of Aspergillus terreus[J].World J Microb Biot,2004,20:657-660.
[9] KIRK D N,TOMS H C,DOUGLAS C,et al.A survey of the high-field 1H NMR spectra of the steroid-hormones,their hydroxylated derivatives,and related-compounds[J].J Chem Soc,Perkin Trans 2,1990,9:1567-1594.
(责任编辑 王 琳)
Biotransformation of progesterone byAspergillusversicolor
YANG Hai-ying,LI Zhong-xiao,SHEN Guang-jian,ZHANG Zhen-yu,LI Shu-juan,DU Gang
(Key Laboratory of Chemistry in Ethnic Medicinal Resources,State Ethnic Affairs Commission and Ministry of Education of China,School of Chemistry and Biotechnology,Yunnan Minzu University,Kunming 650500,China)
Progesterone was transformed byAspergillusversicolorand three transformation products were obtained. These products were elucidated by13C NMR,1H NMR,FTIR and MS. The structures of these compounds were androstenedione,testosterone and androstanedienedione. The results showed that the progesterone could be split at C-17 byAspergillusversicolor.
biotransformation;Aspergillusversicolor; progesterone; structural identification
2014-11-23.
云南省教育厅科学研究基金重点项目(2013Z038);云南民族大学化学与生物技术学院SRT项目(2013HXSRT05).
杨海英(1975-),女,硕士,副教授,硕士生导师.主要研究方向:天然产物及生物催化.
杜刚(1973-),男,博士研究生,副教授,硕士生导师.主要研究方向:生物催化.
O629.2
A
1672-8513(2015)02-0126-03
