正清风痛宁对偏头痛大鼠脑干IL-1β、TNF-α表达的影响
2015-06-15张中菊刘晓丽易桂标于娜杨丽
张中菊 刘晓丽 易桂标 于娜 杨丽
正清风痛宁对偏头痛大鼠脑干IL-1β、TNF-α表达的影响
张中菊 刘晓丽 易桂标 于娜 杨丽
目的 观察正清风痛宁对炎性细胞因子白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)在偏头痛大鼠脑干表达的影响。方法 将60只Wistar大鼠(雌雄各半)随机分为空白对照组(空白组)、偏头痛模型组(模型组)、舒马普坦组及正清风痛宁高、中、低剂量干预组(高、中、低剂量组)共6组。除空白组外,其余5组大鼠均建立三酰甘油偏头痛模型,用免疫组化SP法测定各组大鼠脑干IL-1β、TNF-α阳性细胞数。结果 6组大鼠间IL-1β、TNF-α阳性细胞数比较差异有统计学意义(分别F=7.063,P=0.001;F=8.257,P=0.000);组间两两比较,模型组脑干IL-1β(18.9±8.17)、TNF-α(14.30±6.41)阳性细胞数较空白组(5.90±2.69、5.00±1.63)增多(分别t=-4.780、P=0.000,t=-4.444,P=0.000),舒马普坦组(2.80±2.15,t=6.026,P=0.000;0.00±0.00,t=7.052,P=0.000)、中剂量组(7.70±4.76,t=3.745,P=0.000;6.20±1.99,t=3.815,P=0.000)、高剂量组(7.80±5.90,t=3.482,P=0.003;5.90±2.88,t=3.778,P=0.001)IL-1β、TNF-α阳性细胞数均较模型组减少;低剂量组脑干IL-1β(13.5±4.30,t=1.849,P=0.081)、TNF-α(11.30±6.11,t=1.071,P=0.298) 阳性细胞数与模型组比较差异均无统计学意义;与舒马普坦组比较,低剂量组(t=-7.037,P=0.000;t=-5.847,P=0.000)、中剂量组(t=-2.966,P=0.011;t=-9.858,P=0.000)、高剂量组(t=-2.517,P=0.022;t=-6.467,P=0.000)脑干IL-1β、TNF-α阳性细胞数均增多;与低剂量组比较,中(t=-2.858,P=0.011;t=-2.510,P=0.022)、高剂量组(t=-2.468,P=0.024;t=-2.527,P=0.021)脑干IL-1β、TNF-α阳性细胞数减少;中、高剂量组脑干IL-1β、TNF-α阳性细胞数差异无统计学意义(t=0.042,P=0.967;t=-0.271,P=0.790)。结论 正清风痛宁可能抑制偏头痛大鼠炎性细胞因子IL-1β、TNF-α的表达。
正清风痛宁;偏头痛;白细胞介素-1β;肿瘤坏死因子-α
偏头痛(migraine)是一种反复发作的原发性头痛,为常见的头痛类型,给个人及社会带来了极大的影响。目前偏头痛的发病机制众说纷纭,神经源性炎性反应(neurogenic inflammation,NI)被认为在偏头痛的发病机制中起重要作用。曲坦类药物(如舒马普坦)是特异性5-羟色胺(5-HT)1B/1D受体激动剂,是目前治疗偏头痛疗效较肯定的药物,但由于价格昂贵,且具有心血管等系统的不良反应,限制了其在临床上的应用。正清风痛宁(主要成分为青藤碱)具有镇痛、抗炎及免疫抑制等药理作用,且不良反应小,其在临床上的镇痛作用是肯定的,但其是否对偏头痛治疗有效,目前国内外尚无文献报道。本实验通过建立三酰甘油(glycerylteinitrate,GTN)动物偏头痛模型,予正清风痛宁干预,以舒马普坦为阳性对照,用免疫组化法测定大鼠脑干炎性细胞因子白介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor nesrosis factor-α, TNF-α)表达,探讨正清风痛宁对炎性细胞因子表达的影响,期望为开发偏头痛新药治疗提供依据。
1 材料和方法
1.1 材料
1.1.1 实验动物:清洁级Wistar大鼠60只〔由重庆第三军医大学大坪医院医学实验动物中心提供,许可证号:SCXK(渝)2007-0005〕,雌雄各半,体质量(320±60) g,分笼喂养,可自由进饮食。
1.1.2 主要试剂及仪器:三酰甘油注射液(5 mg/mL)由北京益民药业提供;正清风痛宁缓释片(盐酸青藤碱含量60 mg/片)由湖南正清制药提供;琥珀酸舒马普坦片(批号0903127)购自天津华津制药公司;兔抗大鼠IL-1β抗体(编号sc-1265)、兔抗大鼠TNF-α抗体(编号BA0131)均购自武汉博士德生物公司。麦克奥迪BA400显微镜及麦克奥迪Moticcam 2306摄像为麦克奥迪实业集团公司产品;病理石蜡切片机为北京弘泰嘉业科技发展有限公司产品。
1.2 方法 动物适应性喂养后,随机分为空白对照组(空白组)、偏头痛模型组、舒马普坦组及正清风痛宁低、中、高剂量组(低、中、高剂量组)6组,每组10只。
1.2.1 偏头痛模型制作:空白组不予任何处理,其余各组均参照文献[1]方法制作偏头痛大鼠模型。按10 mg/kg皮下注射三酰甘油注射液,30 min后大鼠出现双耳发红、前肢频繁搔头、爬笼次数增多、竖毛、活动增加等表现为制作大鼠偏头痛模型成功。本实验中造模各组50只大鼠均造模成功。
1.2.2 症状学观察:观察各组大鼠耳红、爬笼、挠头等表现并记录开始及消失时间,从而评价药物干预对大鼠症状是否有改善作用。挠头出现时间以大鼠连续挠头次数达5次以上为标志,消失时间以一个时间段内(以舒马普坦及正清风痛宁灌胃时开始计时,30 min为一个时间段)大鼠挠头次数小于5次并出现怠倦、疲乏的表现为标志。
1.2.3 药物干预:舒马普坦组于注射GTN 30 min后按6 mg/kg琥珀酸舒马普坦灌胃给药;低、中、高治疗组按100 mg/kg、150 mg/kg、200 mg/kg剂量于注射GTN 30 min后灌胃给药;各组药物均以生理盐水稀释到相同体积灌胃,模型组以等体积生理盐水灌胃。空白组不予任何处理。
1.2.4 取材及标本处理:造模药物灌胃后4 h将上述动物用10%(质量浓度)水合氯醛(按0.35 mL/100 g麻醉大鼠)腹腔注射进行全身麻醉,之后仰卧固定开胸,从左心室至主动脉插管,剪开右心耳。首先迅速灌注无菌生理盐水200 mL,然后灌注4℃ 4%(质量浓度)多聚甲醛(PFA)磷酸盐缓冲液200 mL,灌注后断头取大鼠脑组织,在40%(质量浓度)PFA磷酸盐缓冲液中固定24 h,然后放入20%(质量浓度)蔗糖-PBS液中,至组织块下沉。然后常规脱水、石蜡包埋。石蜡切片机切片,对大鼠脑干连续切片,片厚约4 um,对石蜡切片行常规HE染色,100倍显微镜下观察确定组织结构未被破坏,然后进行免疫组织化学染色。
1.2.5 SP免疫组化法脑干IL-1β、TNF-α表达:切片脱蜡梯度酒精水化,3%(质量浓度)过氧化酶阻断剂阻断内源性过氧化物酶的活性,以0.01 mol/L柠檬酸盐抗原修复液(pH 6.0)最低档[2]抗原修复10 min。按免疫细胞化学试剂盒说明SP法进行染色,加兔抗大鼠IL-1β的第一抗体(1∶50稀释)37℃孵育1 h,生物素标记的第二抗体(1∶200稀释)37℃孵育40 min,辣根过氧化酶标记链亲和素溶液(1∶400稀释)37℃孵育 40 min,DAB工作液显色,显微镜下观察,当阳性细胞着色明显、细胞间质无明显DAB颜色时终止反应,脱水、透明、封片,400倍显微镜下观察每张切片左上、右上、左下、右下和中央部5个视野,计数每个视野IL-1β阳性细胞总数,计取均值。TNF-α检测采用相应TNF-α抗体,方法与IL-1β相同。IL-1β阳性细胞表现为细胞质呈棕色或棕褐色,细胞核为圆形或卵圆形;TNF-α阳性细胞表现为细胞质呈棕褐色,细胞核为圆形或卵圆形。IL-1β、TNF-α阳性细胞数多提示IL-1β、TNF-α表达水平高。
1.3 统计学处理 使用SPSS17.0软件进行分析。数据以均数±标准差表示,多组(5组或6组)间均数比较采用方差分析,组间两两比较行LSD-t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠行为症状学表现 空白组始终未出现偏头痛表现,其余各组实验大鼠在注射GTN后6~10 min左右,均出现耳红、前肢频繁搔头、爬笼次数增多等现象。各药物干预组与模型组耳红、挠头及爬笼开始时间比较差异无统计学意义(P>0.05);中、高剂量及舒马普坦组耳红、挠头及爬笼消失的时间较模型组大鼠明显缩短(P<0.05);与舒马普坦组比较,低、中、高剂量组大鼠耳红、挠头及爬笼消失的时间明显延长(P<0.05);中、高剂量组大鼠耳红、挠头及爬笼消失的时间较低剂量组明显缩短(P<0.05);低剂量组与模型组比较,以及中、高剂量组大鼠耳红、挠头及爬笼消失的时间比较无明显差异(P>0.05)(表1)。
2.2 各组大鼠脑干IL-1β、TNF-α阳性细胞数比较 6组间IL-1β、TNF-α阳性细胞数比较差异有统计学意义(F=7.063,P=0.001;F=8.257,P=0.000),组间两两比较,模型组IL-1β、TNF-α阳性细胞数较空白组明显增多(t=-4.780,-4.444,均P=0.000),舒马普坦组(t=6.026,7.052,均P=0.000)、中剂量组(t=3.745,3.815,均P=0.000)、高剂量组(t=3.482,P=0.003;t=3.778,P=0.001)均较模型组模型减少,低剂量组与模型组比较差异均无统计学意义(t=1.849,P=0.081;t=1.071,P=0.298)。与舒马普坦组比较,正清风痛宁低(t=-7.037,P=0.000;t=-5.847,P=0.000)、中(t=-2.966,P=0.011;t=-9.858,P=0.000)、高(t=-2.517,P=0.022;t=-6.467,P=0.000)剂量组脑干IL-1β、TNF-α阳性细胞数增多。与低剂量组比较,正清风痛宁中(t=-2.858,P=0.011;t=-2.510,P=0.022)、高(t=-2.468,P=0.024;t=-2.527,P=0.021)剂量组脑干IL-1β、TNF-α阳性细胞数减少;正清风痛宁中、高剂量组脑干IL-1β、TNF-α阳性细胞数比较差异无统计学意义(t=0.042,P=0.967;t=-0.271,P=0.790)。具体见表2。

表1 各组大鼠耳红、挠头、爬笼出现和消失时间比较 (n=10,min)
注:与模型组比较,*P<0.05;与舒马普坦组比较, △P<0.05;与正清风痛宁低剂量组比较,#P<0.05
空白组有少许IL-1β、TNF-α阳性细胞,模型组阳性细胞明显增多,舒马普坦组及正清风痛宁各剂量组阳性细胞数均较模型组减少,尤以舒马普坦组及正清风痛宁中、高剂量组阳性细胞数减少明显(图1、图2)。

表2 各组大鼠脑干IL-1β、TNF-α阳性细胞数组间比较,个/视野)
与空白组比较,*P<0.05;与模型组比较,△P<0.05;与舒马普坦组比较,#P<0.05;与低剂量组比较,▲P<0.05
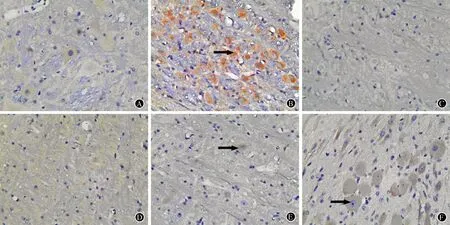
A:空白组;B:模型组;C:舒马普坦组;D:高剂量组;E:中剂量组;F:低剂量组
图1 各组大鼠脑干IL-1β表达:箭头所示为IL-1β阳性细胞(免疫组化×400)
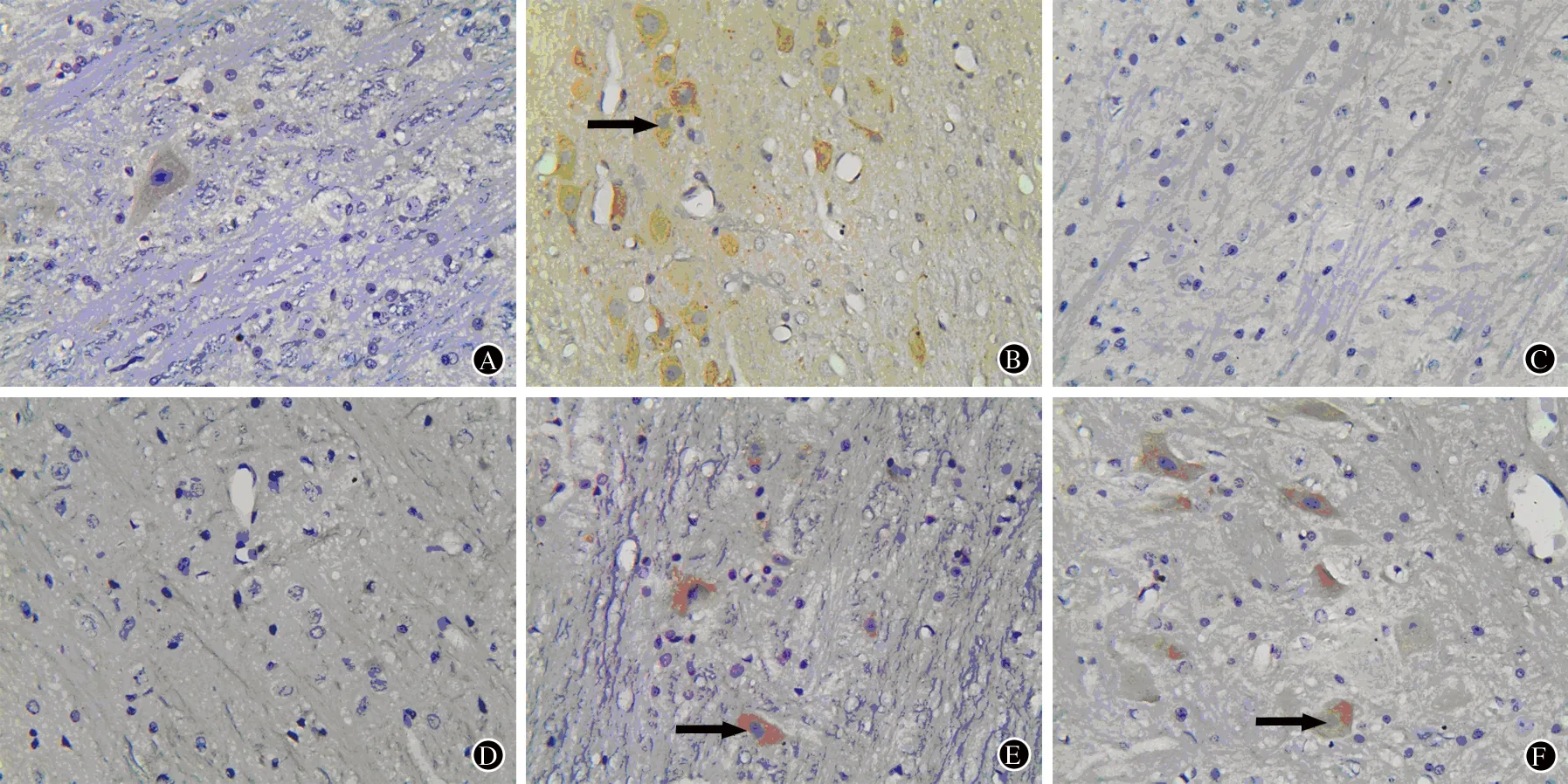
A:空白组;B:模型组;C:舒马普坦组;D:高剂量组;E:中剂量组;F:低剂量组
图2 各组大鼠脑干TNF-α表达:箭头所示为TNF-α阳性细胞(免疫组化×400)
3 讨论
偏头痛的发病机制说法众多,三叉神经血管学说是目前解释偏头痛的主要学说之一。该学说认为,分布于血管或脑膜的三叉神经受到刺激时去极化激活,激活的三叉神经系统释放肽类物质,使血管扩张,产生神经源性炎性反应,进而刺激痛觉纤维顺行性传导,经脑干进入三叉神经核,并如此形成循环,最终出现头痛[3]。
GTN动物模型是一个公认的偏头痛模型[1],是目前用于研究人类偏头痛发病机制较理想的选择。神经源性炎性反应被认为是偏头痛发作的基本病理生理之一。5-HT受体激动剂(如舒马普坦)治疗偏头痛的肯定疗效已达成共识。本实验通过建立GTN偏头痛大鼠模型,以舒马普坦作为阳性药物对照组,观察大鼠脑干IL-1β、TNF-α表达。
IL-1β、TNF-α是主要的炎性介质,在脑内由多种神经元、大小胶质等活性细胞合成及分泌。神经源性炎性反应可使IL-1β、TNF-α分泌增多,上调的IL-1β、TNF-α可激活中性粒细胞,促进血管内皮细胞表达细胞间黏附分子,加强白细胞黏附于血管内皮的能力,引起血管舒缩功能障碍,强化三叉神经的炎性反应状态,增加脑膜伤害性感受器的敏感性。周兆丽等[4]发现静脉注射GTN 0.5 h后观察IL-1β蛋白表达量即有增高,Reuter等[5]发现注射GTN 1 h后IL-1β蛋白表达增高。在急性脑血管病及偏头痛患者血浆、脑脊液中IL-1β、TNF-α水平均升高[6-7],Rozen等发现在每日持续头痛患者脑脊液中TNF-α水平升高,而血清中水平正常,提示TNF-α参与了中枢神经系统炎性反应的发生过程中,这可能是头痛患者久治不愈的原因之一[8]。与上述文献报道类似,本实验结果表明模型组大鼠脑干IL-1β、TNF-α表达较空白组增多(P<0.05)。
正清风痛宁主要成分青藤碱是从中药青风藤的根和茎中提取的生物碱单体,化学结构与吗啡相似,但无躯体及精神依赖性,使用安全性较大,具有明显的抗炎镇痛作用。青藤碱可透过血-脑脊液屏障,干预核转录因子κβ(nucleare facter-kappa κ,NF-κβ)激活通路,抑制IL-1β、TNF-αmRNA表达[8],下调炎性因子IL-1β、TNF-α水平。药理学研究显示,青藤碱对IL-1β基因及TNF-α蛋白表达有明显的抑制作用,其抗炎作用靶点主要是抑制炎性细胞因子的产生[9-10]。吴志茹等[11]报道青藤碱可降低患者血清C反应蛋白(CRP)、IL-1、IL-6、TNF-α水平,从而改善患者微循环炎性状态。本研究中发现,与模型组比较,正清风痛宁中、高剂量组大鼠脑干IL-1β、TNF-α表达明显减少(P<0.05),与上述报道相似。本研究还发现中、高剂量组大鼠耳红、爬笼、挠头等症状减少,持续时间比模型组缩短(P<0.05),提示正清风痛宁中、高剂量可能抑制炎性细胞因子IL-1β、TNF-α在脑干的表达,从而改善GTN偏头痛模型大鼠行为症状。本文作者的前期研究表明,青藤碱可上调偏头痛大鼠脑干5-HT能系统活性[2],结合本实验结果,推测青藤碱可能抑制炎性因子IL-1β、TNF-α表达,减轻三叉神经炎性状态,同时上调5-HT能系统,增加体内镇痛物质水平,最终对偏头痛起镇痛作用。
本实验以治疗偏头痛经典药物舒马普坦为阳性药物对照,结果显示与舒马普坦组比较,正清风痛宁低、中、高剂量组大鼠脑干IL-1β、TNF-α阳性细胞数较明显增多,提示本实验所用正清风痛宁各剂量组对偏头痛大鼠脑干IL-1β、TNF-α阳性细胞数抑制作用可能不及舒马普坦,其他不同剂量的正清风痛宁是否能更明显的抑制偏头痛大鼠脑干炎性细胞因子的表达有待进一步研究明确。
本研究结果表明,正清风痛宁可以抑制IL-1β、TNF-α在偏头痛大鼠脑干的表达,改善偏头痛大鼠行为症状,一定程度上为正清风痛宁治疗偏头痛提供了实验基础依据。
[1]Tassorelli C,Rreco R,Wang D,et al.Nitroglyerin induces hyperalgesia in rat—a time-coure study[J]. Eur J Pharmacol,2003,464(2-3):159-162.
[2]杨丽,罗国标,刘晓丽,等.青藤碱对偏头痛大鼠血浆CGRP、SP含量及脑干5-HT表达的影响[J]. 中风与神经疾病杂志,2013,30(1):60-63.
[3]刘春梅,周俊山. 偏头痛的国际分类、诊断标准、发病机制与防治研究进展[J]. 疑难病杂志, 2010, 9(12): 953-955.
[4]周兆丽,张吉臻.静脉注射三酰甘油大鼠脑膜炎症因子IL-1β及COX-2表达的研究[J].中国实用内科杂志,2006,26(Suppl 2):59-60.
[5]Reuter U,Bolay H,Jansen-Olesen I,et al.Delayed inflammation in rat meninges:implications for migraine pathophysiotogy[J].Brain,2001,124 (Pt12):2490-2502.
[6]Yoshiuchi I,Itoh N,Nakano M,et al. Case report of Klinefelter’s syndrome with severe diabetes,dyslipidemia,and stroke: The effect of pioglitazone and other anti-inflammatoryagents on interleukin-6 and -8,tumor necrosis factor-alpha,and C-reactive protein[J]. Diabetes Care,2006,29(8):1981.
[7]Rozen T, Swidan SZ. Elevation of CSF tumor necrosis factor alpha levels in new daily persistent headache and treatment refractory chronic migraine[J].Headache,2007,47(7):1050-1055.
[8]Wang Y,Fang YF,Zhou X,et al.Effect of FengTongNing ZhengQing on cytokines expressed by peritoneal macrophages in adjuvant arthritis rats[J].Zhonghua Feng Shi Bing Xue Za Zhi,2003,7(7):415-419.
[9]Moskowitz MA. Pathophysiology of headache—past and present[J].Headache,2007,47(Suppl 1):S58-63.
[10]李晓娟,王培训,刘良.青藤碱抗炎抗风湿作用机理研究[J].广州中医药大学学报,2004,21(1):34-36.
[11]吴志茹,程彤,贾志芳.盐酸青藤碱对血液透析患者微炎症状态的影响[J].临床荟萃,2008, 23(19): 1420-1421.
(本文编辑:邹晨双)
Effects of ZhengQing FengTongNing on IL-1 β and TNF- α in the brain stem of the rat migraine model
ZHANGZhongju,LIUXiaoli,YIGuibiao,YUNa,YANGLi*.
*DepartmentofNeurology,AffiliatedHospitalofZunyiMedicalCollege,Zunyi,Guizhou563003,China
Yang Li,Email:yangli1668@126.com
Objective To observe the effect of ZhengQing FengTongNing on the expression of inflammatory cytokines IL-1β and TNF-α in the brainstem of migraine rats, discuss the pharmacology of ZhengQing FengTongNing in migraine, and provide the theoretical basis for the development of new drugs for migraine. Methods Sixty Wistar rats (half female and half male) were randomly divided into 6 groups:the normal control group, the migraine model group,the sumatriptan group,the ZhengQing FengTongNing low-dose intervention group, the ZhengQing FengTongNing medium-dose intervention group, the ZhengQing FengTongNing high-dose intervention group. Except the normal control group, migraine model of the other 5 groups of rats were produced by subcutaneous injection of nitroglycerin.After modeling and drugs intervention, the changes of behavior and symptom of rats were observed,and the number of cells positive for IL-1β and TNF-α in the brainstem of each group were measured by immunohistochemical SP method.Results There were significant differences of the number of cells positive for IL-1β and TNF-α in all the groups(F=7.063,8.257,P<0.05).Further pairwise comparison showed that cells positive for IL-1β(18.9±8.17,t=-4.780,P=0.000) and TNF-α (14.30±6.41,t=-4.444,P=0.000)of the model group were more than the normal control group respectively(P<0.05). Compared with the model group,the number of cells positive for IL-1β and TNF-α in the sumatriptan group(2.80±2.15,t=6.026;0.00±0.00,t=7.052), the medium-dose group(7.70±4.76,t=3.745;6.20±1.99,t=3.815) and the high-dose group(7.80±5.90,t=3.482,P=0.003;5.90±2.88,t=3.778,P=0.001) were significantly decreased. In the low-dose intervention groups, the number of cells positive for IL-1β(13.5±4.30,t=1.849,P=0.081) and TNF-α(11.30±6.11,t=1.071,P=0.298) in brainstem had no statistical difference compared with the model group. The number of cells positive for IL-1β and TNF-α in brainstem of the sumatriptan group was less than the low-dose intervention group(t=-7.037,P=0.000;t=-5.847,P=0.000), the medium-dose group(t=-2.966,P=0.011;t=-9.858,P=0.000), and the high-dose group(t=-2.517,P=0.022;t=-6.467,P=0.000). Compared with the ZhengQing FengTongNing low-dose intervention group, the number of cells positive for IL-1β and TNF-α significantly decreased in brainstem of the medium-dose group(t=-2.858,P=0.011;t=-2.510,P=0.022) and high-dose group(t=-2.468,P=0.024;t=-2.527,P=0.021); the number of cells positive for IL-1β and TNF-α in the medium-dose group and high-dose group had no statistical difference(t=0.042,P=0.967;t=-0.271,P=0.790). Conclusions ZhengQing FengTongNing may achieve the effect of treatment in migraine rats, and one of its mechanisms may be inhibiting the expression of inflammatory cytokines IL-1β and TNF-α.
ZhengQing FengTongNing; migraine; interleukin-1beta; tumor necrosis factor-alpha
10.3969/j.issn.1006-2963.2015.02.006
贵州省省长基金项目〔黔省专合字(2008)112号〕
563003遵义医学院附属医院2010级研究生(张中菊,现工作于遵义市第一人民医院神经内科); 563003遵义医学院附属医院病理科(刘晓丽),神经内科(于娜、杨丽);414500平江县第一人民医院神经内科(易桂标)
杨丽,Email:yangli1668@126.com
R747.2
A
1006-2963 (2015)02-0096-06
2013-07-21)
