脑梗死性共济失调患者手指运动的BOLD-fMRI 定量研究
2015-06-15王小洁元小冬王守红赵艳生邓红亮周立富王淑娟张高勋
王小洁 元小冬 王守红 赵艳生 邓红亮 周立富 王淑娟 张高勋
脑梗死性共济失调患者手指运动的BOLD-fMRI 定量研究
王小洁 元小冬 王守红 赵艳生 邓红亮 周立富 王淑娟 张高勋
目的 运用全脑血氧水平依赖性磁共振脑功能成像(BOLD-fMRI)技术,定量研究脑梗死所致共济失调患者手共济运动中枢的脑功能情况。方法 健康右利手志愿者(对照组)和脑梗死所致共济失调患者(脑梗死组)进行主动与被动复杂对指运动,同时行全脑BOLD-fMRI检查比较两组相应脑运动功能区对侧感觉运动区(SMC)和同侧小脑的激活体积和强度。结果 对照组主动和被动对指运动时右手激活对侧SMC体积(1373.7±509.6vs. 726.8±299.2,t=3.482,P=0.002;1531.2±455.3vs. 539.2±272.7,t=3.761,P=0.001)和强度(9.8±3.2vs. 7.9±6.1,t=2.132,P=0.041;11.3±5.1vs. 10.1±9.7,t=2.256,P=0.032)均大于左手;脑梗死组右手为患手时主动及被动对指运动时激活对侧SMC的体积(605.8±408.2vs. 452.7±213.5,t=2.491,P=0.020;397.2±248.7vs. 311.2±158.3,t=2.681,P=0.013)、强度(9.5±2.7vs. 7.6±5.0,t=2.372,P=0.031;7.9±6.1vs. 5.0±4.7,t=2.482,P=0.023)均低于对照组;脑梗死组左手为患手时主动及被动对指运动时激活对侧SMC的体积(1399.7±209.6vs. 689.5±422.7,t=2.846,P=0.010;3551.2±495.3vs. 413.6±264.2,t=3.072,P=0.007)、强度(11.3±5.1vs. 7.2±3.1,t=2.279,P=0.032;10.1±9.7vs. 6.1±3.9,t=2.811,P=0.016)亦均低于对照组;脑梗死组患手主动运动及被动运动激活同侧小脑的体积(932.5±2016.2vs. 61.8±214.0,t=2.441,P=0.021;197.6±297.4vs. 37.2±19.0,t=3.124,P=0.004)、强度(15.0±3.2vs. 6.7±1.8,t=3.001,P=0.005;13.8±2.9vs. 6.3±1.7,t=2.121,P=0.032)均小于对照组。结论 脑梗死所致共济失调患者主要以对侧SMC及同侧小脑的功能受损为主。
脑梗死;手运动;共济失调;全脑血氧水平依赖性磁共振脑功能成像
全脑血氧水平依赖性磁共振脑功能成像(blood oxygen level dependent functional magnetic resonance imaging,BOLD-fMRI) 是利用局部血氧含量变化实现磁共振成像(MRI)的一种方法。目前对脑梗死所致共济失调患者脑功能成像的研究报道较少,本研究通过了解健康志愿者及脑梗死性共济失调患者手共济运动时相应脑运动功能区的激活情况,探讨其脑功能损害的程度,为定量评估此类患者的脑功能损伤提供客观依据。
1 材料和方法
1.1 观察对象 (1)对照组:选取12名男性健康志愿者,年龄30~71岁,平均(52.4±15.2)岁,右利手,均无精神疾病、神经系统疾病及脑外伤等病史及家族史,非长期从事音乐演奏或键盘操作职业者。(2)脑梗死组:选取2010-01-01-12-31开滦总医院神经内科住院的男性右利手脑梗死患者22例,年龄46~74岁,平均(61.0±6.5)岁,其中临床诊断为小脑梗死者18例,大脑半球梗死者4例,患者中13例右手为患手,9例左手为患手。入选标准:①符合脑梗死诊断[1]的共济失调患者;②患侧肢体肌力Ⅴ-级及以上;③既往无精神疾病史且无家族史;④右利手。排除标准:①意识障碍;②存在失语、失用或忽视症;③患有严重心、肝、肾等疾病;④颅脑CT扫描存在颅内出血性疾病;⑤患者不能配合行MRI检查;⑥曾长期从事音乐演奏或键盘操作等工作。
1.2 方法 设计专用的调查量表,记录患者的姓名、性别、病历号、年龄、头CT或MRI检查所示颅内病灶部位等。
1.2.1 BOLD-fMRI检查:对照组接受主动和被动对指运动两种模式下的BOLD-fMRI成像检查;为保证脑梗死组每人均能完成对指运动,于入院后开始进行复杂对指运动练习,待入院后1~3 d患者可熟练完成主动对指运动时进行BOLD-fMRI检查;记录两组脑功能区激活体积和强度。
(1)仪器设备及扫描技术:①仪器设备:采用GE Signa TwinSPeed 1.5T磁共振成像系统,Signa 1.5T正交发射/接收头线圈。②扫描程序:先扫描定位像,然后扫描兴趣中枢部位的基础解剖图、全脑T1WI FSPGR 3D成像、单激发多时相回波平面成像(echo Planar imaging, EPI)。定位相:采用FSET1WI脑三平面成像,TR 81.2 ms,TE 1.6 ms,层厚5 mm,间隔2.5 mm,扫描野24 cm×24 cm,矩阵256×128。解剖像:扫描取横轴位T1FLAIR成像,扫描参数为TE 40 ms,TR 2250 ms,翻转时间(invtime)760 ms,层厚5 mm,间隔1.5 mm,扫描野24 cm×24 cm,矩阵320×224,共扫描18层图像。进行T2FLAIR成像,发现病灶部位,扫描参数与T1FLAIR相同。全脑横断位T1WI的 3D FSPGR 成像:包括全脑组织,扫描24 cm×24 cm,层厚2 mm,间隔 0,每板序列位置70 mm。运动中枢BOLD-fMRI采用T2WI梯度回波脉冲序列:单激发多时相EPI,取轴位,平行于前后联合线(AC-PC连线),定位扫描18层,单次采集,TR 3000 ms,TE 60 ms,反转角90度,扫描野为24 cm×24 cm,层厚5 mm,间隔1.5 mm,频率编码方向为左右方向(R/L)。
(2)刺激模式:应用Block组块刺激模式,扫描时间设定8 min。检查开始前让受检者仰卧于检查床上至少12 s,保持安静状态,检查者根据时间每30 s轻拍受检者与手指运动同侧的小腿1次,受检者接到提示后进行频率为1 Hz的主动复杂对指运动(即拇指与其余4指依次对指);被动运动时嘱受检者完全放松,由同一实验人员以1 次/s速度对受检者手指进行运动。按照“右手运动→静止→左手运动→静止”的左、右手交替性运动模式,每次运动持续30 s(静止时间亦为30 s),左右手均重复4次,中间无间隔,连续不间断扫描2次。
(3)脑功能成像数据的处理:采用随机SUN Advantage Windows Workstation 4.0系统自带的相关系数计算方法,对所有EPI序列扫描得到DICOM数据进行处理,得到叠加后的解剖-功能图像,再应用SPM2软件进行脑功能成像后处理。将刺激的时间、间隔与血流动力学函数进行卷积,分析结果与全脑像素信号的关系,计算脑功能区的激活体积(用激活区像素数表示)、强度(用统计T值表示,T值越大,强度越高)的精确值,将MNI脑坐标通过Ginger ALE 1.1软件(由美国德克萨斯大学研发)转换为标准Talairach坐标,然后利用Talairach Client 2.4软件查看具体解剖位置。设定激活范围阈值为10个像素。将图像对齐过程中,头部三维平移超过0.5 mm及头部三维转动超过0.5度的数据剔除。结合以往研究结果[2]确定手指运动主要激活区为对侧感觉运动区(SMC)和同侧小脑,记录该两区激活的体积和强度。
1.3 统计学处理 采用SPSS13.0软件包进行分析。整理SUN工作站和SPM计算出的脑功能区激活体积、强度数据,建立EXCEL2007数据库。计量资料用均数±标准差表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 对照组BOLD-fMRI检查结果 对照组在主动和被动两种运动模式下对侧SMC全部激活, 同侧小脑也大部分激活,同时,双侧扣带回有部分激活,同侧SMC、对侧小脑、双侧基底节区也有激活,丘脑区偶有激活;左手主动和被动运动时激活对侧SMC体积和强度均大于右手(P<0.05);两手主动与被动对指运动比较,激活对侧SMC体积、强度差异均无统计学意义(P>0.05;表1)。
2.2 两组BOLD-fMRI检查结果比较 脑梗死组左手及右手为患手时主动及被动对指运动时激活对侧SMC的体积、强度均低于对照组(P<0.05;表2),患手主动运动及被动运动激活同侧小脑的体积、强度亦均低于对照组(P<0.05;表3)。
3 讨论
当某一事件如手指运动时,相应脑皮层运动功能区兴奋,耗氧增加,氧合血红蛋白(为抗磁性物质)和脱氧血红蛋白(为顺磁性物质)含量发生变化,BOLD-fMRI的设计原理正是基于这种变化而获得图像[3]。目前,手运动激发模式是BOLD-fMRI技术中最成熟、可靠的方法,手运动功能代表区的范围在脑皮层运动区中远远大于身体其他部分,故常用其来代表整个运动皮层的位置[4]。本研究选用手运动激发模式,结合共济失调患者症状、体征,运用主动、被动复杂对指运动两种运动模式进行相关脑功能研究。
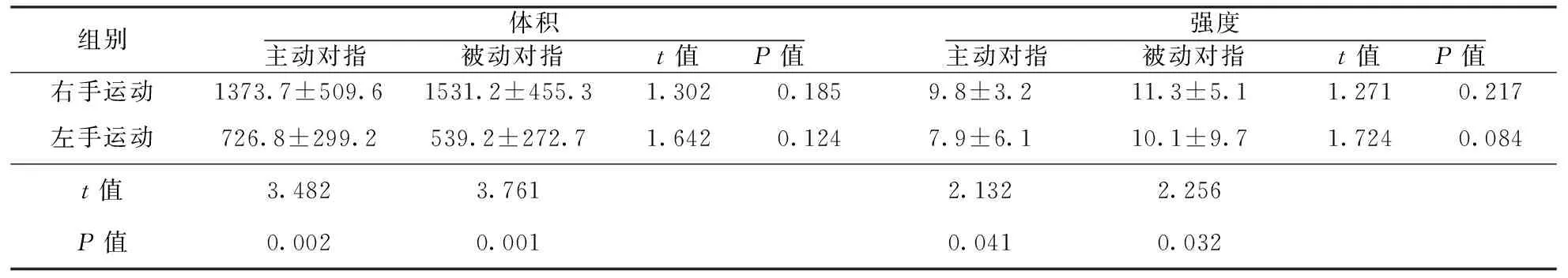
表1 对照组两种运动模式激活对侧SMC体积和强度比较

表2 脑梗死组患手与对照组同侧手运动时激活对侧SMC的体积及强度

表3 两组两种运动模式激活同侧小脑体积、强度比较
以往利用BOLD-fMRI技术对健康人及脑梗死患者的运动机制研究发现,利手复杂运动时脑功能激活区主要位于对侧SMC、同侧或双侧辅助运动区、运动前区和双侧小脑半球,同侧SMC 亦可见少量激活[5-6]。既往研究发现,位于SMC的手运动区是关键部位,同时小脑在运动中所起的作用亦不可忽视[2,7-8],小脑是将感觉联系到脑运动区主要环路的旁回路部分,是构成中枢神经系统中调控运动的最庞大结构,即手指运动激活区主要集中在对侧SMC区及同侧小脑[9],小脑的主要功能是调节和校正肌肉的紧张程度,使随意运动共济协调、精细准确。将对侧SMC与同侧小脑两者结合后则更能反映共济运动的实质,因此本研究主要分析上述两个脑区的激活情况。结果发现对照组在主动和被动对指两种运动模式下,左手(非利手)与右手(利手)对指运动激活对侧SMC体积及同侧小脑体积差异有统计学意义。因此,分析脑梗死组时将右手为患手和左手为患手的患者分为两个亚组以减少误差。日常生活中利手与非利手的灵活性存在差异,共济运动更需要手指活动的精细动作,因而反映到fMRI中的定量结果中激活运动中枢情况亦有差异。本研究中对照组利手和非利手者主动与被动对指运动比较,激活对侧SMC体积和强度差异均无统计学意义,提示健康人主动对指运动和被动运动对大脑的刺激可能是均等的,或是其差异为目前fMRI的扫描精度所不能发现的。
本研究应用GE Signa Twin SPeed 1.5T磁共振成像系统,Signa 1.5T正交发射/接收头线圈,可以识别0.5 cm大小的脑活动区域,检查所得到的激活区体积和强度数据,对照组两种运动模式下激活同侧小脑体积存在差异,而强度无明显差异,提示激活区的体积和强度是相对独立的观察指标,两者并不完全一致,今后有机会还可继续研究。
本研究中脑梗死组患手主动、被动运动时同侧小脑激活区的体积、强度均低于对照组。由于被动运动时患者全身处于放松状态,对肌肉协调机能的要求较低,故主要的肌肉协调功能区小脑激活率低,虽然被动运动时完全由实验人员完成对指运动,但因患者脑组织存在结构受损,故脑梗死患者被动运动时同侧小脑激活区的体积、强度仍与对照组不同;另外主动对指运动对肌肉的协调能力要求较高,脑梗死组患手侧小脑功能受损,故激活区出现率偏低,其强度及体积偏小。同时,脑梗死组无论患手为左手或右手,其患手运动激活对侧SMC的体积和强度均较对照组小,这提示可能与对应肢体的运动功能损害有密切联系。脑梗死患者的功能恢复是通过神经系统的神经功能重组[10]实现的,因此,临床工作中,如能结合患者BOLD-fMRI的客观检查结果采取有效手段促进神经功能重组,将可能更有效地促进脑梗死后神经功能的恢复。
综上可见,脑梗死所致共济失调患者主要以对SMC及同侧小脑的功能受损为主。今后可进一步进行BOLD-fMRI研究,更好地为量化评估共济运动功能受损,相关受损区域的神经康复提供依据。
[1]陈伟群,王新德.全国第五届脑血管病学术会议纪要[J].中华神经科杂志, 2000, 4(33): 110-114.
[2]元小冬,周福玲,赵丽君,等. 脑梗死急性期手运动功能中枢损伤的定量分析[J]. 脑与神经疾病杂志, 2008,16(4):395-397.
[3]倪萍,陈自谦,钱根年,等. BOLD-fMRI研究过程若干质量控制因素分析[J]. 医疗设备信息, 2007,22(12):6-9.
[4]蔡伟森,吴毅,吴军发,等. 健康成年人手部主动及被动运动时大脑功能区的功能性磁共振成像研究[J]. 中华物理医学与康复杂志, 2011,33(1):20-24.
[5]Allison JD, Meador KJ, Loring DW, et al. Functional MRI cerebral activation and deactivation during finger movement[J].Neurology, 2000,54(1):135-142.
[6]Mattay VS, Callicott JH, Bertolino A, et al. Hemispheric control of motor function: a whole brain echo planar fMRI study[J]. Psychiatry Res, 1998,83(1):7-22.
[7]Solodkin A, Hlistik P, Noll DC, et al. Lateralization of motor circuits and handedness during finger movements[J]. Eur J Neurol, 2001,8:425-434.
[8]祝一虹,狄海波,王美豪,等. 参与随意运动脑区的一侧化分布[J]. 浙江大学学报(医学版), 2005,34:518-522.
[9]Khushu S, Kumaran SS, Trapathi RP, et al. Functional magnetic resonance imaging of the primary motor cortex in humans: response to increased functional demands[J]. J Biosci, 2011, 26(2): 205-215.
[10]Hendricks HT, Limbeek J, Geurts AC, et a1. Motor recovery systematic review of the literature[J]. Arch Phys Med Rehabil, 2010,83:1629-1637.
(本文编辑:邹晨双)
BOLD-fMRI quantitive analysis of hand coordination function in cerebral infarction patients with ataxia
WANGXiaojie,YUANXiaodong,WANGShouhong,ZHAOYansheng,DENGHongliang,ZHOULifu,WANGShujuan*,ZHANGGaoxun.
*DepartmentofNeurology,AffiliatedKailuanGeneralHospitalofHebeiUnitedUniversity,TangshanHebei063000,China
WANG Shujuan, Email: wsong68@sina.com
Objective BOLD fMRI was used to make a quantitative analysis of brain function of hand coordination movement center among cerebral infarction patients with ataxia. Methods Healthy volunteers of right-handed (the control group) and cerebral infarction patients with ataxia (the cerebral infarction group) were respectively selected to scan the mode of whole-brain BOLD-fMRI while they were performing complex active and passive finger to finger movement. The corresponding motor cortex’s active volume and intensity were recorded. Results In the control group, contralateral sensorimotor area (SMC) volume (1373.7±509.6vs. 726.8±299.2,t=3.482,P=0.002;1531.2±455.3vs. 539.2±272.7,t=3.761,P=0.001) and intensity (9.8±3.2vs. 7.9±6.1,t=2.132,P=0.041;11.3±5.1vs. 10.1±9.7,t=2.256,P=0.032) activated by left hand (non dominant hand) and right hand (dominant hand) when performing active and passive finger to finger movement were statistically significantly different. In the cerebral infarction group, when the right hand was involved, SMC volume (605.8±408.2vs. 452.7±213.5,t=2.491,P=0.020;397.2±248.7vs. 311.2±158.3,t=2.681,P=0.013) and intensity (9.5±2.7vs. 7.6±5.0,t=2.372,P=0.031;7.9±6.1vs. 5.0±4.7,t=2.482,P=0.023) activated by active and passive finger to finger movement were lower than the control group. In the cerebral infarction group, when the left hand was involved, SMC volume (1399.7±209.6vs. 689.5±422.7,t=2.846,P=0.010;3551.2±495.3vs. 413.6±264.2,t=3.072,P=0.007) and intensity (11.3±5.1vs. 7.2±3.1,t=2.279,P=0.032;10.1±9.7vs. 6.1±3.9,t=2.811,P=0.016) activated by active and passive finger to finger movement were lower than the control group. In the cerebral infarction group, ipsilateral cerebellum volume (932.5±2016.2vs. 61.8±214.0,t=2.441,P=0.021;197.6±297.4vs. 37.2±19.0,t=3.124,P=0.004) and intensity(15.0±3.2vs. 6.7±1.8,t=3.001,P=0.005;13.8±2.9vs. 6.3±1.7,t=2.121,P=0.032) activated by active and passive finger to finger movement were lower than the control group. Conclusions The influenced area was mainly located in contralateral SMC and ipsilateral cerebellum in cerebral infarction patients with ataxia.
cerebral infarction;hand motion;ataxia;BOLD-fMRI
10.3969/j.issn.1006-2963.2015.02.010
063000 河北联合大学附属开滦总医院神经内科(王小洁、元小冬、邓红亮、周立富、王淑娟、张高勋),核磁室(王守红、赵艳生)
王淑娟,Email: wsong68@sina.com
R743.32
A
1006-2963 (2015)02-0113-04
2014-02-27)
