安宫牛黄丸联合神经节苷酯治疗弥漫性轴索损伤疗效观察
2015-06-01江甜甜章赛军周礼鹏
江甜甜章赛军周礼鹏
安宫牛黄丸联合神经节苷酯治疗弥漫性轴索损伤疗效观察
江甜甜1章赛军2周礼鹏2
弥漫性轴索损伤;安宫牛黄丸;神经节苷酯
弥漫性轴索损伤(diffuse axonal injury,DAI)是指头部受钝力作用后引起的以脑白质轴索弥漫性损伤为主要特征的脑损伤,病变部位主要在脑的中轴部分,多属多发挫伤,可见出血及水肿,镜下轴索断裂、轴浆溢出。意识障碍为DAI主要的临床表现之一,也是临床治疗疗效评估的重要标准[1]。由于临床上DAI无明显手术指征,西医仅作对症治疗,治疗难度大且预后差。如何进行有效治疗、改善患者意识障碍及预后逐渐成为国内外学者研究的热点。我院在常规治疗基础上应用安宫牛黄丸联合单唾液酸四己糖神经节苷酯治疗DAI意识障碍,取得一定疗效,现报道如下。
1 临床资料
1.1 一般资料 浙江省台州市中心医院2012年1月—2013年12月收治DAI患者56例,随机分为治疗组28例,男20例,女8例,年龄15~67岁,平均(36.8±13.5)岁;格拉斯哥昏迷评分(GCS)3~5分9例,6~8分19例,平均(6.00±1.22)分;对照组28例,男18例,女10例,年龄14~67岁,平均(36.7±13.6)岁;GCS 3~5分10例,6~8分18例,平均(6.07± 1.46)分。其中车祸致伤20例,重物击伤18例,高处坠落伤12例,其他原因致伤6例。两组患者性别、年龄、入院时GCS评分及疾病程度经统计学分析差异无统计学意义(P>0.05),具有可比性。
1.2 入选标准 DAI诊断符合《临床诊疗指南神经外科学分册》诊断标准[2],同时符合以下条件:①伤后6h内送院诊治;②受伤后立即昏迷,GCS评分3~8分;③无其他脏器致命损伤,既往无颅脑外伤、卒中、脑炎、癫痫、脑瘤及其他重要脏器功能疾病。
2 治疗方法
入院前头颅CT平扫或MRI检查显示所有患者均有不同程度的散在点状出血(直径<20mm),周围水肿轻,占位效应不明显,无弥漫性脑肿胀,未见明显颅内、硬膜外、硬膜下、明显脑干挫裂伤及其他多发脑挫裂伤等,无手术指征。全部病例均给予保持呼吸道通畅,根据情况予气管插管或气管切开,同时辅以脱水降颅压、止血、消肿、预防感染、护脑、维持水电酸碱平衡、营养支持及补液等对症支持治疗。对照组在一般治疗的基础上加用单唾液酸四己糖神经节苷酯针(GM1,规格:20mg/支,商品名:申捷)100mg加入生理盐水针250mL中静脉滴注,1天1次,2周后改为维持量40mg/d,持续1周。治疗组伤后当日即加用安宫牛黄丸(规格:3g/丸),1天1丸,昏迷者药丸磨成粉剂温开水化开后经鼻胃管或鼻空肠管鼻饲,如胃管或鼻肠管拔除后改为口服,持续3周。其余治疗措施同对照组。
观察指标:观察和记录两组患者入院后1、7、14、21天GCS评分,21天时评估患者临床疗效、觉醒时间、死亡率发生情况。
统计学方法:应用SPSS17.0统计软件,计量资料以(均数±标准差)表示,组间资料比较采用t检验;计数资料采用χ2检验。P<0.05为差异有统计学意义。
3 治疗结果
3.1 疗效标准 根据格拉斯哥预后评分(glasgow outcome scale,GOS)制定疗效标准:死亡;植物生存:仅有最小反应(如随着睡眠/清醒周期,眼睛能睁开);重度残疾:清醒,残疾,日常生活需要照料;轻度残疾:残疾,但可独立生活,能在保护下工作;恢复良好:恢复正常生活,但有轻度缺陷。
3.2 两组格拉斯哥昏迷评分(GCS)比较 两组GCS评分均随疗程增长而明显提高(P<0.05),治疗组治疗14、21天GCS评分提高优于对照组(P<0.05),见表1。
表1 两组格拉斯哥昏迷评分(GCS)比较(分,±s)

表1 两组格拉斯哥昏迷评分(GCS)比较(分,±s)
注:与对照组比较,△P<0.05;与本组入院第1天比较,*P<0.05
组别对照组治疗组例数28 28入院1d 6.14±1.46 6.50±1.58入院7d 6.89±2.13* 7.68±2.06*入院14d 7.54±2.33* 9.39±2.54*△入院21d 8.14±2.52* 10.82±2.97*△
3.3 两组临床疗效比较 治疗组恢复良好率优于对照组(P<0.05),见表2。

表2 两组临床疗效比较[例(%)]
3.4 两组觉醒时间比较 治疗组觉醒时间、觉醒率优于对照组(P<0.05),见表3。
表3 两组觉醒时间比较(±s)
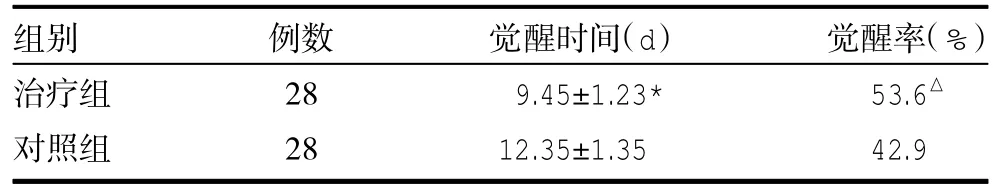
表3 两组觉醒时间比较(±s)
注:与对照组比较,△P<0.05
组别治疗组对照组例数28 28觉醒时间(d)9.45±1.23* 12.35±1.35觉醒率(%)53.6△42.9
4 讨论
据统计,颅脑外伤发生率占全身各部位伤的10%~20%[3],由于多伤及中枢神经系统,致残率和死亡率均较高。研究[4]表明,DAI在重型颅脑损伤中占28%~42%,病死率高达43%~62%,已成为重型颅脑损伤中主要致死原因之一。目前国内外专家对DAI已有了比较一致的认识,其受伤机制为外力使头部产生加速或减速运动,在脑组织内产生剪切力,致神经轴索受损甚至断裂为特征的一系列病理生理变化,其主要病理特征包括脱髓鞘、轴索肿胀、扭曲、轴索骨架崩解、神经微丝致密化(NFC),收缩球(RBs)形成等[5]。DAI因其发病机制的复杂性,目前无特异性的治疗手段[6]。
神经节苷脂是一种拥有复杂基团的酸性鞘糖脂,主要存在于脊椎动物的细胞膜上,特别是神经组织中,是神经细胞膜的重要组成部分[7]。研究表明,神经节苷酯具有非常明显的促进神经细胞修复的作用[8]。其作用机制包括促进神经损伤后修复再生、促进神经分化、促进突出和轴突形成、增强内源性神经生长因子等重要的生理功能[9],这种对中枢神经系统的作用称为“神经重塑”[10],已广泛应用于急性颅脑损伤,疗效显著。
安宫牛黄丸是由牛黄、水牛角浓缩粉、人工麝香、珍珠、朱砂、雄黄、黄连、黄芩、栀子、郁金、冰片组成。药理研究表明[11],朱砂能够抑制外伤后早期中枢神经系统兴奋、起镇静和催眠作用;明雄黄含三硫化二砷,能抑制疏基酶系统以影响细胞代谢,因而减少炎性因子的生成;麝香含各种甾醇,对颅脑损伤导致的持续昏迷具有中枢兴奋作用,并有强心利尿、促进腺体分泌作用;黄连所含多种生物碱,主要为小粟碱,对湿热、呕吐、泻痢、黄疸及高热昏迷有疗效。综上所述,安宫牛黄丸为一种集抗炎、抑制细胞过度代谢、强心利尿和抗真菌感染等复合作用的中成药。朱坤杰等[12]认为,安宫牛黄丸还具有镇静、抗惊厥以及消炎的作用。动物实验也证实[13],该药可以通过抑制位于血脑屏障基膜的星形胶质细胞上的水通道蛋白(AQP)从而有效减轻颅脑损伤后脑水肿发生、降低毛细血管通透性。基于以上研究结果,安宫牛黄丸可降低毛细血管通透性,缓解脑血管痉挛,稳定细胞膜,利于脑血流恢复,减少全身炎性反应,减轻继发性脑损伤,保护脑组织,促进意识恢复。
本研究设计为前瞻性研究,以评价安宫牛黄丸联合GM1治疗弥漫性轴索损伤后意识障碍恢复的临床疗效,采用临床单用神经节苷酯作为对照。两组入院第7、14、21天GCS评分与入院第1天相比有明显提高(P<0.05),入院第14、21天GCS评分治疗组与对照组相比有明显升高(P<0.05)。同时治疗组治疗后临床总有效率高于对照组(P<0.05)。两组死亡率差异无统计学意义(P>0.05),表明综合治疗仍是DAI救治关键。同时治疗组觉醒时间较对照组明显缩短,差异有显著性(P<0.05),治疗组觉醒率显著高于对照组(P<0.05)。本研究中治疗组GCS评分、GOS评分及觉醒时间改善均明显优于对照组,可能与安宫牛黄丸的镇静、抗惊厥以及消炎作用相关。
井慎等[5]应用神经节苷酯与安宫牛黄丸联合亚低温冬眠疗法治疗弥漫性轴索损伤上取得一定疗效,GCS评分3~8分者意识恢复率>50%,本研究中治疗组觉醒率53.6%,与文献报道相符。安宫牛黄丸或神经节苷酯均有减少神经细胞水肿、减轻继发性脑损害及促醒作用,本研究中两者联合使用,可缩短患者意识障碍时间,减少重度残疾及植物生存的发生率,提高患者生存质量。但本研究样本量小,协同机制不明,还需进一步在大样本、多中心的前瞻性的循证医学研究中加以证实。本研究提示,安宫牛黄丸联合神经节苷酯针治疗DAI意识障碍恢复方面取得一定疗效,值得临床推广应用。
[1]宾湘义.安宫牛黄丸对重症颅脑损伤患者意识障碍恢复作用的临床观察[J].深圳中西医结合杂志,2010,20(6):367-369.
[2]中华医学会.临床诊疗指南神经外科学分册[M].北京:人民卫生出版社,2006:16.
[3]Du GS.Developmentof basic research and treatment of traumatic brain injury[J].Chin JPract Nerv Dis(中国实用神经疾病杂志),2008,11(11):l31-133.
[4]贺晓生,章翔,易声禹.弥漫性轴索损伤[J].中华神经外科杂志,1999,15(1):58-60.
[5]井慎,李莫振,高静.弥漫性轴索损伤的治疗及预后[J].临床医学.2011,31(7):52-53.
[6]李明敏,魏俊吉,王任直,等.弥漫性轴索损伤的发病机制及治疗进展[J].中华医学杂志,2013,93(5):397-399.
[7]Furian AF,Rattmann YD,Oliveira MS,et al.Nitric oxide and potassium channelsmediate GM1 ganglioside-induced vasorelaxation[J].Naunyn Schmiedebergs Arch Pharmacol,2009,380(6):487-495.
[8]Feeney DM,Boyeson MG,Linn RT,et al.Responses to cor tical injury:Methodology and local effects of contusions in the rat[J].Brain Res,1981,211(1):66-67.
[9]Lim ST,Esfahani K,Avdoshina V,et al.Exogenous gangliosides increase the release of brain-derived neurotrophic factor[J].Neuropharmacology,2011,60(7-8):1160-1167.
[10]Hirokawa N,Niwa S,Tanaka Y.Molecular motors in neurons:transportmechanisms and roles in brain function,development,and disease[J].Neuron,2010,68(4):610-638.
[11]李丹,李秀明,周宁.安宫牛黄丸的药理作用及临床新应用[J].海军医学杂志,2007,28(2):179.
[12]朱坤杰,孙建宁,马长华.安宫牛黄丸及重金属组分对内毒素脑损伤大鼠大脑皮层单胺类递质的影响[J].中国中药杂志,2007,5(32):949.
[13]Doczi T,Schwarcz A,Gallyas F,et al.Regulation of water transport in brain edema[J].Ideggyogy Sz,2005,58(9-10):298.
(收稿:2015-04-05 修回:2015-06-01)
1浙江省台州市中西医结合医院内科(台州317523);2浙江省台州市中心医院急诊科(台州 318000)
周礼鹏,E-mail:zhoulipeng1101@163.com;Tel:18858610651
