低氧对新生隐球菌生物膜的影响
2015-05-07李宗辉孔庆涛胡治丽
李宗辉,孔庆涛,杜 雪,邓 琳,胡治丽,桑 红
0 引 言
近年来,随着广谱抗生素和免疫抑制剂的大量使用、人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染和器官移植患者的增加、侵入性医疗装置应用,系统性真菌感染不断增加。新生隐球菌是种在环境中广泛分布的机会性致病真菌,特别在免疫缺陷患者中可引起致命性脑膜脑炎,致死率高达90%[1]。新生隐球菌主要的毒力因子有荚膜、产黑素、尿素酶和磷脂酶的毒性作用及其在宿主体温环境生长的能力等。近年发现,生物膜成为许多微生物的主要毒力因子[2]。生物膜是微生物群体黏附到物质表面并包裹有细胞外聚合物的基质的结构,近65%的人类感染与生物膜相关[3]。与浮游细胞相比,生物膜细胞对抗菌因子及宿主抵抗因子的抵抗力明显增加。近年有学者已经发现新生隐球菌可在房室分流装置和气管食管声音假体上形成生物膜[4-7]。真菌生物膜的形成与成熟受到多种因素的影响,包括pH 值、温度、渗透压、周围基质的化学成分、流动性、支持物类型、细菌、宿主的免疫状态、氧气及环境变化等[8-9]。研究表明,在pH 为7.0 的中性环境中,白念珠菌黏附聚苯乙烯表面的能力更强;在厌氧环境及缺氧条件下,念珠菌可以形成生物膜而导致多种感染,并对抗真菌药物有更高的耐药性[10]。新生隐球菌是专性需氧微生物,在大气氧浓度(21%)条件下生长最佳,而人脑组织中氧浓度仅约3%左右[11-12]。因此新生隐球菌致病过程中必须面对宿主组织不同氧浓度的变化。国内外研究大多集中在新生隐球菌低氧适应的机制[13-14],但低氧对新生隐球菌主要毒力因子的影响及其机制尚不清楚。我们在前期研究中发现新生隐球菌在低氧条件下重要致病表型发生变化,即荚膜和黑素形成减少、尿素酶和磷脂酶活性降低[15-16]。本研究进一步探讨了低氧对新生隐球菌重要毒力因子生物膜的影响。
1 材料与方法
1.1 材料
1.1.1 菌株 新生隐球菌标准菌株H99(血清型A,交配型α)由卫生部医学微生物菌(毒)种保藏管理中心真菌中心(中国医学科学院皮肤病研究所)馈赠。
1.1.2 培养基 沙氏固体培养基和酵母浸膏液体培养基、DMEM 液体培养基(含4500 mg/L D-葡萄糖,584 mg/L L-谷氨酰胺,110 mg/L 丙酮酸钠,3700 mg/L 碳酸氢钠,100 U/mL 青霉素,100 μg/mL 链霉素)购自南京凯基生物膜公司。
1.1.3 主要试剂及仪器 MTT、Hepes、维生素K3(Sigma 公司提供),FUN-1 染色剂(美国Invitrogen公司),PBS 缓冲液(上海Generay biotech 公司)。0.22 μm 微孔滤膜(Millipore 公司),细胞爬片(美国Thermo),24 孔细胞培养板、96 孔细胞培养板(美国Corning 公司),直径13 mm 的细胞爬片(美国Thermo 公司),血细胞计数板(上海求精仪器股份有限公司),光学显微镜、共聚焦激光扫描显微镜FV-1000(日本,OLYMPUS 公司),扫描电子显微镜(日本,日立TM-1000),酶标仪(美国,Thermo 公司)。厌氧培养箱(长沙华曦电子科技有限公司)。
1.2 实验方法
1.2.1 菌液制备 菌株于沙氏培养基-70 ℃保存,在实验前将其取出,转种于沙氏培养基中活化3 d,取菌落于30 ℃酵母浸膏培养基中摇动生长18 ~20 h,离心收取菌落(离心半径80 mm,5000 r/min,5 min),用无菌磷酸盐缓冲液(PBS)洗涤3 次。利用血细胞计数板计数,DMEM 液体培养基稀释制成pH7.4 的1×107个/mL 菌悬液。
1.2.2 光镜观察不同氧浓度下新生隐球菌体外生物膜形成 向24 孔细胞培养板中每孔加入500 μL的新生隐球菌菌悬液,分别置于大气氧条件为正常氧浓度(21%)和1%氧浓度的条件下,37 ℃培养,分别在接种的2、4、8、12、24、48、72 h 吸弃培养基,无菌PBS 冲洗3 次,以除去未黏附的隐球菌细胞,在光学显微镜下观察培养板上的生物膜结构。
1.2.3 共聚焦激光扫描显微镜观察新生隐球菌体外生物膜形成 将直径13 mm 无菌细胞爬片放入24 孔细胞培养板中,每孔加入500 μL 的新生隐球菌菌悬液,分别置于大气氧条件和1%氧浓度的条件下,37 ℃培养,分别在2、4、8、12、24、48、72 h,将细胞爬片取出,无菌PBS 冲洗3 次。向上述细胞爬片表面加入100 μL 25 μmol/L 的FUN-1 染色剂,常温下避光孵育30 min。PBS 清洗细胞爬片3 次,将其反扣置于载玻片上,使用共聚焦激光激光扫描显微镜,488 nm 氩离子激光激发,沿z 轴观察生物膜XY 平面的形态及成熟新生隐球菌生物膜在不同氧浓度下的厚度。每张细胞爬片上取3 个视野,收集图像处理数据。
1.2.4 新生隐球菌体外生物膜生长动力学测定将100 μL 细胞悬液接种于96 孔细胞培养板中,分别置于正常氧浓度和1%氧浓度的条件下,37 ℃培养,分别于接种后2、4、8、12、24、48、72 h 吸弃培养基,无菌PBS 冲洗3 次,以除去黏附的隐球菌细胞,用四甲基偶氮唑盐(MTT)降解法测定新生隐球菌H99 不同时间生长动力学改变。每孔加入50 μL MTT 溶液(用PBS 配制成浓度为1 mg/mL)和4 μL甲萘醌溶液(用丙酮配制成浓度为1 mmol/L),37 ℃避光培养5 h。酶标仪测定492 nm 处含生物膜的各孔的A 值,每个条件均设3 个孔,取平均值。取含预先加热杀死的新生隐球菌细胞及DMEM 培养基的96 孔板作为阴性对照孔。既往研究已经证明了MTT 降解分析测量值与生物膜真菌细胞数相一致[17]。
1.3 统计学分析 采用SPSS 20.0 软件进行统计分析,组间比较采用两因素方差分析,以P≤0.05为差异有统计学意义。
2 结 果
2.1 光镜下新生隐球菌生物膜的形态观察 在本实验结果表明,在1%氧浓度和正常氧浓度下均可生长形成成熟的生物膜。正常氧浓度下,在2 ~4 h为孢子黏附阶段,2 h 开始便有孢子黏附于细胞爬片上,随后孢子的黏附数量逐渐增多,部分孢子体积增大,形成稀疏的单细胞层;8 ~12 h 进入微菌落形成阶段,细胞爬片上不断形成多个微小的细胞群落,12 h后各群落的细胞数量明显增多,并向四周扩展、增厚;12 ~24 h 进入生物膜的成熟阶段,细胞进一步增多,随着围绕在细胞周围的细胞外基质的增加,新生隐球菌的微结构变得更加复杂,产生了紧密黏附在细胞爬片上的致密结构。1%氧浓度条件下新生隐球菌生物膜形成过程与正常氧浓度下类似,但在相同时间点下,其生物膜的厚度及生物膜细胞数量均较正常氧浓度下的有所增加。在24 h 后生物膜的形态基本趋于稳定,48 h 与72 h 时不同氧浓度中形成生物膜的差异不大。见图1。
2.2 共聚焦激光扫描显微镜下观察新生隐球菌体外生物膜形成 共聚焦激光显微镜结果显示与光镜一致,2 种受试氧浓度条件下,生物膜均经历黏附、聚集、微菌落形成及生物膜成熟的过程,从而形成厚度相对稳定、包裹有细胞外多聚基质的成熟致密的生物膜,见图2。与正常氧浓度相比,1%氧浓度条件下各时间点生物膜细胞密度更大,最终两者都可形成厚度约16 μm 的生物膜,见图3。
2.3 新生隐球菌体外生物膜的生长动力学特点应用MTT 检测新生隐球菌体外生物膜活性检测显示,相同生长条件下,在0 ~24 h 内新生隐球菌生物膜的代谢活性随时间增长而逐渐增强,这与其细胞量的增加相一致;至第1 ~3 天,各时间点生物膜活性保持在较高水平,差异无统计学意义(P >0.05)。应用重复序列方差分析,与1%氧浓度相比,正常氧浓度条件下新生隐球菌H99 所形成的生物膜在各时间点的代谢活性均明显减小,各时间点比较差异有统计学意义(P <0.05)。见表1。

图1 光镜下观察不同时间点新生隐球菌H99 生物膜生物膜的结构变化(×40)Figure 1 Structures of the Cryptococcus neoformans H99 biofilms after exposed to 1%or 21%oxygen for different hours(×40)
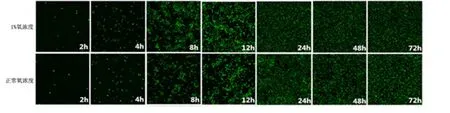
图2 共聚焦激光扫描显微镜下不同时间点新生隐球菌H99 生物膜结构变化(FUN-1 ×40)Figure 2 Structures of the Cryptococcus neoformans H99 biofilms after exposed to 1%or 21%oxygen for different hours(FUN-1 ×40)
表1 不同氧浓度下各时间点新生隐球菌生物膜的A 值比较(x±s)Table 1 Absorbance value of the Cryptococcus neoformans biofilms after exposed to 1%or 21%oxygen for different hours
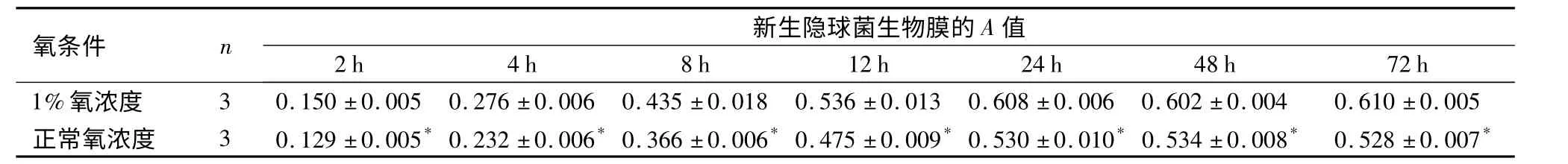
表1 不同氧浓度下各时间点新生隐球菌生物膜的A 值比较(x±s)Table 1 Absorbance value of the Cryptococcus neoformans biofilms after exposed to 1%or 21%oxygen for different hours
与1%氧浓度比较,*P <0.05
氧条件 n 2 h 4 h 8 h新生隐球1菌2生h物膜的A值24 h 48 h 72 h 1%氧浓度 3 0.150±0.005 0.276±0.006 0.435±0.018 0.536±0.013 0.608±0.006 0.602±0.004 0.610±0.005正常氧浓度 3 0.129±0.005* 0.232±0.006* 0.366±0.006* 0.475±0.009* 0.530±0.010* 0.534±0.008* 0.528±0.007*
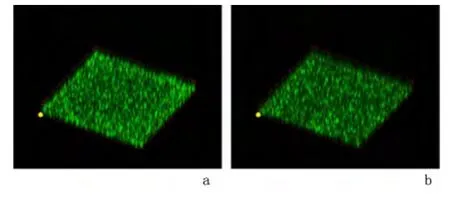
图3 共聚焦激光扫描显微镜下培养第48 h 形成的新生隐球菌H99 生物膜图像(×40)Figure 3 Cryptococcus neoformans H99 biofilms after exposed to 1%or 21%oxygen for 48 hours under the confocal laser scanning microscope(×40)
3 讨 论
本实验首次用低氧条件构建了新生隐球菌生物膜的体外模型,并与正常氧条件下形成的隐球菌生物膜进行了比较。光镜及共聚焦激光扫描显微镜观察结果表明,不论在正常氧还是低氧条件下新生隐球菌均能在体外模型中生长、形成成熟的生物膜,两种条件下生物膜均经历黏附、聚集、微菌落形成及生物膜成熟的过程,最终形成厚度相对稳定,包裹有细胞外多聚基质的成熟的致密的生物膜,厚度约为16 μm,生物膜的形成过程及厚度与国外学者的报导基本一致[18-20]。与正常氧条件相比,低氧条件下各时间点生物膜细胞密度有所增加。同时,MTT 法对2种状态下新生隐球菌生物膜的生长活性进行了观测,并证实其生长活性随培养时间延长而明显增强,达到一定成熟度后逐渐稳定;低氧条件下新生隐球菌形成生物膜的能力高于正常氧条件下,与显微镜观察结果一致,说明低氧条件促进了生物膜的生长,并可能对其毒力产生一定影响。本实验结果提示氧浓度在新生隐球菌生物膜的形成过程中起着重要的作用,并可导致生物膜密度的改变。
低氧状态下真菌生物膜的形成与多种分子机制相关。例如,白念珠菌生物膜黏附相关基因TYE7,编码糖酵解基因的转录活化因子,能影响低氧条件下生物膜的丝化现象[21];新生隐球菌CRZ1/SP1 样基因,能通过对细胞壁和荚膜形成的作用,来影响其生物膜内部低氧状态的适应能力,以影响细胞膜形成[22]。而在低氧条件下,这些因子在新生隐球菌生物膜形成中的具体机制,尚待深入探索。此外,真菌的其他生物膜形成相关基因,如ALS、SAP、PLB、FKS1、BGL2、PHR1、XOG1 等,是否在低氧适应中起到作用也待探讨。
新生隐球菌在感染宿主的过程中,必须适应宿主不同组织中氧浓度的变化,而生物膜的形成也必须适应这种变化。本实通过建立低氧浓度培养条件下新生隐球菌生物膜的体外模型,并与正常氧条件下的生物膜进行比较,对低氧条件下生物膜的形成过程、基本结构和特性有了初步的了解,但其在致病过程中的具体作用及可能涉及的分子作用机制仍待进一步研究。
[1] Pettit RK,Repp KK,Hazen KC.Temperature affects the susceptibility of Cryptococcus neoformans biofilms to antifungal agents[J].Med Mycol,2010,48(2):421-426.
[2] Fanning S,Mitchell AP.Fungal Biofilms[J].PLoS Pathog,2012,8(4):e1002585.
[3] Ramage G,Williams C.The clinical importance of fungal biofilms[J].Adv Appl Microbiol,2013,84:27-83.
[4] Walsh TJ,Schlegel R,Moody MM,et al.Ventriculoatrial shunt infection due to Cryptococcus neoformans:an ultrastructural and quantitative microbiological study[J].Neurosurgery,1986,18(3):373-375.
[5] Bauters TG,Swinne D,Stove V,et al.Detection of single cells of Cryptococcus neoformansin clinical samples by solid-phase cytometry[J].J Clin Microbiol,2003,41(4):1736-1737.
[6] Waltham MC,Cornell BA,Smith R.Associationof ferri-and ferrocytochrome c with lipid multilayers:a 31P solid-state NMR study[J].Biochim Biophys Acta,1986,862(2):451-456.
[7] Ramage G,Rajendran R,Sherry L,et al.Fungal Biofilm Resistance[J].Int J Microbiol,2012:528521.
[8] Ramage G,Wickes BL,Lopez-Ribot JL.A seed and feed model for the formation of Candida albicans biofilms under flow conditions using an improved modified Robbins device[J].Rev Iberoam Micol,2008,25(1):37-40.
[9] Martinez LR,Casadevall A.Susceptibility of Cryptococcus neoformans biofilms to antifungal agents in vitro[J].Antimicrob Agents Chemother,2006,50(3):1021-1033.
[10] Kumar CP,Menon T.Biofilm product ion by clinical isolates of Candida species[J].Med Mycol,2006,44(1):99-101.
[11] Grahl N,Shepardson KM,Chung D,et al.Hypoxia and fungal pathogenesis:to air or not to air?[J]Eukaryot Cell,2012,11(5):560-570.
[12] Moranova Z,Kawamoto S,Raclavsky V.Hypoxia sensing in Cryptococcus neoformans:biofilm-like adaption for dormancy?[J]Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2009,153(3):189-193.
[13] Chun CD,Liu OW,Madhani HD.A link between virulence and homeostatic responses to hypoxia during infection by the human fungal pathogen Cryptococcus neoformans[J].PLoS Pathog,2007,3(2):225-238.
[14] Chang YC,Bien CM,Lee H,et al.Sre1p,a regulator of oxygen sensing and sterol homeostasis,is required for virulence in Cryptococcus neoformans[J].Mol Microbiol,2007,64(3):614-629.
[15] 孔庆涛,桑 红,刘 芳,等.不同氧浓度对新生隐球菌荚膜的影响[J].中华皮肤科杂志,2013,46(8):547-550.
[16] 孔庆涛,桑 红.新生隐球菌氧传感途径的研究进展[J].医学研究生学报,2013,26(10):1080-1082.
[17] Martinez LR,Casadevall A.Cryptococcus neoformansbiofilm formation depends on surface support and carbon source and reduces fungal cell susceptibility to heat,cold,and UV light[J].Appl Environ Microbiol,2007,73(14):4592-4601.
[18] 徐元玲,王建东,蒋琪霞.慢性伤口细菌生物膜的临床识别和影响因素的研究进展[J].医学研究生学报,2014,27(12):1337-1339.
[19] Ravi S,Pierce C,Witt C,et al.Biofilm formation by Cryptococcus neoformans under distinct environmental conditions[J].Mycopathologia,2009,167(6):307-314.
[20] Martinez LR,Casadevall A.Susceptibility of Cryptococcus neoformans biofilms to antifungal agents in vitro[J].Antimicrob Agents Chemother,2006,50(3):1021-1033.
[21] Bonhomme J,Chauvel M,Goyard S,et al.Contribution of the glycolytic flux and hypoxia adaptation to efficient biofilm formation by Candida albicans[J].Mol Microbiol,2011,80(4):995-1013.
[22] Moranova Z,Virtudazo E,Hricova K,et al.The CRZ1/SP1-like gene links survival under limited aeration,cell integrity and biofilm formation in the pathogenic yeast Cryptococcus neoformans[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2014,158(2):212-220.
