RNA 干扰Cofilin-1 基因沉默对人肝癌细胞株Huh-7侵袭和转移能力的影响
2015-05-07曹建平龙晓兰李晓杰谢海龙
曹建平,龙晓兰,龚 勇,李晓杰,谢海龙
0 引 言
肝细胞肝癌(hepatocellular carcinoma,HCC)是严重威胁人类生命的恶性肿瘤之一,其发病率和死亡率在各种类型恶性肿瘤中更是位居前列,超过50%的新发病例发生在中国[1-2]。HCC 早期并无特征表现,早期发现难,一旦出现症状大部分已发生转移[3]。虽然综合治疗HCC 的措施不断改善,但HCC 患者预后仍然很差[4]。因此深入研究HCC 的发病机理,探讨HCC 的早期转移及其高侵袭生长的分子病理机制,发现病理过程中的重要环节和关键分子,寻找具有HCC 治疗价值的药物靶点,将对HCC 的肿瘤生物学研究、药物研发及临床治疗奠定基础。
Cofilin-1 基因定位于11q13,其编码的蛋白质分子量为19 kDa,是一种细胞骨架蛋白,属于肌动蛋白解聚因子家族。Cofilin-1 在促进肌动蛋白解聚/聚合和肌动蛋白丝的快速周转中发挥重要作用[5]。肌动蛋白细胞骨架的重组参与肿瘤进展、细胞运动、细胞粘着、细胞侵袭和血管生成。在癌细胞中抑制Cofilin-1 活性能使细胞运动能力下降[6]。下调Cofilin-1 蛋白表达的降低了侵袭伪足组装及其稳定性,表明Cofilin-1 在细胞侵袭过程中起至关重要的作用[7]。Cofilin-1 在多种肿瘤中存在高表达,参与这些肿瘤的发病过程[8-9]。但该基因在HCC 中表达国内外文献报道少,本研究拟通过实时荧光定量PCR 技术检测Cofilin-1 在HCC 组织中的表达,并通过基因沉默技术观察Cofilin-1 基因表达下调后对人肝癌细胞株Huh-7 迁移和侵袭的影响,探讨Cofilin-1在HCC 发生、发展中的作用。
1 材料与方法
1.1 细胞和组织标本 细胞:Huh-7 细胞是人肝癌细胞,原购自美国模式培养集存库,由本实验室保存。细胞均用含10%胎牛血清的DMEM 培养基培养。组织:收集郴州市第一人民医院病理科2009 年1 月至2013 年2 月肝癌标本30 例,所有患者术前均未接受放化疗处理,均经病理证实为肝细胞癌。30 例肝癌中伴有肝硬化18 例。根据Edmondson 肝癌分级标准进行组织学分级,其中Ⅰ级5 例,Ⅱ级12 例,Ⅲ级13 例。年龄为17 ~71 岁,平均年龄(56.8±2.0)岁,其中男21 例,女9 例。取癌和癌旁<1 cm 范围内正常组织,冻存于-80 ℃。
1.2 主要试剂 DMEM、胎牛血清、DMSO 均购自Gibco 公司;细胞培养皿、Tip 头、冻存管、孔板购自Corning 公司;细胞裂解液,Trizol 试剂,购自Invitrogen公司;BCA 蛋白分析试剂盒(BCA protein Kit)购自Pierce 公司;实时荧光定量PCR 试剂盒均购自TaKa-Ra 公司;DEPC 水购自Invitrogen 公司;HRP 标记的羊抗鼠IgG(H+L)抗体和HRP 标记的羊抗兔IgG 抗体购自上海康城公司;Cofilin-1 抗体购自Santa Cruz;所有引物均由上海Invitrogen 公司合成;siRNA序列由上海吉玛公司合成;Transwell 小室(pore size:8.0 μm)及Matrigel 均购自BD Bioscience 公司。
1.3 实时荧光定量PCR 检测Cofilin-1 在肝癌组织中的表达
1.3.1 组织总RNA的提取 将组织块直接放入研钵中,加入少量液氮,迅速研磨,液氮挥发完后再加入少量液氮,如此反复研磨至组织块成细粉末状,转入离心管中,加入Trizol(50 ~100 mg/mL Trizol),然后用带7 号针头的5 mL 注射器抽吸8 ~10 次,再转入新的EP 管中,充分吹打至不黏稠后移至去除RNA 酶的1.5 mL EP 管中;加入0.2 mL/管新开封的氯仿,剧烈振荡15 s,室温孵育5 min,4 ℃,12000×g,离心15 min;将上清移至新的1.5 mL EP 管中,加入0.5 mL/管的异丙醇,-20 ℃孵育20 min,4 ℃,12 000×g 离心10 min;去除上清,75%乙醇1 mL/管洗涤,4 ℃,7500×g 离心5 min;室温干燥10 ~20 min,用DEPC 处理后的无RNA 酶H2O 溶解沉淀,分光光度计定量RNA。
1.3.2 引物的设计与合成 引物由上海Invitrogen设计及合成。Cofilin-1 基因引物序列上游:5'-GACTGCCGCTATGCCCTCTATG,下 游:5'-CTTCTTCTTGATGGCGTCCTTG;看家基因β-actin 引物序列上游:5' TCCTCCCTGGAGAAGAGCTA,下游:5'-GTACTTGCGCTCAGGAGGAG。
1.3.3 实时荧光定量RT-PCR与相对定量分析在冰上制备反应液:5×PrimerScriptTMBuffer 2.0 μL、Random 6 mers(100 μmol/L)0.5 μL、Primer ScriptTMRT Enzyme Mix 0.5 μL、Oligo dT Primer(50 μmol/L)0.5 μL,加入模板RNA 1 μL(500 ng/μL),补Rnase Free H2O 至10 μL,37 ℃培养15 min,85 ℃5 s 使反转录酶灭活。Real-Time PCR 所用SYBR Premix EX TaqTM 购自TaKaRa 公司。10 μL 反应体系:SYBR Premix Ex Taq(2×)5 μL,PCR Forward Primer(10 μmol/L)0.4 μL,PCR Reverse Primer(10 μmol/L)0.4 μL,ROX Reference Dye(50×)0.2 μL,模板1 μL,dH2O 3 μL。反应条件:95 ℃30 s;95 ℃5 s,60 ℃30 s,40 个循环;95 ℃15 s,60 ℃30 s,95 ℃15 s。使用ABI PRISM 7900HT 仪器。相对定量采用比较CT(Cycle threshold)法。计算公式:

1.4 细胞转染 由上海吉玛公司合成cofilin-1 siRNA 序列。cofilin-1-RNA 序列:正义链为:5'-GGUGUCAUCAAGGUGUUCATT-3';反义链为:5'-UGAACACCUUGAUGACACCTT-3'。非特异性siRNA(CtrlsiRNA)为吉玛公司提供。利用LipofectamineTM2000将cofilin-1-siRNA 和非特异性siRNA(Ctrl-siRNA)转染Huh-7 细胞形成cofilin-1-siRNA 组和Ctrl-siRNA 组,未转染Huh-7 细胞为空白对照组。具体操作如下:将1×通用缓冲液125 μL,加入到2.5 nmol 的双链siRNA 中,得到siRNA 母液,浓度为20 μmol/L。工作母液放置于90 ℃2 min,自然冷却至室温,然后放于4 ℃过夜备用。转染前一天,细胞传代培养于6 孔板中,培养24 h 至细胞铺满孔底的40%~50%。将6 μL 20 μmol/L 的siRNA 双链与100 μL 无血清DMEM 混合于无菌的eppendoff 管中。LipofectamineTM2000 试剂(1 μg/μL)摇匀取3 μL,与100 μL 无血清DMEM 混合于另一无菌eppendorf管中。将上述两管液体在5 min 内混合,并混匀,室温静置至少20 min,形成siRNA-Lipofectamine 复合物。6 孔板细胞弃去培养液,加入含10%FCS 的DMEM 1 mL,然后将上述配制的混合物200 μL 分别加入各孔中,使转染终浓度为100 nmol/L。然后将细胞于37 ℃,5%CO2的细胞孵箱中孵育48 h,收集细胞进行检测。
1.5 Western-blot 检测Huh-7 细胞cofilin-1 蛋白的表达 各个样品取20 μg 加入上样孔。12%的SDS-PAGE 胶分离样品,转膜,PVDF 膜入5%PBST 脱脂奶粉液中,室温封闭2 h。然后将PVDF膜依照Mark 裁剪成条,小鼠抗人Cofilin-1 抗体按1∶200 稀释,小鼠抗人GAPDH 抗体按1∶10000 稀释,分别孵育对应的膜上,4 ℃过夜。次日,用0.5%PBST 分 别 洗 涤PVDF 膜3 次,10 min/次。HRP 标记的羊抗兔IgG 抗体1 ∶2000 稀释,HRP标记的羊抗小鼠IgG 抗体1∶2000 稀释,孵育对应膜上,室温1 h。然后PBST 洗膜3 次,10 min/次。ECL,暗室曝光后显影定影,扫描胶片。凝胶图像分析:将胶片进行扫描,用Image J 软件对胶片进行灰度分析,计算3 组细胞中目标蛋白和内参的电泳条带灰度比值,对不同细胞中目标蛋白的相对表达水平进行分析。
1.6 体外细胞迁移实验 用0.25%胰酶消化细胞,用含10%FBS 的DMEM 培养基收集细胞至1.5 mL EP 管中,用不含血清的培养基洗细胞3 次,细胞计数,用无血清培养基(含0.1%BSA)配成5×105个/mL 的细胞悬液。在24 孔培养板中加入500 μL含有10%FBS 的DMEM 培养基,将Transwell 小室放入,为了免减弱迁移作用,下层培养基和小室间不要产生气泡,在小室内加入200 μL 细胞悬液,盖好培养板。将Transwell 培养板放置于5%CO2、37 ℃培养箱中,孵育8 h。取出Transwell 小室,去除小室内的液体,将小室放入加有500 μL 4%多聚甲醛的孔中固定,室温下1 h 后去除小室内的液体,放入加有500 μL 0.1%结晶紫的孔中,使膜浸没在结晶紫中,染色30 min,PBS 洗2 遍,棉签擦去小室内的细胞(不可碰触小室的外底部),PBS 洗2 遍。晾干,将小室放入干净的24 孔培养板中,在倒置显微镜下观察。随机取5 个高倍镜视野,照相、计数。
1.7 体外细胞侵袭实验 将BD matrigel(冻存于-20 ℃冰箱)放到4 ℃融解,过夜。用预冷的Tip头、移液管,将融解好的Matrigel 用4 ℃的无血清培养基以1∶8 稀释,混匀。在Transwell 小室内均匀铺100 μL 稀释的Matrigel,Transwell 小室放入24 孔培养板中,在5%CO2、37 ℃培养箱中,孵育4 h,使之形成一层均匀的薄层凝胶。用无血清培养基轻洗薄层凝胶2 遍。配制2.5×106个/mL 的细胞悬液,在小室内加入200 μL 细胞悬液,盖好培养板。Transwell 培养板放置于5%CO2、37 ℃培养箱中,孵育14 h。其他步骤与方法同迁移实验。
1.8 统计学分析 采用SPSS 13.0 统计软件进行数据分析。定量资料用均数±标准差)表示,组间均值的比较采用两独立样本t 检验。以P≤0.05为差异有统计学意义。
2 结 果
2.1 肝癌组织与癌旁组织中Cofilin-1 mRNA 表达的检测结果 Cofilin-1 在肝癌组织的表达显著高于癌旁组织[(3.523±0.412)vs(0.698±0.156)],差异有统计学意义(P <0.05)。
2.2 Cofilin-1-siRNA 转染对Huh-7 细胞Cofilin-1蛋白表达的影响 干扰6 h 后,观察羧基荧光素(Carboxyfluorescein,FAM)荧光图,干扰效果达90%以上,见图1。Cofilin-1-siRNA 组Cofilin-1 的蛋白量为0.558±0.033,明显低于Ctrl-siRNA 组0.933±0.015 与未转染组0.961±0.020,差异均有统计学意义(P <0.05);Ctrl-siRNA 组与未转染组的差异无统计学意义(P >0.05)。见图2。
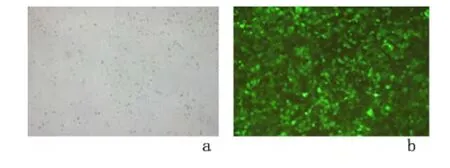
图1 Cofilin-1-siRNA 转染Huh-7 细胞的荧光图(×100)Figure 1 Immunofluorescence figures of Huh-7 cells tranfected with FAM Cofilin-1-siRNA(×100)
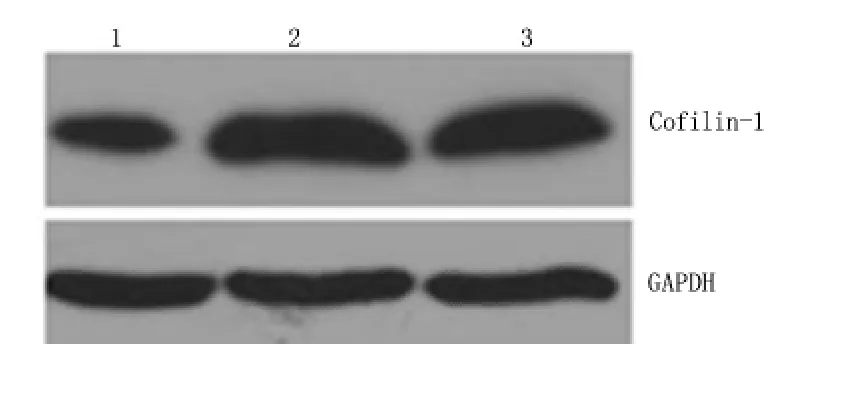
图2 Huh-7 细胞Cofilin-1 蛋白的Western-blot 检测结果Figure 2 Western blot analysis of the expression of Cofilin-1 protein in Huh-7 cells
2.3 Cofilin-1-siRNA 转染对Huh-7 细胞体外迁移的影响 体外细胞迁移实验结果显示:Cofilin-1-siRNA 组穿膜Huh-7 细胞数为[(58.50±1.78)个],明显低于Ctrl-siRNA 组[(79.00±1.33)个]和未转染组[(74.50±1.35)个],差异有统计学意义(P <0.05);Ctrl-siRNA 组与未转染组穿膜Huh-7 细胞数的差异无统计学意义(P >0.05),见图3。
2.4 Cofilin-1-siRNA 转染对Huh-7 细胞体外侵袭的影响 体外细胞侵袭实验结果显示:Cofilin-1-siRNA 组穿膜Huh-7 细胞数为[(36.50±0.83)个],明显低于Ctrl-siRNA 组[(60.20±1.60)个]和未转染组[(51.50±1.14)个],差异均有统计学意义(P <0.05);Ctrl-siRNA 组与未转染组穿膜Huh-7 细胞数的差异无统计学意义(P >0.05)。见图4。
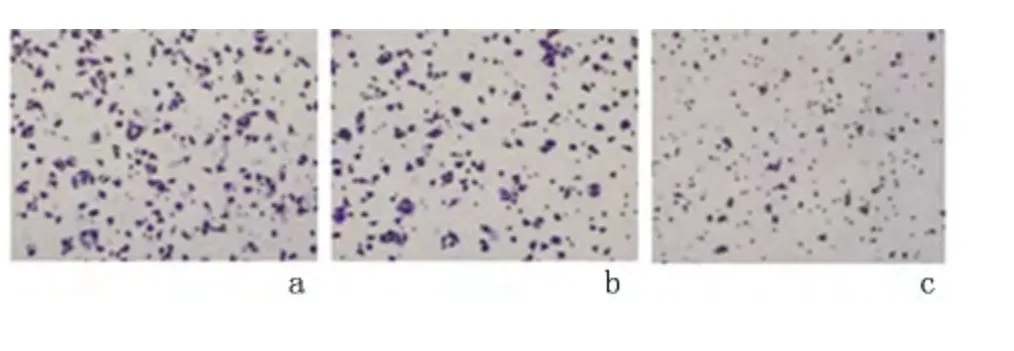
图3 3 组细胞Transwell 迁移实验图(×100)Figure 3 The figures of transwell migration assay of cells in the three groups(×100)
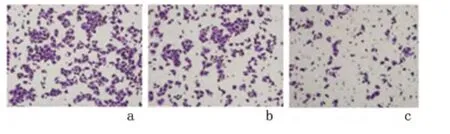
图4 3 组细胞Transwell 侵袭实验图(×100)Figure 4 The figures of transwell invasion assay of cells in the three groups(×100)
3 讨 论
HCC 是最常见的恶性肿瘤,其发病率和死亡率在各种类型恶性肿瘤中更是位居前列[1]。而目前的治疗效果不理想,因此,寻找具有HCC 治疗价值的药物靶点,将对HCC 的临床治疗奠定基础。
Cofilin 基因具有2 种亚型,Cofilin-1 是其中之一,在脑和肝脏表达丰度最高。Cofilin-1 在促进肌动蛋白解聚/聚合和肌动蛋白丝的快速周转中发挥重要 作 用[5]。在 胰 腺 癌[10]、口 腔 鳞 癌[11]、乳 腺癌[12]、胆囊癌[13]、肺癌[14]、卵巢癌[8]中,Cofilin-1 呈过表达。Cofilin-1 可预测早期卵巢上皮性癌(卵巢癌)治疗成功者的预后,Cofilin-1 表达低的患者生存期要长于Cofilin-1 表达高的患者[8]。由此可见,Cofilin-1的表达与肿瘤的迁移、侵袭有关。本研究30 例肝癌患者中Cofilin-1 在癌组织中的表达高于癌旁组织,表明Cofilin-1 基因高表达可能与肝癌发生、发展密切相关。
肌动蛋白细胞骨架的重组参与肿瘤进展、细胞运动、细胞粘着、细胞侵袭和血管生成。在癌细胞中抑制Cofilin-1 活性能使细胞运动能力下降[6]。下调Cofilin-1 蛋白表达的降低了侵袭伪足组装和的稳定性,表明Cofilin-1 在细胞侵袭了起至关重要的作用[7,15-16]。RNA 干扰已经成为功能基因组研究的有力工具,本研究采用Cofilin-1-siRNA 干扰Huh-7细胞中Cofilin-1 基因表达,结果提示:Cofilin-1-siRNA 组Cofilin-1 的蛋白量明显低于Ctrl-siRNA 组与未转染组,差异有统计学意义(P <0.05),这说明本研究采用的Cofilin-1-siRNA 干扰效果好。在此基础上,进一步应用体外细胞迁移实验检测Cofilin-1-siRNA 干扰细胞的迁移能力,结果显示Cofilin-1-siRNA 组细胞的迁移修复能力远低于Ctrl-siRNA 组与未转染组,证明了Cofilin-1 表达受抑制后Huh-7细胞的迁移能力也受到抑制。本研究应用Transwell小室实验证实了Cofilin-1 基因沉默后肝癌细胞Huh-7 侵袭能力均明显受到了抑制,Cofilin-1-siRNA组的穿膜细胞明显低于Ctrl-siRNA 组与未转染组,提示Cofilin-1 在肝癌侵袭过程中起重要作用。为进一步研究Cofilin-1 基因在肿瘤转移中的作用及机制提供实验依据。
总之,本研究初步发现Cofilin-1 基因高表达与肝癌发生、发展密切相关。通过RNA 干扰Cofilin-1基因表达后,可以在体外抑制肝癌Huh-7 细胞的迁移和侵袭,提示Cofilin-1 基因参与肝癌转移过程,可能是肝癌基因治疗的靶点,而Cofilin-1 基因发挥其作用的具体分子机制我们正在进一步研究。
[1] DeSantis CE,Lin CC,Mariotto AB,et al.Cancer treatment and survivorship statistitics[J].CA Cancer J Clin,2014,64(4):252-254.
[2] 林凯璇,穆 洪,孙玉琳,等.肝细胞肝癌重要表面标志的表达和定位[J].医学研究生学报,2013,26(1):4-8.
[3] Ho CM,Wu CY,Lee PH,et al.Analysis of the risk factors of untransplantable recurrence after primary curative resection for patients with hepatocellular carcinoma[J].Ann Surg Oncol,2013,20(8):2526-2533.
[4] 韩菲菲,王婷婷,陈国千.高迁移率族蛋白B1 在肝细胞癌组织中的表达改变[J].医学研究生学报,2014,27(4):344-346.
[5] Chen H,Bernstein BW,Bamburg JR.Regulating actin-filament dynamics in vivo[J].Trends Biochem Sci,2000,25(1):19-23.
[6] Yamaguchi H,Lorenz M,Kempiak S,et al.Molecular mechanisms of invadopodium formation:the role of the N-WASP-Arp2/3 complex pathway and cofilin[J].J Cell Biol,2005,168(3):441-452.
[7] Keezer SE,Krutzsch HC,et al.Angiogenesis inhibitors target the endothelial cell cytoskeleton through altered regulation of heat shock protein 27 and cofilin[J].Cancer Res,2003,63(19):6405-6412.
[8] Nishimura S,Tsuda H,Kataoka F,et al.Overexpression of cofilin 1 can predict progression-free survival in patients with epithelial ovarian cancer receiving standard therapy[J].Hum Pathol,2011,42(4):516-521.
[9] Zhang Y,Tong X.Expression of the actin-binding proteins indicates that cofilin and fascin are related to breast tumour size[J].J Int Med Res,2010,38(3):1042-1048.
[10] Wang Y,Kuramitsu Y,Ueno T,et al.Differential expression of up-regulated cofilin-1 and down-regulated cofilin-2 characteristic of pancreatic cancer tissues[J].Oncol Rep,2011,26(6):1595-1599.
[11] Chanthammachat P,Promwikorn W,Pruegsanusak K,et al.Comparative proteomic analysis of oral squamous cell carcinoma and adjacent non-tumour tissue from Thailand[J].Arch Oral Biol,2013,58(11):1677-1685.
[12] Shaheed SU,Rustogi N,Scally A,et al.Identification of stagespecific breast markers using quantitative proteomics[J].J Proteome Res,2013,12(12):5696-5708.
[13] Yang ZL,Miao X,Xiong L,et al.CFL1 and Arp3 are biomarkers for metastasis and poor prognosis 12 of squamous cell/adenosquamous carcinomas and adenocarcinomas of gallbladder[J].Cancer Invest,2013,31(2):132-139.
[14] Peng XC,Gong FM,Zhao YW,et al.Comparative proteomic approach identifies PKM2 and cofilin-1 as potential diagnostic,prognostic and therapeutic targets for pulmonary adenocarcinoma[J].PLoS One,2011,6(11):e27309.
[15] Garg P,Verma R,Cook L,et al.Actin-depolymerizing factor cofilin-1 is necessary in maintaining mature podocyte architecture[J].J Biol Chem,2010,285(29):22676-22688.
[16] Pfaendtner J,Dela Cruz EM.Actin filament remodeling by actin depolymerization factor/cofilin[J].Proc Natl Acad Sci USA,2010,107(16):239-254.
