钛表面钛酸钙涂层的制备及其生物安全性能的初步研究
2015-05-07王春风吴占敖吴晓亮
王春风,孙 敏,吴占敖,吴晓亮,姜 涛
0 引 言
自骨整合理论的提出,钛金属就以无可比拟的优点成为最普遍和最广泛运用的口腔种植体基质材料[1],但应用中也存在不足[2-3]。因此,对钛及钛合金表面进行改性处理,提高其生物活性是一种很有发展前景的研究工作[4],得到材料界和医学界的普遍重视。
研究表明钛表面原始钝化态氧化膜中引入钙离子,使其转化为活性氧化膜,明显增强钛的生物活性,而钙离子存在形式是钛酸钙(Calcium titanate,CaTiO3)[5-6]。还有研究显示,含钙离子的钛氧化物层能提高钛植入体的骨结合能力[7-8],CaTiO3具有潜在的生物活性,且具有较好的化学稳定性[9-11]。本研究通过水热合成方法在纯钛表面制备CaTiO3涂层,评价其生物学性能和安全性能。
1 材料与方法
1.1 实验动物 清洁级SD 大鼠12 只,选择出生24 h 内的胎鼠,雌雄不限。清洁级ICR 小鼠64 只(江苏大学动物实验中心提供),体重18 ~20 g,7 ~12 周龄,雌雄各半,实验动物许可证号:SYXK(苏)2008-0024。新西兰大白兔普通级1 只(南京医科大学实验动物中心提供),体重2 ~3 kg,实验动物许可证号:SCXK(苏)2002-0031。饲养环境为恒温22 ~23 ℃,湿度50%~60%,光照周期12 h。标准饮食,不限饮水。实验前在饲养环境适应生活7 d,每天密切关注动物的状态。
1.2 主要试剂与仪器 TA2 钛板(西北有色金属研究所产品)、钛酸四丁酯[(C4H9O)4Ti]、氧化钙(CaO,上海化学试剂有限公司产品)、DMEM 培养基、细胞培养板(美国Gibco 公司产品)、DHG-9140A型电热恒温鼓风干燥箱(上海一恒科技有限公司产品)、JSM 扫描电子显微镜(Scanning electronic microscopy,SEM,日本JEOL 公司产品)、X 射线粉末衍射仪(X-ray diffraction,XRD,日本理学株式会社Rigaku 产品)、精密电子天平(日本AND 会社产品)、倒置相差显微镜(日本Olympus 公司产品)、能谱分析仪(Energy dispersive spectrometer,EDS,美国Thermo Scientific 公司产品)。
1.3 方法
1.3.1 钛表面CaTiO3涂层的制备及表面形状分析①将纯钛片(约8 mm×8 mm×1 mm),经过打磨、抛光、喷砂和真空预氧化处理后,再分别用丙酮,无水乙醇,去离子水超声洗涤烘干待用。钛片的制备及预处理在江苏大学化工学院应用化学研究所完成。②将2.5 mL(C4H9O)4Ti 与7.5mL 正丁醇室温下混合,搅拌均匀,即钛酸丁酯正丁醇溶液。将0.5 g CaO 用50 mL 去离子水溶解,混合均匀后置于已固定好钛片的水热反应釜内,然后缓慢加入钛酸丁酯无水乙醇溶液10 mL,然后用蒸馏水加至水热反应釜液体填充量的80%。密闭后放入DGG-9023A 型电热恒温鼓风干燥箱,分别在120 ℃与150 ℃条件下反应6、12 和24 h。反应完成后,将钛片取出,使用蒸馏水冲洗3 遍、120 ℃干燥,再在650 ℃马弗炉中煅烧1 h 得到的产品,即为样品。③采用XRD、SEM 和EDS 对涂层组成和微观组织结构进行观察分析。涂层的XRD 图得出涂层物相由CaTiO3和金红石TiO2组成。
1.3.2 骨髓微核实验 ①钛浸提液的制备 将CaTiO3涂层的钛片材料按3 cm2/mL 的介质比例,分别置于等渗盐水中,37 ℃恒温箱中浸提7 d,过滤除菌后备用。②64 只小鼠随机分为8 组:120 ℃组6、12、24 h 和150 ℃组6、12、24 h、等渗盐水组和环磷酰胺组,每组8 只。分组前禁食16 h,分组后腹腔注射方式染毒,1 次/d,120 ℃组6、12、24 h 和150 ℃组6、12、24 h 分别注射120 ℃6、12、24 h 和150 ℃6、12、24 h 条件下的钛片浸提液,等渗盐水组注射等渗盐水,环磷酰胺组注射40 mg/kg 环磷酰胺,注射量均为0.1 mL,连续注射1 周后处死。③处死小鼠取出股骨,剪去两端骨骺,将其骨髓挤压于已滴有小牛血清的清洁载玻片上,混合均匀后45°推片,吹干,甲醇固定5 min,晾干备用。然后用配制的1∶10 吉姆萨(Giemsa)-磷酸缓冲液(pH7.4)染色20 min,然后用缓冲液洗掉玻片上的染色液,晾干。④计数各组骨髓嗜多染红细胞(bone marrow polychromatic erythrocytes,PCE)微核发生率。本实验每组共检查5000 个PCE,计算公式:
PCE 微核率=含微核的PCE 总数/检查PCE×1000‰
1.3.3 溶血实验 ①兔血的制备:无菌条件下,抽取10 mL 健康成年新西兰大白兔的心脏血,立即注入含有0.5 mL 20 g/L 草酸钾抗凝剂的试管中,制备成新鲜抗凝兔血,再加入等渗盐水稀释,制备稀释的抗凝兔血。②分组情况:实验组(血120 ℃组6、12、24 h 和血150 ℃组6、12、24 h)试管内分别放置5 g样品;并设立阳性对照组(蒸馏水),阴性对照组(等渗盐水),分别制备3 个平行样。实验组、阴性对照组加入10 mL 0.9%氯化钠溶液;阳性对照组加入10 mL 蒸馏水,每组平行操作3 管以上,8 组共24 只试管,放在37 ℃恒温水浴箱中30 min 后,每个试管加0.2 mL 稀释兔血,继续在恒温水浴箱中保温60 min,再在750 g,离心半径10 cm,离心5 min 后,小心抽取上清液,放置于分光光度计比色皿中,用分光光度计在波长为540 nm 波长处测定吸光度(A)值,并记录结果。计算每组3 只试管的A 值。③溶血度计算:
溶血率(%)=A-B/C-B×100%
式中A、B、C 分别为样品、阴性对照组、阳性对照组的A 值。溶血实验结果判定参照文献[12]。
1.3.4 新生大鼠颅盖骨成骨细胞的提取与分化参考文献[13-14]进行新生大鼠颅盖骨成骨细胞分离培养,并将该细胞进行纯化和传代培养,每5 天传代1 次,将传3 代的细胞备用。
1.3.5 甲基噻唑基四盐(Methyl thiazoly terazolium,MTT)的测定 钛片120 ℃组6、12、24 h 和钛片150 ℃组6、12、24 h,每组取5 个钛片置于24 孔细胞培养板内,纯钛片材料孔作为对照组,以3×104/mL 的密度接种于已加有钛片的孔内,每孔接种100 μL,分别于培养1、4、8 d 后终止培养,PBS 漂洗3 次,去除未黏附的细胞,每孔加培养液2 mL 和10 μL MTT 溶液(5 mg/mL,即0.5% MTT),继续培养4 h。弃上清,每孔中加入200 μL DMSO 溶解,置摇床上低速振荡10 min,然后从每孔吸出全部的上清转移至96孔培养板中,纯钛片组孔加入DMSO 200 μL。用酶联免疫检测仪测定A490值。
1.4 统计学分析 采用SPSS 16.0 统计软件进行数据分析。定量数据以均数±标准差)表示,各组间均数的比较采用单因素方差分析(One-way ANOVA)。以P≤0.05 为差异有统计学意义。
2 结 果
2.1 钛表面CaTiO3涂层的制备及表面形状分析涂层由CaTiO3纳米微晶颗粒聚集而成,颗粒尺寸约100 nm,多成立方形,表面光滑,结晶度较高。同时,EDS 表明纳米颗粒晶体由Ca、Ti 和O 元素组成,证明涂层为纳米CaTiO3涂层。见图1、图2。
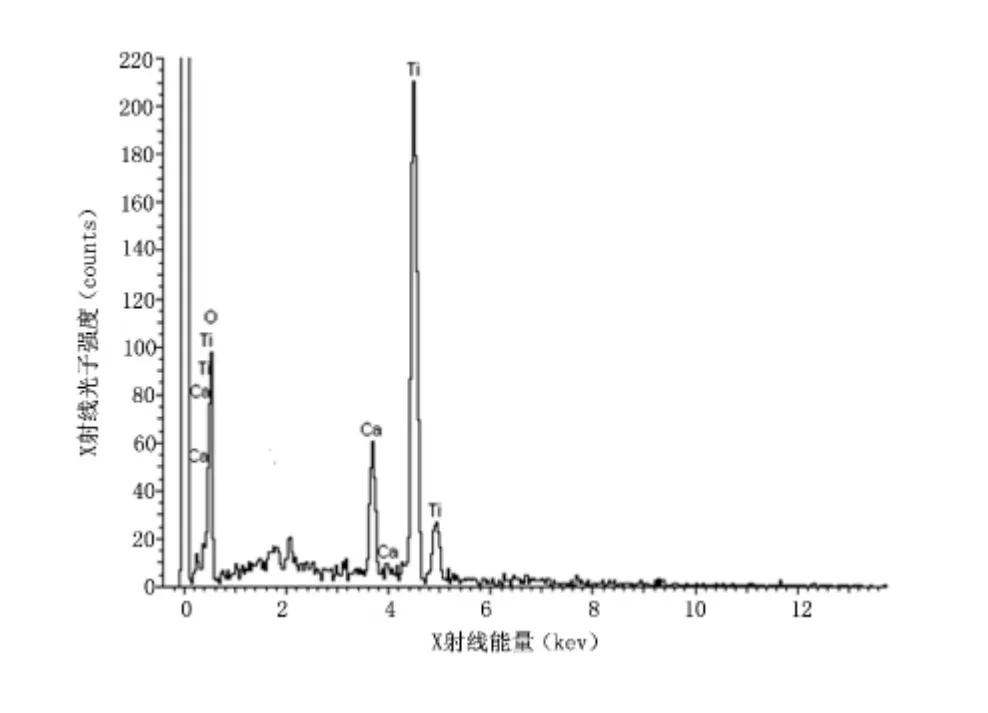
图1 钛表面涂层水热反应150 ℃24 h 的能谱分析Figure 1 Energy distribution spectrometry of titanium coating in the 150 ℃24 h group

图2 钛片表面CaTiO3涂层水热反应的SEM 图(×50000)Figure 2 Scanning electronic microscopy of the hydrothermal reaction of CaTiO3 coating on titanium(×50000)
2.2 骨髓微核实验 在120 ℃6、12、24 h 和150 ℃6、12、24 h 条件下,CaTiO3涂层钛片材料浸提液剂微核率与等渗盐水组比较差异无统计学意义(P >0.05);120 ℃组、150 ℃组与等渗盐水组的微核率均显著低于环磷酰胺组,差异均有统计学意义(P <0.05)。小鼠骨髓PCE 微核率均<4‰,符合标准要求。见表1,图3。
表1 各组小鼠骨髓细胞微核实验结果的比较)Table 1 Results of bone marrow micronucleus tests with different materials in different groups
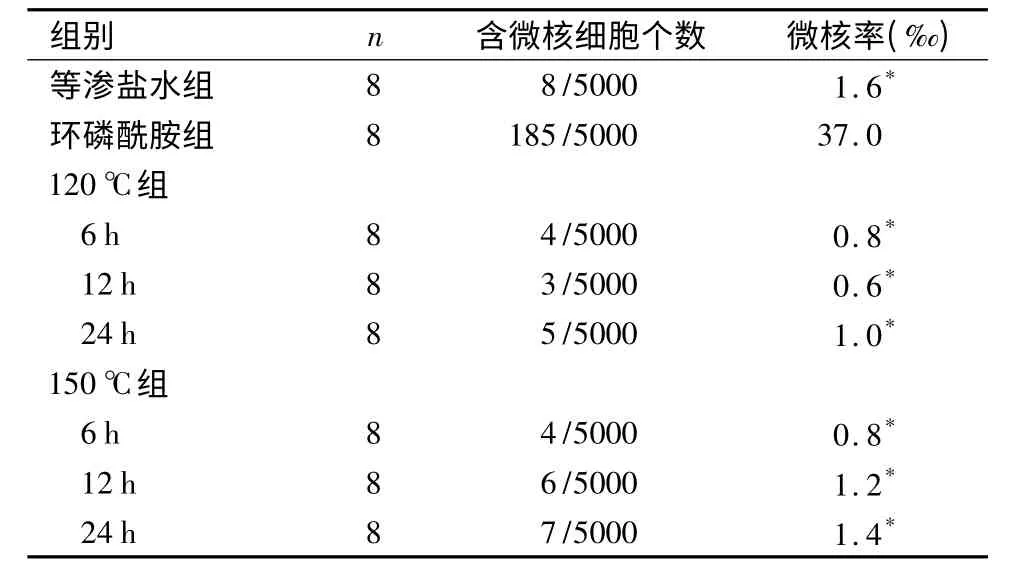
表1 各组小鼠骨髓细胞微核实验结果的比较)Table 1 Results of bone marrow micronucleus tests with different materials in different groups
与环磷酰胺组比较,*P <0.05
组别 n 含微核细胞个数 微核率(‰)等渗盐水组 8 8/5000 1.6*环磷酰胺组 8 185/5000 37.0 120 ℃组6 h 8 4/5000 0.8*12 h 8 3/5000 0.6*24 h 8 5/5000 1.0*150 ℃组6 h 8 4/5000 0.8*12 h 8 6/5000 1.2*24 h 8 7/5000 1.4*
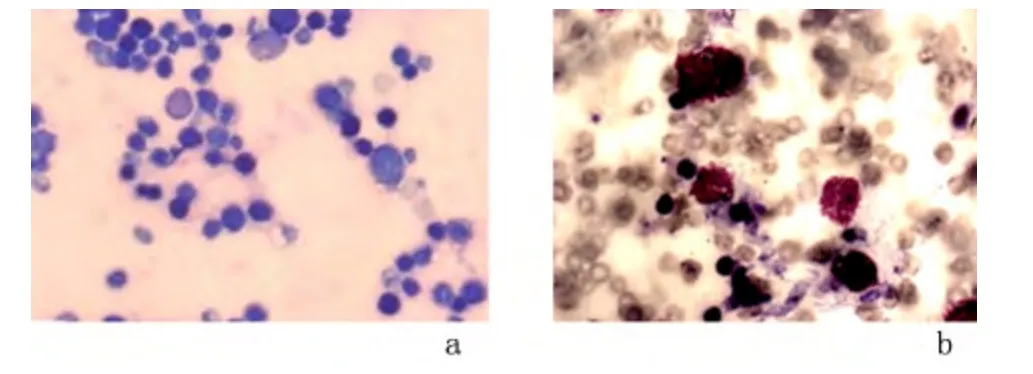
图3 油镜下小鼠骨髓微核试验(×1000)Figure 3 Results of bone marrow micronucleus test under the oil microscope(×1000)
2.3 溶血性评价 血120 ℃6、12、24 h 和血150 ℃6、12、24 h 样品的溶血检测结果与阳性对照组比较,可见阳性对照组上清液呈现红色,实验组红细胞下沉,上清液变清,取实验组下层液进行显微镜观察,未见红细胞破裂。溶血率均符合医用材料的溶血实验要求(<5%),见表2。
表2 各组材料溶血实验结果比较,n=3)Table 2 Results of hemolysis experiment with different materials in different groups,n=3)
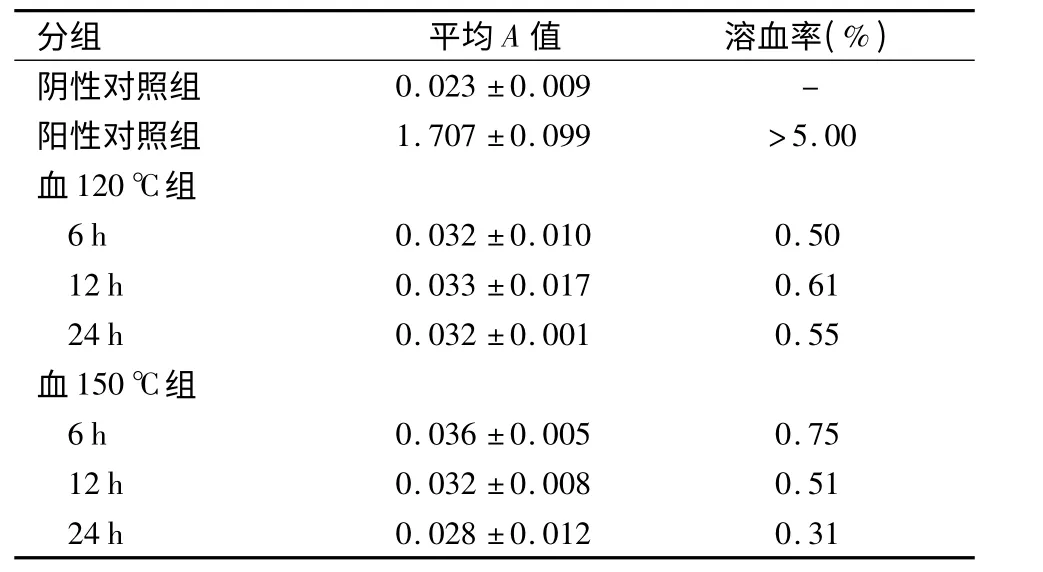
表2 各组材料溶血实验结果比较,n=3)Table 2 Results of hemolysis experiment with different materials in different groups,n=3)
阳性对照组 1.707±0.099 >5.00血120 ℃组6 h 0.032±0.010 0.50 12 h 0.033±0.017 0.61 24 h 0.032±0.001 0.55血150 ℃组6 h 0.036±0.005 0.75 12 h 0.032±0.008 0.51 24 h 0.028±0.012 0.31
2.4 成骨细胞原代培养和传代培养的活细胞观察成骨细胞原代培养,可见组织块边沿有少量细胞游离出来,随着培养时间延长,组织块周围细胞的数量明显增多。成骨细胞刚分离出来时为圆形,贴壁生长后变为星形,具有细胞质突起,数日后胞突连成网状,使星形细胞相互连接,形态观察,多为立方状,体积小,核圆。传代后多为梭形,细胞长满时近似方形,部分出现长梭形,与成纤维细胞非常相似,可出现重叠生长,集落样生长趋势。见图4。

图4 倒置显微镜下大鼠成骨细胞培养的细胞形态(×200)Figure 4 Morphology of the cultured osteoblasts under the inverted microscope(×200)
2.5 CaTiO3涂层的钛片对成骨细胞生长的MTT 结果 MTT 检测结果,钛片120 ℃组12、24 h 和钛片150 ℃组12、24 h 较纯钛片组同培养时间点的A 值显著上升,差异均有统计学意义(P <0.05)。见表3。
表3 MTT 检测各组材料对成骨细胞的A 值比较n=5)Table 3 Results of MTT for different materials in different groups,n=5)

表3 MTT 检测各组材料对成骨细胞的A 值比较n=5)Table 3 Results of MTT for different materials in different groups,n=5)
与纯钛片组同时间点比较,*P <0.05
组别 第1 天 第4 天 第8天纯钛片组0.019±0.011 0.341±0.143 0.731±0.121钛片120 ℃组6 h 0.028±0.018 0.261±0.161 0.538±0.138 12 h 0.024±0.014 0.498±0.218* 0.767±0.267*24 h 0.025±0.017 0.566±0.266* 0.836±0.236*钛片150 ℃组6 h 0.032±0.022 0.283±0.223 0.559±0.259 12 h 0.026±0.021 0.668±0.268* 0.765±0.265*24 h 0.038±0.018 0.769±0.213* 0.903±0.303*
3 讨 论
根据国际标准化组织将“生物医用材料”定义为用于和活组织接触以形成功能的无生命材料,其必须符合医用级基本标准,即材料无毒,不致癌、不致畸,不引起变态反应、具有良好的组织性和血液相容性[15]。从广义上讲,生物医学材料的安全性评价程序为物理和化学性能评价-生物学评价-临床研究。从狭义上讲,生物医学材料的安全性能评价主要是指生物学评价。本研究选用了细胞微核实验和溶血实验进行了初步的生物安全性能评价[16]。
细胞微核测试是现在常用的一种检测方法,代替中期染色体畸变分析,用于辐射损伤、化学诱变剂、新药试验、食品添加剂等的遗传毒性检测。微核实验是一种体内实验方法,用于染色体损伤和干扰细胞有丝分裂的化学毒物的快速检测方法。骨髓中PCE 充足,微核容易辨认,自发率低,因此作为本研究的首选。小鼠PCE 微核率正常值一般在4‰以下,而本研究结果表明CaTiO3涂覆的纯钛骨髓微核率均<4‰,因此可初步认为此种合成CaTiO3涂覆的纯钛方法无毒性作用,符合要求。
作为植入材料,在植入体内后,处于组织液环境中(包括血液),其表面结构和性能与血液相容性紧密相关,通过材料与血液直接接触可检测材料的可溶性或释放性成分的溶血性能及材料表面的溶血性能,其对后期的新骨的形成及稳定性都有很大的关系。中华人民共和国医药行业标准,口腔材料生物实验方法,溶血实验YY/T 0127.1-1993 标准规定了齿科材料溶血实验,适用于拟长期与骨和软组织接触的齿科材料的体外溶血性能评价。而且溶血实验是用生物医学材料进行体外实验,测定红细胞溶解和血红蛋白游离的程度,对材料的体外溶血性进行评价。由于本研究能敏感地反映试样对红细胞的影响,因而是一项有意义的筛选试验。本研究结果表明CaTiO3涂覆的纯钛的溶血率均<5%,因此可认为此种方法合成CaTiO3涂覆的纯钛无溶血作用,符合标准要求。
而一般材料的生物活性和促进成骨形成的过程,是通过成骨细胞与材料的共同培养来研究的,主要表现在成骨细胞黏附、增殖、分化、成熟、矿化和成骨,其中实验采用了,MTT 法对钛片表面的成骨细胞进行细胞增殖活性的测定[13-14]。本研究结果表明随着培养时间的延长,各组细胞增殖率也随着上升,120 ℃6、12、24 h 和150 ℃6、12、24 h 和纯钛片组对成骨细胞生长都有一定的影响,而其中各组之间第1 天无明显差异,可能是细胞在接种第1 天生长缓慢,处于细胞的潜伏期有关系,经过一段滞留期后即开始增殖,而后几天,细胞生长处于了稳定状态后,各组表现出了较高的MTT 代谢活性,细胞增殖率明显上升。共同培养到第4 天和第8 天,材料表面的成骨细胞数量和活性明显增加,可能是由于材料的化学组成和细胞表面的共同作用,促进了成骨细胞的增殖。而不同温度在反应6 h 与纯钛片组之间差异无统计学意义,可能是不同反应时间对材料表面的生成物是有影响的,反应时间作用太短,材料表面生成物对细胞作用不明显有关系。
本研究利用简单的水热合成法在钛基材表面制备CaTiO3涂层,对其生物安全性和生物相容性做了客观的评价,研究表明CaTiO3涂层的钛片溶血率均小于国家标准值5%,具有良好的抗溶血性能。骨髓微核试验的骨髓细胞微核率作用率均在4‰以下,初步可认为具有良好的生物安全性。通过对培养在CaTiO3涂层的纯钛表面成骨细胞的观察和检测,可发现其生长形态良好,而且具有很好的黏附和增殖能力,可初步认为此种方法生成的CaTiO3涂层的钛片,在生成过程中并未带入有毒成分和产生毒性物质,而且有良好的生物相容性,为将来的材料表面改性及临床应用提供了可靠的实验基础。
[1] Billi F,Campbell P.Nanotoxicology of metal wear particles in total joint arthroplasty:a review of current concepts[J].J Appl Biomater Biomech,2010,8(1):1-6.
[2] Sisti KE,de Rossi R,Brochado Antoniolli AM,et al.Surface and biomechanical study of Titanium implants modified by laser with and without hydroxyapatite coating,in rabbits[J].J Oral Implantol,2012,38(3):231-237.
[3] Kokubo T,Miyaji F,Kim HM.Spontaneous apatite formation on chemically surface treated Ti[J].J Amer Ceram Soc,1996:1127.
[4] 孙国静,杨书丰,郭 亭,等.不同浓度钛合金微粒对成骨细胞信号通路中转录表达因子RUNX2 影响[J].医学研究生学报,2013,26(3):251-254.
[5] Hanawa T,Kamiura Y,Yamamoto S,et al.Early bone formation around Calciumion implanted Titanium inserted into rat tibia[J].J Biomed Mater Res,1997,36(1):131-136.
[6] Hanawa T,Kon M,Ukai H,et al.Surface modification of Titanium in Calciumion containing solutions[J].J Biomed Mater Res,1997,34(3):273-278.
[7] Ohtsu N,Ito A,Saito K,et al.Characterization of Calcium titanate thin films deposited on Titanium with reactive sputtering and pulsed laser depositions[J].Surf Coat Technol,2007,201(18):7686-7691.
[8] Wei DQ,Zhou Y,Jia DC,et al.Structure of Calcium titanate/Titania bioceramic composite coatings on Titanium alloy and apatite deposition on their surfaces in a simulated body fluid[J].Surf Coat Technol,2007,201(21):8715-8722.
[9] Li H,Khor KA,Cheang P.Titanium dioxide reinforced hydroxyapatite coatings deposited by high velocity oxy-fuel(HVOF)spray[J].Biomaterials,2002,23(1):85-91.
[10] Ohba Y,Watanabe T,Sakai E,et al.Coating of HAp/CaTiO3 multilayer on Titanium substrates by hydrothermal method[J].J Ceram Soc Jpn,1999,107(10):907-912.
[11] Lynn AK,Duquesnay DL.Hydroxyapatite-coated Ti-6Al-4V part 1:the effect of coating thickness on mechanical fatigue behaviour[J].Biomaterials,2002,23(9):1937-1946.
[12] YY/T 0127.1-1993,口腔材料生物试验方法溶血试验[S].
[13] 张卓然.实用细胞培养技术[M].北京:人民卫生出版社,1999:512-513.
[14] 司徒镇强,吴军正.细胞培养[M].西安:世界图书出版公司西安分公司,1996:200-201.
[15] 郑玉峰,李 莉.生物医用材料学[M].哈尔滨:哈尔滨工业大学出版社,2005:326-327.
[16] 郝和平.医疗器械生物学评价标准实施指南[M].北京:中国标准出版社,2000:5-6.
