小鼠卵巢器官的胰岛素抵抗及中药隐丹参酮的调控作用
2015-05-07匡洪影吴效科
陈 静,李 威,吴 奇,匡洪影,吴效科
0 引 言
胰岛素信号通路与卵巢生殖功能变化的关系,为生殖内分泌领域研究所关注。卵巢器官的胰岛素信号通路障碍往往导致卵巢生殖机能的改变。临床常见的多囊卵巢综合征(polycystic ovarian syndrome,PCOS)即表现为内分泌失调并伴有生殖障碍及胰岛素通路的异常[1]。通过缓解PCOS 患者的胰岛素抵抗程度、应用胰岛素增敏剂等可以缓解PCOS患者的症状,提示胰岛素抵抗与PCOS 发病机制之间存在着密切的联系[2]。PCOS 的主要表现为对促排卵敏感提高并易发卵巢过度刺激综合征,提示胰岛素抵抗的卵巢对促性腺激素的敏感程度可能提高。
地塞米松能够诱导体外培养的T3T 脂肪细胞发生胰岛素抵抗,地塞米松在临床上与克罗米芬连用可以大大提高促排卵的效果[3]。推测在与克罗米芬连用的过程中地塞米松可能通过影响卵巢的胰岛素信号通路从而造成了卵巢器官对促性腺激素敏感性的增加。卵巢来源的甾体激素分泌异常与多种妇科疾病密切相关。本研究对胰岛素抵抗对卵巢生殖功能的影响进行探讨,并评估隐丹参酮对卵巢器官胰岛素抵抗的治疗作用。
1 材料与方法
1.1 药物 纯度95%隐丹参酮购于上海康九化工有限公司;地塞米松注射液购于郑州卓峰制药有限公司;用地塞米松、沃漫青霉素购于Sigma 公司。
1.2 试剂 DMEM/F12 培养基(HyClone 公司)、胎牛血清(BioSource 公司)、胰岛素(Novo Nordisk公司)、隐丹参酮(上海康九化工有限公司)。AKT2、P-AKT2、beta-actin 抗 体 均 购 自 SANTA CRUZ(SC-7127、SC-109903、SC-130656)。氚标记-2-脱氧葡萄糖(2-deoxy-D-[1,2-3H]-glucose)购自PerKin Elmer 公司(328A001MC)。
1.3 方法
1.3.1 实验动物分组及处理 所用小鼠为ICR 品系,共50 只,6 ~8 周龄,性成熟雌鼠,体重为(18±1)g,购自黑龙江中医药大学实验动物中心,动物合格证号:SCXK(黑)2013004,动物饲养于人工控制条件下,室温22 ℃,光照周期为14 h,光照时间:6:00 ~20:00,可以自由取食、饮水。取实验用鼠30 只,随机分为3 组,每组10 只:等渗盐水组(给予等渗盐水腹腔注射),地塞米松a 组(地塞米松1 mg/(kg·d)腹腔注射+等渗盐水灌胃),隐丹参酮a 组(地塞米松1 mg/(kg·d)腹腔注射+隐丹参酮灌胃+等渗盐水灌胃)。实验用雌鼠于下午15:00腹腔注射5 IU孕马血清促性腺激素,间隔48 h 腹腔注射5 IU 人绒毛膜促性腺激素(human chorionic gonadotropin,HCG),进行超数排卵处理。除空白对照组给予等渗盐水腹腔注射外,其余2 组均给予地塞米松进行腹腔注射。隐丹参酮灌胃组同期给予隐丹参酮灌胃处理,其余2 组给予等渗盐水灌胃。
1.3.2 胰岛素抵抗程度检测 3 组实验动物在注射HCG 16 h 后,于第4 天清晨静脉缓慢注射10 μ Ci 2-deoxy-D-[1,2-3H]-glucose 与2 U 胰岛素的混合物,40 min 后处死小鼠,取左侧卵巢、肝、脂肪,经高氯酸消化后,用液体闪烁仪检测单位质量组织2-deoxy-D-[1,2-3H]-glucose 的每分钟衰变数(disintegrations per minute,DPM)。
1.3.3 排卵数检测 注射HCG 16 h 后处死小鼠的同时,取出输卵管。在体式显微镜下撕开输卵管壶腹部,使用0.1%透明质酸酶消化后,计数小鼠排除的卵母细胞的个数。同时将小鼠右侧卵巢固定,做石蜡切片,及HE 染色,镜下(×200),每张切片分5个不同视野统计卵泡及黄体的数目。
1.3.4 卵巢器官体外培养 选取经阴道涂片确定周期稳定并处于动情间期的雌性ICR 小鼠20 只,处死后取出卵巢在显微镜下剥离周围组织,放入含有等渗盐水的50 mm 培养皿中,用配备好的DMEM 和5%BSA 的混合液冲洗卵巢3 次以上进行体外培养,培养液成分:DMEM/F12 培养基、5% BSA、0.1%DMSO 和终浓度10 nmol/L 的胰岛素。所得32 个卵巢随机分为4 组,每组8 个卵巢:空白对照组(空白培养液)、地塞米松b 组(地塞米松单独作用)、隐丹参酮b 组(地塞米松与隐丹参酮共同作用)、沃曼青霉素组(地塞米松与隐丹参酮共同作用的同时加入沃曼青霉素),每2 只卵巢一组置于24孔培养板中进行体外培养,每组分为4 个复孔。根据药物动力学的研究结果[4-5],培养液中地塞米松的终浓度为1 μmol/L,隐丹参酮终浓度为300 nmol/L,保证体外培养药物浓度与体内实验相一致。沃漫青霉素参照文献[6],终浓度1 μmol/L。所有卵巢在空气湿度95%,CO2含量5%的培养箱中培养。
1.3.5 体外培养卵巢组织葡萄糖摄取的测定 培养结束后更换新的2 mL 培养液并同时加入终浓度为100 nmol/L 的胰岛素,作用60 min 后,分别收集培养液,检测培养基中残留的葡萄糖浓度。将原始培养液葡萄糖浓度与残留培养液浓度的差值与培养液体积相乘,并与培养液中卵巢组织的质量作比,即可得到单位质量卵巢组织在胰岛素刺激后所吸收的葡萄糖的量,检测PI3K 信号通路变化对卵巢功能的影响。
1.3.6 激素水平测定 收集培养液上清及小鼠血清,采用化学发光法,测定上清中睾酮、孕酮、雌二醇水平。
1.3.7 Western blot 检测 取小鼠卵巢组织,加裂解液制备组织匀浆,离心后取上清,测蛋白浓度,加蛋白上样液,10%SDS-聚丙烯酰胺凝胶电泳,电转移至PVDF 膜上,5%脱脂奶粉封闭,分别以山羊抗小鼠AKT2 多克隆抗体(1∶3000)、兔抗小鼠P-AKT2(1∶3000)抗体和兔抗小鼠beta-actin 抗体(1∶3000)一抗孵育杂交过夜,洗膜后在过氧化物酶标记的抗兔或抗羊的IgG(1∶3000)二抗中孵育1 h,以化学发光法显示结果。
1.4 统计学分析 采用SPSS 11.0 统计软件进行数据分析。定量数据采用均数±标准差)表示,组间均数比较均采用单因素方差分析。以P≤0.05 为差异有统计学意义。
2 结 果
2.1 小鼠卵巢胰岛素抵抗程度评估 地塞米松a组与等渗盐水组比较,胰岛素靶器官肝、脂肪、卵巢的氚标记葡萄糖吸收量差异均有统计学意义(P <0.05),显示肝、脂肪、卵巢器官都有糖摄取的障碍,产生胰岛素抵抗。隐丹参酮a 组较地塞米松a 组葡萄糖摄取量明显上升(P <0.01)。见表1。
2.2 卵巢胰岛素抵抗小鼠排卵数的变化 体式显微镜下检测结果显示:与地塞米松a 组排卵数目、平均黄体数比较,等渗盐水组和隐丹参酮a 组均显著降低(P <0.01)。3 组小鼠同一视野内平均卵泡数目差异无统计学意义(P >0.05)。见表2。
表1 不同组织氚标记葡萄糖的吸收量,DPM/mg)Table 1 2-deoxy-D-[1,2-3H]-glucose uptake of murine tissue,DPM/mg)
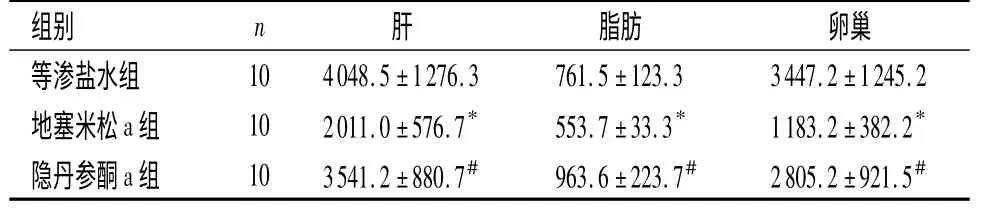
表1 不同组织氚标记葡萄糖的吸收量,DPM/mg)Table 1 2-deoxy-D-[1,2-3H]-glucose uptake of murine tissue,DPM/mg)
与等渗盐水组比较,*P <0.05;与地塞米松a 组比较,#P <0.05
组别 n 肝 脂肪 卵巢等渗盐水组10 4048.5±1276.3 761.5±123.3 3447.2±1245.2地塞米松a 组 10 2011.0±576.7* 553.7±33.3* 1183.2±382.2*隐丹参酮a 组 10 3541.2±880.7# 963.6±223.7# 2805.2±921.5#
表2 超数排卵小鼠排卵及相关指标的比较,个)Table 2 Statistics of murine ovulation rate after super ovulation,count)
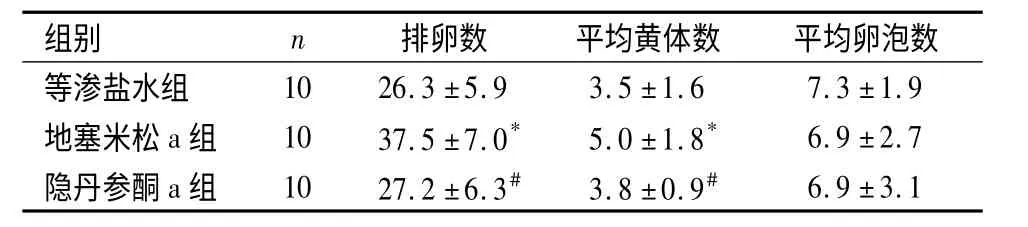
表2 超数排卵小鼠排卵及相关指标的比较,个)Table 2 Statistics of murine ovulation rate after super ovulation,count)
与等渗盐水组比较,*P <0.01;与地塞米松a 组比较,#P <0.01
组别 n 排卵数 平均黄体数 平均卵泡数等渗盐水组10 26.3±5.9 3.5±1.6 7.3±1.9地塞米松a 组 10 37.5±7.0* 5.0±1.8* 6.9±2.7隐丹参酮a 组 10 27.2±6.3# 3.8±0.9#6.9±3.1
2.3 胰岛素抵抗小鼠血清激素水平变化 在发生胰岛素抵抗后,地塞米松a 组血清雌二醇及孕酮水平较等渗盐水组和隐丹参酮a 组均显著上升(P <0.05)。见表3。
2.4 体外培养小鼠卵巢激素分泌比较 地塞米松b 组培养液睾酮水平[(1.88±0.44)nmol/L]较空白对照组[(0.47±0.01)nmol/L]显著上升(P <0.01),而地塞米松b 组孕酮水平[(11.42±10.30)nmol/L]较空白对照组[(35.79±17.83)nmol/L]显著下降(P <0.01);各组雌二醇水平差异无统计学意义(P >0.05)。
表3 各组小鼠血清激素水平比较Table 3 Murine serume hormone level

表3 各组小鼠血清激素水平比较Table 3 Murine serume hormone level
与等渗盐水组比较,*P <0.05;与地塞米松a 组比较,#P <0.05
组别 n 雌二醇(pmol/L) 孕酮(nmol/L)等渗盐水组10 127.8±2.1 67.8±13.5地塞米松a 组 10 238.5±19.7* 93.3±8.6*隐丹参酮a 组 10 140.4±34.4# 79.8±10.2#
2.5 胰岛素抵抗小鼠卵巢胰岛素信号通路变化AKT2 蛋白分子表达量比较,等渗盐水组(0.84±0.02)与地塞米松a 组(0.85±0.05)比较差异无统计学意义(P >0.05);P-AKT2 蛋白含量比较,地塞米松a 组(0.39±0.01)较等渗盐水组(0.77±0.03)显著降低(P <0.05)。见图1。
2.6 体外培养小鼠卵巢中葡萄糖摄取评估 体外培养的卵巢组织中每毫克组织葡萄糖摄取量,隐丹参酮b 组和空白对照组较地塞米松b 组、沃曼青霉素组均显著升高(P <0.01)。见表4。
表4 小鼠卵巢中葡萄糖摄取量DPM/mg)Table 4 Murine ovarian 2-deoxy-D-[1,2-3H]-glucose uptake,DPM/mg)

表4 小鼠卵巢中葡萄糖摄取量DPM/mg)Table 4 Murine ovarian 2-deoxy-D-[1,2-3H]-glucose uptake,DPM/mg)
与地塞米松b 组比较,*P <0.01;与沃曼青霉素组比较,#P <0.01
组别 葡萄糖摄取量空白对照组 3 447.2±1 245.2*#地塞米松b 组 1 183.2±382.2隐丹参酮b 组 2 805.2±921.5*#沃曼青霉素组1 364.2±292.3
3 讨 论
在脂肪细胞的体外培养试验中,地塞米松作为诱导药物,能够导致脂肪细胞发生胰岛素抵抗[7];而卵巢胰岛素抵抗的PCOS 患者中,往往能够发现卵巢中卵泡过度发育,激素水平异常升高等现象[8]。这些证据都提示,卵巢胰岛素抵抗很可能与卵巢功能的亢进有关。在本研究中,诱导小鼠发生全身性的胰岛素抵抗后,卵巢器官存在着胰岛素抵抗的现象。在促性腺激素的刺激下,地塞米松组卵巢较空白对照组表现为排卵数目提高和激素分泌水平提高,说明在胰岛素抵抗的情况下,卵巢功能发生亢进现象。同时,对卵巢超排后黄体数和卵泡数的检测则表明,地塞米松所诱导的胰岛素抵抗提高了小鼠在同一周期内的排卵数目,即地塞米松组小鼠黄体数目增加;但没有明显改变卵巢的卵泡储备量,说明胰岛素抵抗提高了卵巢对促性腺激素的敏感程度,提高了卵巢的排卵能力,但并没有明显影响卵巢的卵子储备。临床治疗当中,也能够发现由于糖皮质激素分泌亢进所导致的库欣氏综合征。患有库欣氏综合征的患者其卵巢也会发生多囊样改变[9]。根据这些现象,本研究推测,临床在促排卵的过程中应用地塞米松,也可能造成了卵巢短期的胰岛素敏感性降低从而提高了卵巢的促性腺激素敏感性。
糖皮质激素能够诱导脂肪细胞的胰岛素抵抗,其主要的机制是阻碍了胰岛素信号通路蛋白的磷酸化水平[10-11]。在体外诱导卵巢胰岛素抵抗的实验当中,本研究借鉴了脂肪细胞诱导胰岛素抵抗的结果,应用高剂量糖皮质激素诱导卵巢组织的胰岛素抵抗。在脂肪细胞当中,地塞米松能够阻碍葡萄糖转运蛋白的跨细胞膜易位功能,降低PI3K 通路蛋白的磷酸化水平但对总蛋白的表达量没有明显的影响[12]。本研究在卵巢组织当中也发现了类似的现象,胰岛素PI3K 通路的标志分子AKT2 其基础蛋白水平在地塞米松诱导后变化不明显,而在地塞米松组小鼠卵巢中AKT2 的磷酸化水平显著降低。信号通路的改变体现在信号分子表达量及活性两个方面,PI3K 通路关键分子AKT2 磷酸化水平的变化会直接影响卵巢的胰岛素敏感性。本研究前期发现,AKT2 基因缺失的小鼠表现为高雄激素血症及胰岛素抵抗,与PCOS 临床症状相似[13]。地塞米松诱导的胰岛素抵抗小鼠卵巢也表现出酪氨酸磷酸化降低的现象,这说明PI3K 信号通路磷酸化的异常是造成卵巢胰岛素抵抗的关键因素。隐丹参酮在体内及体外的实验中均体现出拮抗地塞米松并激活PI3K 通路的生物学效应,而其作用效果能够被PI3K 抑制剂沃漫青霉素所抑制,提示中药隐丹参酮很可能通过激活PI3K 途径发挥治疗效应。
中药丹参性微寒,味苦,无毒,有活血、通络、凉血、消肿的作用。丹参中抗菌消炎的有效成份为隐丹参酮。虽然隐丹参酮单体在动物实验中能够有效的改善小鼠葡萄糖代谢水平,但中药隐丹参酮的作用机制尚不十分明确,尤其在治疗PCOS 的过程当中。在临床治疗过程中,隐丹参酮能降低女性血清雄激素水平并治疗痤疮[14]。女性体内雄激素的来源主要来自于卵巢细胞,本研究发现,隐丹参酮对于糖皮质激素所诱导的卵巢功能异常有很强的拮抗作用。体外培养的隐丹参酮处理组卵巢较地塞米松组,葡萄糖摄取量提高、卵巢睾酮、孕酮的表达水平及对促性腺激素的敏感性均降低。在本研究中检测到隐丹参酮能够调节PI3K 通路关键分子的磷酸化水平,且这种调节作用能够被PI3K 途径抑制剂沃漫青霉素所抑制,说明隐丹参酮能够通过PI3K 途径发挥调节作用。也有研究结果显示,隐丹参酮能够直接调节甾体激素合成酶的表达[15]。虽然本研究结果表明,PI3K 通路与甾体激素合成之间存在联系,但隐丹参酮究竟是调节PI3K 通路还是直接作用于甾体激素合成酶的表达还有待进一步的证实。
[1] Li R,Yu G,Yang D,et al.Prevalence and predictors of metabolic abnormalities in Chinese women with PCOS:a cross-sectional study[J].BMC Endocr Disord,2014,16(14):76-84.
[2] 倪倩倩,朱梦娇,姚根宏,等.高脂肪饮食诱导多囊卵巢综合征表型改变的实验研究[J].医学研究生学报,2014,27(6):596-599.
[3] Elnashar A,Abdelmageed E,Fayed M,et al.Clomiphene citrate and dex amethazone in treatment of clomiphene citrate-resistant polycystic ovary syndrome:a prospective placebo-controlled study[J].Hum Reprod,2006,21(7):1805-1808.
[4] Hansen DK,LaBorde JB,Wall KS,et al.Pharmacokinetic considerations of dexamethasone-induced developmental toxicity in rats[J].Toxicol Sci,1999,48(2):230-239.
[5] Zhang J,Huang M,Guan S,et al.A mechanistic study of the intestinal absorption of cryptotanshinone,the major active constituent of Salvia miltiorrhiza[J].J Pharmacol Exp Ther,2006,317(3):1285-1294.
[6] Menon MB,Kotlyarov A,Gaestel M.SB202190-induced cell type-specific vacuole formation and defective autophagy do not depend on p38 MAP kinase inhibition[J].PLoS One,2011,6(8):e23054.
[7] Patsouris D,Neels JG,Fan W,et al.Glucocorticoids and thiazolidinediones interfere with adipocyte-mediated macrophage chemotaxis and recruitment[J].J Biol Chem,2009,284(45):31223-31235.
[8] Gambineri A,Forlani G,Munarini A,et al.Increased clearance of cortisol by 5beta-reductase in a subgroup of women with adrenal hyperandrogenism in polycystic ovary syndrome[J].J Endocrinol Invest,2009,32(3):210-218.
[9] Zhang L,Fang ZJ,Liu F,et al.Magnetic resonance imaging and magnetic resonance angiography in severe crush syndrome with consideration of fasciotomy or amputation:a novel diagnostic tool[J].Chin Med J(Engl),2011,124(13):2068-2670.
[10] Zhang TY,Daynes RA.Glucocorticoid conditioning of myeloid progenitors enhances TLR4 signaling via negative regulation of the phosphatidylinositol 3-kinase-Akt pathway[J].J Immunol,2007,178(4):2517-2526.
[11] 石 磊,董瓅瑾,孙 静,等.重组胰生定多肽对地塞米松诱导的大鼠胰岛素抵抗的影响[J].医学研究生学报,2013,26(11):1230-1232.
[12] Wang X,Hu Z,Hu J,et al.Insulin resistance accelerates muscle protein degradation:Activation of the ubiquitin-proteasome pathway by defects in muscle cell signaling[J].Endocrinology,2006,147(9):4160-4168.
[13] Wang J,Zhang YH,Wu XK,et al.Insulin resistance enhanced the response of the ovary[J].Zhonghua Yi Xue Za Zhi,2009,89(37):2611-2615.
[14] 赵 杨,陆 茵,郑仕中.隐丹参酮的药理作用研究进展[J].中华中医药杂志,2010,25(11):1839-1841.
[15] Wang X,Yeung JH.Inhibitory effect of tanshinones on rat CYP3A2 and CYP2C11 activity and its structure-activity relationship[J].Fitoterapia,2011,82(4):539-545.
