N,N-二乙基乙醇胺(DEEA)溶液CO2吸收解吸性能的实验研究
2015-04-01高红霞刘森徐彬梁志武
高红霞,刘森,徐彬,梁志武
(CO2捕获与封存国际合作中心(iCCS),化石能源低碳化高效利用湖南省重点实验室,湖南大学化学化工学院,湖南 长沙410082)
引言
全球近年来出现的大气污染、雾霾、温室效应、气候反常等一系列极端异常天气引起了世界各国对环境恶化与人类能源消费结构关系的极大关注。学术界认为二氧化碳浓度的不断攀升是导致温室效益的罪魁祸首。其中,燃煤电厂烟气CO2排放量占中国碳排放总量的30%左右,因此控制燃煤电厂烟气中 CO2的排放对控制温室效应有着极其重要的意义[1]。二氧化碳捕获、利用与封存(CCUS)技术是控制碳排放的有效途径之一,也是中国环境与资源可持续发展的重要战略手段[2]。
从理论上讲,燃烧后捕获更适合于燃煤电站,其捕集方法主要包括吸收法、膜分离法、低温精馏法和吸附法[3-4]。胺法因其对燃烧后烟气中的 CO2进行富集,技术较为成熟,运行稳定,气体纯度高,是一种具备工业化可行性的CO2捕获方法[5]。但是,胺法脱碳工艺存在的最大缺陷是系统能耗较高[6]。
目前,CO2脱除的醇胺主要包括伯胺、仲胺、叔胺、空间位阻胺、环状有机胺及混合胺等[7-11]。伯、仲胺(如MEA、DEA)对CO2具有吸收速率快、投资成本低等优点,但也存在吸收容量低、再生能耗高、溶剂易降解及腐蚀大的缺点;叔胺如MDEA具有吸收容量大、再生能耗低、稳定性高的特点,但存在吸收速率慢、设备投资成本高等缺陷[12]。混合胺溶液在一定程度上虽然能缓解单一吸收剂吸收速率快与再生能耗低不能共存的尴尬,但CO2吸收过程作用机理与混合机制尚不清楚,研究难度大[13]。因此,探寻对CO2具有吸收与解吸综合性能好的吸收剂,可为降低有机胺捕获CO2成本奠定工业化基础。
本文通过快速溶剂筛选实验对6种不同醇胺捕获剂吸收解吸性能进行了对比评价。并对筛选出的综合性能良好的DEEA吸收剂的吸收容量、高效填料塔内传质性能及再生性能进行了实验研究。
1 实验部分
1.1 吸收剂快速筛选实验

图1 CO2溶剂快速筛选实验装置Fig.1 Absorption-desorption screening experiment set up
溶剂快速筛选实验主要利用如图1所示的实验装置,可利用该装置同时进行胺溶液吸收与解吸实验,该装置由 N2和 CO2钢瓶、质量流量计、混合器、带有磁力搅拌的油浴加热器、冷凝管、三口烧瓶、冷凝系统、CO2红外分析仪等组成。实验过程中需定时测量反应后的混合气中CO2的含量与溶液中CO2的负载量。实验为方便溶液性能的对比,所有吸收液质量浓度设为工业上常用的30%,吸收与解吸实验中CO2分压分别为25和0 kPa,N2流量控制在1 L·h-1,吸收与解吸温度恒温设置为313与353 K。
吸收实验:将配制好的350 ml胺溶液置于装配好的反应器中,密封,磁力搅拌1400 r·min-1,预热至313 K。将一定量的N2和CO2混合气体分别通过稳压和质量流量控制器,经混合器混合,通过鼓泡装置将气体喷射进入装有吸收液的反应器,使CO2与吸收液充分接触;未反应的混合气经蛇形冷凝管后进入冷凝系统,再经CO2分析仪记录混合气中CO2浓度;根据吸收效果,每隔一定时间间隔取样,测定其CO2负载,直至CO2负载不再变化达到反应平衡,反应结束。
解吸实验:利用吸收实验结束后的吸收液,不同之处在于进气仅为N2,系统反应温度为353 K。
CO2吸收与解吸速率定义为单位时间内吸收/解吸CO2的物质的量,由以下公式计算[14]
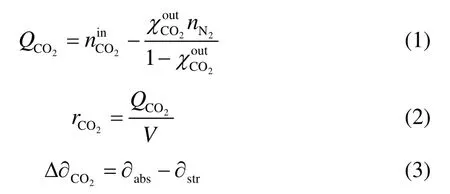
式中,2COQ为单位时间内溶液CO2的吸收量,mol·s-1;为 CO2流量,mol·s-1;n为 N2N2流量,mol·s-1;χ为出口混合气中 CO2的摩尔分数;V为溶液的体积,L;rCO2为溶液吸收的速率,mol·(L·s)-1;∂abs为平衡CO2负载90%时的溶液负载,mol·mol-1;∂str为解吸30 min后溶液的CO2负载,mol·mol-1;Δ∂CO2为CO2循环负载,mol·mol-1。
1.2 高效填料塔传质实验
填料塔传质实验主体设备为内径 28 mm、高1.78 m的散堆填料吸收塔,填料高度为1.31 m,填料类型为Φ3×3不锈钢Dixon ring散堆填料。填料塔传质实验装置图如图2所示。

图2 填料塔吸收传质实验装置Fig.2 Schematic diagram of absorption process
一定量的CO2与空气分别由CO2钢瓶与空气压缩机压缩后,依次经质量流量计、混合器充分混合后,由吸收塔底部进入并与由吸收塔顶部进入的吸收液逆流接触,富液从塔底排出进入富液槽,废气由塔顶排出。运行20~25 min体系稳定后,用CO2分析仪测量不同填料高度CO2的浓度并记录此测量点的温度;测定吸收塔顶部和底部液体的负载。
体积总传质系数KGaV是影响设备投资和操作费用的重要参数,可以直接用于工业设计。根据气液反应的总吸收速率和物料守衡方程,KGaV可表示为[15-17]

式中,G1为惰性气体的摩尔流量,kmol·(m2·h)-1;P为大气压,kPa;yA,a为气体中CO2的摩尔分数;yA为溶液浓度平衡时CO2的摩尔分数,yA≈0;YA为气相中CO2的摩尔分数;z为填料塔高度,m。
1.3 高效填料塔再生实验
再生实验装置为常见的填料塔再生实验系统,如图3所示。解吸塔主体结构及填料类型均与图2中吸收塔相同,填料高度 0.5 m。解吸塔体与相关管道均进行保温处理。

图3 填料塔吸收再生实验装置Fig.3 Schematic diagram of desorption process
实验开始前,用去离子水配制一定浓度的胺溶液,并担载CO2获得一定负载的富液。将约2 L富液倒入再沸器中,启动油浴加热器与油浴泵预热再沸器至预定温度;开启富液泵使水浴预热至90℃的富液进入解吸塔进行再生,同时启动贫液泵使得贫富液流量相同;实验进行2 h待系统稳定后,每隔20 min进行取样,同时记录CO2解吸累积流量及各处温度,测定贫液负载。
解吸能耗定义为再沸器所消耗的能量与解吸塔解吸出的CO2的质量之比[18-20],即

本实验中,再沸器的热量由热油热量传递提供

式中,Qreg是解吸能耗,kJ·kg-1;Hreboiler为再沸器热负荷,kJ·h-1;Hloss为系统热耗损失,很小可忽略不计;2COm为CO2质量流量,kg·h-1;moil为加热油的质量流量,kg·h-1;Coil,f为油的比热容,kJ·kg-1·℃-1;Tin,Tout分别为导热油再沸器进口和出口温度。
2 结果与讨论
为对比评价不同胺溶液吸收解吸性能,本文利用溶剂快速筛选实验装置对MEA,MDEA,DEA,AMP,PZ与DEEA胺溶液的CO2吸收负载、吸收速率、解吸负载、解吸速率、吸收容量、相对反应时间、单位时间CO2处理量及相对再生能耗等方面进行了研究。同时利用溶解度装置、填料塔吸收与解吸装置对DEEA溶液的平衡溶解度、传质与再生性能进行了初步考察。
2.1 溶剂快速筛选实验结果与讨论
图4和图5为质量浓度为30%的不同胺捕获剂对CO2吸收性能的作用曲线。从图中可以看出,不同胺溶液的CO2负载量均随吸收时间的增加而逐渐增加,直至反应达到平衡;吸收速率随吸收液负载的增加而逐渐降低,其主要是因为随着胺吸收CO2反应的进行,溶液中自由胺分子逐渐减少,降低了水溶液中胺分子与CO2碰撞概率,导致胺溶液吸收速率的降低。

图4 不同吸收剂CO2负载吸收时间的变化情况Fig.4 CO2loadingversusabsorption time for different solvents

图5 不同吸收剂吸收速率随CO2负载的分布情况Fig.5 Absorption rateversusCO2loading for different solvents
此外,从图4中可以看出,PZ具有最高的CO2平衡负载,这主要是因为 PZ分子中含有两个活性N原子,属于二元胺。MDEA具有最低的CO2平衡负载,表明其不适用于低分压下CO2的吸收。从图5中可以看出,MEA和PZ具有最快的吸收速率,在低负载的情况下,吸收速率基本保持不变;MDEA和DEEA表现出较低的CO2吸收速率,其原因是叔胺不能与CO2直接反应。不同胺吸收剂的CO2吸收速率排序依次为:MEA≈PZ>AMP>DEA>DEEA>MDEA。
不同胺吸收富液再生性能作用曲线如图6和图7所示。从图中可以看出,溶液CO2负载量随再生时间的增加逐渐降低,然后趋于反应平衡;解吸速率随溶液负载的降低而逐渐降低。在相同实验条件下,不同吸收剂的再生性能对比结果表明,MDEA具有最快的解吸速率,其再生能力最强;PZ和MEA则具有最慢的解吸速率。原因主要是MDEA的反应热最低。同时由图6可以看出,叔胺MDEA和DEEA解吸速率较快,解吸至平衡时,其贫液负载分别为0.014 和0.185 mol·mol-1,但DEEA的解吸程度较大,溶液CO2吸收容量大。MEA和PZ溶液的解吸速率相对较慢,解吸至平衡时,其贫液负载分别为0.254和0.442 mol·mol-1,达到平衡时所需的时间也较长。从解吸角度而言,MEA和PZ不能应用于CO2的捕集。
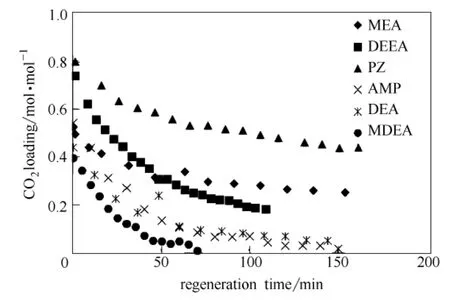
图6 不同吸收剂CO2负载解吸时间的变化情况Fig.6 CO2loadingversusregeneration time for different solvents
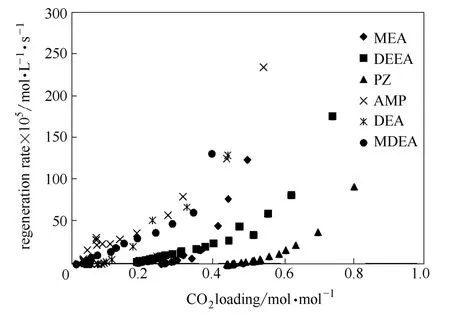
图7 不同吸收剂解吸速率随CO2负载的分布情况Fig.7 Regeneration rateversusCO2loading for different solvents
图8和图9对比了6种不同典型胺吸收剂的循环负载、相对吸收时间、溶液CO2处理量及相对再生能耗。若只考虑循环负载,MDEA表现出最好的解吸特性,MEA则最差。溶液吸收至CO2平衡负载的90%时,所需时间长短排序为:MDEA>DEEA>DEA>AMP>MEA>PZ,PZ表现出最快的吸收速率,MDEA吸收速率最低。实验结果表明,具有最高CO2吸收性能的吸收剂再生能力差,再生能力强的吸收剂其CO2吸收性能不佳。从图4~图7中可以看出,不同胺溶剂具有不同的吸收CO2平衡溶解度、吸收速率、解吸平衡负载与解吸速率,每一种胺均有各自的优势。为寻求吸收解吸综合性能良好的吸收剂,需对不同胺吸收剂进行综合评价。本文引出溶液单位时间CO2处理量2COL的概念,即假设吸收解吸两方面所占权重相同,如式(7)所示。

在溶液解吸时间和解吸温度均相同的情况下,解吸总能耗W相同,假设其值为144 MJ·h-1。单位质量CO2相对解吸能耗E可由式(8)计算
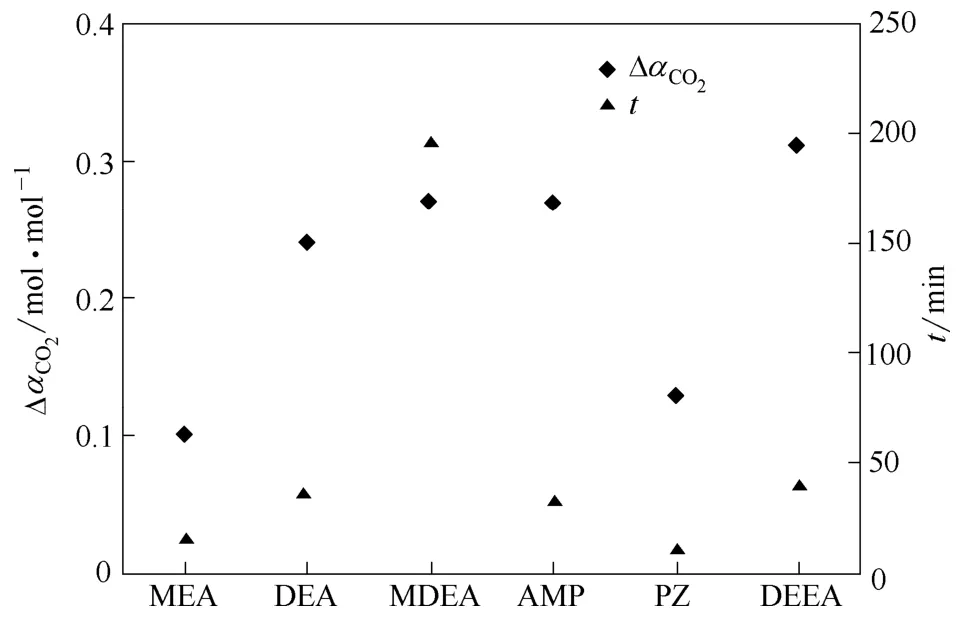
图8 不同吸收剂的吸收容量和反应时间Fig.8 Values of2COαΔ and reaction time for different solvents

图9 不同吸收剂的CO2处理量LCO2和相对再生能耗EFig.9LCO2and relative regeneration heat duty for different solvents

由图9可以看出,从溶液单位时间CO2处理量LCO2方面而言,AMP溶液高达 38 kg·h-1,而MDEA溶液仅为8 kg·h-1。综合考虑吸收与再生性能的参数E,对6种不同胺吸收剂CO2吸收性能和解吸性能进行综合评价,其性能优劣排序依次为:MDEA<DEA<PZ<MEA<DEEA<AMP。MDEA溶液表现出最低的综合性能,主要原因在于其吸收速率最慢,也就意味着其对吸收设备的要求最高,吸收成本最高。在典型吸收剂中,MEA处于中间地位,因再生能耗高而受到严重制约。虽然 AMP为最佳的吸收剂,但在工业化/中试吸收解吸过程中,AMP溶液浓度超过2 mol·L-1时会产生结晶现象,堵塞管道,这就意味着单位体积溶液所吸收的CO2量较少,不经济可行。因此,叔胺DEEA吸收剂表现出较好的吸收解吸性能,作为本文的研究重点,本文将初步对其吸收容量、传质与再生性能的真实情况进行实验研究。
2.2 DEEA溶液吸收再生性能测定
图10给出了温度为313 K时4种浓度(1~4 mol·L-1)下DEEA溶液在不同分压情况下的CO2平衡溶解度变化规律。如图所示,DEEA溶液的平衡溶解度随分压的增大而增加,随浓度的增加而降低。这主要是由于当气相CO2浓度(即CO2分压)升高时,气、液两相间浓度梯度增大,传质推动力增加,既促进了CO2的溶解,又增大了化学吸收量;同时随DEEA溶液浓度的增加,溶液黏度随之增大,增大了CO2进入溶液的阻力,CO2平衡溶解度降低。实验条件为313 K,CO2分压为100 kPa和浓度为3 mol·L-1时,DEEA的平衡溶解度高达 0.902 mol·mol-1。
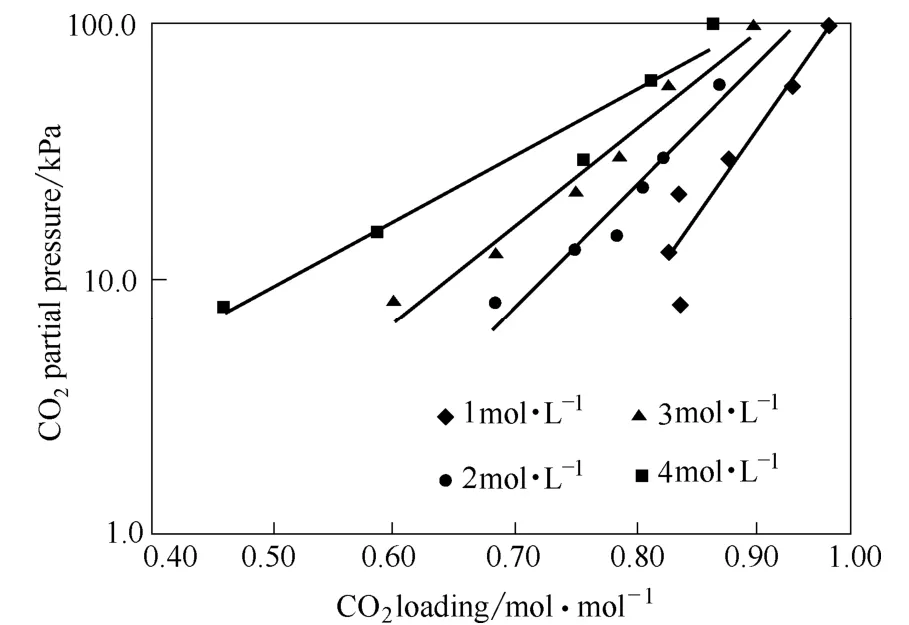
图10 气体CO2分压对DEEA溶液溶解度的影响Fig.10 CO2partial pressure on equilibrium solubility of CO2absorption into aqueous of 1—4 mol·L-1DEEA
温度是影响胺溶液传质系数的一个重要因素。在填料塔中研究DEEA溶液的传质性能,实验过程中通入吸收塔中的CO2体积分数约15%,气体流量为0.54 m3·h-1,液体流量为 3.6 L·h-1,贫液负载为0.1 mol·mol-1。如图11所示,在293~333 K温度范围内,随进料温度的增加,DEEA溶液的传质系数逐渐增加。这是因为升高温度能提高反应速率,降低溶液黏度,增大扩散速率,反应分子碰撞的概率增加,传质速率增加。DEEA吸收CO2为放热反应,但当温度较高时,吸收塔内的温度过高,同样会促进反应的逆向进行,不利于吸收反应的进行;同时操作温度较高时,吸收塔底富液温度较高,贫富液温差较小,不利于热量的有效利用,增大系统能耗。因此,工业上吸收塔操作温度一般为40℃。
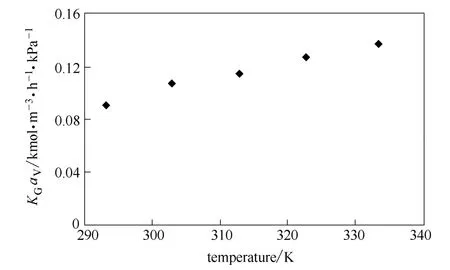
图11 进料温度对DEEA传质系数的影响Fig.11 Effect of temperature onKGaVof aqueous DEEA solution
胺溶液贫富液负载是影响溶液再生能耗的重要因素之一。控制导热油流速和温度,在富液流量为 50 ml·min-1,考察了浓度为 3 mol·L-1的 DEEA溶液贫液和富液负载对其再生能耗的影响,如图12所示。由图可知,贫液和富液负载对溶液再生能耗的影响很大,溶液的再生能耗随贫液负载的增加而降低,但两者并不存在直线关系,再生能耗随富液负载的降低而增大。当贫液负载高于0.25 mol·mol-1时,提供较少的能量便能解吸至目标负载;但是当贫液负载低于0.25 mol·mol-1时,贫液负载的微小变化所需的再生能耗较高。解吸目标值贫液负载较低时,CO2在气相中的平衡分压急剧降低,水蒸气的分压增加,因此需提供更多的蒸汽使气液两相中CO2的分压达到平衡,CO2才能从溶液中解吸出来,溶液潜热增加,再生能耗增加。同样,当富液负载较高时,其所需的水蒸气分压相对较低,再沸器提供的蒸汽潜热降低,再生能耗降低。从再生能耗与溶液循环容量两方面考虑,DEEA溶液的贫液负载在0.25~0.35 mol·mol-1范围内较为经济可行。
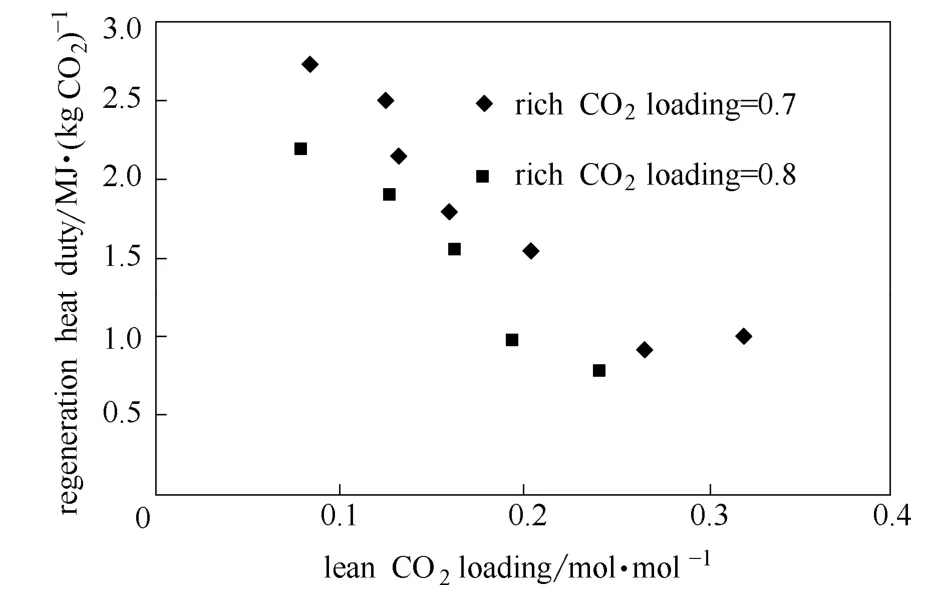
图12 贫液负载对DEEA溶液再生能耗的影响Fig.12 Effect of lean CO2loading on regeneration heat duty
3 结 论
利用溶剂快速筛选实验装置,从胺溶液吸收负载、吸收速率、解吸负载、解吸速率、单位时间溶液CO2处理量、吸收解吸总反应时间、吸收容量与相对再生能耗方面,对MEA,MDEA,DEA,AMP,PZ与DEEA 6种不同胺溶液的吸收解吸性能进行了总体评价。实验研究结果表明,PZ和MEA虽具有较快的反应速率,但其再生性能较差;MDEA具有较高的再生速率,但吸收速率非常缓慢,增加吸收设备成本;AMP表现出最好的吸收解吸综合性能,但其因浓度较高时会产生结晶现象,堵塞管道,单位体积循环量降低,而不能单独使用;DEEA溶液的综合性能评价仅次于AMP,改善了胺吸收剂吸收速率快与再生能耗低的尴尬处境。同时,还对DEEA溶液的CO2平衡溶解度、填料塔传质性能与再生性能情况进行了初步实验。结果表明:
(1)DEEA溶液CO2平衡溶解度在浓度为1~4 mol·L-1范围内随浓度的升高而降低,随CO2分压的增大而增加,其值高达0.902 mol·mol-1。
(2)在填料吸收塔中,DEEA溶液的传质系数随进料温度的增加而有所增加。
(3)在填料再生塔中,DEEA溶液再生能耗均随贫液和富液负载的增加而降低,其再生能耗低于3 MJ·(kg CO2)-1,较MEA吸收剂[约3.5 MJ·(kg CO2)-1]具有更大的优势[6,21]。
[1] IEA (International Energy Agency). CO2Emissions from Fuel Combustion 2011-Highlights [M]. Paris, France:IEA.
[2] Deetman S, Hof A F, Pfluger B, van Vuuren D P, Girod B, van Ruijven B J. Deep greenhouse gas emission reductions in Europe:Exploring different options [J].Energy Policy, 2013, 55:152-164.
[3] Hua Ben (华贲). Resources and energy and energy trends of petrochemical industry in low carbon era [J].CIESC Journal(化工学报), 2013, 64 (1):76-83.
[4] Oexmann J, Hensel C, Kather A. Post-combustion CO2-capture from coal-fired power plants:preliminary evaluation of an integrated chemical absorption process with piperazine-promoted potassium carbonate [J].International Journal of Greenhouse Gas Control,2008, 2:539-552.
[5] Gao H, Zhou L, Liang Z, Idem R O, Fu K, Sema T,Tontiwachwuthikul P. Comparative studies of heat duty and total equivalent work of a new heat pump distillation with split flow process, conventional split flow process, and conventional baseline process for CO2capture using monoethanolamine [J].International Journal of Greenhouse Gas Control,2014, 24:87-97.
[6] Li Xiaofei (李小飞), Wang Shujuan (王淑娟), Chen Changhe (陈昌和). Heat requirement for regeneration of a CO2capture system using amine solutions [J].CIESC Journal(化工学报), 2013, 64 (9):3348-3355.
[7] Maneeintr K, Idem R O, Tontiwachwuthikul P, Wee A G.Comparative mass transfer performance studies of CO2absorption into aqueous solutions of DEAB and MEA [J].Industrial &Engineering Chemistry Research, 2010, 6:2857-2863.
[8] Bishnoi S, Rochelle G T. Absorption of carbon dioxide into aqueous piperazine:reaction kinetics, mass transfer and solubility [J].Chemical Engineering Science, 2000, 55 (22):5531-5543.
[9] Xu G, Zhang C, Qin S,et al. Kinetics study on absorption of carbon dioxide into solutions of activated methyldiethanolamine [J].Industrial & Engineering Chemistry Research, 1992, 31 (3):921-927.
[10] Bosch H, Versteeg G F, van Swa W P M. Kinetics of the reaction of CO2with the sterically hinderedamine 2-amino-2-methyl-propanol at 298 K [J].Chemical Engineering Science, 1990, 45 (5):1167-1173.
[11] Zheng Que (郑碏), Dong Lihu (董立户), Chen Jian (陈健), Gao Guanghua (高光华), Fei Weiyang (费维扬). Absorption solubility calculation and process simulation for CO2capture [J].CIESC Journal(化工学报), 2010, 64 (7):1740-1746.
[12] Lepaumier H, Picq D, Carrette P L. New amines for CO2capture(I):Mechanisms of amine degradation in the presence of CO2[J].Industrial & Engineering Chemistry Research, 2009, 48:9061-9067.
[13] Lawal O, Bello A, Idem R. The role of methyldiethanolamine(MDEA) in preventing the oxidative degradation of CO2loaded and concentrated aqueous monoethanolamine (MEA)-MDEA blends during CO2absorption from flue gases [J].Industrial & Engineering Chemistry Research, 2005, 44 (4):1874-1896.
[14] Aronu U E, Svendsen H F, Hoff K A, Juliussen O. Solvent selection for carbon dioxide absorption [J].Energy Procedia, 2009,1:1051-1057.
[15] Aroonwilas A, Tontiwachwuthikul P. Mass transfer coefficients and correlation for CO2absorption into 2-amino-2-methyl-1-propanol(AMP) using structured packing [J].Industrial & Engineering Chemistry Research, 1998, 37:569-575.
[16] Naami A, Edali M, Sema T, Idem R, Tontiwachwuthikul P. Mass transfer performance of CO2absorption into aqueous solutions of 4-(diethylamino)-2-butanol, monoethanolamine, andN-methyldiethanolamine [J].Industrial & Engineering Chemistry Research, 2012, 51:6470-6479.
[17] Maneeintr K, Idem R O, Tontiwachwuthikul P, Wee A G H.Comparative mass transfer performance studies of CO2absorption into aqueous solutions of DEAB and MEA [J].Industrial &Engineering Chemistry Research, 2010, 49:2857-2863.
[18] Kim I, Svendsen H F. Comparative study of the heats of absorption of post combustion CO2absorbents [J].International Journal of Greenhouse Gas Control, 2011, 5:390-395.
[19] Kolska Z, Kukal J, Zabransk M, Ruzicka V. Estimation of the heat capacity of organic liquids as a function of temperature by a three-level group contribution method [J].Industrial & Engineering Chemistry Research, 2008, 47:2075-2085.
[20] Marrero J, Gani R. Group-contribution based estimation of pure component properties [J].Fluid Phase Equilibr, 2001, 183:183-208.
[21] Zhang X, Fu K, Liang Z, Rongwong W, Yang Z, Idem R,Tontiwachwuthikul P. Experimental studies of regeneration heat duty for CO2desorption from diethylenetriamine (DETA) solution in a stripper column packed with Dixon ring random packing [J].Fuel,2014, 136:261-267.
