右美托咪定通过影响CHOP凋亡通路减轻缺血/再灌注肺损伤*
2015-03-30叶玉柱何金波邱晓晓林丽娜王万铁温州医科大学缺血再灌注损伤研究所附属第一医院麻醉科浙江温州35035
陈 丹,宋 冬,叶玉柱,何金波,陈 磊,邱晓晓,林丽娜△,王万铁△(温州医科大学缺血/再灌注损伤研究所,附属第一医院麻醉科,浙江温州35035)
右美托咪定通过影响CHOP凋亡通路减轻缺血/再灌注肺损伤*
陈丹1,2▲,宋冬1▲,叶玉柱2,何金波1,陈磊2,邱晓晓1,林丽娜2△,王万铁1△
(温州医科大学1缺血/再灌注损伤研究所,2附属第一医院麻醉科,浙江温州325035)
[摘要]目的:探讨右美托咪定(dexmedetomidine,DEX)能否通过CCAAT/增强子结合蛋白同源蛋白(CHOP)凋亡通路减轻小鼠缺血再灌注(I/R)性肺损伤。方法:选取雄性8~10周龄C57BL/6J小鼠40只,体重18 ~22 g,复制在体左肺I/R损伤模型。随机分为4组:假手术组(sham组),I/R模型组(I/R组),生理盐水对照组(I/R+ NS组),右美托咪定干预组(I/R+ DEX组)。DEX组在小鼠左肺缺血前30 min腹腔注射DEX 25 μg/kg,I/R+ NS组给予与DEX等体积的生理盐水。实验毕,留取左肺组织。测定肺组织干湿比(W/D)及总肺含水量(TLW),行肺组织损伤评估(IQA),光、电镜观察肺组织形态学及超微结构改变。原位末端标记(TUNEL)法检测组织细胞凋亡指数(AI)。Western blot和逆转录PCR(RT-PCR)分别检测CHOP、葡萄糖调节蛋白78(GRP78)蛋白和mRNA表达量。结果:与sham组比,I/R组和I/R+ NS组肺W/D、TLW、IQA、AI明显升高(P<0.01),肺组织形态破坏显著,CHOP、GRP78蛋白和mRNA表达量增加(P<0.01) ; I/R组与I/R+ NS组相比,上述指标无显著差异。与I/R组比,I/R+ DEX组肺组织W/D、TLW、IQA及AI明显下降(P<0.05),组织损伤明显减轻,CHOP蛋白和mRNA表达量下降(P<0.01)。结论: DEX可有效减轻小鼠缺血/再灌注性肺损伤,其机制可能与其抑制CHOP通路所致凋亡有关。
[关键词]右美托咪定;缺血/再灌注;肺损伤; CCAAT/增强子结合蛋白同源蛋白;细胞凋亡
[修回日期]2015-03-30
▲并列第1作者
Dexmedetomidine alleviates lung ischemia-reperfusion injury through CHOP pathway in mice
CHEN Dan1,2,SONG Dong1,YE Yu-zhu2,HE Jin-bo1,CHEN Lei2,QIU Xiao-xiao1,LIN Li-na2,WANG Wan-tie1
(1Institute on Ischemia/Reperfusion Injury,2Department of Anesthesiology,The First Affiliated Hospital,Wenzhou Medical University,Wenzhou 325035,China.E-mail: wwt@ wzmc.edu.cn; wzlinlina@ tom.com)
[ABSTRACT]AIM: To explore the effect of dexmedetomidine (DEX) on the CCAAT/enhancer-binding proteinhomologous protein (CHOP) pathway during lung ischemia-reperfusion (I/R) in mice.METHODS: C57BL/6J male mice were randomly divided into sham operation group (sham group),lung ischemia/reperfusion group (I/R group),ischemia/reperfusion+ normal saline group (I/R+ NS group) and ischemia/reperfusion+ dexmedetomidine group (I/R+ DEX group).Dexmedetomidine was infused intraperitoneally with 25 μg/kg for 30 min prior to the ischemia period in I/R+ DEX group,the normal saline was administrated with the same volume of dexmedetomidine in I/R+ NS group.After finished the 3 h-reperfusion period,the left lung tissues were harvested to determine lung wet/dry weight (W/D),the total lung water content (TLW),and index of quantitative evaluation for alveolar damage (IQA).Morphological observation and terminal-deoxynucleotidyl transferase mediated nick end labeling (TUNEL) were applied to evaluate the structure changes and the apoptosis index (AI) of the lung tissues.The expression of CHOP and glucose-regulated protein 78 (GRP78) at mRNA and protein levels in the lung tissues was detected by Western blot and RT-PCR.RESULTS: Compared with sham group,the W/D,TLW,IQA,AI,the mRNA and protein expression of CHOP and GRP78 obviously increased,and the left lung tissues structure were damaged more obviously both in I/R group and I/R+ NS group.Compared with I/R group,the W/D,TLW,IQA,AI and the protein and mRNA expression of CHOP in I/R+ DEX group decreased,the injury of the left lung tissue structures induced by I/R in I/R+ DEX group were also alleviated.CONCLUSION: DEX alleviates thelung I/R injury,which may be related to inhibition of apoptosis mediated by CHOP pathway.
[KEY WORDS]Dexmedetomidine; Ischemia/reperfusion; Lung injury; CCAAT/enhancer-binding protein homologous protein; Apoptosis
缺血/再灌注(ischemia/reperfusion,I/R)肺损伤已成为临床肺移植及心肺转流等术后并发症的明确原因,常导致组织细胞发生凋亡[1-3],研究表明其机制与过度内质网应激(endoplasmic reticulum stress,ERS)导致的未折叠蛋白反应(unfolded protein reaction,UPR)有关[4]。因此,如何减轻和避免I/R损伤可为临床防治提供新方案和思路。机体在缺血、缺氧、钙超载等情况下,内质网发生过度应激,UPR凋亡通路被激活,细胞发生凋亡,进而损伤组织。其中CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)为UPR的主要凋亡信号分子,在机体内质网应激条件下大量表达,目前认为CHOP促凋亡作用与其抑制抗凋亡因子Bcl-2表达有关[5-6]。右美托咪定(dexmedetomidine,DEX)为α2肾上腺素能受体激动剂,具有器官保护、抗炎、抗凋亡等作用[7],本实验旨在研究右美托咪定预处理能否抑制CHOP凋亡途径,影响CHOP和葡萄糖调节蛋白78(glucose-regulated protein78,GRP78)的表达,减轻小鼠I/R性肺损伤,为临床预防和治疗I/R性肺损伤提供新的治疗靶点及途径。
材料和方法
1实验动物
SPF级C57BL/6J小鼠,8~10周龄,雄性,体重18~22 g,由温州医科大学实验动物中心提供,动物使用许可证号为SYXK(浙) 2012-075。
2药品及试剂
右美托咪定(江苏恒瑞医药股份有限公司) ; DNase I、proteinase K(Sigma) ; TUNEL检测试剂盒(Roche) ; DAB显色试剂盒(北京中杉金桥生物科技有限公司) ; Trizol(Invitrogen) ;逆转录试剂盒、PCR试剂盒(Fermentas) ; BCA蛋白浓度测定试剂盒(碧云天生物技术研究所) ;兔抗GAPDH多克隆IgG抗体(杭州至贤生物科技有限公司) ; CHOP、GRP78 (Cell Signaling Technology) ; HRP偶联山羊抗兔IgG抗体(Abcam)。
3实验方法
3.1动物模型的建立模型复制参考文献中方法[8]进行,小鼠麻醉后,仰卧位固定,消毒,行倒T型气管切开术,植入20 G注射针套管,连接呼吸机,调节呼吸参数。于左侧2、3肋间体表处,消毒切皮,逐层钝性分离至胸腔,显露左肺门,用微型动脉夹夹闭30 min,即缺血期;继之松开动脉夹,为再灌注期,时长3 h。实验毕,处死小鼠,留取左肺组织。假手术小鼠仅开胸不夹闭左肺门,其余操作步骤相同,实验结束处死小鼠,留取左肺。术中维持体温在36.5~37.5℃。
3.2实验分组SPF级C57BL/6J小鼠40只,随机分为4组:假手术组(sham组)、肺缺血/再灌注组(I/R组)、生理盐水对照组(I/R+ NS组)、右美托咪定组(I/R+ DEX组)。I/R+ DEX组缺血前30 min腹腔注射DEX(25 μg/kg),I/R+ NS组注射与I/R+ DEX组同体积的生理盐水,其余操作同I/R组。实验结束,处死小鼠,留取左肺组织待检。
3.3肺干湿比(wet weight to dry weight of lung tissue,W/D )及总肺水含量(total lung water content,TLW)值测定实验结束,获取小鼠左肺上叶组织,漂洗,吸除表面血液和水分,称重,记为湿重(wet weight,W),置于80℃恒温烤箱48 h,称重,记为干重(dry weight,D)。以(W-D)/D计算TLW。
3.4肺泡损伤的检测及光镜观察取小鼠左肺下叶组织,大小0.5 cm×0.5 cm×0.5 cm,漂洗,固定。常规石蜡包埋,组织切片,HE染色,光学显微镜(× 200)观察肺组织形态学变化,并计数。随机选取50个视野,连续观察,肺泡内红细胞和(或)白细胞数大于2个或肺泡内有水肿渗出者视为损伤细胞,每视野内损伤肺泡数占总肺泡数百分比即为肺泡损伤定量评估指标(index of quantitative evaluation for alveolar damage,IQA)。
3.5肺组织的电镜观察取小鼠左肺尖处肺组织,切成1 mm×1 mm×1 mm大小,2.5%戊二醛保存,固定、块染后,梯度乙醇脱水,丙酮浸泡,Epon 812包埋聚合,行半薄切片,修块,超薄切片,醋酸铀、硝酸铅双重染色,电镜下读片。
3.6 TUNEL检测按照试剂盒说明书操作,光镜下(×400)观察计数,胞核呈棕褐色者为凋亡细胞。
3.7蛋白表达量的Western blot检测取小鼠肺组织100 mg用液氮加以研磨,以1 000 μL RIPA(含10 μL PMSF)裂解组织,待研磨充分后,吸取匀浆液低温离心,取上清,BCA法测定蛋白浓度,绘制标准曲线,样品蛋白均调配成2 g/L,煮沸变性5 min。配胶进行电泳,上样量30 μg,蛋白转印至PVDF膜。5%脱脂奶粉室温封闭1 h,TBST漂洗,加入I抗(CHOP、GRP78、GAPDH均以1∶1 000稀释),4℃孵育过夜,TBST洗涤5 min 3次,加HRP标记II抗(CHOP 1∶3 500,GRP78 1∶4 500,GAPDH 1∶4 000),室温孵育1 h。TBST洗涤7 min 3次,滴加ECL工作液,反应5 min,暗室内曝光,显影、定影。凝胶分析软件分析目的蛋白与内参照蛋白GAPDH吸光度值。
3.8 mRNA表达量的检测取100 mg小鼠肺组织,加液氮研磨,以TRIzol法提取总RNA,测定RNA浓度,按照RT-PCR试剂盒说明书进行cDNA合成及扩增,PCR参数为94℃1 min; 94℃30 s,50~58℃[CHOP(55℃),GAPDH(58℃),GRP78(50℃)]30 s,72℃30 s,72℃10 min,循环31次。引物序列见表1。

表1 目的基因引物序列Table 1.The primer sequences of the target genes
4统计学处理
使用SPSS 15.0软件分析,计量资料以均数±标准差(mean±SD)表示,组间采用单因素方差分析,两两比较使用LSD-t检验,以为差异有统计学意义。
结果
1各组肺组织W/D、TLW、IQA比较
与sham组比,I/R组和I/R+ NS组W/D、TLW、IQA值明显上升(P<0.01),I/R组和I/R+ NS组相比,两者无统计学差异(P>0.05) ;与I/R组比,I/R+ DEX组上述指标明显下降(P<0.01),见表2。
2肺组织光镜观察结果
Sham组肺泡结构完整,间质未见增厚,无炎症细胞浸润; I/R组和I/R+ NS组肺泡结构严重破坏,间质明显增厚,大量炎症细胞浸润,肺泡腔内见明显渗出和水肿,可见肺不张; I/R+ DEX组肺泡清晰可见,结构相对完整,鲜见炎症浸润及水肿渗出,间质无增厚。箭头所指为损伤部位,见图1。

表2 各组肺组织W/D、TLW、IQA的变化Table 2.The effects of dexmedetomidine (DEX) on the W/D,TLW and IQA in the lung tissues of the mice with I/R injury (Mean±SD.n=10)

Figure 1.The effects of dexmedetomidine (DEX) on the histomorphology changes of the lung tissues in the mice with I/R injury (HE staining,×200).图1肺组织形态学变化
3肺组织透射电镜观察结果
Sham组肺泡II型上皮细胞内板层小体及线粒体等细胞器结构完整,形态良好,清晰可见。I/R组和I/R+ NS组肺泡II型上皮细胞破坏严重,微绒毛少见,板层小体可见空泡化;与I/R组比,I/R+ DEX组肺泡上皮细胞损伤减轻,结构完整性尚可,板层小体偶有空泡化,不如I/R组严重,线粒体稍有肿胀,但仍易发现,见图2。
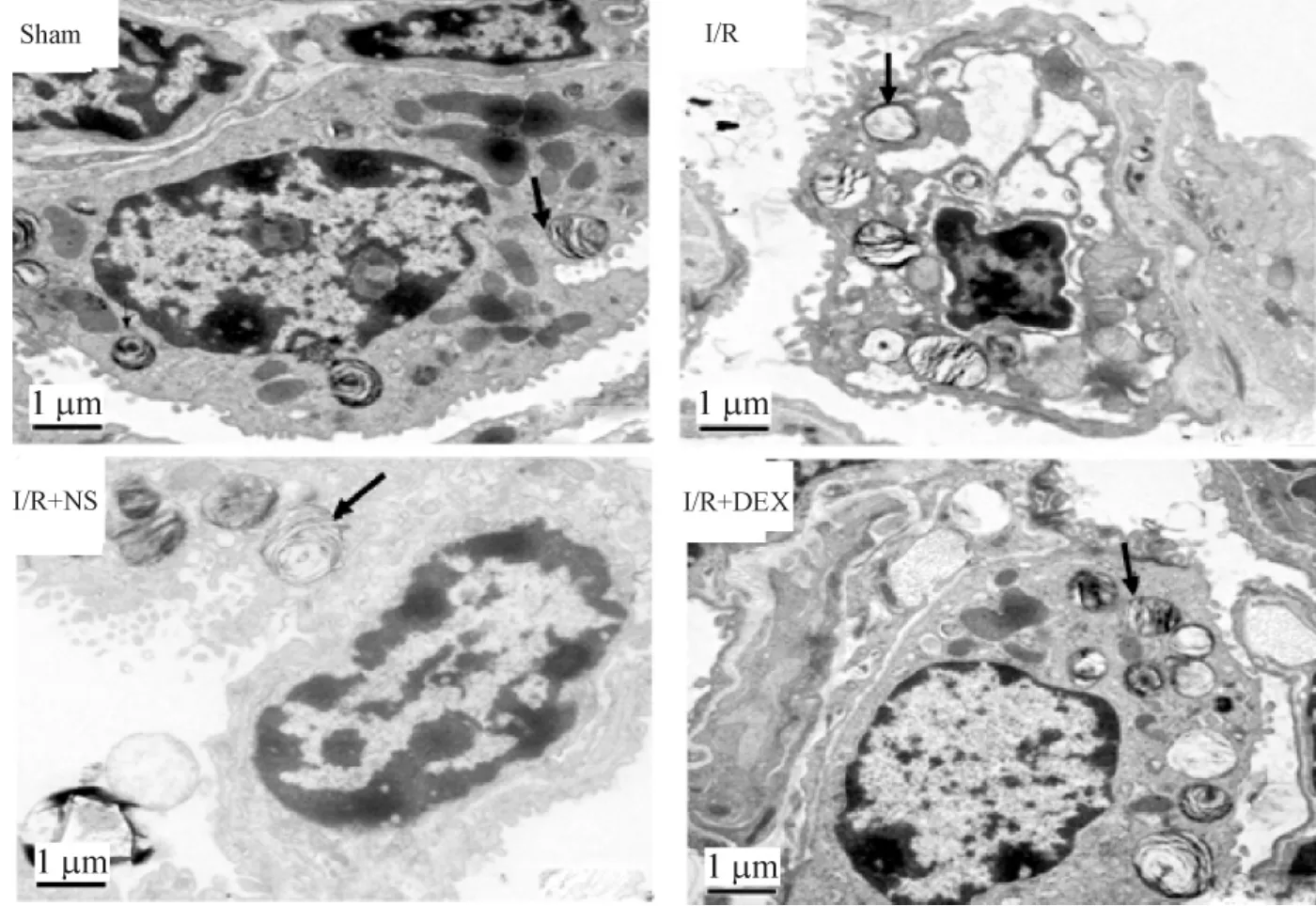
Figure 2.Ultra-structure of alveolarⅡtype cells in the lung tissues of the mice with different treatments.图2各组肺组织肺泡Ⅱ型细胞超微结构的变化
4肺组织内TUNEL法检测细胞凋亡
Sham组凋亡细胞最少; I/R组、I/R+ NS组最为严重,其中以血管内皮细胞凋亡较为明显,肺泡细胞内也有大量凋亡细胞呈现; I/R+ DEX组凋亡相对较弱,较I/R和I/R+ NS组改善明显。图中棕褐色颗粒皆为凋亡阳性细胞,见图3。
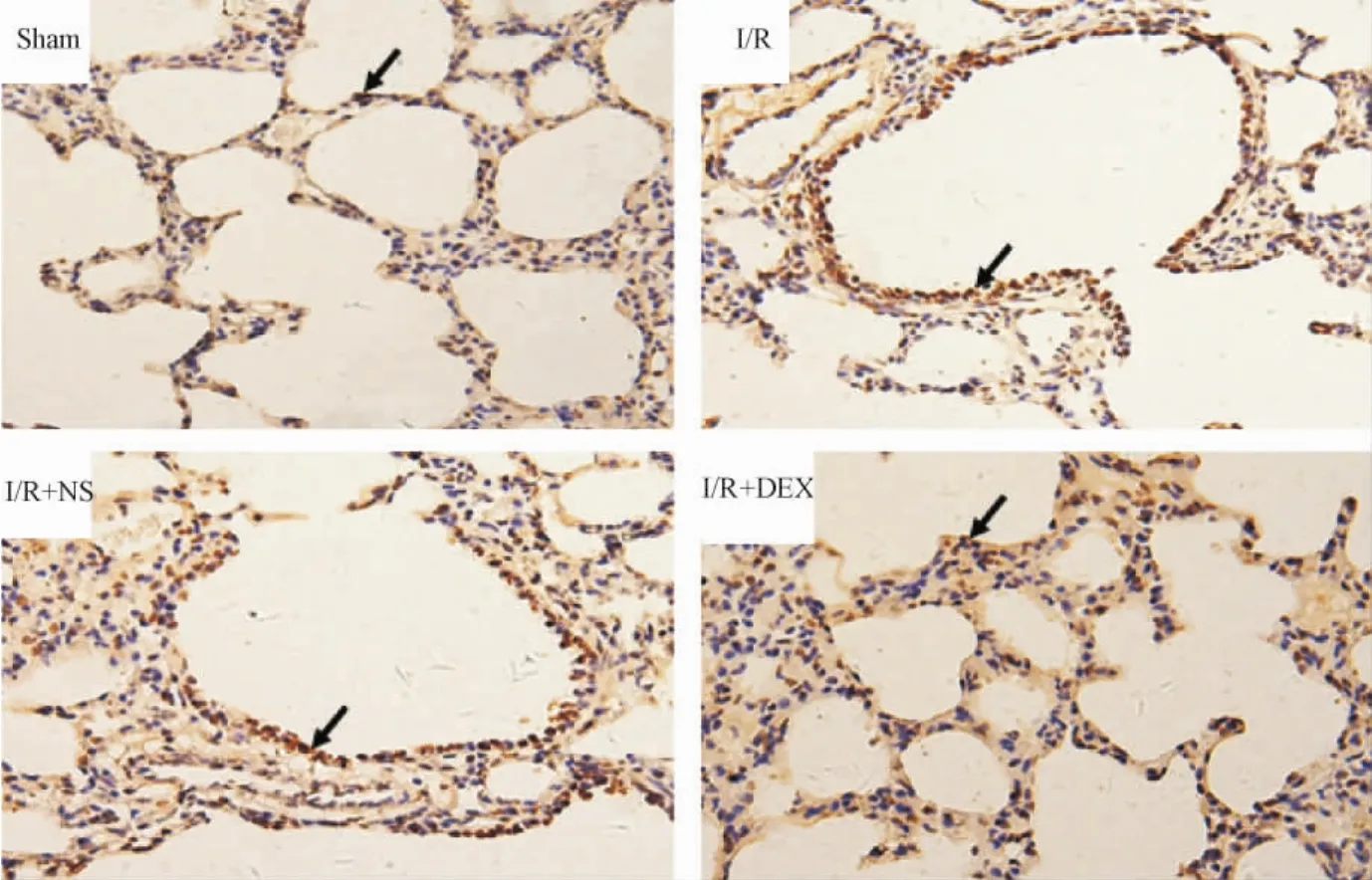
Figure 3.The apoptosis in the lung tissues of mice with I/R injury detected by TUNEL (×400).图3 TUNEL法检测各组肺组织的细胞凋亡
5各组肺组织内的CHOP和GRP78蛋白的表达
与sham组比,其余各组CHOP和GRP78蛋白水平均明显上升(P<0.01) ; I/R组与I/R+ NS组蛋白上升水平相比无明显差异;与I/R组比,I/R+ DEX组CHOP蛋白水平下降趋势明显(P<0.01),见图4。
6各组肺组织内CHOP和GRP78 mRNA表达
与sham组比,其余各组肺组织中CHOP和GRP78的mRNA水平明显上升(P<0.01) ; I/R组与I/R+ NS组mRNA上调程度一致;经DEX预处理后,CHOP mRNA表达量减少(P<0.01),见图5。

Figure 4.The effects of dexmedetomidine (DEX) on the protein levels of CHOP and GRP78 in the lung tissues of the mice with I/R injury.Mean±SD.n=10**P<0.01 vs sham group;##P<0.01 vs I/R group.图4各组肺组织CHOP和GRP78蛋白表达水平
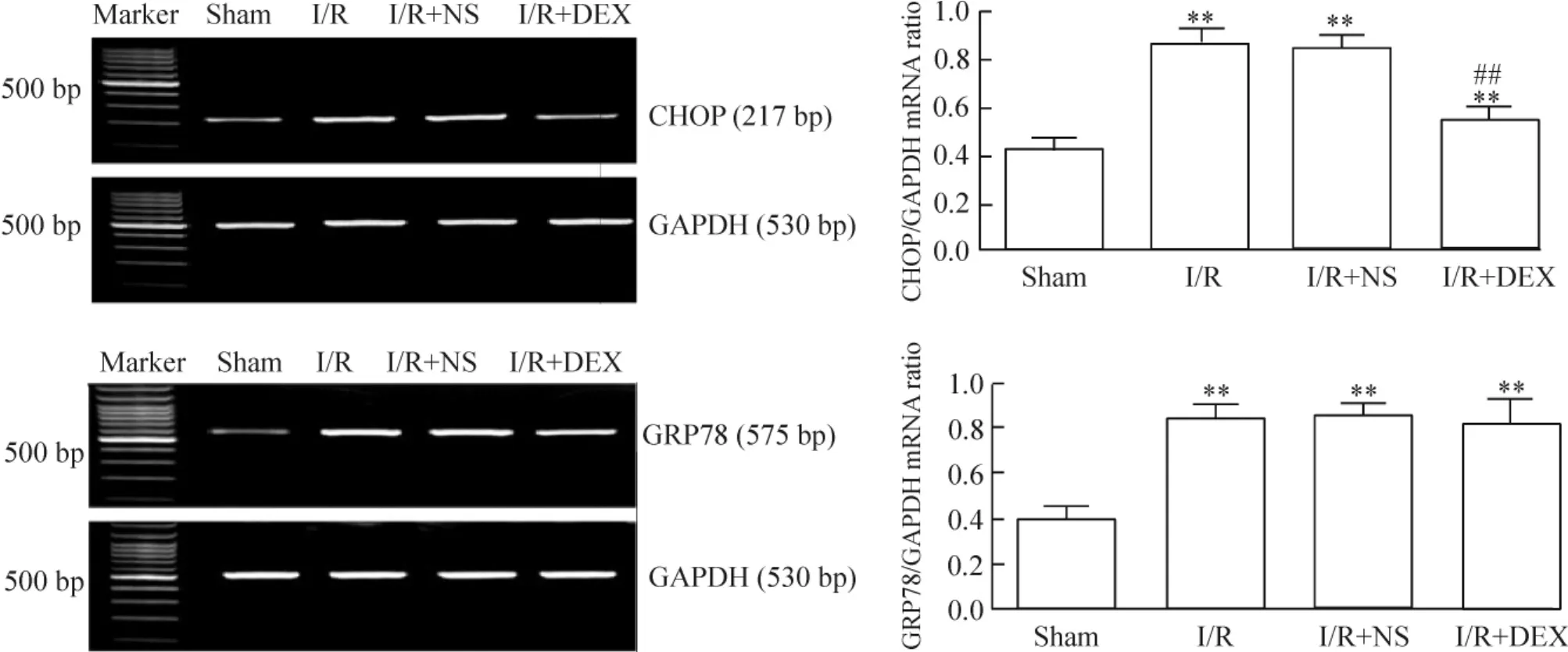
Figure 5.The mRNA expression of CHOP and GRP78 in the lung tissues of the mice with I/R injury.Mean±SD.n=10.**P<0.01 vs sham group;##P<0.01 vs I/R group.图5各组肺组织CHOP和GRP78的mRNA表达水平
讨论
近年来,凋亡机制的研究多关注于内质网途径。研究证实:肺组织I/R诱发过度内质网应激,细胞凋亡参与肺组织缺血再灌注损伤的发生[9-11]。本实验组前期实验证实:小鼠左肺I/R后,肺组织CHOP凋亡通路蛋白和mRNA表达上调[10]。正常情况下,机体内CHOP表达量很低,而应激情况下,其产生量迅速增加,被称为是ERS的标志分子。CHOP诱导凋亡的途径主要与过表达的CHOP破坏Bcl-2与Bax之间的平衡关系、促进Bax移位到线粒体和抑制Akt的活性等有关[12-15]。
内质网膜中,GRP78作为分子伴侣与ER中错误折叠和未折叠蛋白结合,对于其功能的正常运转功不可没,可作为ERS发生的哨兵分子。ERS下,GRP78可游离并迅速增加,结合ER内负荷的错误蛋白,保护ER功能,因而在一定程度的损伤和应激情况下,其表达量会随之上升[15-16]。本实验中,sham组GRP78的产生量处于低位水平,I/R组则明显高出sham组,提示肺I/R诱发ER应激反应。但ER持久和(或)过强的应激也会导致GRP78防御能力发生崩溃,机体丧失自我修复能力,最终宣告凋亡发生。
DEX对心、脑、肺等多种I/R器官具有保护效应,其保护机制多涉及减少自由基生成、抑制炎症细胞产生、降低机体内的儿茶酚胺产生量、抑制交感神经的兴奋性、调节凋亡等[7]。DEX可减少Bax表达,增加Bcl-2的产生起到抗凋亡的作用[17]。在本研究中,I/R使肺内CHOP通路被迅速活化,CHOP、GRP78蛋白及mRNA量明显提升;经DEX预处理后,CHOP的蛋白和mRNA水平下降显著,表明DEX经由CHOP凋亡通路干预I/R诱导的肺损伤,保护肺组织。
DEX缺血前预处理与缺血后处理效果相差甚大,缺血后处理效果不佳[18],这也是本实验采用缺血前预处理的原因。此外,实验发现,小鼠肺在I/R后,肺组织损伤及凋亡明显,表明在I/R早期,凋亡即参与肺损伤。本实验中,小鼠I/R肺经DEX干预后,UPR相关凋亡蛋白CHOP表达下调,而GRP78蛋白表达增加,证实了DEX通过抑制UPR-CHOP凋亡通路,改善I/R肺损伤。在I/R和非I/R性肺损伤模型中,DEX预处理获得良好的肺保护效果。DEX对缺血再灌注器官的保护作用是通过激活α2肾腺素能受体发挥效应,但是与受体A、B、C 3个亚型中的哪些亚型结合,需要进一步的研究。因此,我们可以推测,DEX抗I/R肺凋亡作用可能是多种途径、多种模式共同或相互作用的结果。
本文主要研究DEX对左肺缺血再灌注损伤后左肺组织的保护作用,右侧肺组织的变化另作专门研究,在此不做详述。
综上所述,右美托咪定预处理可减轻小鼠缺血/再灌注性肺损伤,其作用机制与抑制CHOP通路诱发的凋亡有关。
[参考文献]
[1]Weyker PD,Webb CA,Kiamanesh D,et al.Lung ischemia reperfusion injury: a bench-to-bedside review[J].Semin Cardiothorac Vasc Anesth,2013,17(1) :28-43.
[2]Carden DL,Granger DN.Pathophysiology of ischaemiareperfusion injury[J].J Pathol,2000,190(3) :255-266.
[3]Ng CS,Wan S,Yim AP.Pulmonary ischaemia-reperfusion injury: role of apoptosis[J].Eur Respir J,2005,25 (2) :356-363.
[4]Osorio F,Lambrecht B,Janssens S.The UPR and lung disease[J].Semin Immunopathol,2013,35(3) : 293-306.
[5]Kim R,Emi M,Tanabe K,et al.Role of the unfolded protein response in cell death[J].Apoptosis,2006,11 (1) :5-13.
[6]周俊辉,郝卯林,赵珊,等.姜黄素对小鼠肺缺血/再灌注损伤时细胞凋亡及CHOP的影响[J].中国应用生理学杂志,2013,29(4) :318-324.
[7]Ihmsen H,Saari TI.Dexmedetomidine,Pharmacokinetics and pharmacodynamics[J].Anaesthesist,2012,61 (12) :1059-1066.
[8]Zanotti G,Casiraghi M,Abano JB,et al.Novel critical role of TLR 4 in lung ischemia-reperfusion injury and edema[J].J Mol Histol,2011,42(6) :579-587.
[9]赵珊,马迎春,刘亚坤,等.姜黄素通过抑制内质网应激和JNK通路过度活化减轻小鼠肺缺血再灌注损伤[J].中国病理生理杂志,2013,29(2) : 308-313.
[10]周俊辉,王良荣,郝卯林,等.靶向小干扰RNA对小鼠肺缺血/再灌注损伤时细胞凋亡及CCAAT/增强子结合蛋白同源蛋白的作用[J].中华实验外科杂志,2013,30(8) :1608-1610.
[11]赵珊,刘亚坤,陈丹,等.缺血后不同再灌注时间点C57BL/6J鼠肺未折叠蛋白反应的变化及其意义[J].温州医学院学报,2013,43(2) :84-89.
[12]Xu C,Bailly-Maitre B,Reed JC.Endoplasmic reticulum stress: cell life and death decisions[J].J Clin Invest,2005,115(10) :2656-2664.
[13]Kim R,Emi M,Tanabe K,et al.Role of the unfolded protein response in cell death[J].Apoptosis,2006,11 (1) :5-13.
[14]邹晓静,杨乐,姚尚龙.CHOP/GADD153在血管紧张素II诱导心肌细胞凋亡中的表达及作用[J].中国病理生理杂志,2007,23(11) :2732-2736.
[15]刘友平,严冬梅,陈川宁,等.PI3K/Akt调控内质网应激对GRP78的诱导[J].中国病理生理杂志,2011,27 (4) :749-754.
[16]Schauble N,Lang S,Jung M,et al.BiP-mediated closing of the Sec61 channel limits Ca2+leakage from the ER[J].EMBO J,2012,31(15) :3282-3296.
[17]Bell MT,Puskas F,Bennett DT,et al.Dexmedetomidine,an alpha-2a adrenergic agonist,promotes ischemic tolerance in a murine model of spinal cord ischemia-reperfusion[J].J Thorac Cardiovasc Surg,2014,147(1) : 500-506.
[18]Gu J,Chen J,Xia P,et al.Dexmedetomidine attenuates remote lung injury induced by renal ischemia-reperfusion in mice[J].Acta Anaesthesiol Scand,2011,55(10) : 1272-1278.
通讯作者△林丽娜Tel:0577-55579095; E-mail: wzlinlina@ tom.com;王万Tel:0577-86689817; E-mail: wwt@ wzmc.edu.cn
*[基金项目]浙江省公益技术应用研究项目(No.2013C33168) ;浙江省中医药重点学科建设计划项目(No.2012-XK-A28)
[收稿日期]2014-10-27
[文章编号]1000-4718(2015)06-1093-06
[中图分类号]R363.2
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.022
