脂多糖持续刺激巨噬细胞的免疫学机制初探*
2015-03-30龙允麟余汝媛暨南大学生命科学技术学院生命与健康工程研究院广东广州510632
龙允麟,陈 颖,余汝媛,汪 洋(暨南大学生命科学技术学院生命与健康工程研究院,广东广州510632)
脂多糖持续刺激巨噬细胞的免疫学机制初探*
龙允麟,陈颖,余汝媛,汪洋△
(暨南大学生命科学技术学院生命与健康工程研究院,广东广州510632)
[摘要]目的:探讨巨噬细胞在脂多糖(LPS)的持续刺激下产生免疫抑制后的表型变化及对T细胞影响的分子机制。方法:蔗糖密度梯度离心法从全血中分离人外周血单个核细胞,结合磁珠细胞分选技术分选出单核细胞,体外诱导单核细胞分化为巨噬细胞,以未处理和IFN-γ处理为对照,对LPS处理48 h的巨噬细胞进行形态学观察、细胞表面分子(HLA-DR、CD14、CCR7、HLA-ABC及CD40)表达的检测和细胞因子(IL-10、IL-12、IL-6及TNF-α)分泌水平的检测。同时将LPS诱导的巨噬细胞与CD3+T细胞进行异体共培养,进一步观察巨噬细胞对T细胞增殖能力的影响。用实时荧光定量PCR验证Toll样受体4(TLR4)信号通路中的非MyD88依赖型途径相关分子的表达水平。结果: LPS处理48 h的巨噬细胞,抗原递呈能力(HLA-DR)下降,免疫抑制细胞因子IL-10升高,把LPS诱导的巨噬细胞与异体T细胞共培养6 d,其促进CD8+T细胞增殖的能力较弱。实时荧光定量PCR结果显示LPS持续刺激下巨噬细胞的TRIF、IRF3和CIITA均呈下调状态。结论:持续LPS处理巨噬细胞48 h后,巨噬细胞呈现一种免疫抑制的状态,且其刺激CD8+T细胞增殖的能力减弱,这种状态与非MyD88依赖型TLR4信号通路受损有关。
[关键词]巨噬细胞;脂多糖;免疫抑制表型; Toll样受体4
[修回日期]2015-05-04
Immunological mechanism of long-term stimulation by LPS in macrophages
LONG Yun-lin,CHEN Ying,YU Ru-yuan,WANG Yang
(Institutes of Life and Health Engineering,College of Life Science and Technology,Jinan University,Guangzhou 510632,China.E-mail: 373506762@ qq.com)
[ABSTRACT]AIM: To investigate the molecular mechanism and the immunosuppressive phenotype of macrophages under long-term exposure to lipopolysaccharide (LPS).METHODS: We used Ficoll-Hypaque density gradient centrifugation combined with MicroBeads Separation Kits to separate peripheral blood mononuclear cells from human blood,and then induced the monocytes into macrophages.We observed the morphology of the macrophages by treating the cells with LPS for 48 h,in comparison with a negative control and IFN-γ treatment.ELISA was used to detect the levels of cytokines,such as IL-10,IL-12,IL-6 and TNF-α,and flow cytometry was used to detect the expression of the surface molecules (HLA-DR,CD14,CCR7,HLA-ABC and CD40).To observe the effect of macrophage on T cell proliferation,co-culture experiment was carried out for 6 d.Real-time PCR was used to validate the expression levels of molecules related to MyD88-independent pathway in Toll-like receptor 4 (TLR4) signal pathway.RESULTS: The antigen-presenting ability of the macrophages was reduced and the IL-10 expression level was increased after the cells were treated with LPS for 48 h.We observed a poor proliferative capacity of CD8+T cells after co-culturing of LPS-induced macrophages with CD3+T cells for 6 d.The results of real-time PCR indicated that TRIF,IRF3 and CIITA were down-regulated in LPS-induced macrophages.CONCLUSION: We successfully established a macrophage model in vitro and observed that LPS-induced macrophages into an immunosuppressive phenotype with poor CD8+T cell proliferative capacity,in which MyD88-independent TLR4 signaling pathway was impaired.
[KEY WORDS]Macrophage; Lipopolysaccharides; Immunosuppressive phenotype; Toll-like receptor 4
巨噬细胞(macrophage,Mφ)由骨髓前体细胞分化而来,作为抗原递呈细胞,它在固有和适应性免疫反应均发挥关键作用[1-2]。作为一种可塑性极强的调节细胞,它参与机体各种功能调控,如宿主细胞防御调节、组织修复和免疫功能调节等[2-3]。
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性细菌外膜的主要组成部分。它不仅可在宿主机体抗击病原体时引发急性免疫反应,还可以帮助建立适应性免疫反应。在自然界中,不同细菌的LPS的具体结构和组成有差异,用不同细菌来源的LPS刺激巨噬细胞后,虽然免疫应答有差异,但是总体趋势是一致的。另外,作为Toll样受体(Toll-like receptor,TLR)的配体,LPS既可诱导细胞表面主要组织相容性复合体(major histocompatibility complex)的表达上调,又能促进免疫耐受细胞因子(如IL-10)的分泌,并且抑制调节型T细胞[4]。
已经有报道观察到生物体在受LPS刺激后,当二次刺激时会通过下调TLR4(Toll-like receptor 4,TLR4)而实现LPS耐受这一现象[5]。TLR4通路是生物体固有免疫系统识别病原相关分子模式(pathogen-associated molecular pattern,PAMP)的主要受体,其启动的信号通路还能调控适应性免疫应答[6],它被分为髓样分化因子88(myeloid differentiation factor 88,MyD88)依赖和MyD88非依赖途径。有报道发现MyD88缺陷小鼠对LPS刺激几乎没有反应,说明TLR4-MyD88通路是LPS反应所必须的。
在肠道微环境中,巨噬细胞在外来抗原的持续刺激下产生的免疫耐受,其分泌及对T细胞的效应发生何种变化且这些变化的分子机理仍需进一步探索。因此,本研究进一步探讨人巨噬细胞在LPS持续刺激下产生免疫抑制后的表型变化及其对T细胞的影响。
材料和方法
1细胞和样本血液
人血液样本及相应细胞取自广东省血液中心。
2主要试剂
RPMI-1640培养基、胎牛血清、胰酶、非必需氨基酸、HEPES、L-谷氨酰胺、丙酮酸钠、CFSE细胞增殖检测试剂盒、Trizol试剂购自Invitrogen; LPS、干扰素γ(interferon-γ,IFN-γ)、青霉素和链霉素购自Sigma;粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)、巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)、白细胞介素2(interleukin-2,IL-2)和CD3单克隆抗体(Orthoclone OKT3)购自PeproTech;人白细胞介素1β(interleukin-1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor,TNF-α)和人白细胞介素10 (interleukin-10,IL-10)均为BioLegend产品;人白细胞介素6(interleukin-6,IL-6)购自达科为公司。
人淋巴细胞分离液购自天津川页生物制品公司;人Monocyte Isolation Kit II和CD3/CD14/CD4 MicroBeads购自美天妮; RT reagent Kit为TaKaRa产品; SsoFast EvaGreen Supermix为Bio-Rad产品; microElute Total RNA Kit购自Omega。
藻红蛋白(P-phycoerythrin,PE)标记的人CD163抗体(PE-CD163)、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的人CD206抗体(FITC-CD206)、PE-CD14抗体、Alexa488-CD86抗体、PE-CD4抗体、FITC-HLA-DR抗体、PE-CD25抗体和PE-CD69抗体均购自BioLegend。
其它生化试剂均为进口分装或国产分析纯。所用引物由上海吉凯基因技术有限公司根据设计合成,见表1。

表1 引物序列Table 1.Sequences of the primers
3主要方法
3.1从人的外周血中分离单个核细胞(peripheral blood mononuclear cell,PBMC)根据正常人外周血血红细胞和白细胞的沉降速度不同,通过自然沉降先把外周血白细胞层分离出来,在有抗凝剂的试管中混匀,37℃静置60 min,悬液可分3层,上层为淡黄色血浆,底层为红细胞,在紧贴红细胞层上有一呈灰白色的白细胞层,吸出白细胞层,按1∶1的比例用含有1%肝素钠的无血清RPMI-1640培养基稀释;再用人淋巴细胞分离液,通过Ficoll-hypaque密度梯度离心法从白细胞层中分离得到单个核细胞,用PBS重悬,细胞计数,评价单个核细胞的得率。
3.2从单个核细胞中用磁珠分选单核细胞(负选)
将得到的单个核细胞悬液在4℃、300×g离心10 min,去掉上清;每30 μL Running Buffer重悬1×107细胞,加入10 μL FcR Blocking Reagent抗体封闭,加入10 μL Biotin-Antibody Cocktail抗体,4℃均匀孵育10 min;然后加入Running Buffer,再加入20 μL的Anti-Biotin MicroBeads轻柔混匀,4℃均匀孵育15 min;加入1mL Running Buffer稀释后4℃、300×g离心除去上清;用Running Buffer重悬细胞后加到洗涤好的磁珠柱子中分离,收集穿透液,离心得到单核细胞(monocyte),用无血清培养基重悬,通过流式检测分析分选纯度。
3.3体外诱导单核细胞分化成巨噬细胞把分选得到的monocyte按1×106cells/well铺至24孔板,每孔用1 mL RPMI-1640完全培养基培养(含10% Human AB血清,1%双抗,10 mol/L Hepes,1×非必需氨基酸,1 mol/L丙酮酸钠,2 mol/L L-谷氨酰胺),外加20 μg/L的MCSF刺激5 d。培养16 h后,用含0.1% FBS的PBS轻柔地洗涤细胞1次,然后继续用新鲜的RPMI-1640完全培养基培养5 d(含20 μg/L MCSF)。5 d后,单核细胞分化至巨噬细胞状态,显微镜下观察细胞形态。
3.4巨噬细胞与异体淋巴细胞共培养实验将培养5 d的巨噬细胞加入特定的刺激(LPS/IFN-γ/LPS+ IFN-γ) 48 h后,把富集好的CD3+T细胞按巨噬细胞∶T细胞比例为1∶5的细胞数量比进行共培养。共培养的新鲜培养基为含10%人血清的RPMI-1640,并加入0.1 U/L的IL-2和100 μg/L的OKT3。共培养5 d后,轻柔吸取培养上清,收获半贴壁的T细胞,流式上机分析。
3.5 CFSE染色细胞增殖检测,Annexin V-FITC细胞凋亡检测及细胞因子IL-1β、TNF-α和IL-10的ELISA检测根据试剂盒中提供的实验操作方法进行检测。
4统计学处理
采用SPSS 11.0软件处理数据,数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,对照组与其它各组比较采用LSD法,以P <0.05为差异有统计学意义。
结果
1 LPS刺激的巨噬细胞(LPS-Mφ) 48 h后抗原递呈能力下降
建立巨噬细胞体外诱导模型。首先用PE抗人CD14流式抗体检测分离得到纯度较高的单核细胞,图1A中单核细胞纯度从分离前的13.3%达到分离后的95%,表明单核细胞被成功富集。其次将分离出来的单核细胞经过MCSF诱导分化形成巨噬细胞。
为了研究LPS刺激对巨噬细胞的影响,我们选取人类抗原递呈能力相关分子HLA-DR、HLAABC[7]及免疫反应能力的相关分子表面抗原CD40、CC类趋化因子受体7(chemokine CC motif receptor 7,CCR7)进行检测。图1B和图1C中LPS-Mφ的HLA-DR表达下调,表明巨噬细胞经过LPS刺激48 h后抗原递呈能力下降,而作为同样的炎症因子IFN-γ-Mφ却无明显变化。CD14和CD40分别作为单核细胞及巨噬细胞的标志物也未出现明显变化。巨噬细胞和树突状细胞(dendritic cell,DC)在趋化因子CC配体21 (chemokine CC motif ligand 21,CCL21)的招募下能进入淋巴结与T细胞相互作用受CCR7的依赖[8]。此处LPS-Mφ的CCR7表达下调,间接表明LPS-Mφ响应CCL21的召募参与免疫反应的能力减弱。
2 LPS长时间刺激的巨噬细胞无凋亡发生
为了验证LPS处理后巨噬细胞的功能减弱不是由于LPS引起巨噬细胞凋亡所致,我们对LPS及IFN-γ处理过的巨噬细胞进行Annexin V-PI凋亡检测。从图2可知,由LPS及IFN-γ长时间刺激的巨噬细胞并无凋亡发生,说明了LPS-Mφ的HLA-DR与CCR7的表达下调不是由于凋亡所致。
3不同时点LPS-Mφ的细胞表面分子HLA-DR和CCR7的动态变化
体外诱导单核细胞至巨噬细胞至第5天时,用LPS和IFN-γ分别刺激巨噬细胞0 h~48 h,分别收集0 h、4 h、24 h和48 h时点的巨噬细胞,流式检测其表面分子的动态表达情况。如图3所示,受LPS刺激的巨噬细胞,在0 h~4 h,HLA-DR有所升高,24 h后渐降,表明抗原递呈能力是一个先升后降的动态变化。而IFN-γ-Mφ却是一直上升,CCR7也有与HLA-DR相类似的结果,说明促炎症因子IFN-γ能持续促进巨噬细胞的抗原递呈能力,而持续的LPS诱导却能导致巨噬细胞抗原递呈能力下降。
4不同时点LPS-Mφ分泌的细胞因子的动态变化

Figure 1.The continuous stimulation of LPS decreased the antigen-presenting ability of macrophages (Mφ).A: Ficoll-Hypaque density gradient centrifugation separated peripheral blood mononuclear cells (PBMC) from blood and anti-CD14 MicroBeads Separation Kits was used to enrich the monocytes from PBMC.B: the monocytes were induced into Mφ and then treated with LPS or IFN-γ for 48 h.Antigen presentation-associated markers HLA-ABC,HLA-DR and CCR7 were detected.CD14 and CD40 were used as markers for monocytes and Mφ.C: the mean fluorescent intensity (MFI) of B was measured by flow cytometer.Mean±SD.n=3.*P<0.05,**P<0.01 vs LPS-Mφ.图1 LPS持续刺激巨噬细胞后导致抗原递呈能力下降
巨噬细胞的免疫反应都会伴随细胞因子分泌的变化,为了进一步研究LPS刺激后不同时点巨噬细胞分泌的细胞因子是否有对应的变化情况,我们将巨噬细胞用LPS和IFN-γ处理后收集其上清,用ELISA方法检测不同时点细胞因子IL-10、IL-6、TNF-α和IL-1β的分泌变化。结果显示: LPS-Mφ分泌的IL-10从4 h至24 h一直升高,IFN-γ-Mφ则保持低下,表明48 h的LPS-Mφ是巨噬细胞的一种免疫抑制亚型。LPS-Mφ分泌的IL-1β和TNF-α从4 h至48 h先升后降,IFN-γ-Mφ则一直保持在较低水平,在48 h处上调。LPS-Mφ和IFN-γ-Mφ分泌的IL-6的变化规律与前几种细胞因子的变化不一样。以上结果表明同为促炎症因子的IFN-γ和LPS对巨噬细胞的刺激后却有着不同的表型变化及分子机理,短时间的LPS刺激能促进巨噬细胞的免疫反应,而持续刺激却诱导其产生免疫抑制,见图4。
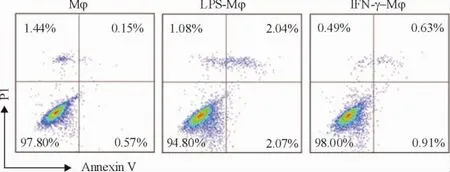
Figure 2.The continuous stimulation of LPS and IFN-γ for 24 h did not induce apoptosis of macrophages.图2巨噬细胞在LPS和IFN-γ刺激24 h后无凋亡发生

Figure 3.The dynamic changes of HLA-DR and CCR7 of macrophages treated with LPS or IFN-γ from 0 h to 48 h.Mean±SD.n=3.**P<0.01 vs LPS-Mφ.图3不同刺激时间LPS-Mφ和IFN-γ-Mφ的HLA-DR和CCR7的动态变化
5排除IL-10自分泌引起HLA-DR的高表达
LPS处理后巨噬细胞的IL-10的表达水平持续升高,表示IL-10可能存在自分泌的形式抑制巨噬细胞的免疫应答。为了验证得到免疫抑制亚型的可靠性,需要排除HLA-DR的表达下调是来自内分泌的IL-10作用。我们利用anti-IL-10R特异性结合细胞外的IL-10,从而阻止IL-10的自分泌途径。图5中,在巨噬细胞的培养基加入不同浓度的IL-10细胞因子,48 h后流式检测,100 μg/L的IL-10会引起HLADR的表达下调,用5 mg/L的anti-IL-10R抗体进行封闭,可见HLA-DR表达上升,封闭效果明显。即使在封闭了IL-10的情况下,LPS-Mφ的HLA-DR下调且不能恢复。这结果说明LPS-Mφ引起HLA-DR低表达并不是由于巨噬细胞自分泌IL-10所引起的,而是由于LPS本身刺激作用所产生的。
6 LPS-Mφ对T细胞增殖的影响
在机体环境中,巨噬细胞能够递呈抗原激活T细胞,而处于免疫抑制的巨噬细胞却不能实现抗原递呈[9]。经过以上的实验确实表明LPS的持续刺激确实能诱导巨噬细胞产生免疫抑制表型,于是我们进一步探索LPS的持续刺激能否抑制巨噬细胞对T细胞的作用。我们先利用淋巴细胞分离液结合CD3+T细胞磁珠正选试剂盒,从人外周血分离得到纯度较高的CD3+T细胞,再用抗人的CD3流式抗体检测其纯度,可达97%左右,见图6。
我们以DC作为阳性对照,把不同处理的巨噬细胞和DC分别与CD3+T按1∶5混合培养,6 d后流式细胞仪检测T细胞的CFSE荧光强度和CD4[T细胞是由CD4阳性的辅助性T细胞(helper T cell,简称Th细胞)和CD4阴性、CD8阳性的T杀伤细胞组成]的表达情况,进而观察LPS处理后的巨噬细胞是否对T细胞有激活效应,本实验通过检测T细胞的增殖情况来评价其活化程度。如图6所示,巨噬细胞与CD3+T细胞相互作用都能够激活并促进其增殖,而LPS-Mφ刺激CD4-/CD8+T细胞增殖为24%,比Medium-Mφ(40%)和IFN-γ-Mφ(50%)少。综上所述,LPS-Mφ刺激CD8+T细胞的增殖能力较弱。此处DC作为一个阳性对照,旨在更好地说明不同条件下的刺激对T细胞的促增殖情况。
7 LPS持续刺激导致TLR4信号通路关键调控基因表达受损
进一步探索LPS持续刺激导致巨噬细胞免疫抑制的分子机理,已经有文献表明LPS导致巨噬细胞免疫抑制的原因是通过下调TLR4通路而实现的,由于TLR4信号通路分为MyD88依赖性和MyD88非依赖性通路两种,我们对MyD88非依赖途径的相关调控分子TRIF、IRF3、CIITA和SATA1进行real-time PCR检测,结果表明这4个调控因子的表达均降低。说明LPS持续刺激巨噬细胞是通过损伤非依赖于MyD88的TLR4信号通路而实现免疫抑制的,见图7。
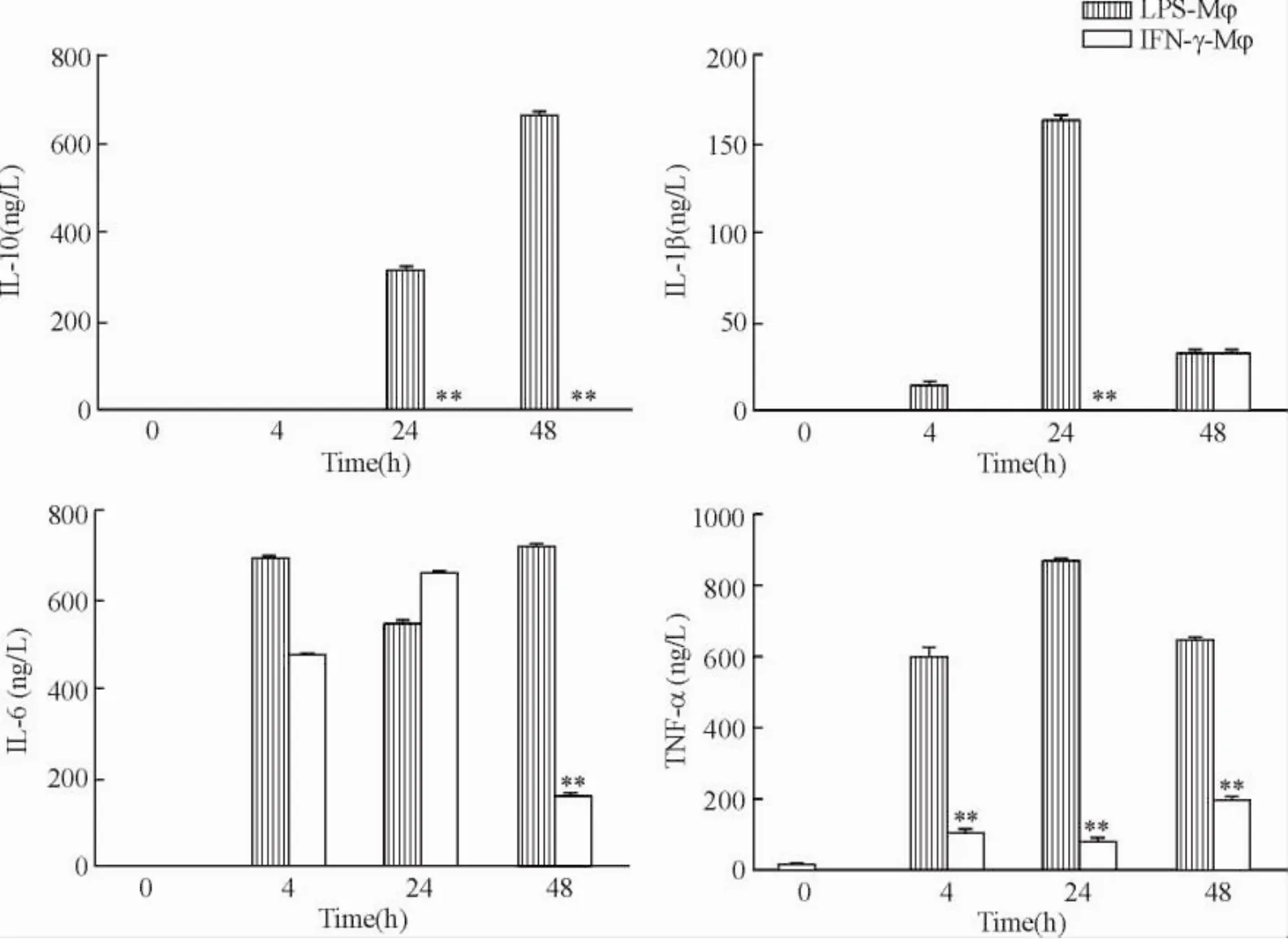
Figure 4.The dynamic change of IL-10,IL-6,TNF-α and IL-1β secretion in macrophages treated with LPS or IFN-γ from 0 h to 48 h.Mean±SD.n=3.**P<0.01 vs LPS-Mφ.图4不同刺激时间LPS-Mφ和IFN-γ-Mφ的IL-10、IL-6、TNF-α和IL-1β分泌的动态变化
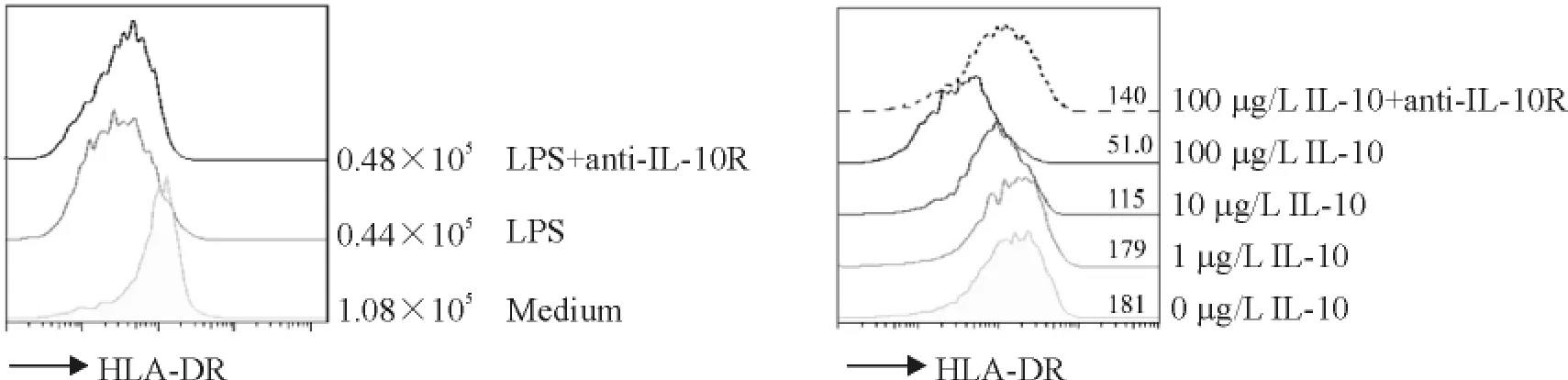
Figure 5.LPS decreased HLA-DR expression in macrophages not through IL-10 paracrine pathway.图5 IL-10受体封闭后LPS刺激巨噬细胞的HLA-DR表达情况以及不同浓度IL-10对巨噬细胞HLA-DR表达的影响
讨论
1在对巨噬细胞的刺激中,LPS和IFN-γ的作用效果不同
在免疫系统中,正常巨噬细胞是一种多功能的免疫细胞,在天然免疫中发挥吞噬病原体和分泌炎性因子的作用,又可以作为抗原递呈细胞在获得性免疫中活化T淋巴细胞。巨噬细胞对于炎症刺激的反应一直以来都是研究的热点,其分子机制也得到很好的阐述。已经有报道表明在小鼠腹腔注射LPS之后,第2次注射小鼠机体会产生免疫抑制[9-10],并且这种抑制是通过下调TLR4信号通路实现的[5],本研究在此基础上进一步探索LPS导致巨噬细胞免疫抑制后对T细胞的影响及其分子机理。我们对巨噬细胞刺激48 h后,LPS-Mφ的HLA-DR降低,IL-10升高,表明抗原递呈能力减弱,推断细胞处于一种免疫抑制状态。由于LPS-Mφ在48 h分泌的IL-10升高,不可避免地会联想到是否由于IL-10的自分泌作用于巨噬细胞,使其HLA-DR表达下降,基于此思考,我们的研究中用IL-10R封闭实验排除了此点疑虑。另外凋亡实验也表明LPS导致的HLA-DR的下调不是由于LPS诱导凋亡导致。
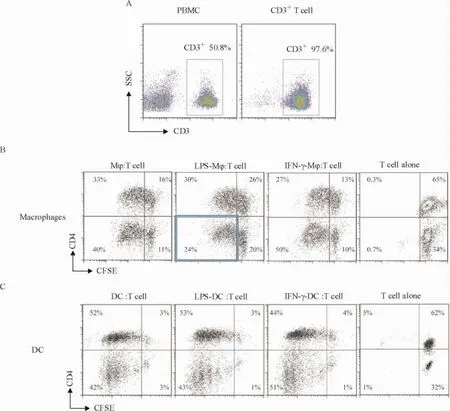
Figure 6.The continuous stimulation of LPS on macrophages decreased the proliferation of CD4-/CD8+T cells in co-culture.A: anti-CD3 MicroBeads Separation Kits was used to enrich the CD3+T cells from PBMC by flow cytometer; B: macrophages were treated with LPS or IFN-γ and co-cultured with CD4-/CD8+T cells for 6 d,then the proliferation of T cells was determined by CFSE assay; C: DC was set as a positive control as compared to macrophages.图6 LPS刺激后的巨噬细胞对T细胞的增殖影响
2 LPS刺激体现的是先激活后抑制的动态变化
CCR7是淋巴细胞和DC等迁移进入次级淋巴器官T细胞区域的主要调节者,在这里表达升高间接表明巨噬细胞响应趋化因子分泌,一定程度上表明巨噬细胞的活化程度。LPS刺激在0 h、4 h、24 h 和48 h过程中,HLA-DR和CCR7表现为先升后降,在前24 h,巨噬细胞响应LPS的刺激,HLA-DR和CCR7升高,但从24 h开始,它们二者开始下降。这种结果表明,LPS在24 h内的刺激会激活巨噬细胞,但超过24 h的刺激后,巨噬细胞逐渐产生一种免疫抑制表型。
3 LPS导致巨噬细胞抗原递呈能力下降及TLR4信号受阻
LPS-Mφ与CD3+T细胞的混合淋巴细胞培养中,CD4+T细胞的增殖并未受到LPS-Mφ的影响,LPS-Mφ仅对CD8+T细胞的促增殖能力较弱。表明LPS长时间刺激巨噬细胞能够抑制机体内部杀伤性T细胞的增殖,降低机体对病原体的防御。
为了验证LPS诱导的巨噬细胞免疫抑制表型的产生机制,有文献表明LPS是一个经典的与TLRs的配体[11]且会引起免疫反应,于是我们在RNA水平上验证了MyD88依赖和非依赖的2条经典TLR4的信号通路。此外,MyD88非依赖途径在肿瘤相关巨噬细胞缺损中响应TLR的研究亦有报道[12]。我们在巨噬细胞中验证了IFR3/STAT1信号通路,发现IFR3的表达显著下降,而且,它们的直接下游调控蛋白CIITA也显著下调,此蛋白直接调控MHCⅡ类分子的表达[13]。结合前面的结果,提示LPS-Mφ的HLA-DR表达下降,有可能激活的是IFR3信号通路的MyD88非依赖途径。
综上所述,本研究进一步阐明了持续的LPS刺激能够通过阻碍巨噬细胞的TLR4信号通路,从而促使巨噬细胞产生免疫抑制表型,减弱了巨噬细胞对CD8阳性T细胞的活化及促增殖作用。在机体环境受到外来病原体入侵或者肿瘤发生时,DC和巨噬细胞都有着抗击肿瘤、病原体和抗原递呈的作用,成熟DC已经在多种癌症中被作为细胞免疫治疗的疫苗[14-16],然而,与DC有相同祖先的巨噬细胞,它的抗原递呈能力和激活T细胞的信号能力却甚少有人关注。本研究进一步探索巨噬细胞的免疫应答分子机理,为抗炎症及抗肿瘤药物研发提供依据。
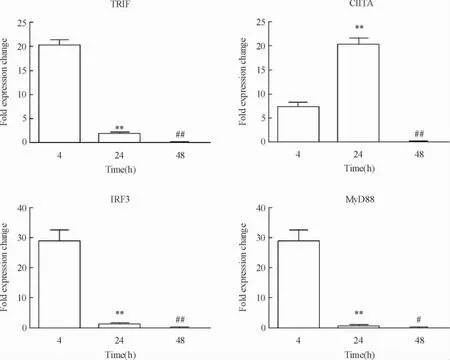
Figure 7.The continuous stimulation of LPS impaired TLR4 pathway in an MyD88-independent manner in macrophages.Macrophages were treated with LPS for 48 h and then the mRNA levels of TRIF,CIITA,IRF3 and MyD88 were detected by real-time PCR.Mean±SD.n=3.**P<0.01 vs 4 h;#P<0.05,##P<0.01 vs 24 h.图7 LPS持续刺激能损伤非MyD88依赖性的TLR4信号通路
[参考文献]
[1]Mantovani A,Sica A,Sozzani S,et al.The chemokine system in diverse forms of macrophage activation and polarization[J].Trends Immunol,2004,25 (12) : 677-686.
[2]Biswas S K,Mantovani A.Macrophage plasticity and interaction with lymphocyte subsets: cancer as a paradigm [J].Nat Immunol,2010,11(10) : 889-896.
[3]Banchereau J,Briere F,Caux C,et al.Immunobiology of dendritic cells[J].Annu Rev Immunol,2000,18: 767-811.
[4]Pasare C,Medzhitov R.Toll pathway-dependent blockadeof CD4+CD25+T cell-mediated suppression by dendritic cells[J].Science,2003,299(5609) : 1033-1036.
[5]Nomura F,Akashi S,Sakao Y,et al.Cutting edge: endotoxin tolerance in mouse peritoneal macrophages correlates with down-regulation of surface toll-like receptor 4 expression[J].J Immunol,2000,164(7) : 3476-3479.
[6]罗兵,李涛,徐元宏.Toll样受体的信号转导及抗感染免疫研究进展[J].免疫学杂志,2011,27(2) : 165-169.
[7]Trombetta ES,Mellman I.Cell biology of antigen processing in vitro and in vivo[J].Annu Rev Immunol,2005,23:975-1028.
[8]Tateyama M,Fujihara K,Misu T,et al.CCR7+myeloid dendritic cells together with CCR7+T cells and CCR7+macrophages invade CCL19+nonnecrotic muscle fibers in inclusion body myositis[J].J Neurol Sci,2009,279(1-2) : 47-52.
[9]Poltorak A,He X,Smirnova I,et al.Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene[J].Science,1998,282 (5396) : 2085-2088.
[10]Qureshi ST,Lariviere L,Leveque G,et al.Endotoxin-tolerant mice have mutations in Toll-like receptor 4 (Tlr4) [J].J Exp Med,1999,189(4) :615-625.
[11]Hoshino K,Takeuchi O,Kawai T,et al.Cutting edge: Toll-like receptor 4 (TLR4) -deficient mice are hyporesponsive to lipopolysaccharide: evidence for TLR4 as the Lps gene product[J].J Immunol,1999,162(7) : 3749-3752.
[12]Iwasaki A,Medzhitov R.Toll-like receptor control of the adaptive immune responses[J].Nat Immunol,2004,5 (10) :987-995.
[13]Banerjee S,Halder K,Bose A,et al.TLR signaling-mediated differential histone modification at IL-10 and IL-12 promoter region leads to functional impairments in tumorassociated macrophages[J].Carcinogenesis,2011,32 (12) :1789-1797.
[14]Li H,Hong S,Qian J,et al.Cross talk between the bone and immune systems: osteoclasts function as antigen-presenting cells and activate CD4+and CD8+T cells[J].Blood,2010,116(2) :210-217.
[15]Tuyaerts S,Aerts JL,Corthals J,et al.Current approaches in dendritic cell generation and future implications for cancer immunotherapy[J].Cancer Immunol Immunother,2007,56(10) :1513-1537.
[16]Kawai T,Takeuchi O,Fujita T,et al.Lipopolysaccharide stimulates the MyD88-independent pathway and results in activation of IFN-regulatory factor 3 and the expression of a subset of lipopolysaccharide-inducible genes[J].J Immunol,2001,167(10) :5887-5894.
通讯作者△Tel: 020-85227039; E-mail: 373506762@ qq.com
*[基金项目]国家973项目(No.2011CB910701) ;教育部博士点基金资助项目(No.20104401120008)
[收稿日期]2015-03-10
[文章编号]1000-4718(2015)06-1048-09
[中图分类号]R392.32
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.015
