纳米金逆转人肝癌耐药细胞HepG2/ADM耐药性的实验研究*
2015-03-30邵明涛潘运龙赵晓旭暨南大学附属第一医院胃肠外科医学院组织胚胎学教研室附属第一医院体部伽玛刀中心广东广州506
邵明涛,潘运龙,△,覃 莉,巫 青,丁 晖,赵晓旭(暨南大学附属第一医院胃肠外科,医学院组织胚胎学教研室,附属第一医院体部伽玛刀中心,广东广州506)
纳米金逆转人肝癌耐药细胞HepG2/ADM
耐药性的实验研究*
邵明涛1,潘运龙1,3△,覃莉2,巫青1,丁晖1,赵晓旭3
(暨南大学1附属第一医院胃肠外科,2医学院组织胚胎学教研室,3附属第一医院体部伽玛刀中心,广东广州510632)
[摘要]目的:探讨纳米金(gold nanoparticles,GNPs)对人肝癌阿霉素(adriamycin,ADM)耐药细胞株HepG2/ADM的阿霉素耐药性的逆转作用及其可能机制。方法: MTT比色法检测GNPs对人肝癌细胞株HepG2及其耐药细胞株HepG2/ADM对不同浓度ADM耐药性的影响;流式细胞术检测GNPs处理后ADM(2 mg/L)对HepG2/ADM细胞凋亡的影响;紫外分光光度计检测GNPs处理后HepG2/ADM细胞内ADM的药物浓度;谷胱甘肽(GSH)检测试剂盒(DTNB法)检测GNPs处理后HepG2/ADM细胞GSH的含量。结果: GNPs处理前HepG2和HepG2/ADM细胞对不同浓度ADM的半数抑制浓度分别为: (9.16±2.03) mg/L、(29.46±1.73) mg/L,耐药倍数为3.22; GNPs处理后HepG2/ADM细胞对不同浓度ADM的半数抑制浓度为(15.18±0.85) mg/L,逆转指数为1.95。GNPs+ ADM组HepG2/ADM的细胞凋亡率明显高于单独ADM组(P<0.05)。HepG2/ADM组细胞内的ADM含量低于HepG2组细胞内的ADM含量(P<0.01) ; GNPs处理后HepG2/ADM细胞内的ADM含量较处理前明显增加(P<0.01)。HepG2/ADM组细胞内GSH含量高于HepG2组(P<0.01) ; GNPs处理后HepG2/ADM细胞内的GSH含量较处理前明显降低(P<0.05)。结论:纳米金具有逆转耐药肝癌细胞对阿霉素耐药性的作用,并且可以降低细胞内GSH含量及增加胞内化疗药物浓度。
[关键词]纳米金;阿霉素;谷胱甘肽;耐药性;肝细胞癌
[修回日期]2015-03-27
Effect of gold nanoparticles on reversing adriamycin resistance of human hepatocellular carcinoma HepG2/ADM cells
SHAO Ming-tao1,PAN Yun-long1,3,QIN Li2,WU Qing1,DING Hui1,ZHAO Xiao-xu3
(1Gastrointestinal Surgery,The First Affiliated Hospital,2Department of Histology&Embryology,School of Medicine,3Body Gamma Knife Center,The First Afftiliated Hospital,Jinan University,Guangzhou 510632,China.E-mail: tpanyl@ jnu.edu.cn)
[ABSTRACT]AIM: To investigate whether gold nanoparticles (GNPs) reverses adriamycin (ADM),resistance of human hepatocellular carcinoma drug-resistant cell line HepG2/ADM and to explore the potential mechanism.METHODS: The sensitivities of HepG2 cells and HepG2/ADM cells to ADM were tested by MTT assay before and after GNPs pretreatment.The apoptotic rate was examined by flow cytometry.The concentration of ADM in HepG2/ADM or HepG2 cells was determined by ultraviolet-visible spectrophotometer.The content of glutathione (GSH) in HepG2/ADM or HepG2 cells by DTNB method.RESULTS: The half maximal inhibitory concentrations (IC50) of ADM for HepG2/ADM cells were(29.46±1.73) mg/L and (15.18±0.85) mg/L before and after GNPs pretreatment,respectively.The IC50of ADM for HepG2 cells was (9.16±2.03) mg/L before pretreatment.The apoptotic rate in GNPs+ ADM group was higher than that in ADM group (P<0.05).The concentration of ADM in HepG2/ADM group was lower than that in HepG2 group (P<0.01).After GNPs pretreatment,the concentration of ADM in HepG2/ADM cells was higher than that before pretreatment.The content of GSH in HepG2/ADM group was higher than that in HepG2 group (P<0.01).After GNPs pretreatment,the content of GSH in the HepG2/ADM cells was lower than that before pretreatment.CONCLUSION: Gold nanoparticles can reverse ADM resistance of human hepatocellular carcinoma drug-resistant cell line HepG2/ADM,reduce the content of GSH and increase the concentration of ADM in HepG2/ADM cells.
[KEY WORDS]Gold nanoparticles; Adriamycin; Glutathione; Drug resistance; Hepatocellular carcinoma
化疗是肿瘤,尤其是晚期肿瘤治疗的重要手段之一,然而由于肝癌细胞多药耐药性(multidrug resistance,MDR)的存在,化疗效果并不理想[1]。因此,对MDR机制的研究变得尤为重要。近年来,人们对MDR的发生机制、检测手段及其逆转的研究取得了较大进展。目前认为,MDR的主要机制与肿瘤细胞对抗肿瘤药物的主动外排作用密切相关[2]。纳米金(gold nanoparticles,GNPs)是金的微小颗粒,在肿瘤治疗方面具有很大的潜能[3]。我们前期研究表明纳米金不仅具有抗肿瘤血管生成[4]及诱导肿瘤血管正常化[5-6]的作用,还可以通过减少肿瘤细胞对化疗药物的主动外排或增加化疗药物的摄入而发挥增敏作用[7]。那么,纳米金是否可以逆转肿瘤细胞的耐药性,本研究旨在探讨纳米金能否逆转人肝癌阿霉素(adriamycin,ADM)耐药细胞HepG2/ADM对ADM耐药性及可能的机制。
材料和方法
肝癌细胞株HepG2及对ADM耐药的肝癌细胞株HepG2/ADM由本实验室保存。RPMI-1640培养液、L-谷氨酰胺、青霉素和链霉素均购自HyClone; ADM购自浙江海正药业股份有限公司;胎牛血清和胰蛋白酶购自Gibco; MTT和DMSO购自Sigma; AnnexinⅤ-FITC/碘化丙啶(propidium iodide,PI)细胞凋亡试剂盒和细胞周期检测试剂盒均购自南京凯基生物科技发展有限公司;谷胱甘肽(glutathione,GSH)检测试剂盒购自南京建成生物工程研究所。紫外可见分光光度计购自Perkin Elmer;酶联免疫检测仪购自Bio-Rad;相关酶标板购自Costar。
2主要方法
2.1细胞培养HepG2细胞株用含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养液,置于37℃、CO2体积分数为5%的饱和湿度条件下培养; HepG2/ADM细胞在上述培养条件下,加入ADM(1.0 mg/L)培养,以维持其耐药性,取对数生长期细胞进行实验。
2.2 MTT法检测GNPs对HepG2/ADM细胞耐药性的逆转作用取对数生长期的HepG2、HepG2/ADM细胞,0.25%胰蛋白酶消化成单细胞悬液,以1× 107/L的细胞密度接种于96孔板中,每孔100 μL。细胞培养24 h后,吸出上清液,MTT法进行检测。实验分成HepG2组、HepG2/ADM组和GNPs (10 nmol/L)+ HepG2/ADM组。每组设3个重复孔。细胞培养24 h后,HepG2组、HepG2/ADM组分别加入不同浓度的ADM(0.1、1、5、25、50、100、150、200 mg/L),GNPs+ HepG2/ADM组加入GNPs预处理1 h后去掉上清液,分别加入不同质量浓度的ADM(0.1、1、5、25、50、100、150、200 mg/L) ;细胞继续培养24 h,各孔加入MTT溶液(5 g/L) 20 μL继续培养4 h,弃去上清,每孔加入150 μL二甲基亚砜,在测量波长570 nm、参比波长630 nm处测吸光度(A)值。细胞增殖抑制率(inhibitory rate,IR)=(1-药物组A 值/对照组A值)×100%。以ADM浓度为横坐标、IR为纵坐标绘制药物浓度-IR曲线,求出回归方程,得到半数抑制浓度(half maximal inhibitory concentration,IC50)值,计算耐药倍数(resistant factor,RF)和逆转指数(reversal index,RI)。RF=耐药细胞IC50值/非耐药细胞IC50值,RI=GNPs处理前耐药细胞IC50值/GNPs处理后耐药细胞IC50值。
2.3流式细胞术检测GNPs处理后ADM对HepG2/ADM细胞凋亡率的影响取对数生长期HepG2/ADM细胞,调整细胞密度为1×108/L,接种于6孔板中,每孔2 mL;细胞贴壁生长24 h后,分为对照(control)组、GNPs(10 nmol/L)、ADM(2.0 mg/L)和GNPs+ ADM组;药物作用24 h后,用胰酶消化细胞并收集于试管中,PBS洗涤细胞3次。按AnnexinⅤ-FITC/PI细胞凋亡试剂盒说明书提供的方法,每管样品中分别加入200 μL binding buffer重悬细胞后,加入5 μL AnnexinⅤ-FITC和5 μL PI,轻轻混匀,避光室温反应15 min,上流式细胞仪检测细胞凋亡率。
2.4紫外分光光度计检测GNPs处理后HepG2/ADM细胞内积聚的ADM量在室温(25℃)条件下配制浓度为50 mg/L的ADM溶液,用紫外分光光度计于200~800 nm波长范围扫描,结果显示在480 nm处有最大吸收峰,配制8个不同浓度的ADM标准溶液,用紫外分光光度计测其480 nm吸光度,得到浓度-吸光度标准曲线。实验分组同方法2.2,每组设4个复孔。按分组将HepG2和HepG2/ADM细胞分别以每孔1×104接种于96孔板。培养24 h后,HepG2组和HepG2/ADM组加无血清培养基100 μL,而GNPs+ HepG2/ADM组加入10 nmol/L GNPs溶液预处理1 h后用PBS洗净,最后各组分别加入10 mg/L的ADM 200 μL,继续培养4 h后收集各组上清液,测其480 nm处的吸光度。根据标准曲线得到各实验组细胞内积聚的ADM量。
2.5 GSH检测试剂盒检测GNPs处理后HepG2/ADM细胞内GSH的含量取对数生长期的HepG2 和HepG2/ADM细胞,0.25%胰蛋白酶消化成单细胞悬液,以1×108/L的细胞密度接种于6孔板中,每孔2 mL。每组设3个复孔。细胞培养24 h后: HepG2组和HepG2/ADM组换为无血清培养基培养1 h,GNPs+ HepG2/ADM组则加入10 nmol/L GNPs处理1 h,弃上清后使用胰蛋白酶消化细胞并收集,反复冻融收集细胞3次,使样本细胞破碎。离心后取样本细胞的上清液按照GSH检测试剂盒的操作说明检测各实验组细胞内GSH水平。
3统计学处理
奥氮平治疗高致吐化疗引起恶心呕吐的meta分析……………………… 郭 蕊,张晋萍,丁选胜,等(1·30)
采用SPSS 13.0统计软件进行统计学分析。所有检测实验均重复3次,统计资料用均数±标准差(mean±SD)表示,组间比较用两独立样本t检验或配对t检验,组间两两比较采用SNK法,以P<0.05为差异有统计学意义。
结果
1 GNPs对HepG2/ADM细胞耐药性的逆转作用
MTT检测结果显示,人肝癌HepG2/ADM细胞对ADM显示耐药性,HepG2/ADM组细胞对ADM的IC50为(29.46±1.73) mg/L,明显高于HepG2组(P<0.01)。HepG2/ADM组细胞对ADM的RF为3.22倍;经GNPs处理后,GNPs+ HepG2/ADM组细胞对ADM的耐药性降低,IC50为(15.18±0.85) mg/L(P<0.01),见图1。因此,GNPs可有效逆转HepG2/ADM细胞对ADM的耐药性,RI为1.95。

Figure 1.The effect of gold nanoparticles on reversing adriamycin resistance of HepG2/ADM cells.Mean±SD.n=3.**P<0.01 vs HepG2 group;##P<0.01 vs HepG2/ADM group.图1 GNPs对HepG2/ADM细胞耐药性的逆转作用
2 GNPs对HepG2/ADM细胞凋亡率的影响
GNPs+ ADM组HepG2/ADM细胞的凋亡率明显高于ADM组,差异有统计学意义(P<0.05) ;单独GNPs组与对照组相比差异无统计学意义(P>0.05),见图2。由此说明,GNPs处理后,ADM诱导HepG2/ADM细胞凋亡的作用增强,GNPs本身对细胞无明显的毒副作用。
3 GNPs增加HepG2/ADM细胞内的ADM含量
紫外分光光度计检测结果显示,HepG2/ADM组细胞内ADM含量低于HepG2组细胞内ADM含量(P<0.01) ;经GNPs作用后,HepG2/ADM细胞内的ADM含量明显增加(P<0.01),见图3。由此说明,GNPs能明显增加HepG2/ADM细胞内ADM的积聚。
4 GNPs降低HepG2/ADM细胞内GSH含量
HepG2/ADM组细胞内的GSH含量高于HepG2组细胞内GSH含量(P<0.01) ;经GNPs处理后,HepG2/ADM细胞内的GSH含量较HepG2/ADM组明显降低(P<0.05),见图4。由此说明,GNPs能降低HepG2/ADM细胞内GSH含量。
讨论
化疗是治疗肿瘤,尤其是恶性肿瘤的重要手段之一,但是由于肝癌细胞多药耐药作用的存在,使得许多肝癌患者化疗效果并不理想。研究肝癌多药耐药性的逆转,从而提高肝癌的化疗效果是急需解决的问题。相关研究发现,肿瘤细胞产生耐药的机制主要包括通过ATP-结合盒转运蛋白增加药物的外排,通过谷胱甘肽系统增加对抗肿瘤药物的解毒作用等[8-11]。另有相关研究[12]表明谷胱甘肽也与肿瘤细胞的主动外排作用密切相关。陈家念等[13]总结发现纳米粒给药系统可以逆转肿瘤细胞的多药耐药性。纳米金是金的纳米粒子,在肿瘤治疗方面具有很大的潜能[3],本课题组前期研究发现,GNPs可以增加肿瘤细胞对表柔比星的敏感性[7]及增加化疗药物顺铂对肿瘤细胞的细胞毒性作用[14],那么纳米金可能具有逆转肿瘤细胞耐药性的作用。
本研究从GNPs诱导耐药细胞HepG2/ADM凋亡、影响胞内药物浓度及胞内GSH含量方面初步探讨了GNPs对HepG2/ADM细胞耐药性的影响。由MTT结果可知经GNPs处理后,HepG2/ADM的耐药倍数降低。GNPs可以逆转HepG2/ADM细胞对ADM的耐药性。同时,结合流式细胞术结果,GNPs处理后HepG2/ADM细胞的凋亡率明显增高。更进一步证明,纳米金可以逆转肝癌耐药细胞株HepG2/
ADM对ADM的耐药性。
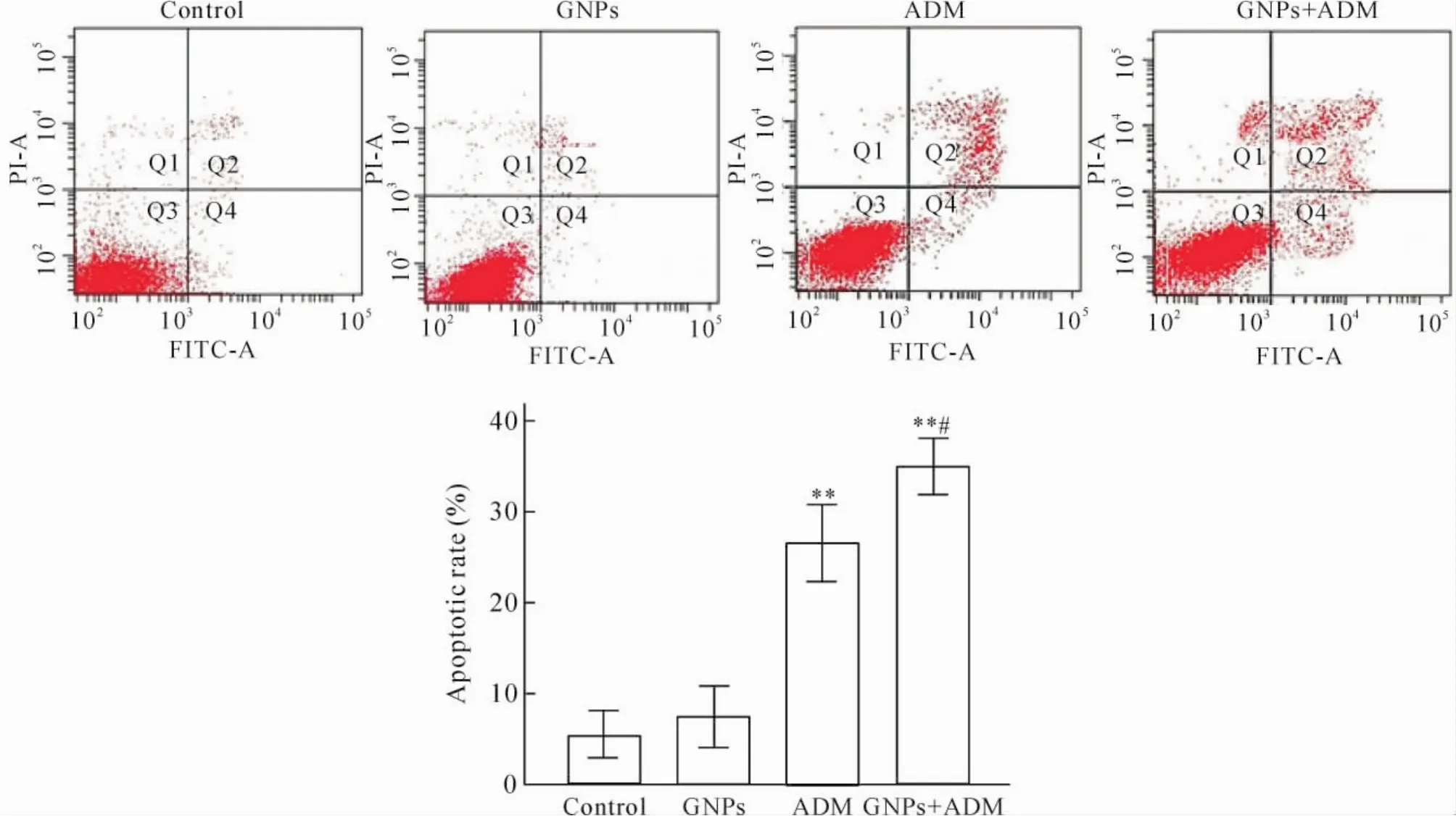
Figure 2.Apoptotic rates of HepG2/ADM cells.Mean±SD.n=3.**P<0.01 vs control group;#P<0.05 vs ADM group.图2 GNPs对HepG2/ADM细胞凋亡率的影响
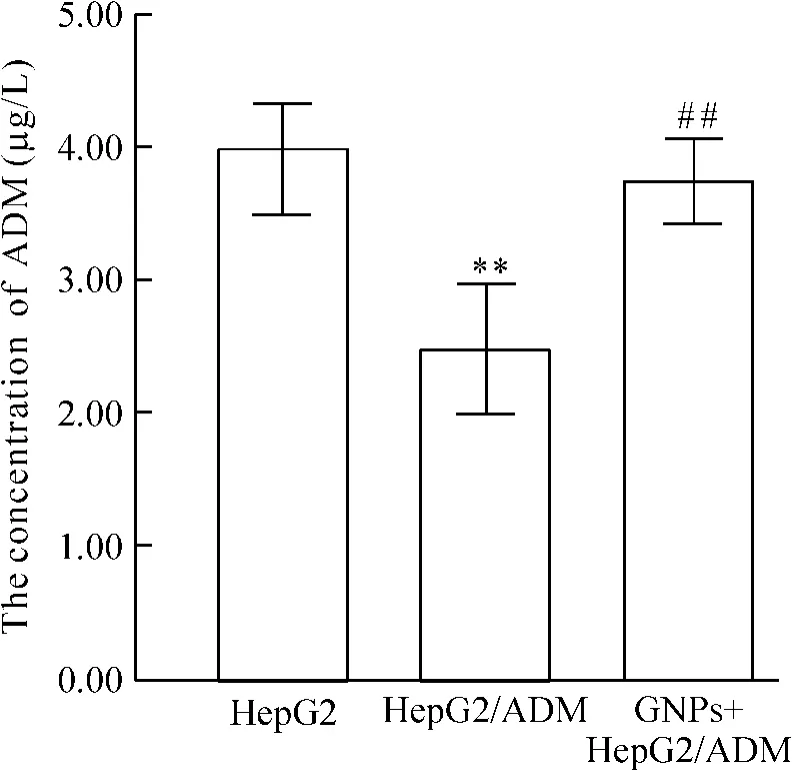
Figure 3.The concentration of ADM in HepG2/ADM or HepG2 cells.Mean±SD.n=3.**P<0.01 vs HepG2 group;##P<0.01 vs HepG2/ADM group.图3 HepG2/ADM和HepG2细胞内ADM的含量

Figure 4.The content of GSH in HepG2/ADM or HepG2 cells.Mean±SD.n=3.**P<0.01 vs HepG2 group;##P<0.01 vs HepG2/ADM group.图4 HepG2和HepG2/ADM细胞内GSH的含量
GSH参与癌细胞耐药的机制目前认为与多药耐药相关蛋白(multidrug resistance-associated protein,MRP)和谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)相关,GSH是人类细胞质中自然合成的一种肽,由谷氨酸、半胱氨酸和甘氨酸组成,含有巯基,是细胞内抗氧化体系的重要组成部分,同时,GSH作为细胞内的一种主要电子供体,在GST催化下可与许多亲电子性药物、毒物结合。GST本身也可与许多亲脂性药物结合,从而促进抗肿瘤药物的解毒与外排。而MRP发挥作用也与细胞内足够的GSH相关[15]。本研究结果显示,耐药细胞株HepG2/ADM 中GSH含量明显高于非耐药细胞HepG2; HepG2/ADM细胞内ADM浓度低于HepG2细胞。这与韩晓群、刘明华等[12,16-17]研究结果相一致:谷胱甘肽参与肿瘤细胞的的主动外排作用,并且肿瘤细胞内GSH含量的增高与MDR密切相关。因此,结合本研究结果,经GNPs处理后,HepG2/ADM胞内ADM含量明显增加、GSH含量降低。我们推测,纳米金与细胞内谷胱甘肽的巯基结合形成很强的共价键[18]后,减少了ADM与谷胱甘肽的结合,从而影响耐药细胞HepG2/ADM对ADM的外排作用,增加了胞内ADM药物浓度,进而逆转了HepG2/ADM细胞对ADM的耐药性。另外,我们前期研究[7,14]表明,GNPs还可以通过改变肿瘤细胞表面超微结构,增加细胞对化疗药物的内吞作用,从而增加胞内化疗药物浓度。
综上所述,纳米金具有逆转耐药肝癌细胞对阿霉素耐药性的作用,并且可以降低细胞内GSH含量及增加胞内化疗药物浓度。关于其更详尽的细胞机制有待进一步研究。
[参考文献]
[1]Ferrer G,Acuna-Villaorduna C,Escobedo M,et al.Outcomes of multidrug-resistant tuberculosis among binational cases in El Paso,Texas[J].Am J Trop Med Hyg,2010,83(5) :1056-1058.
[2]Zhou SF.Structure,function and regulation of P-glycoprotein and its clinical relevance in drug disposition[J].Xenobiotica,2008,38(7-8) : 802-832.
[3]Jain S,Hirst DG,O’sullivan JM.Gold nanoparticles as novel agents for cancer therapy[J].Br J Radiol,2012,85(1010) :101-113.
[4]潘运龙,邱思远,覃莉,等.纳米金抑制裸鼠肝癌血管生成及肝癌生长[J].中华医学杂志,2009,89(12) : 800-804.
[5]Pan YL,Ding H.Gold nanoparticles induce nanostructural reorganization of VEGFR2 to repress angiogenesis [J].J Biomed Nanotechnol,2013,9(10) :1746-1756.
[6]傅岳武,潘运龙,覃莉,等.纳米金抑制Ang-2和RGS5表达导致裸鼠肝癌血管正常化[J].中国病理生理杂志,2011,27(12) :2247-2252.
[7]潘运龙,赵晓旭,覃莉,等.纳米金对表阿霉素的增敏作用[J].中华实验外科杂志,2011,20(4) : 533-535.
[8]Szakacs G,Paterson JK,Ludwig JA,et al.Targeting multidrug resistance in cancer[J].Nat Rev Drug Discov,2006,5(3) :219-234.
[9]Rabik CA,Dolan ME.Molecular mechanisms of resistance and toxicity associated with platinating agents[J].Cancer Treat Rev,2007,33(1) : 9-23.
[10]Martelli C,Dei S,Lambert C,et al.Inhibition of P-glycoprotein-mediated multidrug resistance (MDR) by N,N-bis(cyclohexanol) amine aryl esters: Further restriction of molecular flexibility maintains high potency and efficacy [J].Bioorg Med Chem Lett,2011,21(1) :106-109.
[11]Burg D,Riepsaame J,Pont C,et al.Peptide-bond modified glutathione conjugate analogs modulate GSTπ function in GSH-conjugation,drug sensitivity and JNK signaling [J].Biochem Pharmacol,2006,71(3) :268-277.
[12]Polgar O,Robey RW,Bates SE.ABCG2: structure,function and role in drug response[J].Expert Opin Drug Metab Toxicol,2008,4(1) :1-15.
[13]陈家念,沈琦,李绍顺,等.纳米粒给药系统逆转肿瘤多药耐药性的研究进展[J].药学学报,2009,44 (4) : 333-337.
[14]巫青,潘运龙,覃莉,等.纳米金增强顺铂对肝癌HepG2细胞的细胞毒作用[J].肿瘤,2012,32(9) : 675-680.
[15]Folmer Y,Schneider M,Blum HE,et al.Reversal of drug resistance of hepatocellular carcinoma cells by adenoviral delivery of anti-ABCC2 antisense constructs[J].Cancer Gene Ther,2007,14(11) :875-884.
[16]韩晓群,李著华,张敬各,等.降低细胞内GSH浓度对乳腺癌细胞阿霉素敏感性的影响[J].四川大学学报:医学版,2007,38(5) :770-774.
[17]刘明华,任美萍,李蓉,等.川芎嗪对人卵巢癌顺铂耐药细胞株COC1/DDP的逆转作用研究[J].重庆医学,2011,40(20) :1982-1987.
[18]Ghosh P,Han G,De M,et al.Gold nanoparticles in delivery applications[J].Adv Drug Deliv Rev,2008,60 (11) :1307-1315.
通讯作者△Tel: 020-38688358; E-mail: tpanyl@ jnu.edu.cn
*[基金项目]国家自然科学基金资助项目(No.81472849) ;广东省自然科学基金资助项目(No.2014A030313383) ;暨南大学第一临床医学院科研培育基金资助项目(No.511005004)
[收稿日期]2014-12-02
[文章编号]1000-4718(2015)06-1014-05
[中图分类号]730.23
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.009
