基因工程菌糖基转移酶的分离纯化与酶学性质研究
2015-03-20陈小龙连振静范永仙
陈小龙,连振静,范永仙
(浙江工业大学生物与环境工程学院,浙江杭州 310014)
基因工程菌糖基转移酶的分离纯化与酶学性质研究
陈小龙,连振静,范永仙
(浙江工业大学生物与环境工程学院,浙江杭州 310014)
将含重组质粒pET28b-ValG在BL21(DE3)宿主菌中成功表达,以镍柱亲和层析、超滤脱盐及真空冷冻干燥结晶获得糖基转移酶并初步研究酶学性质。在10~40°C或pH 5~11下,该酶还能保持较好的稳定性,且最适反应温度及pH分别为30°C与8.0。1 mmol/L金属离子Ca2+、Mg2+、Mn2+、Co2+对酶反应有着显著的促进作用,而Cu2+、Zn2+对酶反应有强烈的抑制效果。当酶反应进程中酶活达到最大时,底物及产物的最适浓度分别为8 μmol/L与2 μmol/L。以底物井冈羟胺A足量为前提,双倒数作图法表明KmB为35.275 μmol/L,Vm为0.153 μmol/(L· min),酶对井冈羟胺A的亲和力较尿苷二磷酸葡糖(UDPG)好,因此在全细胞酶催化过程中对提高UDPG供应量的研究是有必要的。
糖基转移酶;纯化;酶学性质
井冈霉素是一类氨基环醇类抗生素,包含一个有效烯胺结构,被广泛应用于水稻纹枯病的防治。井冈霉素主要由A、B、C、D、E、F、G、H共8个组分组成,其中井冈霉素A是井冈霉素的主要有效成分。在井冈霉素发酵生产的过程中,发现井冈霉素A的前体井冈羟胺A会大量积累,直接影响井冈霉素的产量和产品的质量[1]。而井冈霉素生物合成的遗传学研究表明,井冈霉素A生物合成的最后一步就是由糖基转移酶将一分子葡萄糖转移至井冈羟胺A生成井冈霉素A,研究表明编码该糖基转移酶的基因为井冈霉素生产菌吸水链霉菌ValG基因[2]。
为了减少井冈羟胺A的积累,提高产品中井冈霉素A的含量和产品质量,实验室已经构建了糖基转移酶基因工程菌,并初步运用于生物转化井冈羟胺A为井冈霉素A,但是全细胞转化效率并不高,这可能是由于没有找到适宜糖基转移酶催化的最优条件。
以重组蛋白中His-tag镍柱亲和层析[3]分离糖基转移酶并对该酶的酶学性质及反应动力学进行研究,为进一步研究全细胞转化井冈羟胺A糖基化指明方向;另一方面,通过对糖基转移酶的催化特性及反应动力学的深入研究,将为进一步开发该糖基转移酶在抗生素等活性分子糖基化修饰的应用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 菌种
基因工程菌pET28b-ValG BL21(DE3)由本实验室构建、保存。
1.1.2 试剂与设备
用于配制酶催化反应的不同pH缓冲液的缓冲盐及金属离子盐购自国药集团各子公司;用于酶纯化、蛋白胶的相关试剂大多购自上海生工生物工程有限公司与美国Bio-Rad公司;尿苷二磷酸二钠盐购自美国Sigma公司;其他试剂大多来自国内生产厂家;HPLC为日本岛津公司生产的LC-20AT;PCR仪为美国Bio-Rad公司生产的S1000。
1.2 方法
1.2.1 蛋白纯化
将培养好的菌体,4°C下10000 r/min离心5 min获得菌体,菌体用50 mmol/L pH为8.0的Tris-HCl缓冲液洗涤3次,获得湿菌体。
将菌体悬浮于50 mmol/L pH为8.0的Tris-HCl缓冲液中,菌体浓度大约为0.05 g/mL,冰浴条件下200 W功率超声破碎,工作1 s,停1 s,一次3 min,重复8次。于4°C下12000 r/min离心30 min,取上清。
将Ni-NTA填料装于1.6 cm×20 cm柱子中,柱床体积大约为10 mL;柱子装好以后,在柱上缓慢加入5倍柱体积的平衡液(pH 8.0,25 mmol/L Tris-HCl),以充分平衡Ni-NTA柱子;平衡完成后取过滤后的工程菌破碎液匀速加入镍柱,直至样品完全进入。
用10倍柱体积的平衡液继续洗涤凝胶柱,保持流速为1 mL/min,分别用含5 mmol/L咪唑的洗脱液(pH 8.0,25 mmol/L Tris-HCl,500 mmol/L NaCl)及250 mmol/L咪唑的洗脱液(pH 8.0,25 mmol/L Tris-HCl,500 mmol/L NaCl)进行洗脱,流速为1 mL/min,下端用试管接住流出液体,将试管标记顺序。
将含有目标蛋白的穿透液放入Millipore超滤管中,于4°C下5000 r/min离心,用适量的25 mmol/L Tris-HCl(pH 8.0)洗涤两次,最后加入适量的超纯水溶解蛋白,将蛋白溶液置于冷冻干燥机中干燥,干燥得白色丝状物,置于-20°C保存。
以3 μL 50 mmol/L Tris-HCl(pH 8.0)缓冲液,2 μL 25 mmol/L Tris-HCl(pH 8.0)缓冲液溶解的纯化酶储液(50 μg/mL),2 μL尿苷二磷酸葡糖(UDPG)储液(终浓度8.20 μmol/L),3 μL底物井冈羟胺A储液(10.44 μmol/L)的10 μL反应体系,在30°C温度下反应20 min,完毕于100°C加热6 min淬灭反应。取5 μL HPLC测定井冈霉素的生成量。酶活定义如下:在上述反应条件下,每分钟产生1 μmol井冈霉素A所需酶量为一活力单位U。
1.2.2 SDS-PAGE鉴定
将诱导后的1 mL菌液12000 r/min离心5 min,悬浮于1 mL去离子水中,分别取20 μL悬浮的菌液、细胞超声波破碎液、镍柱亲和层析穿透峰溶液与2×上样缓冲液充分混匀,沸水煮8 min制成样品,取10 μL上样,浓缩胶电压65 V,分离胶电压改为120 V,染色脱色后判断蛋白纯化的情况。
1.2.3温度对纯酶酶活影响的测定
以3 μL 50 mmol/L Tris-HCl(pH 8.0)缓冲液,2 μL 25 mmol/L Tris-HCl(pH 8.0)缓冲液溶解的纯化酶储液(50 μg/mL),2 μL尿苷二磷酸葡糖(UDPG)储液(终浓度8.20 μmol/L),3 μL底物井冈羟胺A储液(10.44 μmol/L)的10 μL反应体系,在10~60°C温度范围内,以5°C为梯度温度,反应20 min,完毕于100°C加热6 min淬灭反应。取5 μL测定井冈霉素的生成量。
1.2.4 纯酶的温度稳定性测定
将纯酶放在10~60°C温度范围内,以5°C为梯度温度处理30 min,在10 μL反应体系下进行酶反应,反应方法同上所述,取5 μL测定井冈霉素的生成量。
1.2.5 pH对纯酶酶活影响的测定
分别配制50 mmol/L pH为3、4、5、6、7、8、9、10的缓冲液(pH 3~4(Na2HPO4-柠檬酸缓冲液)、pH 5~7(Na2HPO4-NaH2PO4)、pH 8~9(Tris-HCl)、pH 10~11(Na2CO3-NaHCO3),各缓冲离子对配成50 mmol/L溶液,按比例混合成pH不同的缓冲液),采用10 μL反应体系,在30°C温度下反应20 min,完毕于100°C加热6 min淬灭反应,取5 μL测定井冈霉素的生成量。
1.2.6 纯酶的pH稳定性测定
将上述酶储液放于50 mmol/L pH为3、4、5、6、7、8、9、10、11的缓冲液中,在室温下放置30 min,10 μL反应体系反应方法同上所述,取反应液5 μL检测井冈霉素A生成量。
1.2.7 金属离子对纯酶酶活的影响
称取相应可溶性金属离子盐(KCl、CaCl2、MgCl2、MnCl2、CrCl3、CoCl2、ZnCl2、FeCl2、NiSO4、Cu-SO4、AlCl3)配制10 mmol/L K+、Ca2+、Mg2+、Mn2+、Cr3+、Co2+、Zn2+、Fe2+、Ni2+、Cu2+、Al3+金属离子储液,采用10 μL反应体系:其中3 μL 50 mmol/L Tris-HCl(pH 8.0)缓冲液,2 μL 25 mmol/L Tris-HCl (pH 8.0)缓冲液溶解的纯化酶储液(50 μg/mL),2 μL UDPG储液(终浓度8.20 μmol/L),2 μL底物井冈羟胺A储液(10.44 μmol/L),1 μL 10 mmol/L的金属离子储液(反应体系中金属离子终浓度1 mmol/L)。反应方法同上所述,取反应液5 μL检测井冈霉素A生成量。
1.2.8 底物与产物对纯酶酶活的影响
采用上述10 μL反应体系:其中3 μL 50 mmol/L Tris-HCl(pH 8.0)缓冲液,2 μL 25 mmol/L Tris-HCl(pH 8.0)缓冲液溶解的纯化酶储液(50 μg/mL),2 μL UDPG储液(终浓度8.20 μmol/L),3 μL不同浓度的井冈羟胺A储液(井冈羟胺A终浓度分别为1.49、2.98、5.96、7.45、8.95、10.44、11.93、14.91、17.89 μmol/L)。反应方法同上所述,取反应液5 μL检测井冈霉素A生成量。
采用上述10 μL反应体系:其中3 μL 50 mmol/L Tris-HCl(pH 8.0)缓冲液,2 μL 25 mmol/L Tris-HCl(pH 8.0)缓冲液溶解的纯化酶储液(50 μg/mL),2 μL UDPG储液(终浓度8.20 μmol/L),2 μL井冈羟胺A储液(终浓度10.44 μmol/L),1 μL不同浓度的井冈霉素A(井冈霉素A终浓度分别为0.08、0.20、0.40、0.80、1.21、1.61、2.01、3.62、4.82、6.83 μmol/L)。反应方法同上所述,取反应液5 μL检测井冈霉素A生成量。
1.2.9 酶反应动力学相关参数的测定
第一次作图,固定反应体系中的UDPG的浓度为13.67、10.25、6.83 μmol/L,改变井冈羟胺A的浓度为3.58、4.47、5.96、7.45、8.95 μmol/L,反应方法同上所述,取反应液5 μL检测井冈霉素A生成量,从而求出反应速率,双倒数作图。第二次作图,固定井冈羟胺A的浓度为28.33 μmol/L,改变UDPG的浓度为3.41、4.78、6.83、10.25、13.66 μmol/L,酶反应与上述实验相同。
2 结果与讨论
2.1 酶的分离纯化
镍柱亲和层析色谱图、纯化穿透峰电泳图如图1、2所示。
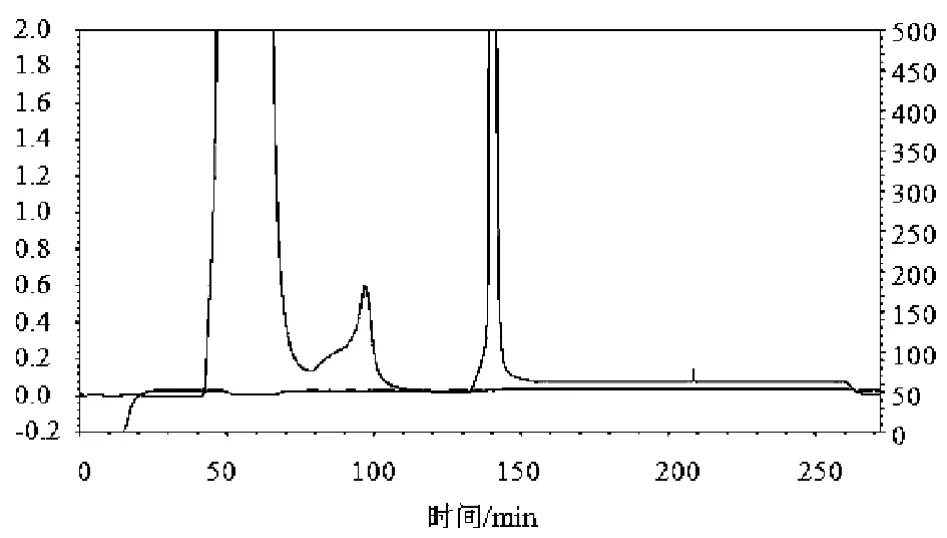
图1 糖基转移酶镍柱亲和层析纯化图
图1的镍柱层析色谱图的左侧纵坐标为穿透峰的紫外吸收,右侧纵坐标为穿透峰的电导率。从图中推测在50~80 min左右,是一些未被镍离子结合的杂蛋白,且含量较高,80~110 min之间出现了一个小的杂峰,推测是被5 mmol/L咪唑洗脱液洗下来的弱吸附杂蛋白,在135~150 min之间出现一个窄而尖的穿透峰,推测是被250 mmol/L咪唑洗脱液洗下来的目的蛋白峰。而从图2的凝胶电泳图可以看出推测是否正确及纯化的效果是否理想。图2的右侧开始第一泳道为蛋白质Marker,往左侧依次为未破碎的菌体、菌体破碎液、杂蛋白穿透峰,最左侧为目的蛋白穿透峰。SDS-PAGE图谱经扫描,BandScan软件分析菌体破碎液中ValG约占细胞总蛋白的32%。从图中可以看到在45 kD处看到明显的蛋白条带,这与目标蛋白的大小(47 kD)一致,推测为糖基转移酶,进一步酶活实验得到验证。另在杂蛋白穿透峰中并没有看到很亮的目的蛋白条带,说明镍柱对糖基转移酶的特异性吸附较强,而从目的蛋白的穿透峰锋形看出,250 mmol/L咪唑洗脱液能很好的从镍柱上洗脱目的蛋白,通过对纯化后ValG的总酶活1862.5 U与破碎完后粗酶的总酶活2191.2 U之比,计算得ValG回收率在85%以上。综上所述,该方法分离糖基转移酶快速有效。
2.2 温度对糖基转移酶酶活的影响[4]
温度对酶活影响的研究以最高酶活(100%)作为参照,分别计算各温度下的相对酶活(为了减小误差,实验数据都取两个平行的平均值),糖基转移酶的温度稳定性研究以未处理酶的酶活为参照,分别计算各温度条件下处理过的酶的剩余酶活力,结果如图3所示。
从图3可知,糖基转移酶催化糖基转移的最适温度为30°C,当温度在10~30°C之间时,酶活随着温度上升而增大,而当温度为10°C时,相对酶活只有62.64%,这可能是因为低温条件下,酶、底物分子的扩散速率变慢,酶与底物碰撞几率降低所致,而当温度超过35°C时,酶活随着温度的升高剧烈下降,到60°C时相对酶活只有8%左右,这是因为随着温度的上升,酶逐渐变性所致;而温度稳定性实验结果正好验证了这一点,在10~40°C时,酶是较为稳定的,当温度大于45°C,酶基本失活。
2.3 pH对糖基转移酶酶活的影响[5]
pH对酶活影响的研究以最高酶活(100%)作为参照,分别计算各pH缓冲液反应体系的相对酶活,糖基转移酶的pH稳定性研究以未处理酶的酶活为参照,分别计算各pH缓冲液处理过的酶的剩余酶活力,结果如图4所示。

图2 纯化的糖基转移酶电泳图
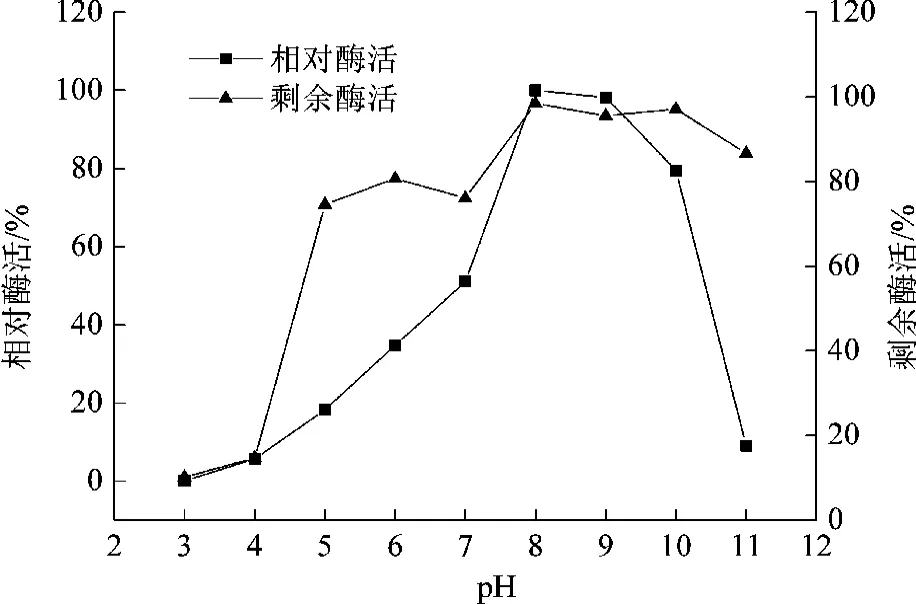
图4 pH对糖基转移酶的影响
从图4可知,糖基转移酶催化糖基转移的最适pH在8~9之间,当pH在4~8之间时,酶活随着pH增大而升高,而当pH为3时,酶完全变性,没有检测到酶活。而当pH超过10时,酶活随着pH的升高剧烈下降,到pH为11时,相对酶活只有9%左右。从上可知,在pH 8~10之间,酶的活力相对较高,结合糖基转移酶的结构特征,由于该酶存在DTG基序(对应于其他糖基转移酶的DXD基序)[6],这可能是该酶催化的活性位点,无论该酶是采用碱催化机制还是双取代机制,都需要该酶在催化时活性中心有一个去质子化的亲和基团,DTG基序可以提供这样一个基团,当pH为碱性时,更有利于活性中心的亲核基团的去质子化,从而加速催化反应中的亲核攻击,加快反应速率。酶pH稳定性实验结果表明该酶的pH稳定性还是很好的,在pH 5~11之间,剩余酶活均在80%以上,特别是在碱性条件下,酶的稳定性更好,而当pH小于4时,酶就容易变性失活。
2.4 金属离子对糖基转移酶酶活的影响[7]
以未添加金属离子反应体系的酶活(100%)作为参照,研究添加1 mmol/L金属离子对酶活的影响,分别计算添加不同金属离子反应体系的相对酶活,结果如图5所示。

图5 金属离子对酶活的影响
从图5中可以看出,1 mmol/L的Al3+、Cr3+、Fe2+对糖基转移酶酶活基本上没有影响,而Ni2+对酶反应有轻微的抑制作用,Cu2+、Zn2+对酶反应有强烈的抑制作用,1 mmol/L的Cu2+、Zn2+离子对酶的抑制率都达到了90%,相反K+、Ca2+、Mg2+、Mn2+、Co2+却对酶反应有不同程度的促进作用,且相对酶活都达到了150%以上,最高的相对酶活(加Mg2+)达到了234%。可以推测大多数糖基转移酶催化反应过程中,当活性位点的亲核基团攻击磷酸离去基团时,会产生部分负电荷,推测加入的二价金属阳离子稳定了这些负电荷,加速了磷酸离去基团的脱离,从而加快了酶反应速率。
2.5 底物与产物对糖基转移酶酶活的影响[8]
通过改变酶反应体系中底物井冈羟胺A的含量,以最高酶活作为对照(100%),计算各个底物浓度下的相对酶活,从而研究底物对酶反应速率的影响及可能存在的底物抑制。通过向酶反应体系中添加不同浓度的井冈霉素A,以未添加产物的反应体系作为对照(100%),计算各反应体系的相对酶活,研究产物对酶反应速率的影响及可能存在的产物抑制,结果如图6、7所示。
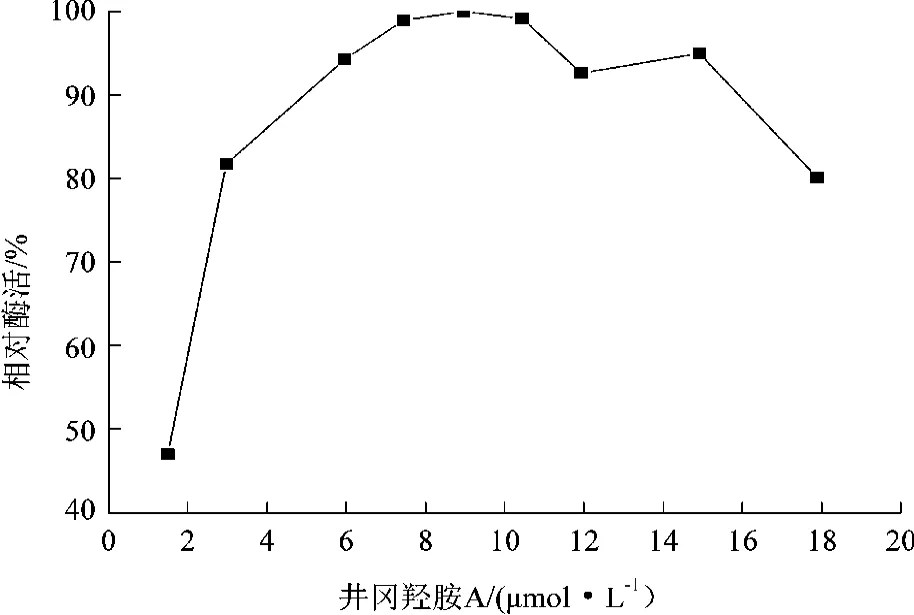
图6 底物浓度对糖基转移酶酶活的影响
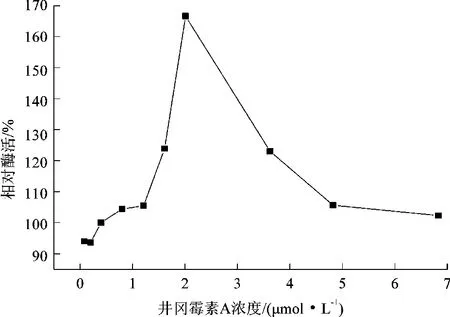
图7 产物对糖基转移酶酶活的影响
从图6可知,当底物浓度在1.49~8 μmol/L之间时,相对酶活随着底物浓度的增加而提高,当底物浓度达到8 μmol/L以上时,相对酶活达到最大,而当浓度超过18 μmol/L时,可能出现轻微的底物抑制现象(不同底物浓度下的酶学反应都有着底物的残留);从图7可知,当产物浓度为1.5 μmol/L时,产物对酶反应并没有影响,而有趣的是当产物浓度为2 μmol/L,相对酶活居然达到了167%,这说明一定量的产物可能对酶反应有促进效果,显现一定正反馈的作用,而当产物浓度达到7 μmol/L时,并未发现产物的反馈抑制作用。
2.6 酶反应动力学相关参数的测定
采用研究多底物酶反应动力学较常用的方法:二次作图法,具体方法见上,结果如图8、9所示。
通过对数据进行线性回归,发现图8中出现三条几乎平行的直线,这符合多底物催化兵乓机制的动力学模型特征,根据兵乓机制的反应历程及稳态学说,可推导动力学方程为:1/V=1/Vm(1+ KmB/[B]+KmA/[A]),其中A为井冈羟胺A,B为UDPG;第二次双倒数作图是以底物井冈羟胺A达到饱和浓度为前提,如图9所示,运用单底物动力学模型得出动力学方程为:1/V=1/Vm(1+KmB/ [B]),1/C(UDPG)—1/V的回归方程为y=230.43x+ 6.5323,R2=0.9932,从该回归方程可以可以得出糖基供体UDPG的KmB值为35.275 μmol/L,酶表观最大反应速率Vm为0.153 μmol/(L·min),代入图8的动力学方程可以计算出井冈羟胺A的KmA值为8.943 μmol/L,从得出的动力学参数可以得知,酶对底物井冈羟胺A的亲和性较好,对UDPG的亲和性没有那么高,可以推测,当细胞转化时,UDPG量是影响转化率的主要因素之一。
而另一方面,通过双倒数作图,我们可以进一步推测该酶的催化机制,该酶有DTG基序,且该酶催化反应产物的糖基构型与供体底物的构型是一致的,该酶属于保留型糖基转移酶,各种证据指向该酶的催化机制符合保留型糖基转移酶催化机制中的双取代机制,酶结构上已经存在一个亲核的活性中心,于是提出该酶可能的催化过程:酶活性中心的亲核基团攻击UDPG的异头碳导致异头碳糖苷键断裂,葡萄糖与酶形成复合物,而磷酸离去基团作为碱催化剂攻击井冈羟胺A羟基,质子化的井冈羟胺A亲核攻击葡萄糖与酶,最终形成井冈霉素A,金属离子的加入,能稳定酶活性中心的亲核基团攻击UDPG的异头碳产生的负电荷,加速磷酸离去基团的脱离,金属离子对催化的影响正好说明了这一点,另酶反应动力学结果也支持这一推论,当然要确认酶催化机制,还需要更多更深入的实验验证。

图8 固定UDPG浓度双倒数作图

图9 固定井冈羟胺A浓度双倒数作图
[1]周祥.井冈霉素生物合成限速步骤解析及高产[D].上海:上海交通大学,2012.
[2]SINGH D,SEO M J,KWON H J,et al.Genetic localization and heterologous expression of validamycin biosynthetic gene cluster isolated from Streptomyces hygroscopicus var.limoneus KCCM 11405(IFO 12704)[J].Gene,2006,376(1):13-23.
[3]LOUGHRAN S T,LOUGHRAN N B,RYAN B J,et al.Modified His-tag fusion vector for enhanced protein purification by immobilized metal affinity chromatography[J].Analytical Biochemistry,2006,355(1):148-150.
[4]LIEBL W,FEIL R,GABELSBERGER J,et al.Purification and characterization of a novel thermostable 4-alpha-glucanotransferase of Thermotoga maritima cloned in Escherichia coli[J].European Journal of Biochemistry,1992,207(1):81-88.
[5]RYU S I,PARK C S,CHA J,et al.A novel trehalose-synthesizing glycosyltransferase from Pyrococcus horikoshii:molecular cloning and characterization[J].Biochemical and Biophysical Research Communications,2005,329(2):429-436.
[6]BAI Linquan,LI Lei,XU Hui,et al.Functional analysis of the validamycin biosynthetic gene cluster and engineered produc tion of validoxylamine A[J].Chemistry and Biology,2006,13 (4):387-397.
[7]LAIRSON L L,HENRISSAT B,DAVIES G J,et al.Glycosyltransferases:structures,functions,and mechanisms[J].Annual Review of Biochemistry,2008,77(1):521.
[8]MORIWAKI C,COSTA G L,PAZZETTO R,et al.Production and characterization of a new cyclodextrin glycosyltransferase from Bacillus firmus isolated from Brazilian soil[J].Process Biochemistry,2007,42(10):1384-1390.
(责任编辑:朱小惠)
Studies on purification and characteristics of glycosyltransferase from an engineering strain
CHEN Xiaolong,LIAN Zhenjing,FAN Yongxian
(College of Biological and Environmental Engineering,Zhejiang University of Technology,Hangzhou 310014,China)
The recombinant plasmid pET28b-ValG was functionally expressed in E.coli BL21 (DE3)and the overexpressed glycosyltransferase was purified sequentially by nickel affinity chromatography,ultra-filtration desalination and freeze-drying.Then the purified enzyme was characterized and it showed good stability at 10-40°C and pH 5-11.The optimum reaction temperature and pH were 30°C and 8.0,respectively.The metal ions,such as Ca2+,Mg2+,Mn2+and Co2+,activated the enzyme activity,while Cu2+and Zn2+inhibited the enzyme activity instead.The maximum enzyme activity was obtained at substrate and product concentrations of 8 μmol/L and 2 μmol/L, respectively.When sufficient validoxylamine A was added as substrate,the Lineweaver-Burk plot showed that the KmBand Vmwere 35.275 μmol/L and 0.153 μmol/(L·min),respectively.The affinity of validoxylamine A was much better than that of the uridine diphosphate glucose(UDPG)to the glycosyltransferase,which made it necessary to study the supply of UDPG in the process of the whole-cell catalysis.
glycosyltransferase;purification;enzymatic properties
Q55
A
1674-2214(2015)02-0001-06
2014-12-15
浙江省科技厅重大科技专项重点农业项目(2012C12003-1)
陈小龙(1970—),男,浙江仙居人,教授,主要从事抗生素的发酵与结构修饰,E-mail:richard_chen@zjut.edu.cn.
