大肠杆菌tdcD基因缺失株的构建及其用于耐高糖L-色氨酸发酵的研究
2015-03-20孟刚魏爱英贾慧萍马风勇杨立鹏李小刚
孟刚,魏爱英,贾慧萍,马风勇,杨立鹏,李小刚
(宁夏伊品生物科技股份有限公司,宁夏银川 750100)
大肠杆菌tdcD基因缺失株的构建及其用于耐高糖L-色氨酸发酵的研究
孟刚,魏爱英,贾慧萍,马风勇,杨立鹏,李小刚
(宁夏伊品生物科技股份有限公司,宁夏银川 750100)
发酵过程中产生的过量乙酸会严重影响色氨酸发酵的效率,通常采用严格控制发酵液中葡萄糖浓度来减少发酵过程中乙酸的积累。通过敲除乙酸代谢途径中具有乙酸激酶活性的丙酸激酶编码基因(tdcD)控制乙酸溢流,并分别研究在“微糖”及“高糖”控制条件下乙酸含量的变化及其对发酵的影响。结果显示,在“高糖”控制条件下tdcD缺失菌株在对数生长后期保持较高的生长速率和产酸效率,色氨酸产量最高为48.85 g/L,比对照菌提高了54.88%;而产生的乙酸为2.79 g/L,比对照菌降低了64.72%。tdcD缺失菌可以适应更灵活的残糖控制范围。
Red重组技术;tdcD基因;乙酸;微糖;高糖
在大肠杆菌色氨酸发酵过程中,如果发酵液中残糖浓度过高,会产生“反巴斯德效应”,乙酰辅酶A积累,副产物开始生成,严重时15%~30%的糖会形成乙酸[1],即出现所谓的“乙酸溢流”现象,并引起一系列的问题:如抑制菌体生长[2]、抑制蛋白合成[3]、发酵过程pH控制难[4]等。因此,在大肠杆菌色氨酸发酵生产过程中,控制乙酸的形成是非常重要的。
在工业发酵生产色氨酸过程中,为了控制发酵液中乙酸的含量,通常采用严格控制发酵液中残余葡萄糖浓度的工艺,即“微”糖控制(控制在2 g/L以下)。但是这并不能从根本上解决问题,同时还增加了发酵过程控制的复杂性,降低了发酵的稳定性。为了克服“乙酸溢流”造成的目标产物合成障碍,对大肠杆菌乙酸代谢通路进行干预,削弱乙酸的生物合成,减少乙酸对发酵造成的负面影响,使色氨酸发酵脱离“微”糖控制的制约,从而提高色氨酸发酵过程的稳定性,降低控制的复杂性。
好氧条件下大肠杆菌产生乙酸的主要途径是Pta-Ack途径,即在磷酸转乙酰基酶和乙酸激酶的作用下将乙酰辅酶A转化为乙酸,其中由pta基因编码磷酸转乙酰基酶,而乙酸激酶的编码基因有两个:ackA基因和tdcD基因,这两个基因为同源基因(图1)。本文以E.coli YPTRP01为出发菌,利用Red重组技术敲除tdcD基因编码区,构建得到tdcD基因缺失菌株E.coli YPTRP01△tdcD,并比较研究了在不同残糖浓度条件下tdcD缺失菌株及出发菌在菌体生长、产酸以及乙酸合成方面的变化。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
色氨酸生产菌E.coli YPTRP01由宁夏伊品生物科技股份有限公司菌种中心提供;E.coli DH5,购自大连宝生物工程有限公司;质粒pMD19-T vector购自大连宝生物工程有限公司;pKD46、pKD3、pcp20购自Biovector。
1.1.2 引物
pKD3含有氯霉素抗性基因,且在抗性基因两侧有FRT位点,在Red重组系统中作为抗性标记使用;根据NCBI提供的E.coli K-12 W3110基因序列信息,设计含有56 bp同源臂的一对引物P1、P2(划线部分为同源臂),用于从质粒pKD3 上PCR扩增出含有氯霉素抗性及FRT位点的基因片段;在大肠杆菌染色体tdcD基因同源重组区域外侧,设计引物P3、P4,用于检测重组菌株。
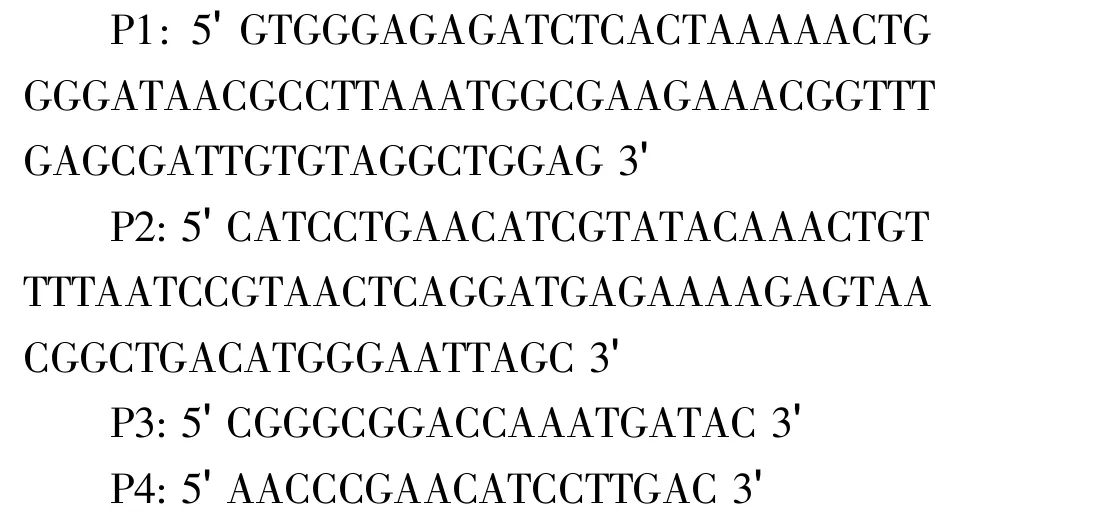
1.1.3 主要试剂
Taq DNA聚合酶、限制性内切酶、2 kb marker购于大连宝生物工程有限公司;PCR引物由上海英俊生物工程有限公司合成;L-阿拉伯糖、IPTG、X-gal、溶菌酶、氨苄青霉素、氯霉素、四环素购于北京索莱宝公司;DNA片段回收试剂盒、基因组DNA的提取试剂盒、质粒小提试剂盒购于北京天根生物科技有限公司;蛋白胨、酵母粉为Oxoid公司产品。
1.1.4 培养基及发酵控制条件
种子培养基(g/L):K2HPO424,KH2PO49.6,(NH4)2SO45,MgSO41,酵母粉15.2,葡萄糖10,pH 7.0,121°C灭菌20 min。葡萄糖和其他成分灭菌后再混合。
固体培养基:种子培养基+1.5%琼脂。
5 L发酵罐发酵培养基(g/L):酵母粉1.5,柠檬酸2,葡萄糖10,MgSO42,(NH4)2SO41,KCl 5,(NH4)2HPO43,微量元素混合液1 mL,pH 7.0,121°C灭菌20 min。
发酵控制条件:温度35°C,pH 7.0,罐压0.03 MPa,控制补糖阀门的开度使溶氧保持在20%~30%之间,发酵周期36 h。
1.2 方法
1.2.1 葡萄糖测定方法
葡萄糖浓度采用SBA-40C葡萄糖生物传感仪(山东省科学院生物研究所)分析。
1.2.2 发酵液样品预处理
用体积分数为5%的浓硫酸将发酵液样品酸化,释放由Ca(OH)2中和的有机酸,离心去除Ca-SO4沉淀后用等体积100 g/L的三氯乙酸沉淀蛋白质,经0.45 μm微孔滤膜过滤后用于高效液相色谱分析。
1.2.3 有机酸测定方法
有机酸含量用高效液相色谱进行分析,检测器为UV(210 nm)检测器,色谱柱为SH1011 (Shodex),流动相为0.01 mol/L H2SO4,流速为0.6 mL/min,柱温50°C。
1.2.4 色氨酸含量检测
色氨酸检测方法见参考文献[5]。
2 结果
2.1 大肠杆菌YPTRP01 tdcD基因缺失株的构建
质粒pKD3含有氯霉素抗性基因,且在抗性基因两侧有反转酶结合位点(FRT),常在Red重组系统中作为抗性标记使用。根据大肠杆菌W3100基因组中tdcD基因序列信息,设计含有56 bp同源臂的引物P1和P2,以质粒pKD3为模板,PCR扩增氯霉素抗性基因片段。将扩增出的上游同源臂-氯霉素抗性基因-下游同源臂的片段电击转化含有辅助质粒pKD46并经2 mmol/L L-阿拉伯糖诱导的E.coli YPTRP01感受态细胞,37°C复苏1~2 h,涂布于氯霉素抗性平板,使用鉴定引物P3、P4对转化子进行菌落PCR,筛选获得阳性重组子E.coli YPTRP01(tdcD::cm),tdcD基因的长度为1589 bp,而氯霉素抗性基因的长度为1347 bp,经琼脂糖凝胶电泳检测(图2),两片段长度与预计相符,说明重组菌株染色体上的tdcD基因已经被氯霉素基因替代。
质粒pCP20含有温度敏感型的复制起点,同时含有一个反转重组酶(Flippase recombination enzyme,FLP)基因,FLP重组酶可以与FRT位点结合,使FRT位点自身发生同源重组,从而消除一个FRT位点及抗性基因。将质粒pCP20电转入含氯霉素抗性的重组子,37°C复苏1~2 h,涂布于氨苄青霉素抗性平板上,使用鉴定引物P3、P4对转化子进行菌落PCR,将筛选到的阳性转化子接种于LB培养基中,42°C过夜培养,经划线分离,对每个单菌落进行无抗及氯霉素的抗性检测,挑选对氯霉素不生长且在无抗平板上生长的单克隆,得到消除质粒pCP20的重组菌株E.coli YPTRP01△tdcD。结果表明,在463 bp处有目的条带,如图2所示。
将重组子E.coli YPTRP01△tdcD使用鉴定引物P3、P4扩增出的PCR产物经上海英俊公司测序,测序结果经DNAMAN软件进行序列对比,与理论一致,这表明已经成功获得E.coli YPTRP01△tdcD缺失株。
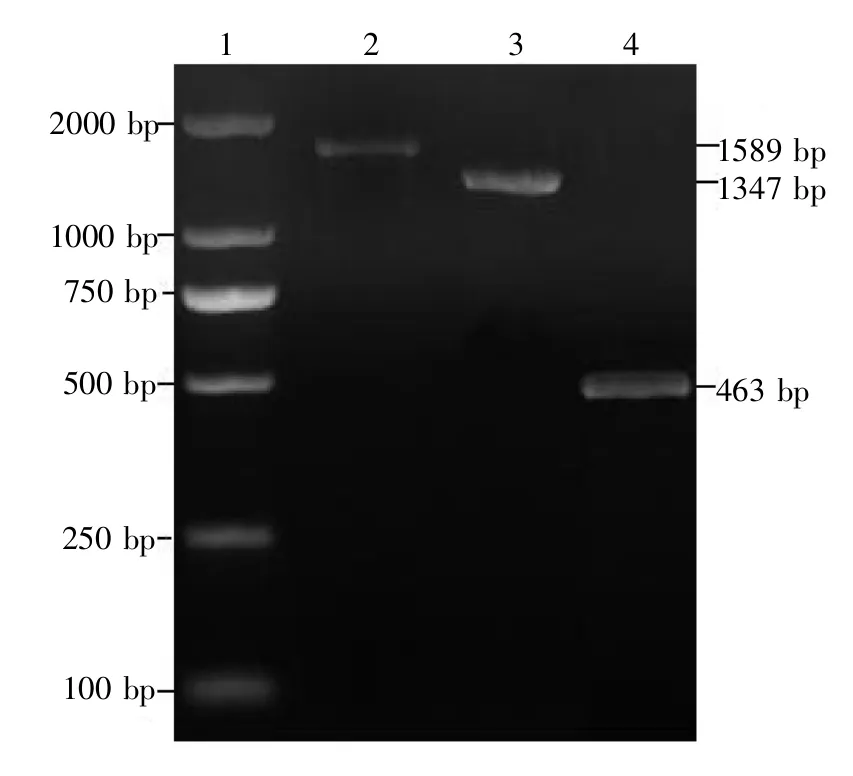
图2 tdcD基因敲除转化子的PCR鉴定电泳图
2.2 “微糖”控制条件下tdcD敲除对色氨酸发酵的影响
在5 L自动控制发酵罐上进行分批补料发酵,发酵初始培养基1.5 L,接种量13%,采用补料分批发酵(补加60%葡萄糖,用氨水调pH)的方式进行发酵,发酵温度35°C,pH维持在7.0,残糖控制在0~2 g/L,溶解氧控制在20%~30%,发酵周期36 h。每隔2 h测定OD660、残糖含量、L-色氨酸产量、乙酸含量,结果如图3、4所示。
由图3、4可知,在“微糖”控制发酵过程中,E.coli YPTRP01及其tdcD缺失株在整个生长周期没有明显差异,均在6 h左右进入生长指数期,在24 h进入稳定期,30 h后开始衰老。整个过程的产酸确有差异,特别是进入稳定期后,E.coli YPTRP01△tdcD菌株的色氨酸增加量明显高于出发菌株,最高可达48.98 g/L,比对照菌株高15%左右。根据文献报道,通常乙酸含量在2 g/L以下不会影响细胞的正常代谢,但若高于5 g/L,就会抑制菌体生长。虽然在整个发酵过程中尽量控制残糖浓度低于2 g/L,但是在发酵后期通常残糖浓度很难控制在这个水平以下,乙酸会逐步加快积累。由测定结果可知,E.coli YPTRP01在发酵过程中不断积累乙酸,在36 h达到最大4.89 g/ L,而采用tdcD敲除菌的发酵过程中,乙酸虽然有所积累,但增长速度明显减慢,且最终含量为2.01 g/L,比对照菌株降低了58%以上。发酵液中乙酸含量的降低除了可以减少对微生物细胞的破坏外,还有利于降低碳流的损失,增加色氨酸合成的碳源利用率。
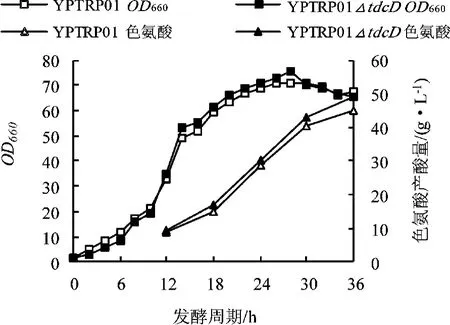
图3 YPTRP01及tdcD缺失菌在微糖控制条件下OD及色氨酸含量曲线
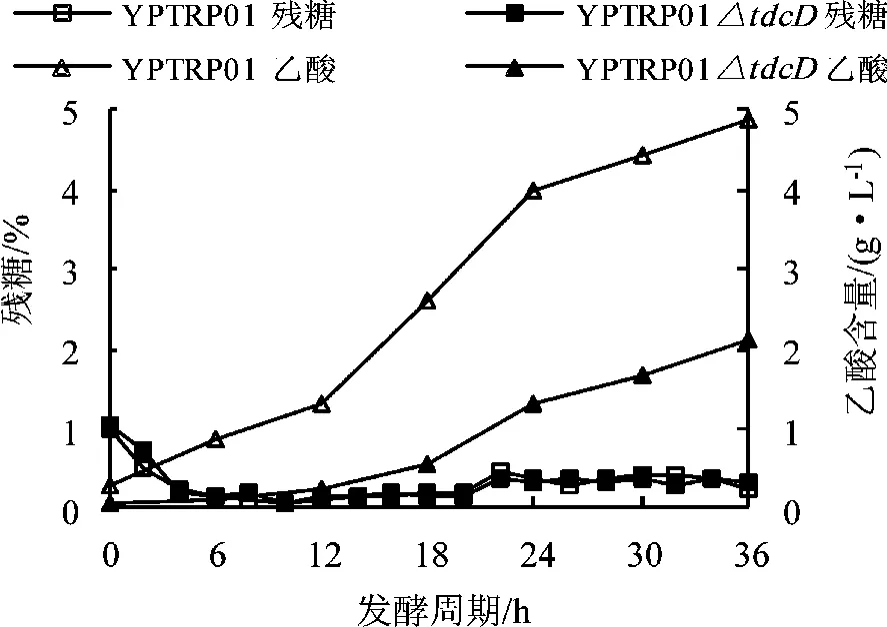
图4 YPTRP01及tdcD缺失菌在微糖控制条件下残糖及乙酸含量曲线
2.3 “高糖”控制条件下tdcD敲除对色氨酸发酵的影响
所谓“微糖”是指残糖含量在2 g/L以下,且发酵是可以正常运行的,但是当残糖含量高于3 g/L时,发酵液容易出现发臭发黑的现象,导致发酵无法进行。而所谓“高糖”是指在残糖含量达到5 g/L时发酵还可以正常运行。具体发酵条件:在5 L自动控制发酵罐上进行分批补料发酵,发酵初始培养基1.5 L,接种量13%,采用补料分批发酵(补加60%葡萄糖,用氨水调pH)的方式进行发酵,发酵温度35°C,pH维持在7.0,残糖控制在5 g/L左右,溶解氧控制在20%~30%,发酵周期36 h。每隔2 h测定OD660、残糖含量、L-色氨酸产量、乙酸含量,结果如图5、6所示。
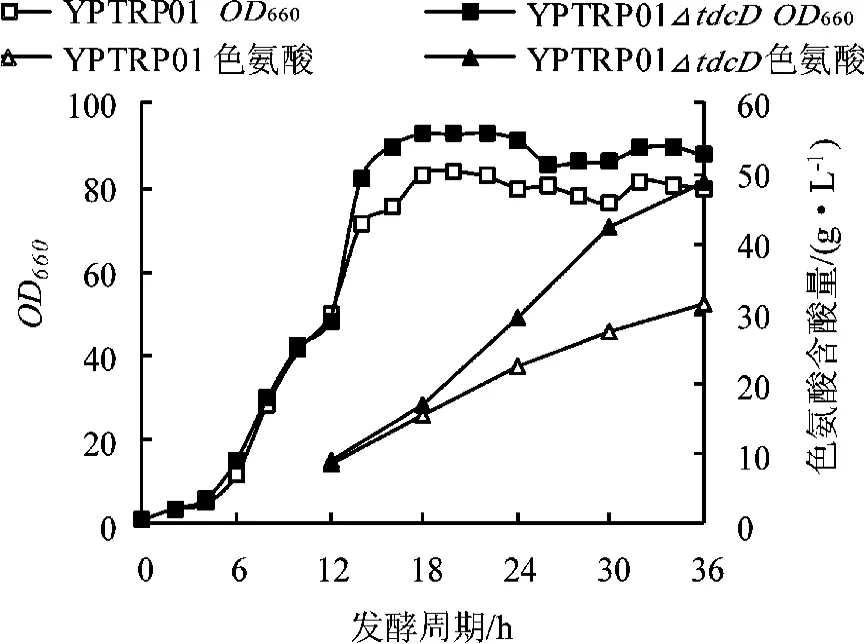
图5 YPTRP01及tdcD缺失菌在高糖控制条件下OD及色氨酸含量曲线
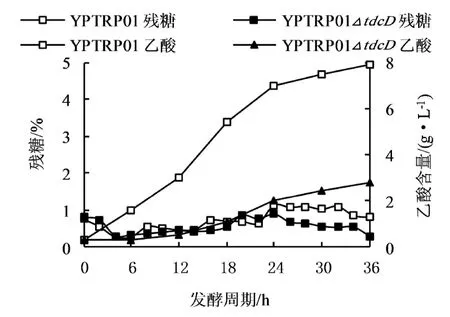
图6 YPTRP01及tdcD缺失菌在高糖控制条件下残糖及乙酸含量曲线
由图5、6可知,在“高糖”控制发酵过程中,E.coli YPTRP01及其tdcD缺失株在生长前期没有明显差异,但是在对数生长期差距明显。E.coli YPTRP01△tdcD菌株增长较快,产酸水平更高,发酵液颜色正常;而E.coli YPTRP01菌株在指数后期生长缓慢,进入稳定期后OD偏低,同时产酸量增长慢,放罐时色氨酸含量为31.5 g/L,乙酸含量高达7.93 g/L,且出现发酵液发黑发臭现象,发酵无法继续。相比较而言,E.coli YPTRP01△tdcD菌株在对数生长后期保持较高的生长速率和产酸效率,色氨酸含量最高为48.85 g/L,比对照菌株提高了42.23%,而乙酸含量最高为2.79 g/L,比对照菌株降低了62.48%。E.coli YPTRP01在发酵过程中出现发酵液发黑的现象,很可能是因为在“高糖”控制条件下乙酸大量积累造成的,E.coli YPTRP01在放罐时乙酸含量接近8 g/L,已经超过文献报道的阈值,对细胞的生长和代谢产生显著影响。
由上述结果可知,在不同的糖浓度控制条件下,E.coli YPTRP01△tdcD菌株的产酸及发酵过程中乙酸的积累量没有明显差异,且均要优于对照菌株。这也说明tdcD基因的敲除确实显著减弱了乙酸的积累,同时也使得发酵过程中所要求的残糖控制范围有所扩大,降低了发酵控制的复杂性,增强了发酵的稳定性。
3 讨论
大肠杆菌产生乙酸的途径主要有两条:一是通过PoxB途径由丙酮酸氧化酶直接作用丙酮酸产生乙酸,这主要发生在厌氧培养时;另一条是Pta-Ack途径,在磷酸转乙酰基酶和乙酸激酶的作用下将乙酰CoA转化为乙酸,主要发生在好氧培养条件下,这也是大肠杆菌色氨酸发酵中产生乙酸的主要途径。该途径中有两个基因编码乙酸激酶:ackA、tdcD。采用大肠杆菌发酵生产色氨酸的过程中,残糖含量的控制是发酵过程控制的关键因素,如果残糖含量过高,会导致代谢流量发生迁移,大约15%~30%的糖会转化形成乙酸,出现所谓的“乙酸溢流”现象。乙酸的积累量过高会影响整个细胞的生长状态及发酵性能,从而导致发酵过程难以控制。虽然过高的乙酸对细胞的生长代谢具有抑制作用,但是乙酸作为一种中间代谢产物保持适量的存在对细胞的生长,其他物质的代谢及一些酶的作用也是必不可少的,因此,也不宜将乙酸代谢途径完全敲除。有文章报道[6]对乙酸代谢途径中的pta基因进行敲除同样可以达到减少乙酸含量的目的,但是从代谢途径上分析是阻断了乙酸合成的代谢通路,使乙酸的合成量大量减少。本研究通过敲除大肠杆菌乙酸合作途径中的关键基因之一(tdcD),弱化乙酸合成代谢途径,减少乙酸生成的代谢流量来控制乙酸的生物合成,从而减少乙酸的积累量,使得乙酸在较宽的残糖控制范围内仍能保持适量的存在,而不对细胞生长及目标产物的生物合成产生不利的影响。
随着基因工程、代谢工程及反应器工程等学科的更新和发展,现代发酵工程已越来越强调多尺度研究的视角和策略。大肠杆菌的色氨酸发酵相较于谷氨酸、赖氨酸、苏氨酸等产品的发酵而言更具难度,若要进一步提高色氨酸发酵的效率和水平,迫切需要在基因尺度、细胞尺度、环境(或反应器)尺度上多维度综合研究,提出改进策略和思路。残糖浓度作为一种环境参数,它的变化直接导致了基因水平上的异动(乙酸溢流加强或减弱),进而在细胞水平上影响细胞工厂的整体运作,这些都可以通过发酵指标的变化和发酵液颜色的改变获得直观的信息。也就是说,每一个维度的参数或信息都与另一维度有着千丝万缕的联系,各维度之间必须协调统一才能实现发酵控制的优化,获得最优的发酵表现。本研究基于多尺度研究的改造理念和思路,通过基因水平的操作,使细胞代谢特性与环境尺度参数的变化相适应,通过各维度参数的协调统一来实现色氨酸发酵水平和质量的提升。本研究是多尺度发酵调控及菌种改造策略的一次尝试,也为色氨酸发酵的进一步优化和提升积累了有益的经验。
[1]DOELLE H W,EWINGS K N,HOLLYWOOD N W.Regulation of glucose metabolism in bacterial systems[M]//Microbial Reactions.Springer Berlin Heidelberg,1982:1-35.
[2]NAKANO K,RISCHKE M,SATO S,et al.Influence of acetic acid on the growth of Escherichia coli K12 during high-celldensity cultivation in a dialysis reactor[J].Applied Microbiology and Biotechnology,1997,48(5):597-601.
[3]JENSEN E B,CARLSEN S.Production of recombinant human growth hormone in Escherichia coli:expression of different precursors and physiological effects of glucose,acetate,and salts[J]. Biotechnology and Bioengineering,1990,36(1):1-11.
[4]ROE A J,MCLAGGAN D,DAVIDSON I,et al.Perturbation of anion balance during inhibition of growth of Escherichia coli by weak acids[J].Journal of Bacteriology,1998,180(4):767-772.
[5]黎景丽,文一彪.对氨基酸测定的研究(上)[J].中国调味品,2002(12):34-37.
[6]黄静,史建明等.pta基因敲除对L-色氨酸发酵的影响[J].微生物学报,2011,51(4):480-487.
(责任编辑:朱小惠)
Construction of a tdcD gene deletion strain of Escherichia coli and the study of its application in L-tryptophan fermentation process with high glucose tolerance
MENG Gang,WEI Aiying,JIA Huiping,MA Fengyong,YANG Lipeng,LI Xiaogang (Ningxia EPPEN Biotech Co.,Ltd.,Yinchuan 750100,China)
Excessive acetic acid is harmful to tryptophan fermentation,and thus the level of acetic acid is normally restricted through the regulation of glucose content in the broth.In this study,the tdcD gene in Escherichia coli was knocked out in order to reduce the accumulation of acetic acid during tryptophan fermentation.The acetic acid content variation was investigated under various glucose levels.It showed that under high glucose content,the tdcD deletion strain YPTRP01 had a higher growth rate and exhibited increased tryptophan production in late exponential phase.The tryptophan yield was increased by 54.88%to 48.85g/L and the acetic acid level was reduced by 62.8%to 2.79g/L.In conclusion,the tdcD mutant showed more flexibility in the control of glucose contents during the tryptophan fermentation.
Red recombination;tdcD gene;acetic acid;glucose content
TQ922.9
A
1674-2214(2015)02-0012-05
2015-01-09
孟刚(1976—),男,辽宁辽阳人,硕士,研究方向为微生物育种,E-mail:pufeel@163.com.
