利用胞内核磁共振法快速筛选高产DHA裂殖壶菌的研究
2015-03-20李悦明徐建春孙慧彬于水见李霞
李悦明,徐建春,孙慧彬,于水见,李霞
(青岛琅琊台集团股份有限公司,山东青岛 266400)
利用胞内核磁共振法快速筛选高产DHA裂殖壶菌的研究
李悦明,徐建春,孙慧彬,于水见,李霞
(青岛琅琊台集团股份有限公司,山东青岛 266400)
采用化学试剂亚硝基胍和紫外结合的方式对生产用裂殖壶菌进行诱变。通过核磁共振法快速原位检测约三百个突变株的胞内油脂含量和DHA占总脂肪酸比例,综合考虑两个指标,筛选出性状较优良的10余个突变株。通过进一步对其各项指标的仔细检测,最终筛选得到一株DHA高产突变菌株。突变株生物量较野生菌株没有变化,油脂含量为68%,DHA占总油脂比例57%,比出发菌株分别提高17%和14%,该突变菌株被命名为Aurantiochytrium sp. KYX-01,其性状优异,非常适合工业化生产DHA油脂。
裂殖壶菌;胞内核磁共振;诱变育种;二十二碳六烯酸(DHA)
前言
二十二碳六烯酸(DHA)属于n-3系列多不饱和脂肪酸,含有多个典型的“戊烯双键”,化学性质活泼。DHA具有很重要的生理功能,主要表现在调节中枢神经、促进智力发育、保护视力、治疗心血管疾病和抗肿瘤等方面[1]。DHA属于人体必需多不饱和脂肪酸,人体不能从头合成,只能通过食物获取。DHA来源主要是鱼油和藻油。由于鱼油存在污染、资源短缺等缺点,藻油DHA越来越受到人们重视。工业化生产藻油DHA主要菌株是寇氏隐甲藻和裂殖壶菌。1996年Nakahara等采用海水—松花粉诱捕法从珊瑚礁附近海水中首次分离得到裂殖壶菌[2],目前已经有很多株裂殖壶菌用于DHA工业生产。但是野生菌株产量偏低,后代性状单一,难以满足越来越高的工业需求。目前主要的裂殖壶菌新菌株筛选手段依然是诱变筛选。其中,诱变包括射线辐照、激光、紫外线等物理手段和亚硝基胍、硫酸二乙酯、叠氮化钠等化学试剂诱变,两者各有优势,混合使用可能收到意想不到的效果。本研究使用亚硝基胍和紫外结合的诱变方式,通过核磁共振作为初筛手段,快速原位检测油脂含量和油脂组成,进而进行复筛,得到一株油脂含量68%,DHA含量占总油脂含量57%的菌株,适合进行工业化生产。
1 材料与方法
1.1 菌株及培养条件
出发菌株裂殖壶菌SD116为生产用菌株[3]。种子培养基配方为(g/L):葡萄糖60,酵母粉20,海水晶15。将-80°C保藏的甘油菌在种子培养基中25 °C生长48 h后,将菌液按10%的接种量接入新鲜的装有50 mL种子培养基的250 mL锥形瓶中,在25°C、转速为200 r/min条件下培养4 d。在离心机中以转速4500 r/min离心10 min后收集菌体。
1.2 亚硝基胍及紫外诱变
将生长至对数中期的裂殖壶菌4500 r/min离心10 min收集菌体,无菌水洗涤两次后用磷酸盐缓冲液(pH 6.0,0.1 mol/L)重悬。分别加入终浓度为10 mg/L的亚硝基胍,处理10、20、30、40、50和60 min。处理后,稀释至合适倍数进行平板计数,确定诱变剂量。紫外诱变如下:将菌液稀释至合适浓度,涂布平板,紫外灯下照射10~200 s,置于暗处培养2 d,绘制致死曲线。
1.3 核磁共振初步筛选
样品制备:将油脂和氘代氯仿按体积比2∶5混合,置于核磁管中。胞内NMR样品制备:将培养的菌液在6500 r/min离心,将菌体重悬于缓冲液(50 mmol/L磷酸钠缓冲液,pH 7.0,200 mmol/L氯化钠)中,再反复离心重悬3~4次。最后一次将菌体沉淀重悬于等体积的缓冲液中,加10%重水,置于核磁管中。核磁共振谱仪为Bruker 600 MHz谱仪,探头为TCI超低温探头。对提取的油脂样品,采用标准的一维氢谱脉冲程序和氢去耦的碳谱脉冲程序采集氢谱和碳谱。对胞内NMR样品,采用预饱和水峰压制的氢谱脉冲程序采集氢谱,采用氢去耦的碳谱脉冲程序采集碳谱。使用Topspin 3.1软件对谱图进行处理和分析[4]。
1.4 胞内油脂提取
油脂提取方法基本参照文献中的方法进行[5]。首先将收集得到的菌体进行冷冻干燥。然后称取40~50 mg冻干粉,加入300 μL 6 mol/L HCl,室温放置30 min,再沸水浴5 min。冷却后的溶液中加入900 μL氯仿-甲醇(2∶1,V/V),蜗旋振荡混匀,然后在离心机中10000 r/min离心5 min,收集下层液体。收集的液体中加入等体积的饱和氯化钠,蜗旋振荡混匀,在离心机中10000 r/min离心5 min,收集下层液体。将收集的液体35°C旋转蒸发除去溶剂,置于50°C真空干燥,得到提取的油脂。
1.5 脂肪酸组成测定
脂肪酸组成测定参照Xiao等的方法[6]。油脂加入1 mL氯仿,2.5 mL硫酸甲醇溶液(2%,V/V)置于85°C反应3 h后,加入1 mL饱和氯化钠溶液,1 mL正己烷,振荡混合后取有机相部分进行气相色谱测定。气相色谱测定条件:采用Agilent-GC7890 A气相色谱仪,色谱柱为HP-INNOWax (30 m×250 μm×0.25 μm),载气为高纯氮,设定程序升温为100°C保持1 min,然后每分钟升温15°C至240°C,240°C保持10 min,氢离子火焰检测器(FID)温度为260°C。恒流控制,氮气流量为30 mL/min,氢气流量为30 mL/min,空气流量为400 mL/min,进样量为1 μL。
2 结果
2.1 诱变剂量确定
在进行诱变之前,需要对诱变剂的使用剂量进行确定,在合适的致死率下进行诱变,以获得尽可能大的正向突变频率。对于亚硝基胍使用剂量的确定,实验结果如图1(a)所示。可以看出,随着处理时间的延长,致死率在不断上升。在前40 min时,致死率几乎是直线上升,之后上升幅度大幅下降,最终致死率达到约100%。众所周知,亚硝基胍属于效果显著的化学诱变剂,致死率太高反而效果不佳。所以,我们把诱变剂量确定在致死率为75%时,对应的诱变剂使用剂量为100 mg/L,处理时间30 min。
紫外诱变致死率曲线如图1(b)所示。与亚硝基胍处理结果相似,随着照射时间延长,裂殖壶菌致死率不断升高。紫外诱变效率远低于亚硝基胍,所以其使用剂量我们确定在致死率为95%时,对应条件为紫外照射时间为25 s左右。

图1 诱变致死曲线
2.2 亚硝基胍诱变及初步筛选
采取前述诱变剂进行亚硝基胍化学诱变。待菌落长出后,进行摇瓶培养。培养后采用核磁共振的方法,快速检测胞内油脂含量和油脂组成成分。共计初步筛选300株,其中73株胞内油脂含量有所上升,上升超过10%的有12株,DHA含量升高的有11株。综合油脂含量和DHA含量,进行气相色谱测定,最终确定一株诱变菌株作为下一步诱变的出发菌株。其性状为:4 d摇瓶发酵,胞内油脂含量为60%,其中DHA占总油脂比例的55%。
2.3 紫外诱变及筛选
对化学诱变得到的出发菌株进行紫外诱变,诱变剂剂量为紫外照射25 s。再次利用核磁共振的方法进行检测,胞内油脂含量上升的有13株,DHA含量升高的有5株。根据此次结果进行两轮摇瓶复筛,最终得到一株油脂含量为68%的菌株,DHA占总油脂比例的57%,命名为Aurantiochytrium sp.KYX-01。相对于原始出发菌株,油脂含量提高17%,DHA比例提高14%。筛选菌株KYX-01与原始菌株的脂肪酸组成变化如表1所示。可以看出,油脂中除了DHA外还有DPA (C22:5 n-6),软脂酸(C16:0),硬脂酸(C18:0)等成分。相比较出发菌株,变化比较明显的是软脂酸(C16:0)比例有较大幅度下降,DPA和DHA有较大幅度提升。
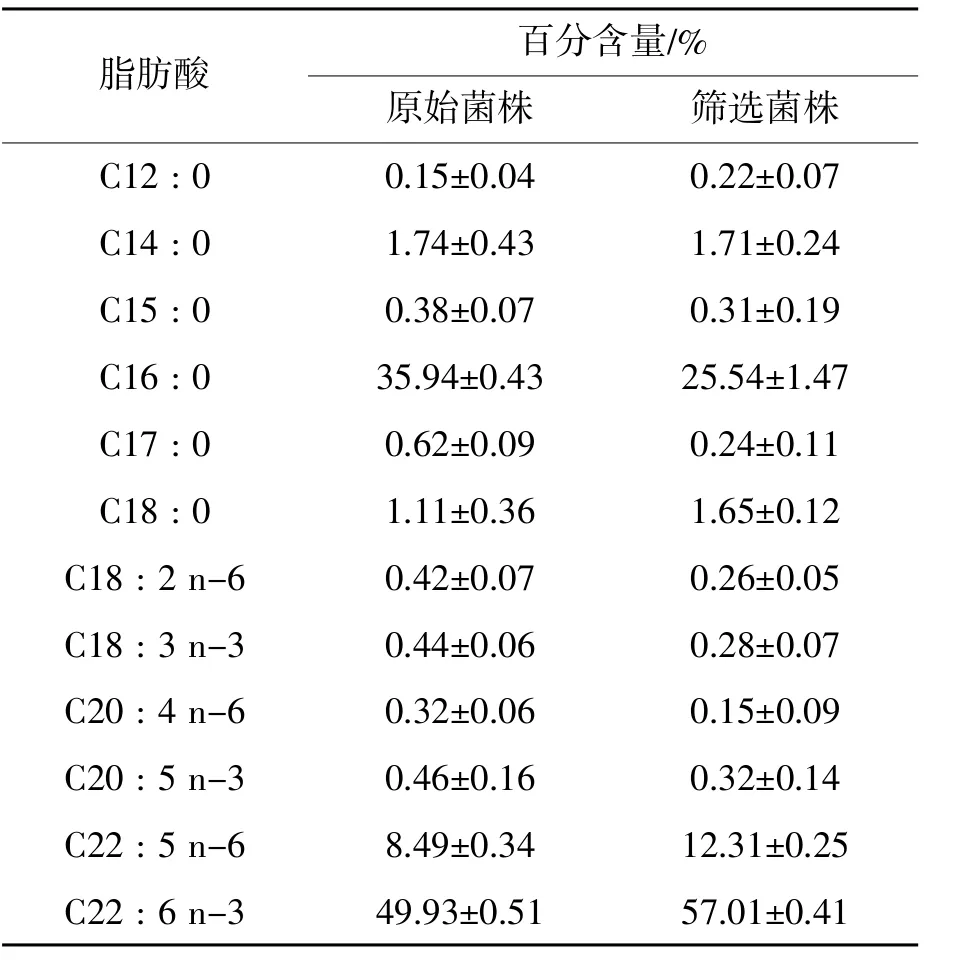
表1 筛选菌株与原始菌株脂肪酸组成比较
3 讨论
目前微生物发酵法生产制备DHA所使用的菌株为裂殖壶菌、寇氏隐甲藻和吾肯氏菌。其中,裂殖壶菌和寇氏隐甲藻使用最为广泛。而裂殖壶菌由于其生长迅速,营养需求简单,可以高密度发酵等特点备受关注。在生产过程中,裂殖壶菌可以达到的生物量(DCW)、胞内油脂含量和DHA占总脂肪酸的比例是最重要的三个指标。前两个决定了DHA油脂的产量,而DHA占脂肪酸的比例决定了油脂的品质。目前,针对这三个指标,许多研究组都在进行各方面的努力。Ren等[7]从代谢工程角度改进菌株,Zhu等[8]从培养基成分及培养条件等角度进行研究。目前,已经公开报道的适用于工业生产的裂殖壶菌菌株有SR21[9]、BL10[10]等。这些菌株性状差异不明显,油脂含量和DHA占总脂肪酸比例均不够理想,亟待开发新的性状优良的工业生产菌株。
全世界范围内,关于裂殖壶菌生理生化及代谢工程改造手段等研究相对匮乏,所以传统的诱变仍然是选育优良性状裂殖壶菌的重要手段。本研究中,选用化学和物理诱变剂相结合的方法,筛选得到了一株适合工业生产的菌株。首先采用亚硝基胍作为诱变剂进行诱变,获得优良生产性状。众所周知,亚硝基胍(NTG)是公认的效果显著的化学诱变剂,其诱变原理是易取代DNA分子中活泼的氢原子,使DNA分子上的碱基及磷酸部分被烷化,DNA复制时导致碱基配对错误而引起突变。根据经验,亚硝基胍在低致死率下,有较好的正向突变频率,致死率过高反而会降低正向突变频率。本研究中,我们选在致死率为75%时的剂量作为诱变剂量,正向突变频率达到24.3%,这也验证了亚硝基胍低致死率下有较好的正向突变频率,也说明亚硝基胍确实是良好的化学诱变剂。为了进一步改良菌种,巩固化学诱变得到的优良结果,我们又进行了紫外诱变。根据经验,紫外诱变在很高致死率下才有较好效果,所以我们选择致死率达到95%时的剂量作为诱变条件进行研究。最终筛选得到含油率68%,DHA占总脂肪酸比例为57%的适用于工业生产的菌株。
一直以来,菌种诱变后的筛选是一项极其耗费时间和精力的工作。对于不同的产物,很多研究者开发了如透明圈、变色圈、抑菌圈等快速筛选的方法。针对裂殖壶菌,很多研究者进行了许多方法的尝试,朱路英等[11]先以生物量为首要因素进行初筛,再以含油率高作为指标进行复筛,最后得到高DHA含量菌株;而张丽等[12]使用超氧化物歧化酶、丙二醛、脯氨酸作为裂殖壶菌菌种性能评价的新指标进行筛选。以上方法无法同时兼顾含油率和DHA含量两个指标,存在漏选优良性状菌株的可能。本研究采用了兰君等[4]开发的核磁共振原位检测胞内油脂含量和DHA含量,兼顾两者,不漏选优良菌株。但是,核磁共振法也存在干扰因素较多,对仪器设备要求较高和对研究者要求高的缺点。在今后的研究中,干扰因素的去除和灵敏度的提高将会是重点。
[1]DESAI A,KEVALA K,KIM H Y.Depletion of brain docosahexaenoic acid impairs recovery from traumatic brain injury[J]. PloS One,2014,9(1):e86472.
[2]NAKAHARA T,YOKOCHI T,HIGASHIHARA T,et al.Production of docosahexaenoic and docosapentaenoic acids by Schizochytrium sp.isolated from Yap islands[J].Journal of the American Oil Chemists’Society,1996,73(11):1421-1426.
[3]GAO Mang,SONG Xiaojin,FENG Yingang,et al.Isolation and characterization of Aurantiochytrium species:high docosahexaenoic acid(DHA)production by the newly isolated microalga, Aurantiochytrium sp.SD116[J].Journal of Oleo Science,2013, 62(3):143-151.
[4]兰君,谭延振,宋晓金,等.裂殖壶菌SD116油脂的胞内核磁共振研究[J].生物物理学报,2014(3):193-206.
[5]SONG Xiaojin,TAN Yanzhen,LIU Yajun,et al.Different impacts of short-chain fatty acids on saturated and polyunsaturated fatty acid biosynthesis in Aurantiochytrium sp.SD116[J]. Journal of Agricultural and Food Chemistry,2013,61(41): 9876-9881.
[6]XIAO Yan,ZHANG Jingtao,CUI Jiatao,et al.Metabolic profiles of Nannochloropsis oceanica IMET1 under nitrogen-deficiency stress[J].Bioresource Technology,2013,130:731-738.
[7]REN Lujing,HUANG He,XIAO Aihua,et al.Enhanced docosahexaenoic acid production by reinforcing acetyl-CoA and NADPH supply in Schizochytrium sp.HX-308[J].Bioprocess and Biosystems Engineering,2009,32(6):837-843.
[8]ZHU Luying,ZHANG Xuecheng,REN Xueying,et al.Effects of culture conditions on growth and docosahexaenoic acid production from Schizochytrium limacinum[J].Journal of Ocean U-niversity of China,2008,7(1):83-88.
[9]YOKOCHI T,HONDA D,HIGASHIHARA T,et al.Optimization of docosahexaenoic acid production by Schizochytrium limacinum SR21[J].Applied Microbiology and Biotechnology, 1998,49(1):72-76.
[10]YANG Hueylang,LU Chungkuang,CHEN Shufen,et al.Isolation and characterization of Taiwanese heterotrophic microalgae:screening of strains for docosahexaenoic acid(DHA)production[J].Marine Biotechnology,2010,12(2):173-185.
[11]朱路英.环境条件对裂殖壶菌生长和脂肪酸组成的影响及鲨烯合酶基因和上游调控区序列的克隆与分析[D].青岛:中国海洋大学,2006.
[12]张丽,任路静,胡元维,等.超氧化物歧化酶、丙二醛、脯氨酸作为裂殖壶菌菌种性能评价的新指标[J].微生物学报,2013,53(2):136-144.
(责任编辑:朱小惠)
Screening of high DHA yield strains from Aurantiochytrium sp.by using intracellular NMR method
LI Yueming,XU Jianchun,SUN Huibin,YU Shuijian,LI Xia
(Qingdao Langyatai(Group)Co.,Ltd.,Qingdao 266400,China)
Aurantiochytrium sp.was mutated by the combination of nitrosoguanidine and UV radiation.The intracellular lipid content and DHA proportion in total fatty acid of three hundred mutants were detected by means of a rapid in situ NMR method,and 10 mutants were selected considering these two indicators.Finally,one high DHA yield mutant was characterized through further characterization of its other properties.Compared with the wild strain,the mutant has equivalent biomass but 1.17 and 1.14 times of lipid contents and DHA proportion,which reached 68%of dry cell weight and 57%of total fatty acids respectively.This mutant was designated as Aurantiochytrium sp.KYX-01,which is very suitable for the industrial production of DHA oil because of its excellent properties.
Aurantiochytrium;intracellular Nuclear Magnetic Resonance;mutation breeding;docosahexaenoic acid(DHA)
TQ64
A
1674-2214(2015)02-0020-04
2014-12-16
国家高技术研究发展计划(863计划)(2014AA021701)
李悦明(1964—),男,高级工程师,主要从事有机酸发酵工程研发、工程项目设计等方面的研究,E-mail:xjclyt@126.com.
