人胃癌细胞系MKN-45中二甲双胍对顺铂的拮抗作用
2015-03-12王晓东李红涛朱予津
王晓东,李红涛,杨 涛,姚 旻,朱予津
300162,武警天津总队医院:1.药剂科,2.内二科
人胃癌细胞系MKN-45中二甲双胍对顺铂的拮抗作用
王晓东1,李红涛2,杨涛2,姚旻2,朱予津2
300162,武警天津总队医院:1.药剂科,2.内二科
【摘要】目的初步研究二甲双胍(metformin,Met)和Met联合顺铂(cisplatin, Cisp)对人胃癌MKN-45细胞系的抗癌作用。方法应用不同浓度Met和Cisp单独或联合处理人胃癌MKN-45细胞系,MTT法分析细胞存活率,RT-PCR检测生存素、mTOR和Akt的mRNA表达水平,流式细胞仪检测细胞凋亡。结果单独使用Met可抑制增殖并诱导凋亡;Met联合Cisp时,可降低Cisp的抗增殖作用,且生存素、Akt和mTOR的mRNA表达明显增加(P<0.05)。Met对Cisp的拮抗作用可能是通过生存素、Akt和mTOR信号通路调节。结论Met能抑制人胃癌MKN-45细胞系对Cisp化疗的敏感性,在患有2型糖尿病的胃癌患者中,应该慎重将Met与Cisp联合使用。
【关键词】二甲双胍;顺铂;胃癌;生存素
【中国图书分类号】R753.2
Preliminary study on the antagonistic effect of metformin on cisplatinin human gastric cancer MKN-45 cellline
WANG Xiaodong1, LI Hongtao2, YANG Tao2, YAO Min2, and ZHU Yujin2.1.Pharmacy Department, 2.Second Internal Medicine Department, Tianjin Municipal Corps Hospital, Chinese People’s Armed Police Force, Tianjin,300162, China
【Abstract】ObjectiveTo evaluate the effect of Metformin and Metformin combined with Cisplatin on human gastric MKN-45 cell line. MethodsTreated the human gastric cancer MKN-45 cell line withof the Metformin alone or Metformin combined withCisplatinby different concentrations,thenanalysed the cell survival rate by MTT,checked mRNA levels of survivin, mTOR, and Akt by real-time PCR, and assessed the Cell apoptosis by flow cytometry. ResultsMetformin alone could inhibit theproliferation and induce apoptosis, but it diminish anti-proliferative effects of theCisplatin when they were used in combination. When MKN-45 cells were treated with Metformin and Cisplatin, the expression of survivin and mTOR were increased. The antagonistic effect of the Metformin on the Cisplatinmight be through survivin, Akt and mTOR signaling pathways. ConclusionsMet can inhibit the chemotherapy sensitivity of CispinMKN-45 human gastric cancer cell line.For gastric cancer patients with Type 2 Diabeteswho treated with Cisp,Met should be carefully used.
【Key words】metformin;cisplatin;gastric cancer;survivin
二甲双胍(metformin,Met)是常用的以改善胰岛素抵抗为主的降糖药物[1]。Met可激活胞内AMPK,从而抑制肝脏中的糖异生,并促进外周组织的葡萄糖摄取[2]。近年来还有研究表明,使用Met可降低糖尿病患者结直肠癌、肝癌、胰腺癌的风险[3, 4]。Met还可以诱导细胞凋亡,在体外可抑制乳腺癌和卵巢癌细胞的增殖,并可抑制体内肿瘤发生和进展[5, 6]。另外Met还能改善糖尿病乳腺癌患者对化疗的反应[7]。目前,关于Met在肿瘤细胞中的详细作用机制还不十分明确,有研究发现,Met可能通过LKB1-AMPK介导的信号转导通路诱导细胞凋亡[8, 9]。
顺铂(cisplatin, Cisp)是肿瘤科常用的化疗药物,广泛应用于治疗肉瘤、淋巴瘤、生殖细胞瘤,以及卵巢癌、小细胞肺癌和胃癌等。Cisp抗癌作用的主要机制是其与DNA中嘌呤碱基相互作用,形成DNA-蛋白质,DNA-DNA链交联体,从而阻断肿瘤细胞增殖和诱导细胞凋亡[10]。有研究发现Met能提高Cisp的化疗效力,使其成为基于Cisp化疗的候选联合药物[11,12]。但在一些癌细胞中研究结果并不一致,Met还可能会拮抗抑制Cisp的化疗效力[13]。Met通过抑制氧化应激和抑制胱天蛋白酶激活抑制Cisp诱导的细胞凋亡,可能是通过抑制生存素(Survivin)途径来完成的,而生存素与信号通路PI3K-AKT-mTOR又密切相关[14]。胃癌是消化道常见恶性肿瘤,每年有超过80万人死于该病[15]。Cisp作为一种胃癌化疗的传统药物,目前尚无对Met与Cisp联合应用的效率评估,如果这两种药物联用存在拮抗作用,则对应用Met降糖的2型糖尿病合并胃癌患者使用Cisp化疗造成严重影响。因此,研究人胃癌细胞系MKN-45中Met是否通过AKT-mTOR途径,促进生存素表达,对Cisp产生拮抗抑制作用,可为2型糖尿病患者合并胃癌的治疗提供新的证据。
1材料与方法
1.1细胞培养和处理胃癌MKN-45细胞系来自伊朗巴斯德研究所(德黑兰,伊朗),在RPMI1640培养基(Invitrogen公司,美国)中进行培养,5%CO237 ℃下补充10%胎牛血清(Invitrogen公司,美国),然后将培养细胞分别用5、10、20 mg/ml浓度的Met和0.1、1.0、2.5、5.0、10.0 μg/ml浓度的Cisp(Sigma公司,美国)分别进行处理48 h和72 h。
1.2MTT法分析细胞存活率MTT测定法来检测单独应用Met和Cisp,以及Met和Cisp联合应用对MKN-45细胞存活率的影响作用。将种子细胞以每孔5000个细胞/100 μl的密度接种于含PRMI培养基的96孔板中,然后设立实验组和空白对照组,实验组给予不同浓度的Met和(或)Cisp处理48 h和72 h,对照组不给予Met和Cisp处理。实验组和对照组的介质分别用MTT溶液(0.5 mg/ml)和DMSO(3 h后)替换。进行ELISA分析,吸光度为578 nm。计算两组的细胞存活率,了解Met和Cisp单独或联合使用对胃癌细胞的作用。应用calcusin软件计算Met和Cisp联合使用的复合指数(CIS)。细胞存活率计算为(%)=(ODEXP/ODCON)×100,其中ODEXP和ODCON分别是实验组和对照组细胞的光密度。
1.3RT-PCR分析生存素、Akt和mTOR基因在MKN-45细胞系的表达快速纯的RNA试剂盒(Takara 公司,日本)从培养的细胞中提取RNA,应用NanoDrop ND-1000微量分光光度计(Nanodrop公司, 美国)进行定量分析。然后取1 μgRNA反转录,使用RT试剂盒(Takara Bio公司,日本)。RT-PCR应用PCR仪(Roche Diagnostic公司,德国)进行,使用SYBR预混液Taq技术(TakaraBio公司,日本)。分别检测生存素、Akt和mTOR基因的表达。SYBR Green主混合物(10 μl)加入2 μl cDNA样品,0.5 μl正向和反向引物(10 pmol)水和7 μl不含核酸酶的水(Qiagen公司,德国),以20 μl体系进行PCR反应。热循环条件包括在95 ℃下进行30 s的初始活化步骤,随后40个循环,包括在95 ℃下5 s的变性步骤,和60 ℃ 20 s的退火/延伸步骤,引物序列见表1。进行熔解曲线分析,以验证各个引物的单一PCR产物。以次黄嘌呤磷酸核糖转移酶1(HPRT1)扩增作为内部控制,在Ct(2-ΔΔCT)倍数变化方法的基础上,计算每个目标mRNA的相对表达量。
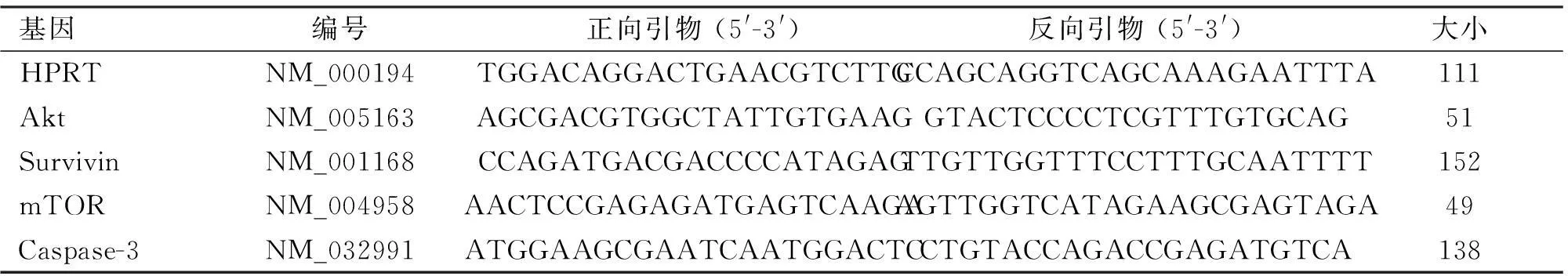
表1 RT-PCR的引物核苷酸序列
1.4流式细胞仪定量分析MKN-45细胞凋亡应用Hoechst 33342和碘化丙啶(PI)双染色试剂盒(Invitrogen公司,美国),定量分析Cisp和Met对胃癌MKN-45细胞系细胞凋亡的影响。分别应用Cisp、Met和Met/Cisp处理细胞48 h后,收获细胞并在冷PBS中洗涤,细胞密度调整至0.5×106个细胞/mlPBS。应用Hoechst33342和PI双染色,取1 μl的Hoechst 33342原液(5.0mg/ml水溶液)和1 μl的PI储备液(1.0mg/ml水溶液)加入到1 ml细胞悬浮液。15 min后,将染色的细胞通过流式细胞仪(PartecPasIII,德国)检测,使用激发/发射波长分别为350/461 nm 和535/617 nm。
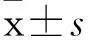
2结果
2.1Met和Cisp对MKN-45细胞存活率的抑制作用单独应用Met和Cisp作用于MKN-45细胞系,两种药物均显示对胃癌细胞具有抑制作用,且随着Met和Cisp浓度的增加,细胞的存活率逐渐下降;但是Met和Cisp联合应用处理MKN-45细胞系时,细胞的存活率并未呈更明显下降趋势,Cisp的抑癌作用并未比单独应用时更显著,反而低于单独应用,且随着Met浓度的增加,细胞的存活率更进一步降低,说明Met可拮抗Cisp的抑癌作用并呈浓度依赖关系(图1)。

图1 评估Met,Cisp和Met/Cisp对人胃癌细胞系MKN-45的生存率(P<0.05)
2.2生存素、Akt和mTOR基因在MKN-45细胞系的表达RT-PCR结果表明,胃癌MKN-45细胞系经Met或Cisp单独处理48 h后生存素表达显著降低,但在不同浓度间无统计学差异。然而,与单用Met和Cisp相比,Met联合Cisp应用可诱导生存素表达量升高,且Met剂量越大时,升高更明显(P<0.05,图2)。进一步检测Akt和mTOR基因的转录表达水平,以验证Met对Cisp是否存在的拮抗特性。结果表明,Met或Cisp单独处理48 h后,与空白对照组相比,Akt基因的转录表达水平有轻度增高,但不同浓度间无统计学差异。mTOR基因经Met处理后表达水平有轻度减低,经Cisp处理后表达水平有轻度增高,但不同浓度间无统计学差异。Met联合Cisp处理时胃癌MKN-45细胞系,与Met或Cisp单独处理相比,Akt和mTOR的表达也显著增加,且Met剂量越大,Akt和mTOR基因表达增加越显著(P<0.05,图3,图4)。
2.3Met、Cisp对MKN-45细胞凋亡影响Hoechst33342染色,凋亡细胞染色质浓缩比正常细胞更亮,PI染色只渗透到死细胞(FL2:PI,FL6:Hoechst33342)。与未处理的空白对照组相比,Met,Cisp和Met联合Cisp处理MKN-45细胞的细胞凋亡
率显著增高(图5)。FlowMax软件中得到的分析数据显示,与未处理对照组及Met处理组相比,Cisp可诱导更多的MKN-45细胞凋亡,且随着浓度增高诱导凋亡作用更显著。然而当Met与Cisp联合应用时,与Cisp单独应用相比,MKN-45细胞凋亡率却降低。Met 10 mg/ml联合Cisp 5 μM/ml比Cisp 5μM/ml单独应用诱导的细胞凋亡率更低(P<0.05);Met 20 mg/ml联合Cisp 10 μM/ml比Cisp10 μM/ml单独应用诱导的细胞凋亡率更低(P<0.05),说明Met对Cisp诱导的细胞凋亡具有一定的拮抗作用(图6)。
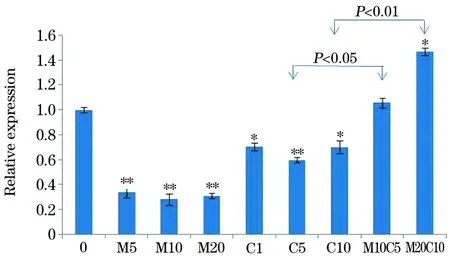
图2 RT-PCR检测Met、Cisp和Met/Cisp对的

图3 RT-PCR检测Met、Cisp和Met/Cisp
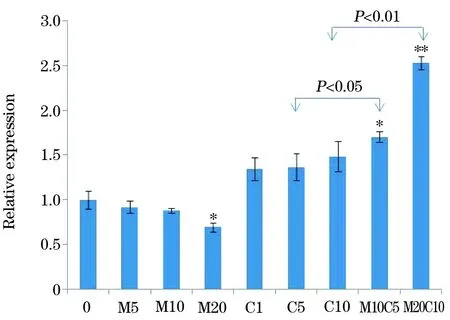
图4 RT-PCR检测Met、Cisp和Met/Cisp

图5 Met,Cisp和Met联合Cisp处理MKN-45细胞双染色流式细胞图
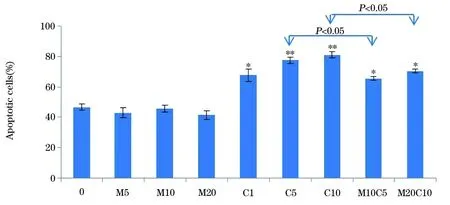
图6 B.Met,Cisp和Met联合Cisp处理MKN-45细胞的凋亡率
3讨论
大量研究表明,Met可降低多种癌症的风险,包括结肠癌、直肠癌和胰腺癌[1,16]。此外,Met在体外培养的乳腺癌和卵巢癌细胞还具有抑制细胞增殖和诱导细胞凋亡的作用[17],在体内抗肿瘤发生和抑制血管生成[18]。还有研究报道,Met可以增强Cisp在乳腺癌和卵巢癌中的抗癌效果[19-21],这与先前的报告并不一致。有研究表明,在多种其他细胞系中Met可以通过抑制氧化应激和抑制胱天蛋白酶活化抑制Cisp抗肿瘤效果[11, 22, 23]。因此,Met对Cisp的效果可能依赖于肿瘤细胞的类型。
本研究评估了单独应用不同浓度的Met和Cisp以及Met和Cisp联合应用对胃癌MKN-45细胞系的作用。MTT和流式细胞术的结果分析表明,Met可拮抗Cisp对胃癌MKN-45细胞系凋亡的影响,促进肿瘤细胞生长。进一步研究表明,这种拮抗作用可能是通过上调生存素、Akt和mTOR的转录来完成的[24-26]。生存素是一种可特异性抑制细胞凋亡和调控细胞分裂的蛋白,其编码基因定位于人类染色体17q25上。生存素可特异性结合到终端效应器细胞凋亡蛋白酶胱天蛋白酶,从而抑制细胞凋亡,使机体细胞在有丝分裂后期避免凋亡,从而促进肿瘤细胞发生恶性增殖,并促进肿瘤向周围组织进行侵袭性生长或者形成癌栓,发生远处转移[27]。有研究还发现生存素过量表达抑制依托泊苷诱导的细胞凋亡,接受化疗的食管癌患者生存素mRNA表达水平比化疗耐受患者水平明显降低,揭示生存素的mRNA和蛋白表达量与恶性肿瘤预后不良密切相关[26]。因此,生存素的过表达是肿瘤细胞对于化疗耐药性是一个极为重要的指标。有研究发现Met可激活AMPK,在磷酸化状态可通过TSC1和TSC2抑制雷帕霉素靶蛋白mTOR[21]。mTOR是一种丝/苏氨酸蛋白激酶,进化十分保守,从酵母到哺乳动物广泛存在。mTOR蛋白属于磷脂酰肌醇3-激酶相关激酶(PIKK)蛋白家族,在调节细胞生长、增殖和调控细胞周期等方面有着重要作用。mTOR的上游信号传导途径包括经典的PI3K-Akt-mTOR信号通路和非依赖PI3K-Akt途径。mTOR的下游信号传导途径是通过磷酸化蛋白翻译过程中的某些因子,参与细胞的多项功能,其过度活化与肿瘤的发生、发展密切相关。AMPK/mTOR也可以抑制生存素,对Met诱导的人胃癌细胞的凋亡起到部分抑制作用,因此是肿瘤治疗的一个重要靶点[24]。Akt也称蛋白激酶B,是调节细胞生长和凋亡的重要的丝氨酸-苏氨酸激酶,是经典的信号通路PI3K-AKT-mTOR中重要的组成部分。 AKT被活化后可磷酸化多种酶、激酶和转录因子,对细胞的功能进行调节。AKT还可促进葡萄糖的代谢和细胞周期的调节。 AKT磷酸化TSC1/2(tuberous sclerosis complex),可对mTOR活化,激活蛋白的翻译,促进细胞的生长。AKT还可对下游靶蛋白磷酸化如磷酸化Bcl-2家族成员BAD,从而产生抗凋亡作用。此外,AKT还可抑制caspase的活性,从而阻止激活凋亡的级联反应[27-29]。
本研究发现,对胃癌MKN-45细胞系单独应用Met和Cisp抑制生存素的表达,在Met单独作用下mTOR可轻度降低,Akt可轻度增高;但Cisp单独作用下mTOR和Akt均可轻度增高。但Met和Cisp联合应用时,mTOR和Akt均可明显增加,导致生存素的表达也明显增加,进而抑制细胞凋亡,造成肿瘤细胞存活率增加,引起胃癌MKN-45细胞对Cisp化疗的耐药。因此,Met与Cisp联合应用时,可拮抗降低Cisp对胃癌细胞的细胞毒性作用,其机制可能是Met激活AMPK,通过PI3K-Akt-mTOR信号传导通路,引起生长素的基因和蛋白水平表达增高,继而促进胃癌细胞的增殖,抑制胃癌细胞凋亡。因此,对于胃癌同时患2型糖尿病患者,应用Cisp进行化疗时,降糖药物的选择应慎重应用Met,因为Met有可能拮抗降低Cisp的化疗效力。鉴于本研究仅在一种胃癌细胞系发现此种现象,在其他肿瘤细胞系及人体中,是否存在Met对Cisp的拮抗抑制作用还有待进一步深入研究。
【参考文献】
[1]Iliana C Lega, Prakesh SShah, David Margel,etal. The effect of metformin on mortality following cancer among patients with diabetes[J].Cancer Epidemiol Biomarkers Prev, 2014, 23(10): 1974-1984.
[2]Cao J, Meng S, Chang E,etal. Low concentrations of metformin suppress glucose production in hepatocytes through AMP-activated protein kinase (AMPK)[J]. J Biol Chem,2014, 289(30):20435-20446.
[3]Lee M S, Hsu C C, Wahlqvist M L,etal. Type 2 diabetes increases and metformin reduces total, colorectal, liver and pancreatic cancer incidences in Taiwanese: a representative population prospective cohort study of 800,000 individuals[J].BMC Cancer, 2011, 11: 20.
[4]Zhang H, Gao C, Fang L,etal.Metformin and reduced risk of hepatocellular carcinoma in diabetic patients: a meta-analysis[J]. Scand J Gastroenterol, 2013,48(1):78-87.
[5]Vallianou N G, Evangelopoulos A, Kazazis C.Metformin and cancer[J].Rev Diabet Stud, 2013,10(4):228-235.
[6]Jiang X, Ma N, Wang D,etal.Metformin inhibits tumor growth by regulating multiple miRNAs in human cholangiocarcinoma[J].Oncotarget,2015,6(5):3178-3194.
[7]Oppong B A, Pharmer L A, Oskar S,etal.The effect of metformin on breast cancer outcomesin patients with type 2diabetes[J].Cancer Med,2014, 3(4):1025-1034.
[8]Qu C, Zhang W, Zheng G,etal. Metformin reverses multidrug resistance and epithelial-mesenchymal transition (EMT) via activating AMP-activated protein kinase (AMPK) in human breast cancer cells[J].Mol Cell Biochem, 2014, 386(1-2):63-71.
[9]Hadad S M, Hardie D G, Appleyard V,etal.Effects of metformin on breast cancer cell proliferation, the AMPK pathway and the cell cycle[J].Clin Transl Oncol, 2014, 16(8):746-752.
[10]Andreas R de Biasi, Jonathan Villena-Vargas, Prasad S. Adusumilli. Cisplatin-Induced antitumor immunomodulation: A review of preclinical and clinical evidence[J]. Clin Cancer Res, 2014, 20(11): 5384-5391.
[11]Chan J,Jung H H,Yang J Y,etal.Protectiveeffect of metformin against cisplatin- induced ototoxicity in an auditory cell line[J].J Assoc Res Otolaryngol, 2014, 15(2):149-158.
[12]Quattrini I, Conti A, Pazzaglia L,etal. Metformin inhibits growth and sensitizes osteosarcoma cell lines to cisplatin through cell cycle modulation[J].Oncol Rep, 2014, 31(1):370-375.
[13]Uehara T, Mitsuhashi A, Tsuruoka N,etal.Metformin potentiates the anticancer effects of cisplatin under normoxic conditions in vitro[J].Oncol Rep, 2015, 33(2):744-750.
[14]Huang J, Lyu H, Wang J,etal. MicroRNA regulation and therapeutic targeting of survivin in cancer[J].Am J Cancer Res, 2014, 5(1):20-31.
[15]Fock K M.Review article: the epidemiology and prevention of gastric cancer[J]. Aliment Pharmacol Ther, 2014, 40(3):250-260.
[16]Ryan J O, SarojNiraula, VukStambolic,etal. Metformin in cancer: translational challenges[J]. J Mol Endocrinol, 2012, 48(3): 31-43.
[17]Zhuang Y, Chan D K, Haugrud A B,etal. Mechanisms by which low glucose enhances the cytotoxicity of metformin to cancer cells both in vitro and in vivo[J]. PLoS One, 2014, 9(9):e108444.
[18]Dallaglio K, Bruno A, Cantelmo A R,etal.Paradoxic effects of metformin on endothelial cells and angiogenesis[J].Carcinogenesis, 2014,35(5):1055-1066.
[19]Rattan R, Graham R P, Maguire J L,etal.Metformin suppresses ovarian cancer growth and metastasis with enhancement of cisplatincytotoxicity in vivo[J].Neoplasia, 2011, 13(5):483-491.
[20]Xie Y, Peng Z, Shi M,etal.Metformin combined with p38 MAPK inhibitor improves cisplatin sensitivity in cisplatinresistantovarian cancer[J].Mol Med Rep, 2014, 10(5):2346-2350.
[21]Hongyu LIU, Christian Scholz, Chuanbing ZANG,etal. Metformin and the mTOR inhibitor everolimus (RAD001) sensitize breast cancer cells to the cytotoxic effect of chemotherapeutic drugs in vitro[J]. Anticancer Res, 2012, 32(5): 1627-1637.
[22]Zi F M, He J S, Li Y,etal.Metformin displays anti-myeloma activity and synergistic effect with dexamethasone in in vitro and in vivo xenograftmodels[J].Cancer Lett, 2015, 356(2):443-453.
[23]Janjetovic K, Harhaji-Trajkovic L, Misirkic-Marjanovic M,etal.In vitro and in vivo anti-melanoma action of metformin[J].Eur J Pharmacol, 2011, 668(3):373-382.
[24]Han G, Gong H, Wang Y,etal.AMPK/mTOR-mediated inhibition of survivin partly contributes to metformin-induced apoptosis in human gastric cancer cell[J].Cancer Biol Ther, 2015,16(1):77-87.
[25]Lesan V, Ghaffari S H, Salaramoli J,etal.Evaluation of antagonistic effects of metformin with Cisplatin in gastric cancer cells[J].Int J HematolOncol Stem Cell Res, 2014, 8(3):12-19.
[26]Cao W, Yang W, Fan R,etal.miR-34a regulates cisplatin-induce gastric cancer cell death by modulating PI3K/AKT/survivinpathway[J].Tumour Biol, 2014 ,35(2):1287-1295.
[27]Ettl T, Viale-Bouroncle S, Hautmann M G,etal.AKT and MET signalling mediates antiapoptoticradioresistance in head neck cancer cell lines[J].Oral Oncol,2015,51(2):158-63.
[28]Tsubaki M, Takeda T, Ogawa N,etal.Overexpression of survivin via activation of ERK1/2, Akt, and NF-κB plays a central role in vincristine resistance in multiple myeloma cells[J].Leuk Res, 2015, 39(4):445-452.
[29]Hsin I L, Ou C C, Wu M F,etal.GMI, an Immunomodulatory Protein from Ganodermamicrosporum, Potentiates Cisplatin-Induced Apoptosis via Autophagy in Lung Cancer Cells[J].Mol Pharm, 2015, 12(5):1534-1543.
(2015-01-26收稿2015-05-22修回)
(责任编辑岳建华)
作者简介:王晓东,本科学历,副主任药师,E-mail:18920968578@163.com通讯作者:李红涛,E-mail:hongtlee@126.com
