猪霍乱沙门菌裂解性噬菌体的分离鉴定及生物学特性研究
2015-03-11蒋依倩齐宇徐凤宇
蒋依倩,齐宇,徐凤宇
(吉林农业大学动物科技学院,长春 130118)
猪霍乱沙门菌裂解性噬菌体的分离鉴定及生物学特性研究
蒋依倩,齐宇,徐凤宇*
(吉林农业大学动物科技学院,长春 130118)
以药敏试验筛选出的多重耐药猪霍乱沙门菌为宿主,经双层琼脂纯化法从健康猪粪便中获得裂解性噬菌体SP3383。电镜观察发现该噬菌体为长尾病毒科成员;酶切分析表明其基因组为大于47.4 kb的双链DNA,可被限制性内切酶NcoI和BamH I酶切;生物学特性研究表明SP3383对温度和酸碱环境耐受力较好;最佳感染复数为0.1,潜伏期约为30 min,爆发期约60 min,平均爆发量为48 PFU/cell。本研究可为应用噬菌体治疗耐药猪霍乱沙门菌感染提供参考。
猪霍乱沙门菌;裂解性噬菌体;生物学特性
猪沙门菌病是危害养猪业发展的重要传染病之一,主要由猪霍乱沙门菌、猪伤寒沙门菌、肠炎沙门菌等病原菌引起[1]。近年来,沙门菌的耐药性日益增强[2],具有多重耐药的猪霍乱沙门菌在世界各地陆续被报道[3-5]。如何有效防控耐药沙门菌株感染,成为困扰养殖户的难题。噬菌体作为细菌的“天敌”,已被各国学者作为治疗多重耐药菌感染的新希望,也是当前的研究热点[6]。大量动物实验结果表明,噬菌体能有效治疗细菌感染,其与抗生素相比有很大优势:依赖宿主菌进行复制,治疗所需剂量小;专一性强,对机体正常菌群副作用小[7]。本研究选取对多种抗生素耐药的猪霍乱沙门菌为宿主,分离裂解性沙门菌噬菌体,通过研究其基本生物学特性,在丰富对噬菌体多样性认知的同时,也为更深入地研究和利用该噬菌体奠定基础。
1 材料与方法
1.1 菌株 猪霍乱沙门菌CVCC3383株、CVCC3775株、CVCC3780株、TTBSS株、大肠杆菌ATCC25922株;本实验室分离并保存的沙门菌JL-1株、JL-2株、JL-3株、GZL-3株、SY-11株、CF-1株、CF-2株、金黄色葡萄球菌LY株、大肠杆菌SHY株、TH株。
1.2 主要试剂与仪器 聚乙二醇、DNase I、RNase A、Mung Bean Nuclease酶购自北京鼎国生物技术有限责任公司;限制性内切酶购自大连宝生生物工程有限公司;阿莫西林、恩诺沙星、链霉素等7种药敏片购自杭州微生物公司;LB培养液、上层LB培养基(含0.7%琼脂)、下层LB培养基(含1.5%琼脂)、2×LB培养液(酵母粉10 g,胰蛋白胨20 g,NaCl 20 g,定容至1L)依标准方法配制;水解酪蛋白琼脂(MH琼脂)购自海博生物技术有限公司。Himac CP100MX超速离心机为日本日立公司产品;TEM-100CX透射电镜为日本TEOL LTD公司产品。
1.3 方法
1.3.1 宿主菌的筛选 分别用无菌生理盐水稀释猪霍乱沙门菌CVCC3383株、CVCC3780株、CVCC3775株、TTBSS株过夜培养菌液,使菌液浓度为108CFU/mL。将菌液均匀地涂布于直径9 cm的MH平板上,室温下放置5 min后,将阿莫西林、恩诺沙星、链霉素等7种药敏片贴于培养基表面并做好标记,将平板置于37 ℃恒温箱内培养16~18 h后观察结果,根据CLSI动物源细菌药敏试验标准以及人医CLSI细菌药敏试验标准[8-9]判断细菌耐药情况。以大肠杆菌ATCC25922株进行质量控制。
1.3.2 噬菌体的分离与纯化 以筛选出的耐药沙门菌作为宿主菌分离噬菌体。采集不同猪场的新鲜粪样用生理盐水重悬后静置1 h,上清液7000 r/min离心20 min,收集上清用0.22 μm微孔滤器过滤。取滤液5 mL加入5 mL 2×LB培养液,再加入200 μL过夜培养宿主菌,室温静置 15 min,37 ℃、150 r/min 振荡过夜进行噬菌体富集培养。将培养液4 ℃、12000 r/min离心20 min,取上清重复富集操作3次,用0.22 μm滤膜过滤得拟含噬菌体的原液。通过点滴法进行验证实验:用涂布棒将100 μL过夜培养的宿主菌(菌液浓度达1.0×109CFU/mL)于直径7 cm的LB平板上涂开,滴加噬菌体原液5μL,阴性对照组(CK)滴加等量LB培养液,37 ℃培养12 h观察菌苔形成情况,滴加噬菌体原液后形成无菌区域即噬菌体分离成功。
利用双层平板法进行噬菌体的纯化:取适当稀释倍数的噬菌体原液100 μL与100 μL菌液混合,室温放置15 min,加入50 ℃上层培养基5 mL,迅速混匀,倾倒入下层LB平板上,37 ℃恒温培养过夜,观察噬菌斑。挑取大且透亮的单一噬斑于5 mL LB培养液中,加入100 μL宿主菌培养过夜,培养液4 ℃ 12000 r/min离心20 min,取上清检测噬菌斑形成情况。此过程重复多次,即得纯化噬菌体。
1.3.3 噬菌体的浓缩与电镜观察 纯化后的噬菌体按照λ噬菌体颗粒的PEG/NaCl沉淀提取方法[8]进行浓缩,得到噬菌体浓缩液。采用磷钨酸负染法,在透射电镜下观察噬菌体的形态。
1.3.4 噬菌体核酸类型鉴定与酶切分析 参照《分子克隆实验指南》中从大规模培养物中提取λ噬菌体基因组的方法[8]得到噬菌体核酸。分别将DNase I、RNase A和Mung Bean Nuclease与噬菌体核酸混合,37 ℃温育1 h,0.7%琼脂糖凝胶电泳检测其结果。分别用限制性内切酶BInI、EcoR I、BamH I、NcoI和Xhol I将噬菌体核酸37 ℃酶切10 h,0.7%琼脂糖凝胶电泳检测酶切结果。
1.3.5 噬菌体的宿主谱分析 通过点滴法分析噬菌体的噬菌谱:将除宿主菌外的12株受试菌株(108CFU/mL)菌液均匀地涂布于培养基上,室温放置5 min后,滴加5 μL纯化后的噬菌体液,待吸收后恒温培养过夜,观察细菌和噬菌体的生长情况。统计各细菌的裂解情况即得该噬菌体的宿主谱。
1.3.6 噬菌体的热稳定性与酸碱稳定性测定 取200 μL噬菌体分别与等体积不同pH值的LB培养液(pH值2~13)混匀,37 ℃水浴2 h,利用双层平板法测定效价。取200 μL噬菌体(9×108PFU/mL)分别于 40、45、50、55、60、65、70、75、80、85 ℃水浴环境中作用20、40、60 min,测定其效价变化。
1.3.7 噬菌体最佳感染复数(MOI)的测定 取对数期宿主菌,按感染复数分别为1000、100、10、1、0.1、0.01、0.001加入噬菌体和宿主菌,37 ℃振荡培养5 h,4 ℃ 12000 r/min离心20 min,取上清液测定各组噬菌体效价。
1.3.8 噬菌体的一步生长曲线 取对数期宿主菌,按测得的MOI值加入噬菌体,37 ℃温育20 min,10000 r/min离心1 min,弃上清,沉淀用LB培养液洗涤两次后加入37 ℃预热的LB培养液中混匀,迅速于37 ℃振荡培养,于0时刻和每隔10 min取样,测定噬菌体效价。以感染时间为横坐标,噬菌体效价对数值为纵坐标,绘制一步生长曲线。
2 结果
2.1 宿主菌的筛选 药敏试验结果表明,大肠杆菌ATCC25922株的抑菌圈在预期范围内,4株猪霍乱沙门菌中,CVCC3383株沙门菌仅对头孢噻肟敏感,对阿莫西林、恩诺沙星、链霉素、氟苯尼考、环丙沙星、多西环素不敏感(图1),选作宿主菌。

1.阿莫西林;2.恩诺沙星;3.链霉素;4.氟苯尼考;5.环丙沙星;6.头孢噻肟;7.多西环素图1 CVCC3383株沙门菌药敏实验结果
2.2 噬菌体的分离纯化 点滴法验证结果见图2,LB平板上滴加拟含噬菌体的原液后出现CVCC3383沙门菌的无菌区域,阴性对照正常长出菌苔,说明噬菌体分离成功。通过反复纯化,得到纯化后的噬菌体,双层平板噬斑结果见图3。纯化后的噬菌体噬斑透亮,边缘整齐,直径约1.5~1.8 mm(培养12 h),将其命名为SP3383。

CK:滴加LB培养液作阴性对照;SP3383:滴加拟含噬菌体的原液后形成的无菌区图2 噬菌体原液点滴法验证实验
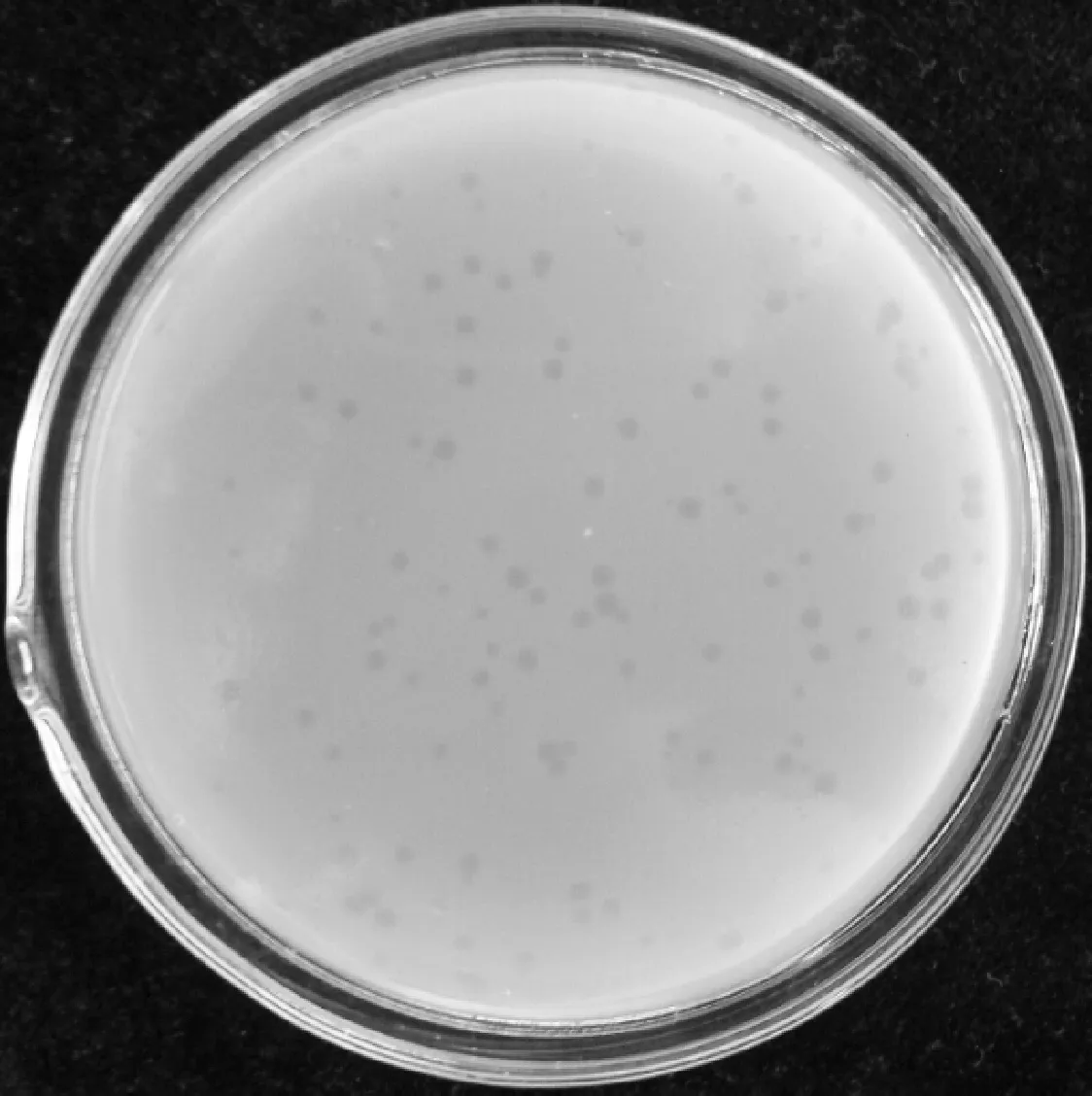
图3 噬菌体纯化结果
2.3 噬菌体的电镜观察 透射电镜观察SP3383呈蝌蚪状,头长(41.40±0.33)nm,宽(43.86±0.26)nm,尾长(96.49±0.38)nm,属于有尾噬菌体目,长尾病毒科(图4)。

图4 噬菌体SP3383的透射电镜观察图
2.4 噬菌体的核酸类型鉴定与酶切分析 提取噬菌体SP3383基因组,分别用DNase I、RNase A、Mung Bean Nuclease作用后进行电泳检测,发现SP3383核酸能被DNase I完全降解,证实SP3383为双股DNA噬菌体(图5)。用限制性内切酶BInI、EcoR I、BamH I、NcoI、XholI对SP3383的核酸进行酶切,经电泳检测发现,SP3383含有BamH I、NcoI的酶切位点,经NcoI酶切后可获得清晰的5条带,通过与Maker比较经计算可知噬菌体SP3383基因组长度大于47.4 kb(图6)。
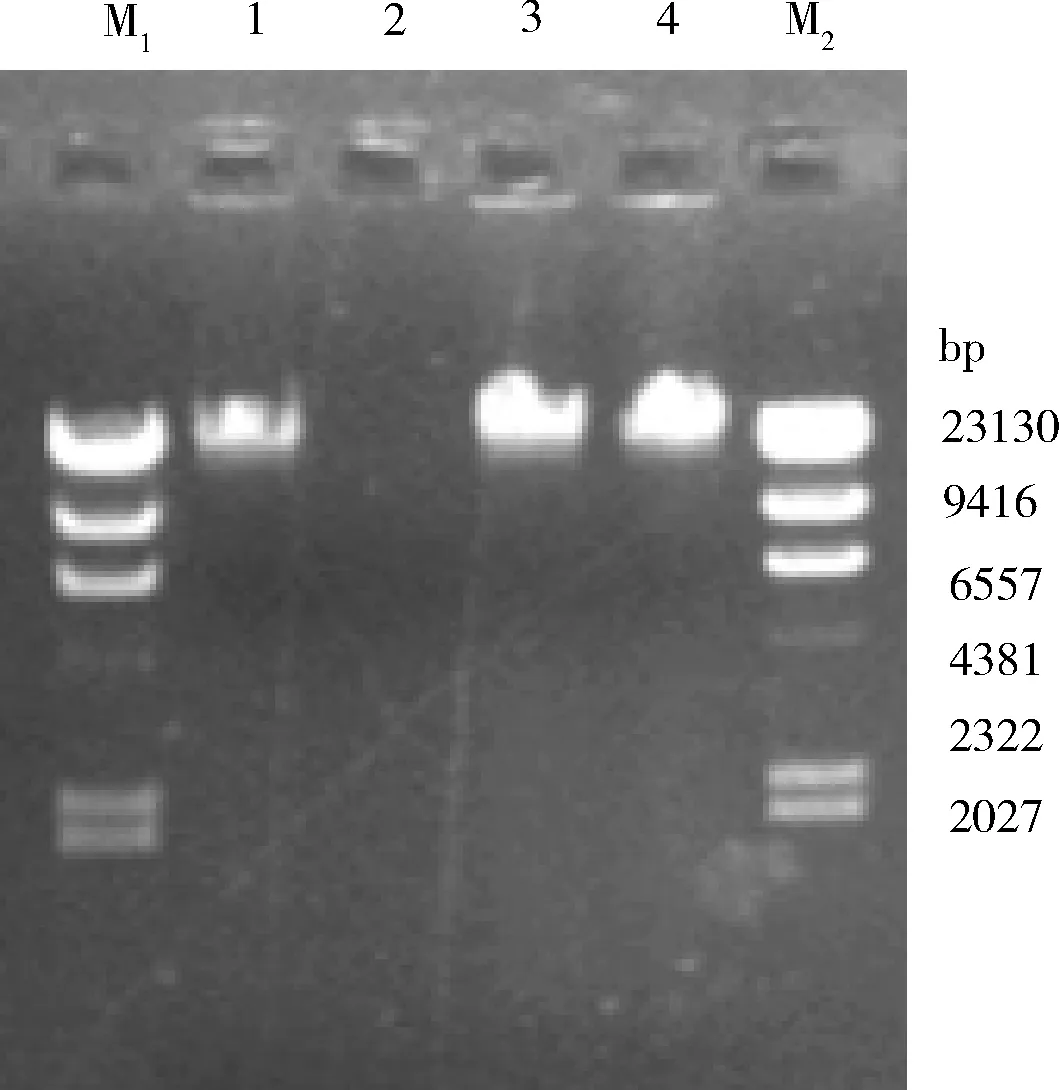
M1、M2:λ-Hind Ⅲ digest DNA Marker;1.SP2基因组;2.DNase I作用结果;3.RNase A作用结果;4.Mung Bean Nuclease作用结果图5 噬菌体SP3383核酸类型鉴定结果
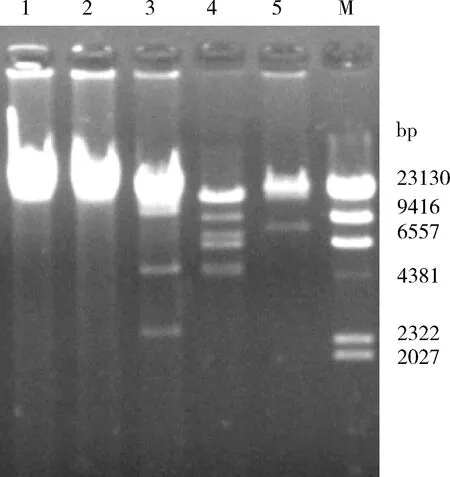
M:λ-Hind Ⅲ digest DNA Marker;1.BIn I酶切;2.EcoR I酶切;3.BamH I酶切;4.Nco I酶切;5.Xhol I酶切图6 噬菌体SP3383基因组DNA酶切图
2.5 噬菌体的宿主谱分析 点滴法测定SP3383的宿主范围,除裂解猪霍乱沙门菌CVCC3383外,还能裂解CVCC3775株霍乱沙门菌、CVCC3780株霍乱沙门菌。
2.6 噬菌体的热稳定性与酸碱稳定性 噬菌体SP3383在pH值为4~11的条件下具有较高的效价。虽然pH值小于6及大于9都会导致噬菌体效价降低,但仍能达到108PFU/mL。SP3383在强酸或强碱环境下(pH≤3或pH≥12时)丧失活性(图7)。

图7 噬菌体SP3383的酸碱稳定性
温度对噬菌体SP3383的影响见图8,从中可以看出噬菌体在40~65 ℃下作用20、40、60 min效价变化不明显,几乎维持在初始效价。当环境温度达到70 ℃时,作用时间越长噬菌体效价降低约明显,75 ℃作用60 min后几乎不存在活性噬菌体。而在80 ℃的高温处理条件下噬菌体基本被灭活。
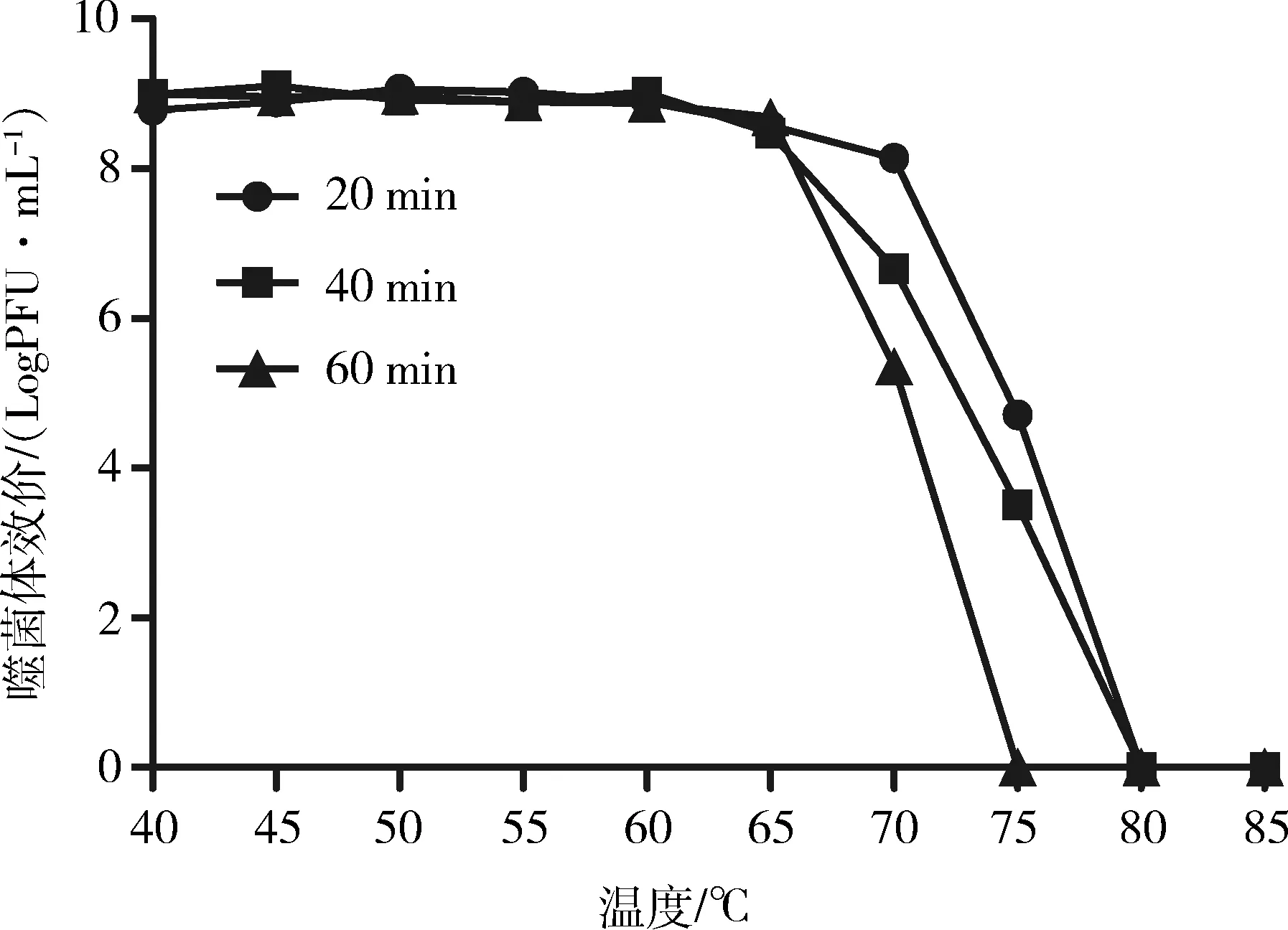
图8 噬菌体SP3383的热稳定性
2.7 噬菌体的最佳感染复数 结果见表1。当感染复数为0.1时噬菌体SP3383效价为1.54×1010PFU/mL,在7个感染复数中最高,为最佳感染复数。

表1 噬菌体SP3383的MOI测定结果
2.8 噬菌体的一步生长曲线 绘制噬菌体SP3383的一步生长曲线如图9所示,SP3383感染宿主菌后30 min内,噬菌体的量基本不变,即潜伏期约30 min;在感染后的30~90 min内,噬菌体的量急速增加,因而该噬菌体的爆发期约60 min;在随后的60 min,噬菌体的量变化不大,即噬菌体进入到稳定期;根据公式爆发量=爆发末期噬菌体效价/感染初期宿主菌浓度,算得SP3383爆发量约为48 PFU/cell。

图9 噬菌体SP3383一步生长曲线
3 讨论
目前,细菌耐药问题日益凸显,已成为世界关注的焦点。而近年来的耐药检测结果表明沙门菌耐药情况也越来越严重,加春生等[9]对25株猪霍乱沙门菌临床分离株进行了18种临床常用抗生素的药敏试验,结果表明它们对氨苄青霉素、氟喹诺酮类、四环素类和氨基糖苷类药物高度耐药。本研究经药敏试验筛选出多重耐药沙门菌作为宿主分离到裂解性噬菌体SP3383,为防控耐药沙门菌提供了新思路。
为了更合理地应用噬菌体SP3383,本研究对其进行了生物学特性分析。结果表明:SP3383对酸碱的耐受能力明显优于李萌等[10]报道的沙门菌噬菌体SP3和Ahiwale 等[11]报道的噬菌体φSPB,与包红朵等[12]报道的噬菌体PA13076、PC2184和江艳华等[13]报道的SLMP1相近;SP3383较噬菌体SP3、φSPB、PA13076、PC2184以及SLMP1耐受的温度更高;SP3383与噬菌体SP3、PA13076相比,潜伏期长,爆发持续时间短,爆发量高,说明其具有良好的裂解能力。
一般而言,噬菌体侵入的宿主非常特异,这与其吸附的特异受体有关,也与细菌演化的免疫机制有关[14]。毛普加等[15]通过试验确定了长尾副甲噬菌体受体为副甲菌的脂多糖和外膜蛋白,而噬菌体SP3383的受体是否与此相同,需要进一步深入研究。
[1] 迟国文.仔猪副伤寒的流行、诊断及防治[J].养殖技术顾问, 2015, (4):88-88
[2] Hur J, Jawale C, Lee J H.Antimicrobial resistance ofSalmonellaisolated from food animals: a review[J].Food Research International, 2012, 45(2): 819-830
[3] Li R, Jing L, Yang W,etal.Prevalence and characterization ofSalmonellaspecies isolated from pigs, ducks and chickens in Sichuan Province, China[J].International Journal of Food Microbiology, 2013, 163(1): 14-18.
[4] He Y, Lin L, Alam M J,etal.Prevalence and antimicrobial resistance of Salmonella in retail foods in northern China[J].International Journal of Food Microbiology, 2010, 143(3): 230-277.
[5] Gómez-Laguna J, Hernández M, Creus E,etal.Prevalence and antimicrobial susceptibility of Salmonella infections in free-range pigs.[J].Veterinary Journal, 2011, 190(1):176-178.
[6] Robert J Citorik, Mark Mimee, Timothy K Lu.Bacteriophage~based synthetic biology for the study of infectious diseases[J].Current Opinion in Microbiology, 2014, 19: 59-69.
[7] Nigam A, Gupta D, Sharma A.Treatment of infectious disease: beyond antibiotics[J].Microbiological Research, 2014, 169:643-651.
[8] Clinical and Laboratory Standards Institute.Performance Standards for Antimicrobial Disk and Dilution Susceptibility Tests for Bacteria Isolated from Animals: Approved Standard [M].Third Edition, CLSI Document, 2008:M31-A3.
[9] Clinical and Laboratory Standards Institute.Performance Standards for Antimicrobial susceptibility Testing: Approved Standard[M].CLSI Document, 2012:M100-S22.
[10]Sambrook J, Russell D W.分子克隆实验指南[M].第3版.北京: 科学出版社, 2002: 185-187, 195-197.
[11]加春生, 毛泽明, 耿明杰, 等.猪沙门菌分离株的毒力及耐药特征[J].中国兽医科学, 2015, (2): 190-194.
[12]李萌, 韩峰, 林洪, 等.一株沙门氏菌烈性噬菌体的分离纯化与生理特性研究[J].水产科学, 2013, 32(9): 531-535.
[13]Ahiwale S S, Bankar A V, Tagunde S N,etal.Isolation and characterization of a rare waterborne lytic phage ofSalmonellaentericaserovarParatyphiB[J].Canadian Journal of Microbiology, 2013, 59(5): 318-323.
[14]包红朵, 张鹏禹, 周艳, 等.沙门氏菌裂解性噬菌体的分离鉴定及其生物学特性[J].食品科学, 2015, (5): 131-136.
[15]江艳华, 李风铃, 王联珠, 等.一株沙门氏菌裂解性噬菌体的分离鉴定及生物学特性[J].微生物学通报, 2015, 42(3):534-542.
[16]李铁民.解析细菌免疫系统[J].微生物学报, 2011, 51(10): 1297-1303.
[17]毛普加, 冯 金, 洪 愉, 等.甲型副伤寒沙门菌噬菌体的分离及其生物学特性的分析[J].中国生物制品学杂志, 2014, 27(4): 458-466.
(编辑:李文平)
Isolation, Identification and Biological Characteristics Study of LyticSalmonellacholeraesuisBacteriophage
JIANG Yi-qian, QI Yu, XU Feng-yu*
(CollegeofAnimalScienceandTechnology,JilinAgriculturalUniversity,Changchun130118,China)
This research used the multiple drug-resistantSalmonellacholeraesuisstrain which was screened out through the drug sensitive test as the host, and isolated the lytic bacteriophage SP3383 from the health pig’s feces by double agar purification method.The electron microscopic observations found that SP3383 belonged toSiphoviridae, and the enzyme digestion analysis indicated that its genome was double stranded DNA whose length was greater than 47.4kb and the genomes could be digested by restriction enzymesNcoI andBamH I.The results of biological characteristics studies showed that SP3383 had excellent tolerance to temperature, acidic or alkaline environment, the optimal MOI was 0.1, the latent period was 30 min, the burst period was 60 min and the average burst size was about 48 PFU per cell.This research can provide reference for the application of bacteriophage to treat the infection of multi-drug resistanceSalmonellacholeraesuis.
Salmonellacholeraesuis; lytic bacteriophage; biological characteristics
吉林省科技厅项目(20140204069NY)
蒋依倩,硕士研究生,从事动物微生态制剂研究。
徐凤宇。E-mail: Xvfengyv2002@126.com
2015-08-07
A
1002-1280 (2015) 11-0005-06
S852.6
