特异性免疫治疗儿童咳嗽变异性哮喘远期疗效分析
2015-03-09王翠华
王翠华,汤 林
(菏泽市立医院儿科,山东 菏泽 274031)
特异性免疫治疗儿童咳嗽变异性哮喘远期疗效分析
王翠华※,汤林
(菏泽市立医院儿科,山东 菏泽 274031)
摘要:目的探究并分析特异性免疫治疗儿童咳嗽变异性哮喘(CVA)远期疗效。方法选取2010年1月至2012年1月菏泽市立医院收治的儿童CVA的112例,按照随机数字表法分为观察组(60例)和对照组(52例)。对照组按需给予对症治疗(包括β2激动剂,或缓释茶碱,或白三烯调节剂糖皮质激素等),观察组患者在常规治疗基础上给予舌下特异性免疫治疗(SLIT),于清晨早饭前将滴剂滴于舌下,含1~3 min后吞服,每日1次,具体用药剂量也可根据患者治疗情况给予调整,已达到最佳治疗效果,治疗时间为2年,停药后随访1年。观察两组患儿治疗开始1、2年及停药1年的咳嗽发作次数、持续的时间、每年患儿儿童哮喘控制测试中文版(Ch-CACT)测试、峰值呼气流速(PEF)监测,每年CVA转变为典型哮喘的例数。结果两组患儿随着治疗的进行Ch-CACT评分呈上升趋势[对照组:(21.0±2.1)分、(22.4±1.9)分、(22.2±1.5)分;观察组:(20.6±2.2)分、(25.1±1.5)分、(24.4±1.3)分],观察组治疗结束时和治疗后1年Ch-CACT评分高于对照组(P<0.05)。观察组患儿治疗后PEF实测值/预计值呈先上升趋势[观察组:(88±5)%、(96±6)%、(97±5)%、(96±5)%],停药1年末略有降低;对照组入组、治疗1年末、治疗2年末、停药1年末PEF实测值/预计值波动较大[对照组:(88±17)%、(92±6)%、(89±7)%、(90±5)%,P<0.05]。观察组与对照组患儿治疗后咳嗽次数呈下降趋势[观察组:(4.68±1.87)次,(2.33±0.58)次,(2.36±0.41)次;对照组:(4.75±1.79)次,(4.26±0.73)次,(3.98±0.66)次],且观察组患儿停药后1年咳嗽次数明显少于对照组(P<0.05)。观察组患儿治疗后持续时间组间呈下降趋势(P<0.05),且观察组患儿停药后1年持续时间显著短于对照组(P<0.05)。停药1年末对照组转变为典型哮喘19例(36.5%),而观察组转变为典型哮喘11例(18.3%),观察组转变为典型哮喘率显著低于对照组,差异有统计学意义(P<0.05)。结论SLIT能有效改善CVA患者呼吸功能,改善患者咳嗽症状,减少发作,安全有效,效果稳定,值得临床广泛推广。
关键词:咳嗽变异性哮喘;儿童;特异性免疫治疗;远期疗效
咳嗽变异性哮喘(cough variant asthma,CVA)是儿童慢性咳嗽最常见的原因之一,占儿童慢性咳嗽的17%~40%,CVA以咳嗽为唯一或主要表现,喘息明显,属于特殊类型哮喘[1-3]。尘螨是目前世界上存在最广泛的变应原之一,也是诱发支气管哮喘发作的重要变应原。目前,哮喘的治疗主要为对症治疗,通过使用气管扩张剂以及糖皮质激素达到缓解症状的目的,但以上治疗需长期用药,未针对病因进行治疗[4]。近年来,随着医学技术的发展以及对免疫学的深入研究,关于特异性免疫疗法的研究在临床逐渐开展。特异性免疫治疗(specific immunotherapy,SIT)是指让患儿反复接触特定种类变应原,待患儿对变应原敏感性降低后,逐渐增加变应原提取物的浓度,如此反复接触,可使患儿减轻或者消除对变应原的过敏状态[5]。舌下SIT (sublingual SIT,SLIT)治疗儿童过敏性哮喘疗效已有相关报道,但SLIT治疗CVA停药后患儿的长期效果评估的相关报道还比较少。为此,本研究对SLIT治疗儿童CVA的疗效进行探讨,现报道如下。
1资料与方法
1.1一般资料 选取2010年1月至2012年1月菏泽市立医院收治的儿童CVA 112例,按照随机数字表法分为观察组(60例)和对照组(52例)。观察组男33例、女27例,年龄5~12岁,平均(6.1±1.5)岁,病程2~5年,平均(3.5±0.3)年;对照组男28例、女24例,年龄4~11岁,平均(6.9±1.1)岁,病程2~6年,平均(3.5±0.4)年;纳入标准:①CVA诊断依据2008年儿童支气管哮喘防治指南[4];②年龄4~13岁;③受试者行皮肤点刺试验,对尘螨过敏(++)以上。排除标准:①有自身免疫疾病史;②有呼吸系统感染不能入选;③合并严重心、肝、肾、血液系统疾病,恶性肿瘤,传染性疾病,寄生虫疾病;④肺结核活动期;⑤对本研究所用药物过敏或者无法耐受本研究涉及的变应原,因各种原因无法完成本试验包含检查,以上患儿均于本院确诊为CVA,并且两组患儿性别、年龄、病程等比较,差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会批准,患儿及家属知情同意并签署知情同意书。
1.2方法 对照组患儿按需给予对症治疗(包括β2激动剂,或缓释茶碱,或白三烯调节剂糖皮质激素等);观察组患儿在常规治疗基础上给予SLIT,具体方法:治疗前对患儿进行尘螨皮肤试验,并进行试验前准备(包括抢救药品以及向患儿家属交代本实验基本情况),如患儿发生危急情况,立即停止治疗,进行抢救。试验确定无过敏反应后于清晨早饭前将粉尘螨滴剂1~4号(浙江我武生物科技股份有限公司生产,批号:20091124)滴于舌下,含1~3 min后吞服,每日1次。若患儿用药后出现疲劳症状,也可将用药时间改为晚上。治疗前3周服用剂量逐渐递增,依次为1号(总蛋白浓度1 mg/L),2号(总蛋白浓度10 mg/L),3号(总蛋白浓度100 mg/L),每周1~7 d依次服用1、2、3、4、6、8、10滴。第4周开始服用粉尘螨滴剂4号(总蛋白浓度333 mg/L),每次服用3滴,每日1次。具体用药剂量也可根据患儿治疗情况给予调整,已达到最佳治疗效果。两组患儿均按照儿童哮喘规范化治疗方案[6]进行治疗,治疗时间为2年,停药后随访1年。
1.3观察指标以及评价标准观察两组患儿治疗开始1、2年及停药1年的咳嗽发作次数、持续的时间、每年患儿儿童哮喘控制测试中文版(Chinese-Childhood Asthma Control Test,Ch-CACT)测试、峰值呼气流速(peak expiratory flow rate,PEF)监测,每年CVA转变为典型哮喘的例数。哮喘控制测试参考葛兰素史克公司制订的儿童哮喘控制测试(Childhood asthma control test,C-ACT)测试中文版[7-8]。
2结果
2.1两组患儿治疗前后Ch-CACT比较两组患儿治疗前、治疗结束时、治疗后1年Ch-CACT评分呈上升趋势,观察组上升速度更快,组间、不同时间点、组间·不同时点间交互效应比较差异有统计学意义(P<0.05)。见表1。
2.2两组患儿治疗前后PEF实测值/预计值比较 观察组患儿入组、治疗1年末、治疗2年末PEF实测值/预计值呈先上升趋势,停药1年末略有降低,对照组入组、治疗1年末、治疗2年末、停药1年末PEF实测值/预计值波动较大,组间、不同时点间、组间·不同时点间交互效应比较差异有统计学意义(P<0.05)。见表2。
2.3两组患儿治疗前后咳嗽次数、持续时间比较 两组患儿用药前、用药期间、停药后1年咳嗽次数呈下降趋势,组间、不同时点间、组间·不同时点间交互效应比较差异有统计学意义(P<0.05),且观察组患儿停药后1年咳嗽次数显著少于对照组,差异有统计学意义(P<0.05)。观察组患儿用药前、用药期间、停药后1年持续时间组间呈下降趋势,对照组变化不明显,组间、不同时点间、组间·不同时点间交互效应比较差异有统计学意义(P<0.05),且观察组患儿停药后1年咳嗽持续时间显著短于对照组,差异有统计学意义(P<0.05)。见表3。
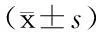
表1 两组CVA患儿治疗前后Ch-CACT结果比较
CVA:咳嗽变异性哮喘; Ch-CACT:儿童哮喘控制测试中文版;对照组:按需给予对症治疗(包括β2激动剂,或缓释茶碱,或白三烯调节剂糖皮质激素等);观察组:在常规治疗基础上给予舌下特异性免疫治疗
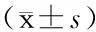
表2 两组CVA患儿治疗过程中PEF实测值/预计值比较
CVA:咳嗽变异性哮喘; PEF:峰值呼气流速;对照组:按需给予对症治疗(包括β2激动剂,或缓释茶碱,或白三烯调节剂糖皮质激素等);观察组:在常规治疗基础上给予舌下特异性免疫治疗
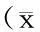
表3 两组CVA患儿治疗前后咳嗽次数、持续时间比较 ±s)
对照组:按需给予对症治疗(包括β2激动剂,或缓释茶碱,或白三烯调节剂糖皮质激素等);观察组:在常规治疗基础上给予舌下特异性免疫治疗
2.4两组患儿治疗过程中转变为典型哮喘例数 停药1年末对照组患儿转变总数为19例(36.5%),而观察组患儿转变总数为11例(18.3%),观察组患儿转变率显著低于对照组,差异有统计学意义(χ2=4.708,P=0.030)。
3讨论
CVA是指以慢性咳嗽为主要或唯一临床表现的一种特殊类型哮喘。在支气管哮喘开始发病时,有5%~6%是以持续性咳嗽为主要症状的,多发生在夜间或凌晨,常为刺激性咳嗽,此时往往被误诊为支气管炎[9-10]。而在儿童时期,咳嗽可能是哮喘的唯一症状,迁延不愈者可发展为支气管哮喘。因此,对于儿童患者积极治疗,缓解或者阻止病情发展十分必要。CVA本质同典型哮喘一样,是因变应原或其他诱因引起的气道慢性非特异性炎症,以及在此基础上形成的气道高反应性和顽固性咳嗽,故治疗原则和典型哮喘一样,主要应用支气管扩张剂,口服茶碱类药物和(或)β2受体兴奋剂[11-12]。一些抗变态反应及稳定肥大细胞的药物如奈多罗米、色甘酸、酮替芬也可以收到良好的效果,严重者可考虑使用糖皮质激素。但此类药只能缓解病情,而且需要长期用药,并不能阻止病情的发展。本研究针对儿童咳嗽变异性哮喘进行讨论,儿童处于免疫系统发育时期,各种免疫功能并未完全发育成熟,接受免疫治疗的成功率较成人高[13]。因此,若能找到患者变应原,然后通过脱敏的方法增加患者对变应原的免疫耐受,便可大大改善患儿的过敏症状。而且LIT是针对病因进行治疗,若能成功,则不需要长期采用药物控制病情,提高患儿的生活质量。以往LIT通常采用皮下注射的方式,这种手段因其需要反复注射,用药不便,可能出现休克、死亡等严重的全身不良反应,不易被患儿及家长接受,在儿童脱敏治疗中难以广泛开展,限制了SIT的发展[14]。而SLIT的应用则较好地避免了皮下注射带来的不便。针对SLIT的安全性及有效性在国外已有多项研究证实,研究表明SLIT能明显减少轻中度过敏哮喘发作次数,减轻其严重程度[15]。以上均是对典型哮喘的治疗,而对于CVA的SLIT治疗及SLIT停药后的长期疗效鲜有报道。
本研究结果显示,两组患儿治疗前、治疗结束时、治疗后1年Ch-CACT评分呈上升趋势(P<0.05);观察组患儿入组、治疗1年末、治疗2年末PEF实测值/预计值呈先上升趋势,停药1年末略有降低。两组患儿用药前、用药期间、停药后1年咳嗽次数、持续时间呈下降趋势(P<0.05),表明SLIT不仅在用药期间有效改善患儿呼吸功能,缓解患儿哮喘发作,而且患儿的症状也得到明显改善。这可能与SLIT可调节Th1、Th2淋巴细胞平衡,并诱导B细胞产生阻断性抗体Ig4,进而发挥免疫调节作用,同时能使体内IgE水平下降,导致变态反应炎症反应明显减弱有关。但这种作用能持续时间,是否有永久免疫作用还需要进一步研究。两组患儿在治疗终止后1年的统计,转变为典型哮喘的比例差异有统计学意义,表明SLIT可阻止CVA患儿出现喘息症状,减少CVA转变为典型哮喘,在停药后也有持续作用。但患儿在以后更长时间内是否还有喘息、咳嗽发作,是否哮喘的发作还是其他的呼吸道疾病还有待于更进一步的研究。
综上所述,SLIT在VCA治疗中明显优于单纯对症治疗,且治疗过程中未出现明显的不良反应,患儿耐受性及依从性好,是儿童CVA安全、有效的治疗方法,但在更长的时间内是否会出现病情的反复,应对患儿做长期的随访。
参考文献
[1]苗世敏.孟鲁司特对咳嗽变异性哮喘患儿血嗜酸性粒细胞、IgE和IL-17的影响[J].中国实用医刊,2015,42(2):44-46.
[2]孙洮玉,王俊宏,徐荣谦,等.加味芎蝎散对咳嗽变异性哮喘大鼠气道重塑及气道平滑肌相关凋亡分子表达的影响[J].中国中医急症,2015,24(3):406-408.
[3]徐轩,王彬,陈三,等.黄芪注射液对咳嗽变异性哮喘的免疫调节作用[J].内科急危重症杂志,2014,20(5):322-324.
[4]袁安辉.孟鲁司特对咳嗽变异性哮喘患儿血清IgE、ECP的影响及疗效观察[J].右江民族医学院学报,2014,36(3):414-415.
[5]陶迪,司振阳,隆红艳,等.黄龙止咳口服液对咳嗽变异性哮喘模型大鼠白细胞介素4和γ干扰素的影响[J].中国医药导报,2015,2(2):8-11,15.
[6]张晓燕,吕桂凤,南云蓉,等.中药内服联合中药穴位贴敷治疗小儿咳嗽变异性哮喘50例临床观察[J].河北中医,2014,7(6):820-821,942.
[7]孙爱玲,延永,亓艳华,等.肺炎支原体感染所致患儿咳嗽变异性哮喘与血清细胞因子的关系及临床意义[J].国际呼吸杂志,2014,34(15):1125-1127.
[8]夏海峰,王金花,陈锋,等.匹多莫德联合沙美特罗替卡松对咳嗽变异性哮喘的临床疗效研究[J].医学研究杂志,2014,43(9):88-91.
[9]可秋萍,张永梅,张建华,等.咳嗽变异性哮喘患儿血清过敏原检测与血中嗜酸性粒细胞、免疫球蛋白的关系[J].中国妇幼保健,2014,29(23):3764-3766.
[10]刘淑梅,李华浚,姚欢银,等.咳嗽变异性哮喘患儿尿LTE4水平与白三烯受体拮抗剂治疗反应的相关性[J].中国现代医生,2014,52(12):13-16.
[11]Kamimura M,Izumi S,Hamamoto Y,etal.Superiority of nebulized corticosteroids over dry powder inhalers in certain patients with cough variant asthma or cough-predominant asthma[J].Allergol Int,2012,61(3):411-417.
[12]Takemura M,Niimi A,Matsumoto H,etal.Clinical,physiological and anti-inflammatory effect of montelukast in patients with cough variant asthma[J].Respiration,2012,83(4):308-315.
[13]Lougheed MD,Turcotte SE,Fisher T,etal.Cough variant asthma: Lessons learned from deep inspirations[J].Lung,2012,190(1):17-22.
[14]Ohkura N,Fujimura M,Nakade Y,etal.Heightened cough response to bronchoconstriction in cough variant asthma.[J].Respirology,2012,17(6):964-968.
[15]Matsumoto H,Tabuena RP,Niimi A,etal.Cough triggers and their pathophysiology in patients with prolonged or chronic cough[J].Allergol Int,2012,61(1):123-132.
致读者:
感谢广大读者多年以来对《医学综述》的支持和厚爱,本刊全体员工向您们致意!
您若由于某种原因而延误了订阅《医学综述》杂志或漏订了某一期,可以直接电话联系或发E-mail到本杂志社补订,以保证完整收藏。
联系电话:010-60551103E-mail:yxzs2005@163.com
Analysis of Long-term Efficacy of Specific Immunotherapy for Cough Variant Asthma in Children
WANGCui-hua,TANGLin.
(DepartmentofPediatrics,HezeMunicipleHospital,Heze274031,China)
Abstract:ObjectiveTo explore and analyze the long-term efficacy of specific immunotherapy for children with cough variant asthma.MethodsA total of 112 children with cough variant asthma(CVA) were selected in Shandong province from Jan.2010 to Jan.2012. According to the random number table method,they were randomly divided into observation group(60 cases) and control group(52 cases).The control group was treated according to symptoms(including β2agonists,or sustained-release theophylline or leukotriene modifier glucocorticoid),patients in the treatment group received the conventional treatment and sublingual immunotherapy (SLIT),drops under the tongue early in the morning before breakfast,swallowing after containing 1-3 min,1 time a day,specific dosage can be adjusted according to the treatment condition,so as to achieve the best treatment effect,treatment duration was 2 years,after discontinuation of the drug they were followed up for 1 year.The cough episodes,the coughing days number,children asthma control test (Ch-CACT) every year,peak expiratory flow rate (PEF) monitoring,number of CVA developing into typical asthma per year of the two groups at the start of treatment,after 1 year and 2 years of treatment,and after 1 year of discontinuation were observed.ResultsThe Ch-CACT score of both groups increased as the treatment progressed[control group:(21.0±2.1) scores,(22.4±1.9) scores,(22.2±1.5) scores;observation group:(20.6±2.2) scores,(25.1±1.5) scores,(24.41±1.28) scores].At the end of the treatment and 1 year after the observation group was higher than the control group(P<0.05).After treatment,the PEF measured value/expected value of the observation group were increased [observation group:(88±5)%,(96±6)%,(97±5)%,(96±5)%],and was slightly lower at 1 year of discontinuation.The PEF measured value/measured value of the control group fluctuated obviously through the four measuring time points[control group:(88±17)%,(92±6)%,(89±7)%,(90±5)%,P<0.05]After treatment,the number of cough of both the observation group and control group were decreasing[observation group: (4.68±1.87) times,(2.33±0.58) times,(2.36±0.41) times;control group: (4.75±1.79) times,(4.26±0.73) times,(3.98±0.66) times],and the number of cough in the observation group was significantly lower than that in the control group(P<0.05) 1 year after discontinuation.In the observation group,the cough days were significantly decreased (P<0.05),and the observation group was significantly less than the control group (P<0.05) 1 year after discontinuation.At the end of 1 year of discontinuation,there were 19 cases (36.5%) developing into typical asthma in the control group,while in the observation group there were 11 cases (18.3%),the difference was statistically significant(P<0.05).ConclusionSLIT can effectively improve the respiratory function of patients with CVA,improve the symptoms of cough,reduce the attack,with good safety and stable effect,thus is worthy of wide clinical promotion.
Key words:Cough variant asthma; Children; Specific immunotherapy; Long-term effect
收稿日期:2015-07-07修回日期:2015-10-10编辑:相丹峰
doi:10.3969/j.issn.1006-2084.2015.23.069
中图分类号:R752
文献标识码:A
文章编号:1006-2084(2015)23-4406-03
