重金属镉对斜生栅藻光合作用的影响*
2015-03-08段晨雪张宝玉伍松翠冯建华王广策
段晨雪 张宝玉 伍松翠, 冯建华 王广策①
(1. 天津科技大学海洋科学与工程学院 天津 300457; 2. 中国科学院海洋研究所 青岛 266071;3. 中国科学院大学 北京 100049)
随着采矿、冶炼电镀、化工等工业的发展, 镉(Cd)污染问题日益严重(王建龙等, 2010)。镉是毒性最强的重金属之一, 一旦进入环境后, 不仅不能被生物所降解, 且往往参与食物链的循环并在生物体内积累,破坏生物体正常生理代谢, 最终危害人体健康(Mountouris et al, 2002; 邹森林, 2010)。现阶段处理含重金属污水的方法一般是化学方法、絮凝、沉淀法等。这对于去除重金属比较方便, 但其回收费用高而效果不明显(孟春晓等, 2009)。研究表明利用微藻吸附重金属有以下诸多优点: 应用范围广, 不容易产生二次污染; 吸附容量大, 去除效率高; 原料来源广,容易人工培养; 成本低; 吸附的金属容易重新获取,有利于微藻的重复利用和重金属的回收(潘进芬等,2000; 李琛, 2011; 张阳等, 2012)。
斜生栅藻(Scenedesmus obliquus)是一种单细胞真核绿藻, 生境分布广泛。该藻因其能积累大量中性脂而作为生产生物柴油的理想原料之一(Gouveia et al,2009)。斜生栅藻通常由4个细胞组成定形群体, Salim等(2011)的研究表明斜生栅藻的细胞可以自絮凝, 因此, 这对微藻的采收工作非常有利, 有效降低了采收成本。
目前, 关于利用斜生栅藻吸附重金属已展开较多的研究, 研究内容主要集中在重金属吸附动力学和对微藻细胞结构、生长的影响(刘益浩, 2007), 而重金属对微藻光合作用影响的相关报道还相对少见(Zeng et al, 2012; Ouyang et al, 2013)。因此, 本实验采用Dual-PAM-100双通道荧光仪, 研究了不同Cd2+浓度 处 理对 斜 生栅 藻 光系统Ⅰ(PSⅠ)和 光系统Ⅱ(PSⅡ)的影响, 以及微藻吸附重金属后的恢复能力。实验结果可作为斜生栅藻耐镉机理研究的必要补充, 从而为斜生栅藻吸附重金属的生态修复工作提供一定的理论基础。
1 材料与方法
1.1 藻种
斜生栅藻(Scenedesmus obliquus)由中国科学院海洋研究所实验海洋生物学重点实验室王广策课题组提供。用BG-11培养基(Rippka et al, 1979)单藻种静置培养。培养温度(28±2)°C, 光强为 100μmol/(m2·s),光暗比为12h∶12h。
1.2 叶绿素a浓度测定
每天取藻液, 用80%的丙酮抽提, 通过分光光度计(Shimadzu UV-1800, Japan)测定663nm和645nm处的光密度值, 即OD663和OD645, 通过公式计算叶绿素a浓度(Arnon, 1949):
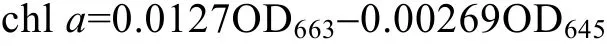
1.3 重金属胁迫及恢复处理
实验在 500mL锥形瓶里进行, 在 BG-11培养液中加入CdCl2, 使Cd2+终浓度分别为0、1、10、50、100、150μmol/L。将培养到指数生长期的斜生栅藻,分别接种到上述含不同浓度Cd2+的BG-11培养基中,接种密度为3×106cell/mL。每个浓度设置三个平行。
恢复处理时, 将经过重金属处理的斜生栅藻静置 1—2h, 待藻细胞自然沉降到锥形瓶底部后, 将上面的培养液缓慢倒出一半, 并加入等量无 Cd2+的标准BG-11培养基, 放回光照培养箱继续培养。此时重金属含量比之前降低了一半, 恢复处理时每天重复这样的步骤, 3天后藻液中的重金属含量仅为最初的1/8。
1.4 半抑制浓度(IC50–96h)的测定
按照等对数间距设置 Cd2+浓度为 0、50、75、112.5、169、253μmol/L, 藻细胞密度通过测定650nm吸光度的变化来反映。半抑制浓度(IC50-96h)利用机率单位法(周永欣等, 1989)计算得出。
1.5 光合活性测定
使用双通道脉冲振幅调制荧光仪(Dual-PAM-100), 同时测定P700(PSⅠ)和叶绿素荧光。
每天取藻液, 通过离心(Eppendorf 5804R, 5000g,5min)浓缩成叶绿素a浓度=60mg/L, 放入配套的石英测定杯中进行测定。测定前暗适应 15min, 并在暗适应期间通过小转子进行混匀。
当测定开始时, 关闭转子。设定测量参数后(保存测量参数模板, 以备下次使用), 同步测定其P700(PSⅠ)和叶绿素荧光(PSⅡ)的诱导曲线。按照Maxwell等(2000)介绍的原理和方法, 分别对藻体PSⅡ的最大光合量子产量(Fv/Fm)、实际光合量子产量Y(Ⅱ); PSⅠ反应中心的光合活性采用Schreiber介绍的方法(Klughammer et al, 1994)在远红光存在的条件下对藻体施以饱和脉冲进行测定光化学量子产量Y(Ⅰ)。
1.6 培养液中重金属含量测定
在实验的第1, 3, 5天分别取5mL藻液, 反复离心几次确保得到无藻细胞的培养液。将样品送至中国科学院海洋研究所分析测试中心, 通过原子吸收分光光度法(国家标准GB7475-87)测定Cd2+浓度。

图1 96h不同Cd2+浓度下斜生栅藻的细胞密度Fig.1 The change of OD650 in S. obliquus under different Cd2+concentrations in 96h treatment

图2 不同Cd2+浓度下斜生栅藻的叶绿素a含量Fig.2 The change of chl a in S. obliquus under different Cd2+concentrations
1.7 数据分析
实验数据通过SPSS 19.0软件进行统计分析, 统计图用Microsoft Excel软件绘制。
2 结果
2.1 不同Cd2+ 浓度对斜生栅藻生长以及光合作用的影响
图1为96h时, 不同浓度Cd2+下由OD650表示的细胞密度值。可以看出随 Cd2+浓度的升高, OD650值缓慢下降, 当浓度大于 112.5μmol/L时, 与对照组有显著差异(P<0.05)。根据机率单位法, 计算每个 Cd2+浓度下的斜生栅藻生长抑制率, 转换为机率单位, 在建立机率单位(y)与浓度对数(x)的关系方程, y=2.0474x+0.7502 (R2=0.9892), 从曲线中得出 IC50=119.04μmol/L。
图 2表明了不同 Cd2+浓度对斜生栅藻叶绿素 a含量的影响。接种初期, 低浓度1、10μmol/L两组的叶绿素a比对照组略高, 而从第3天开始降至低于对照组的水平, 但与对照组没有显著差异。而高浓度50、100、150μmol/L组则一直呈现逐渐下降的趋势,第3天开始这三组的叶绿素a含量与对照组有极显著的差异(P<0.01)。高浓度的Cd2+能够明显抑制斜生栅藻叶绿素a的合成, 而低浓度的影响不显著。
从图3可以看出, Cd2+对于斜生栅藻PSⅠ的实际光合量子产量 Y(Ⅰ)影响并不十分明显, 直至第五天,50、100、150μmol/L组与对照组有显著的差异(P<0.05)。对于 PSⅠ来说, Cd2+浓度低于 150μmol/L对PSⅠ的实际光合量子产量影响不大。

图3 不同Cd2+浓度下斜生栅藻光系统Ⅰ的光化学量子产量Y(Ⅰ)Fig. 3 The change of the effective quantum yield of PSⅠ [Y(Ⅰ)]of S. obliquus under different Cd2+ concentrations
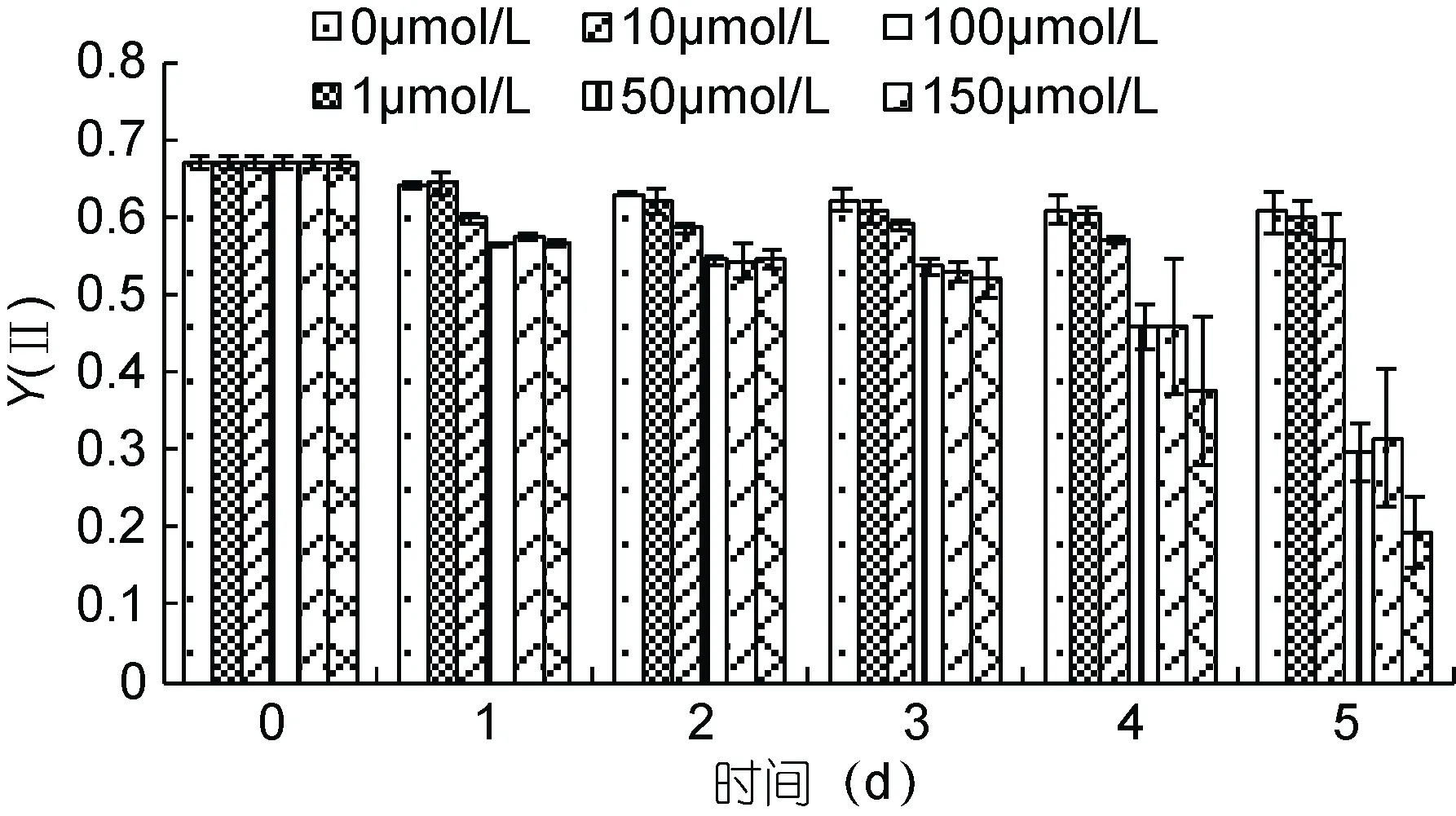
图4 不同Cd2+浓度下斜生栅藻光系统Ⅱ的光化学量子产量Y(Ⅱ)Fig.4 The change of effective quantum yield of PSⅡ [Y(Ⅱ)] in S. obliquus under different Cd2+ concentrations
Fv/Fm值代表了PSⅡ的最大光合量子产量, 正常培养状态下的斜生栅藻Fv/Fm值一般在0.7左右。从图5的数据中可以看到, Fv/Fm从加入Cd2+24h后就开始出现下降趋势, 除 1μmol/L组外都有显著差异(P<0.01)。
与Fv/Fm的趋势相似, 加入浓度大于1μmol/L的Cd2+时, Y(Ⅱ)的活性会在 24h 出现明显降低(P<0.01)。第5天时, 150μmol/L组的Y(Ⅱ)值降到了0.2, 仅为对照组的31.66%, PSⅡ的活性相当低。
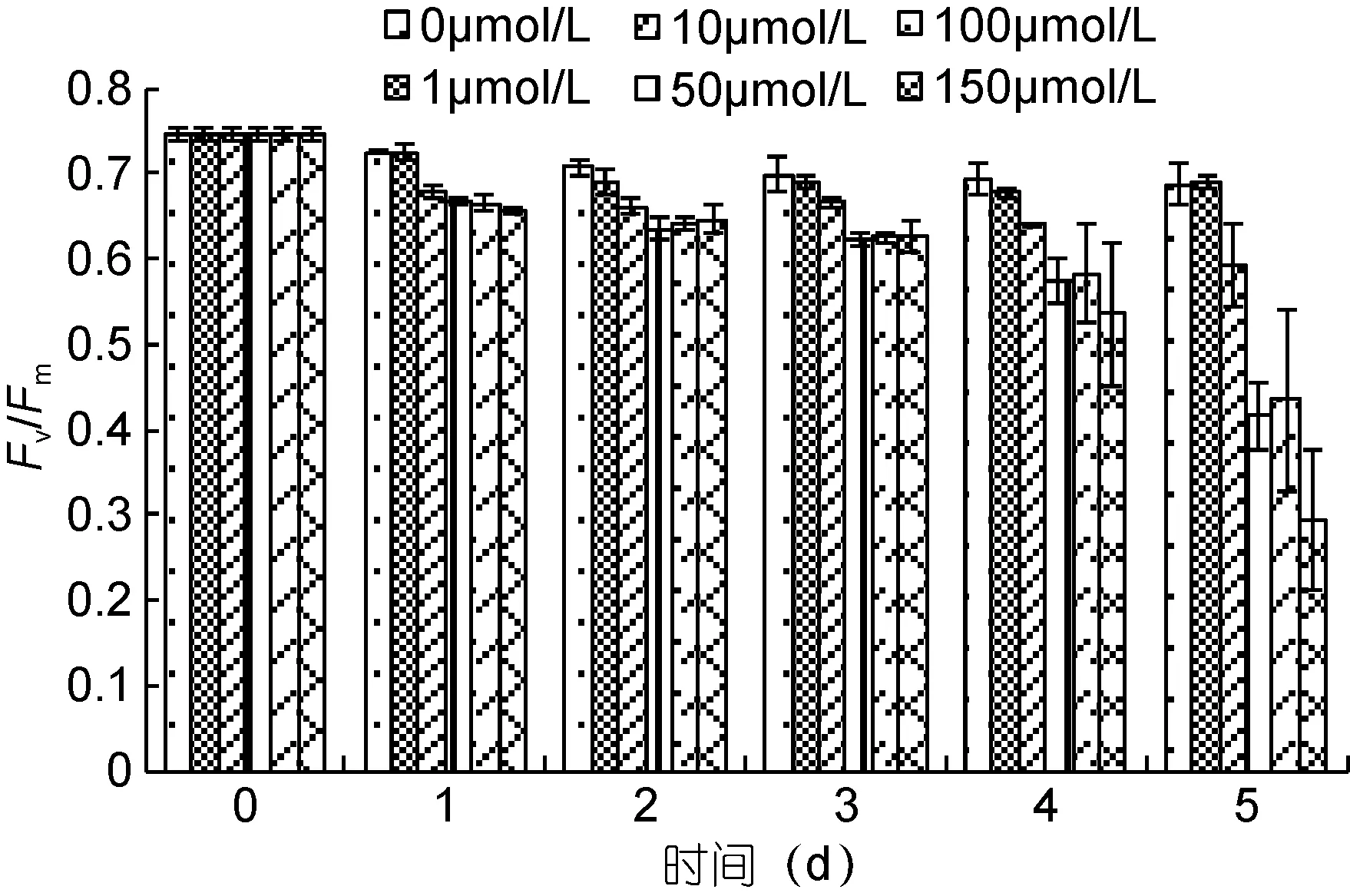
图5 不同Cd2+浓度下斜生栅藻光系统Ⅱ的最大光合量子产量(Fv/Fm)Fig.5 The change in the maximum PSⅡ quantum yield (Fv/Fm)in S. obliquus under different Cd2+ concentrations

表1 斜生栅藻吸附过程中溶液的Cd2+浓度Tab.1 The concentration of dissolved Cd2+ during the adsorption of S. obliquus

表2 斜生栅藻对Cd2+的吸附率Tab.2 The Cd2+ absorption rate in S. obliquus +
2.2 重金属吸附情况
加入Cd2+24h后, 溶液中的Cd2+浓度达到了最低值, 与刚加入重金属时有极显著差异(P<0.01), 含量都低于0.4mg/L。第3天开始出现上升趋势, 第5天时, 50、150μmol/L组的Cd2+浓度出现了显著的上升(P<0.05)。Cd2+浓度的回升, 可能是由于斜生栅藻的细胞受损而导致的重金属解析。
表 2中可以看到, 斜生栅藻对 Cd2+的吸附率随Cd2+浓度的升高从71.58%升至了97.83%。同时, 这5组浓度中, 吸附率最高时都在第1天, 之后都出现了一定的降低。只有50、150μmol/L组在第5天的吸附率出现了显著降低(P<0.05)。
2.3 恢复处理对斜生栅藻生长以及光合作用的影响
在3天恢复处理中, 对照组的叶绿素a含量明显升高, 补充的新鲜培养基促进了斜生栅藻的生长。恢复初期, 低浓度1、10μmol/L两组的叶绿素a含量呈上升趋势, 恢复至第 3天时两组都出现了降低, 1μmol/L 组比对照组显著降低(P<0.05),10μmol/L组与对照组有极显著差异(P<0.01)。而高浓度组 50、100、150μmol/L则一直呈下降趋势。说明重金属Cd2+的加入会影响斜生栅藻叶绿素a的合成, 并且随着Cd2+浓度升高叶绿素a的合成明显受到抑制, 即使进行恢复处理也不能缓解这种抑制情况。
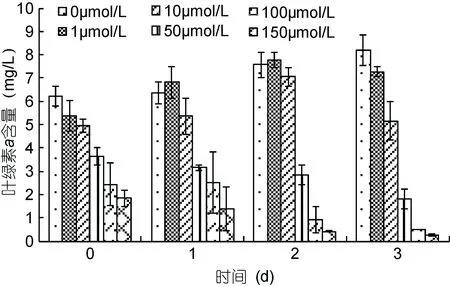
图6 恢复期间, 不同浓度Cd2+对斜生栅藻的叶绿素a含量Fig.6 The change of chl a in S. obliquus under different Cd2+concentrations during recovery stage
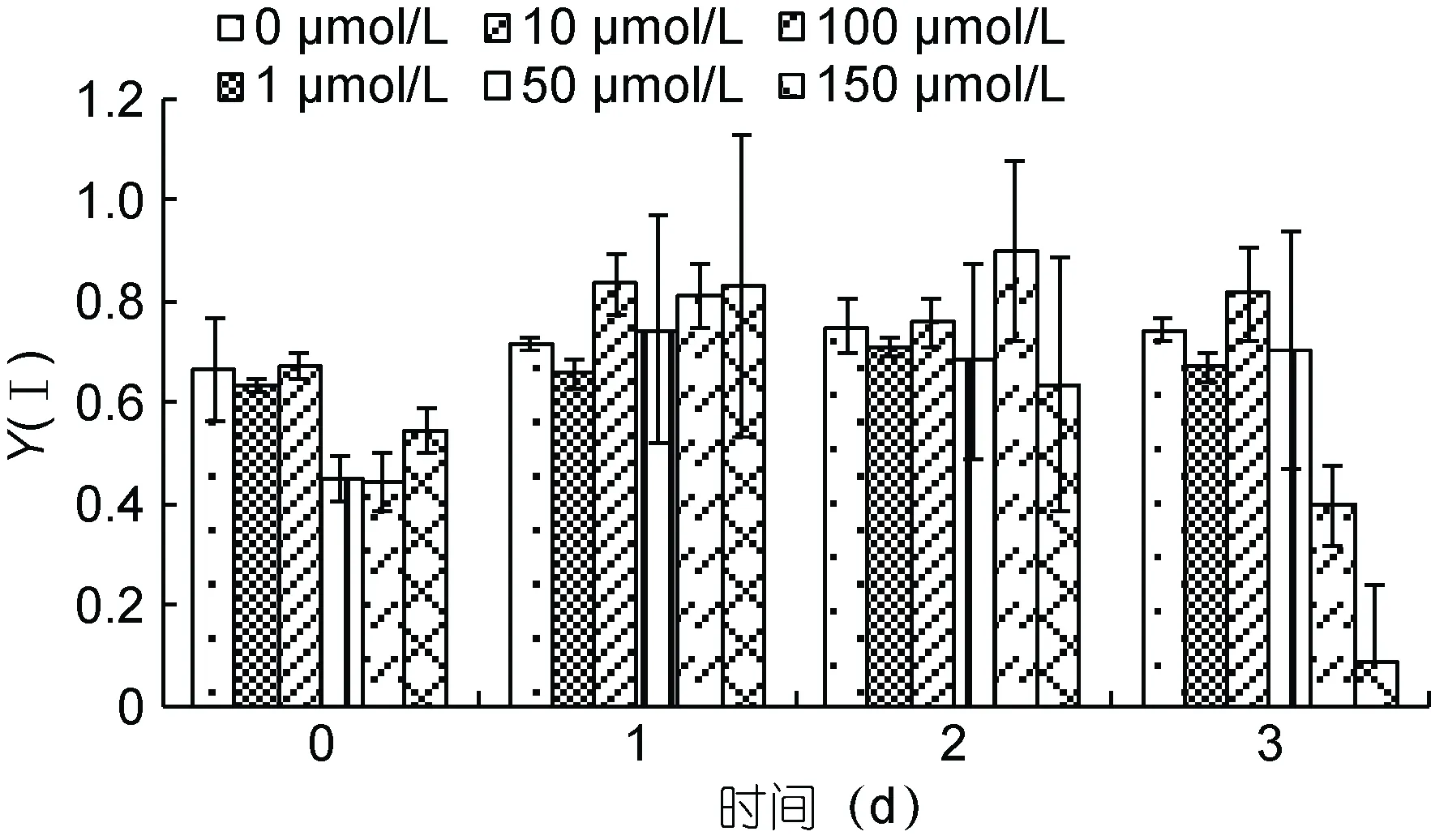
图7 恢复期间不同Cd2+浓度下斜生栅藻光系统Ⅰ的光化学量子产量Y(Ⅰ)Fig.7 The change in the effective quantum yield of PSⅠ [Y(Ⅰ)]of S. obliquus under different Cd2+ concentrations during recovery stage
虽然在恢复初期, Y(Ⅰ)出现了一定的升高, 但到了第 3天, 高 Cd2+浓度组即 100、150μmol/L出现了显著地降低(P<0.05)。

图8 恢复期间不同Cd2+浓度下斜生栅藻光系统Ⅱ的光化学量子产量Y(Ⅱ)Fig.8 The change in the effective quantum yield of PSⅡ [Y(Ⅱ)]in S. obliquus under different Cd2+ concentrations during recovery stage
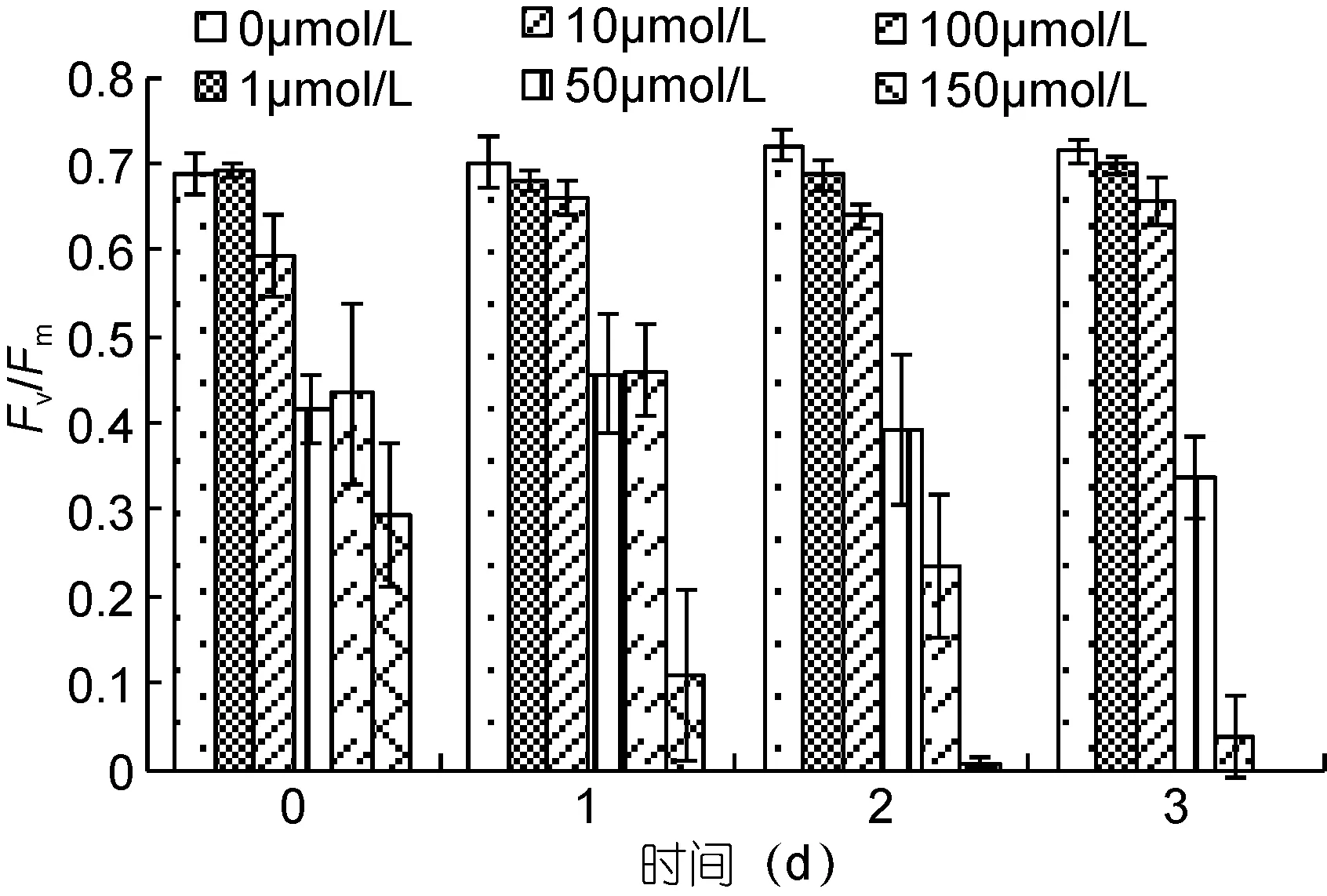
图9 不同Cd2+浓度下斜生栅藻光系统Ⅱ的最大光合量子产量(Fv/Fm)Fig.9 The change of the maximum PSⅡ quantum yield (Fv/Fm)in S. obliquus under different Cd2+ concentrations during recovery stage
图8中可以看到, 即使在恢复期中添加了新鲜培养基, 但Y(Ⅱ)的光合活性仍然在降低。
从 Fv/Fm的数据来看, 低浓度组依然保持着略低于对照组的水平, 其中 10μmol/L组在恢复的第一天出现了显著的上升(P<0.05), 但之后的第三天仍出现了明显的下降(P<0.05)。而 50μmol/L 和 100μmol/L 组与之类似, 同样有着先小幅度升高, 而后显著降低的趋势。150μmol/L组则在恢复中一直处于下降趋势。
Y(Ⅱ)的数据中我们可以看到, 100μmol/L和150μmol/L两组分别于恢复的第 2、3天降到了几乎为零, 说明此时的斜生栅藻 PSⅡ几乎无活性, 无法进行正常的光合作用。而低浓度组 1μmol/L和10μmol/L组虽然出现了一定程度的升高, 却始终未能恢复到对照组的水平, 再次证明了重金属 Cd2+胁迫的不可逆。
3 讨论
综合所有数据, 我们发现, 当Cd2+浓度为10μmol/L时, 吸附率为75.09%, 而其他几组浓度时吸附率均高达90%, Cd2+浓度为150μmol/L时吸附率最高, 为97.83%。也就是说, 斜生栅藻对重金属Cd有较好的吸附率。Chen等(2012)利用通气(2.5% CO2)培养斜生栅藻CNW-N, 得到其吸附CdCl2的最适条件为: pH 6.0、温度30°C、Cd2+浓度为50mg/L, 最高吸附率为98.4%,与本文中的最高吸附率97.83%数据相近。
本文研究表明在低Cd2+浓度时, 由于斜生栅藻自身对重金属的耐性机制, 使其对斜生栅藻的叶绿素含量以及光合作用影响不明显。而高浓度Cd2+毒害作用则明显表现在光合活性的快速降低。叶绿素是光合作用的物质基础, 其含量高低将直接影响光合作用的强弱及物质合成速率的高低(李裕红等, 2006)。叶绿素a既是天线色素也是参与光反应的中心色素,因而其含量的高低对光合作用更为重要。本实验的数据表明, 重金属Cd2+对斜生栅藻叶绿素a的合成有抑制作用。Stobart等(1985)认为, 叶绿素含量的降低与合成叶绿素所需的酶受重金属破坏有关, Cd抑制原叶绿素酸酯还原酶活性, 进而影响了氨基-γ-酮戊二酸的合成, 从而导致了叶绿素含量的下降(李建宏等, 2004)。
图4、5的数据表明, 当加入Cd2+后, 斜生栅藻PSⅡ的Y(Ⅱ)和Fv/Fm值在24h后就有了显著的下降趋势, 说明重金属Cd2+对栅藻PSⅡ的破坏作用是相当快的, 并随着时间的推移光合活性越低, 并且这种对PSⅡ的损伤既不能自愈, 也不能通过加入新鲜培养基缓解。Cd2+对PSⅡ的抑制作用在Mallick等(2003)和Miao等(2005)的研究中都有报道。Nirupama的研究发现, 在Zn、Cr、Cd几种重金属胁迫下, 绿藻Scenedesmus的PSⅡ各项光合活性参数初始荧光产量F0、Fv/Fm、非光化学淬灭系数qN、光化学淬灭系数qP等都有着显著的下降趋势, 推测PSⅡ是重金属胁迫的最初反应位点。Sbihi等(2012)的研究发现, Cd对硅藻P. Lanceolatum的IC50为0.25mg/L, 但当Cd浓度大于等于0.1mg/L时叶绿素a含量和Fv/Fm值都出现了显著的变化, 并且Zn和Cu的数据也发现了这种规律,所以Shibi认为重金属对微藻光合作用的影响要大于对藻细胞生长的影响。通过比较本文96h的OD650(图1)与Cd2+处理4天的叶绿素a含量(图2)、Fv/Fm值(图5)两组数据, 也能得到类似的结果。
同时, 本文的数据发现, 相比于 PSⅡ的影响来说, Cd2+对斜生栅藻PSⅠ的破坏虽然也不可逆, 但程度比 PSⅡ较低。Husaini等(1991)认为这是由于在应对镉胁迫时 PSⅡ比 PSⅠ的反应更加敏感。而相反,Zhou等(2006)通过对铜绿微囊藻(M. Aeruginosa)的研究认为, Cd2+的抑制作用位点并不是在 PSⅡ或者PSⅠ水平, 而是位于电子传递链的末端铁氧还蛋白/NADP+还原酶(FNR)。对于重金属离子在 PSⅡ的抑制部位和作用机理, 可以加入人工电子供体(如DPC、NH2OH 和 Mn)来研究。Bazzaz等(1974)用 Cd2+处理木豆pigeonpea(Cajanus cajan L., cv. UPAS-120)叶片的离体叶绿体, 加入PSⅡ氧化侧电子供体DPC, Cd2+抑制的 PSⅡ活性恢复至对照水平, 推测 Cd2+作用于PSⅡ氧化侧。重金属离子可能和一些参与光合作用的酶结合, 进入细胞内的 Cd2+能与酶活性中心或蛋白质的琉基结合, 而且还能取代重金属蛋白中的必需元素(如 Ca2+, Mg2+, Zn2+, Fe2+等)而导致酶活性的下降或丧失, 抑制细胞的生理过程(罗立新等, 1998;Zhao et al, 2002)。
Cd2+对植物的毒害及植物的耐性机理十分复杂。到目前为止, 镉污染对植物的生理生态效应的研究中主要集中在一些高等植物上, 对微藻光合作用的影响、后期恢复能力及微藻的耐受机理研究相对较少。本文从光合作用方面探讨了Cd2+对栅藻生长的影响, 从而为利用微藻处理含重金属废水的开发应用提供基础研究数据。
王建龙, 陈 灿, 2010. 生物吸附法去除重金属离子的研究进展. 环境科学学报, 30(4): 673—701
刘益浩, 2007. 斜生栅藻与重金属的相互作用研究. 南京: 河海大学硕士学位论文, 8—10
李 琛, 2011. 藻类在含重金属废水处理中的应用. 电镀与精饰, 33(2): 19—23
李建宏, 浩云涛, 翁永萍, 2004. Cd2+胁迫条件下椭圆小球藻的生理应答. 水生生物学报, 28(6): 659—663
李裕红, 黄小瑜, 2006. 重金属污染对植物光合作用的影响.环境科研, (6): 23—24
邹森林, 2010. 电镀废水处理的研究进展. 广东化工, 37(8):142—144
张 阳, 耿存珍, 2012. 天然藻类吸附重金属的研究. 环境保护科学, 38(6): 27—32
罗立新, 孙铁珩, 靳月华, 1998. 镉胁迫对小麦叶片细胞膜脂过氧化的影响. 中国环境科学, 18(1): 72—75
周永欣, 章宗涉, 1989. 水生生物毒性试验方法. 北京: 农业出版社, 114—122
孟春晓, 高政权, 2009. 微藻对重金属污染的生物修复研究现状与展望. 水产科学, 28(12): 795—797
潘进芬, 林荣根, 2000. 海洋微藻吸附重金属的机理研究. 海洋科学, 24(2): 31—34
Arnon D I, 1949. Copper enzymes in isolated chloroplasts.Polyphenoloxidase in beta vulgaris. Plant Physiology, 24(1):1—15
Bazzaz M B, Govindjee, 1974. Effects of cadmium nitrate on spectral characteristics and light reactions of chloroplasts.Environmental Letters, 6(1): 1—12
Chen C Y, Chang H W, Kao P C et al, 2012. Biosorption of cadmium by CO2-fixing microalga Scenedesmus obliquus CNW-N. Bioresource Technology, 105: 74—80
Gouveia L, Oliveira A C, 2009. Microalgae as a raw material for biofuels production. Journal of Industrial Microbiology &Biotechnology, 36(2): 269—274
Husaini Y, Rai L C, 1991. Studies on nitrogen and phosphorus metabolism and the photosynthetic electron transport system of Nostoc linckia under cadmium stress. Journal of Plant Physiology, 138(4): 429—435
Klughammer C, Schreiber U, 1994. An improved method, using saturating light pulses, for the determination of photosystem I quantum yield via P700+-absorbance changes at 830nm.Planta, 192(2): 261—268
Mallick N, Mohn F H, 2003. Use of chlorophyll fluorescence in metal-stress research: a case study with the green microalga Scenedesmus. Ecotoxicology and Environmental Safety,55(1): 64—69
Maxwell K, Johnson G N, 2000. Chlorophyll fluorescence—a practical guide. Journal of Experimental Botany, 51(345):659—668
Miao A J, Wang W X, Juneau P, 2005. Comparison of Cd, Cu,and Zn toxic effects on four marine phytoplankton by pulseamplitude-modulated fluorometry. Environmental Toxicology and Chemistry, 24(10): 2603—2611
Mountouris A, Voutsas E, Tassios D, 2002. Bioconcentration of heavy metals in aquatic environments: the importance of bioavailability. Marine Pollution Bulletin, 44(10): 1136—1141 Rippka R, J Deruelles J, Waterbury J B et al, 1979. Generic assignments, strain histories and properties of pure cultures of cyanobacteria. Journal of General Microbiology, 111(1):1—61
Salim S, Bosma R, Vermue M H et al, 2011. Harvesting of microalgae by bio-flocculation. Journal of Applied Phycology, 23(5): 849—855
Sbihi K, Cherifi O, El Gharmali A et al, 2012. Accumulationand toxicological effects of cadmium, copper and zinc on the growth and photosynthesis of the fresh water diatom Planothidium lanceolatum (Brébisson) ange-Bertalot: a laboratory study. Journal of Material Environment Sciences,3(3): 497—506
OuYang H L, Kong X Z, Lavoie M et al, 2013. Photosynthetic and cellular toxicity of cadmium in Chlorella vulgaris.Environmental Toxicology and Chemistry, 32(12): 2762—2770
Stobart A K, Griffiths W T, Ameen-Bukhari I, et al, 1985. The effect of Cd2+on the biosynthesis of chlorophyll in leaves of barley. Physiologia Plantarum, 63(3): 293—298
Zeng Y, Wu Y, Li D et al, 2012. Two-photon excitation chlorophyll fluorescence lifetime imaging: a rapid and noninvasive method for in vivo assessment of cadmium toxicity in a marine diatom Thalassiosira weissflogii. Planta,236(5): 1653—1663
Zhao F J, Hamon R E, Lombi E et al, 2002. Characteristics of cadmium uptake in two contrasting ecotypes of the hyperaccumulator Thlaspicaerulescens. Journal of Experimental Botany, 53(368): 535—543
Zhou W B, Juneau P, Qiu B S, 2006. Growth and photosynthetic responses of the bloom-forming cyanobacterium Microcystis aeruginosa to elevated levels of cadmium. Chemosphere,65(10): 1738—1746
猜你喜欢
杂志排行
海洋与湖沼的其它文章
- 俄罗斯鲟(Acipenser gueldenstaedtii)家系构建及不同家系间生长性能比较*
- 杂色鲍(Haliotis diversicolor)硒结合蛋白1基因的克隆及其应激表达*
- 盐度调控对花鲈(Lateolabrax maculatus)生长相关基因表达的影响*
- 鳗弧菌(Vibrio anguillarum)侵染对青蛤(Cyclina sinensis)髓样分化因子88基因表达的影响*
- 连续降温对大菱鲆(Scophthalmus maximus)成鱼血清生化指标及Wap65-1基因表达的影响*
- 洞庭青鲫(Carassius auratus var. Dongtingking)与三个鲫品系群体遗传多样性的ISSR分析*
