杂色鲍(Haliotis diversicolor)硒结合蛋白1基因的克隆及其应激表达*
2015-03-08蔡秀红黄贻涛张子平王国栋邹志华王淑红王艺磊
张 鑫 蔡秀红 黄贻涛 张子平 王国栋 邹志华 王淑红 王艺磊
(集美大学水产学院 农业部东海海水健康养殖重点实验室 厦门 361021)
杂色鲍(Haliotis diversicolor)是一种海生软体动物, 我国于20世纪70年代培育出杂色鲍苗, 并成功进行了人工养殖。如今, 杂色鲍已成为我国东南沿海最重要的经济养殖鲍类之一(苏天凤, 2006)。然而, 随着温室效应的不断加剧, 使得一些海洋和陆地生态系统的温度也随之升高(Pörtner, 2001)。而高温又必然会伴随着水中氧浓度的降低(Pörtner, 2001; Huey et al,2005)。这些因素都会对杂色鲍的生存环境产生很大的影响, 并且导致杂色鲍的大量死亡(周晶等, 2006)。
硒结合蛋白1(selenium-binding protein 1, SBP1)是一类不含硒半胱氨酸并且在生物体内普遍存在且高度保守的含硒蛋白。按照分子量的不同可以分为两类——14 kDa SBP和54 kDa SBP。14 kDa SBP作为脂肪酸结合蛋白首先是在鼠的肝脏中被发现的(Bansal et al, 1989)。54 kDa SBP则是在线虫、植物和哺乳动物中被发现的一种高度保守的蛋白(Bansal et al, 1989;Bevan et al, 1998)。研究表明, 氧化应激可以诱导SBP的表达(Hassan et al, 1983)。此外, SBP还可能参与抑制癌细胞的增长(Morrison et al, 1988; Yang et al,1998)、还原/氧化反应的调控(Yang et al, 1998)、解毒(Ishii et al, 1996)和高尔基体蛋白转运(Porat et al,2000)等过程。在软体动物中, SBP1仅在栉孔扇贝(Chlamys farreri)和皱纹盘鲍(H. discus hannai)中有相关报道。Song等(2006)的研究表明, 栉孔扇贝在被微生物感染以及 H2O2的氧化应激处理之后, SBP的表达量逐渐上升。Zhang等(2011)通过研究发现: 当皱纹盘鲍每天摄入足够的硒、铁和锌时可以使 SBP的mRNA表达量增加。目前尚未有SBP1参与杂色鲍免疫调控的相关报道, 本研究将可为此提供一定的参考依据。
1 材料与方法
1.1 实验材料和试剂
1.1.1 实验动物 从宏运鲍鱼场(福建漳浦)购买杂色鲍健康个体, 体长(6.20±0.50)cm, 体质量(18.70 ± 2.50)g, 分批暂养于本实验室(25±1.50)°C的海水循环系统中, 每日晚间投喂海带1次, 暂养10 d后用于实验。
1.1.2 试剂与工具酶 总RNA提取试剂RDP由本实验室自行配制, 逆转录所用的逆转录酶(M-MLV)以及荧光定量实验所用的SYBR Green Master Mix均购自Promega公司, GenClean琼脂糖凝胶DNA回收试剂盒购于捷瑞生物公司(上海), 连接所用的pMD19-T试剂盒购自宝生物(大连)公司。大肠杆菌JM109感受态细胞和副溶血弧菌菌种均为本实验室保种。
1.1.3 引物 根据本课题组已发表的文章中所用的通用引物(张鑫等, 2014), 以及从本实验室已有的杂色鲍转录组EST数据库(依托上海众信生物技术有限公司完成)中获得的 SBP1基因的部分序列, 利用Primer软件设计出特异性的RACE引物来获得全长。之后, 再根据完整的HdSBP1的cDNA 序列设计荧光定量PCR引物以及head to toe验证引物, 以上所有引物均是由捷瑞生物工程有限公司(上海)合成的。主要的引物序列列于表1。

表1 主要的引物序列信息Tab.1 Sequence information of the primers used in this study
1.2 方法
1.2.1 杂色鲍高温应激实验、缺氧诱导实验、副溶血弧菌感染实验以及高温和缺氧联合应激实验 参照本课题组已发表的文章(张鑫等, 2014)中的实验方法, 实验组与对照组的杂色鲍均各取8只, 分别取血淋巴和鳃组织, 将离心后得到的血细胞保存于–80°C超低温冰箱; 鳃组织部分保存于 RNAlater中,部分保存于液氮中, 用于RNA的提取。
1.2.2 总RNA的提取及cDNA的合成 杂色鲍鳃组织和血细胞的总RNA的提取根据本实验室自制的RDP试剂的常规使用方法进行(王艺磊等, 2003)。总RNA的完整性利用 2%的琼脂糖凝胶进行电泳检测,同时使用微量分光光度计测定 A260/A280的值以及RNA的浓度。cDNA的合成按照逆转录试剂盒的具体说明严格操作。
1.2.3 HdSBP1基因 cDNA全长的克隆 利用Primer 5.0软件, 根据从本实验室的杂色鲍转录组测序所获得的EST序列中筛选出的HdSBP1基因片段,设计特异引物。使用SMART-RACE的方法扩增得到基因的全长 cDNA序列, 并用 head to toe引物对其ORF (open reading frame)的准确性进行验证。引物列于表1。
1.2.4 HdSBP1的生物信息学分析 分别使用NCBI (http://www.ncbi.nlm.nih.gov/)中的不同工具对测序结果进行验证、拼接以及开放阅读框的确定。HdSBP1蛋白的等电点及分子量则是使用 ExPASy(http://web.expasy.org/compute_pi/)进行预测。序列中可能存在的信号肽序列通过 SingalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)进行查询。潜在的糖基化位点和磷酸化位点分别使用 NetNGlyc 1.0 Server (http://www.cbs.dtu.dk/services/NetNGlyc/)以及NetPhos 2.0 Server (http://www.cbs.dtu.dk/services/NetPhos/)进行预测。通过 The PSIPRED Protein Sequence Analysis Workbench (http://bioinf.cs.ucl.ac.uk/psipred/)进行蛋白质二级结构的预测, 同时利用SWISS-MODEL (http://swissmodel.expasy.org/interactive)对HdSBP1蛋白的三级结构进行预测。序列的多重比对通过BioEdit软件进行, 随后使用MEGA5.05软件完成系统进化树的构建。
1.2.5 HdSBP1基因在杂色鲍各组织及不同应激条件下的表达 实时荧光定量PCR使用的cDNA模板以随机引物逆转录合成, 选用β-actin作为内参基因(张鑫等, 2014)。qRT-PCR 采用 20μL 的反应体系:10μL SYBR Green Realtime PCR Master Mix(购自Promega公司), 10μmol/L 的 HdSBP1RT-F Primer和HdSBP1RT-R Primer(表 1)各 0.5μL, cDNA 模板 9μL。具体反应条件如下: 95°C 1 min, 95°C 15 s, 60°C 1 min,45个循环。每个时相分别取5个样品进行分析, 并根据仪器分析得出的Ct值计算RQ值即2–ΔΔCt, 随后利用SPSS 20.0和Microsoft office 2010软件对所得数据进行分析与作图, 显著性差异表示为P<0.05。
2 结果
2.1 HdSBP1基因的克隆及序列分析
杂色鲍cDNA全长序列为2269 bp (GenBank登录号: KJ459335), 包括 5’UTR 113 bp, 3’UTR 662 bp和1494 bp的ORF, 可编码497个氨基酸。推测蛋白的分子质量为55.69 kDa, 等电点为5.53。SignaIP在线分析的结果表明, HdSBP1基因中不含有信号肽序列。另外, 7个苏氨酸磷酸化位点、11个丝氨酸磷酸化位点、7个酪氨酸磷酸化位点以及1个糖基化位点也分别包含在该序列之中(图 1)。在 HdSBP1的氨基酸序列的 N端还包含着一个典型的还原信号基序105CSSC108(CXXC, X代表任意氨基酸残基)和一个内质网螯合信号基序(95DELHIJ99)。同样, 一些 CXXC的衍生序列(30TSECC34,123CINS126,166CLGS169,293CALS296和38lCKGG384)也包含其中(Chivers et al, 1997; Fomenko et al, 2003)。另外, 在HdSBP1的氨基酸序列还包含着多个金属位点的结合序列(162HTTH165,354HGD356,171HIM173,220HNVM223,250HSIHVWDWTTH260和448MFLM451)(She et al, 2003; Urvoas et al, 2003)。
2.2 HdSBP1空间结构模拟
通过PSIPRED v3.3对HdSBP1的二级结构进行预测, 结果显示, 该蛋白共含有 3个α-螺旋和 32个β-折叠。此外, 利用 SWISS-MODEL在线软件将推导的 HdSBP1蛋白序列与软件数据库中已有的 PDB code: 2eceA模板进行人工配联, 并最终构建HdSBP1蛋白的三维空间结构模型(图2)。
2.3 同源性分析以及对 HdSBP1蛋白系统进化树的构建
使用BioEdit软件将已推导的HdSBP1的氨基酸序列和其它物种的SBP1的氨基酸序列一起进行多重比较(图3)。比较分析的结果表明, 不同物种的SBP1氨基酸序列具有很高的保守型, 并且HdSBP1与栉孔扇贝、人(Homo sapiens)、斑马鱼(Danio rerio)、果蝇(Drosophila melanogaster)和线虫(Caenorhabdi elegans)的 SBP1氨基酸序列的一致性分别为 62%、62%、67%、53%和 49%, 其中与皱纹盘鲍的一致性最高, 达到了93%。
根据NCBI上已有的SBP1的氨基酸序列, 利用MEGA5.05软件, 以邻位相连法构建了 15 种生物的系统进化树(图 4)。分析表明, 脊椎动物和无脊椎动物分别聚在两个大支, 在无脊椎动物里, 杂色鲍与软体动物皱纹盘鲍和栉孔扇贝聚为一支。
2.4 杂色鲍HdSBP1基因在不同组织器官中的表达
以杂色鲍的7种不同组织作为检测对象, 实时荧光定量PCR结果显示(图5), HdSBP1基因在各组织中均有表达, 并且在鳃和肾中的表达量显著性高于肝胰腺、肌肉、消化道、粘液腺和血细胞中的表达量(P<0.05)。
2.5 HdSBP1基因在缺氧诱导、高温应激、高温缺氧联合应激以及弧菌感染后的表达
通过 qRT-PCR对经过不同外界刺激后 HdSBP1基因在杂色鲍鳃组织中的表达情况进行分析, 结果显示: 缺氧诱导处理之后, 实验组HdSBP1的表达量在处理24 h时显著性高于对照组(P<0.05), 而在4 h、96 h和192 h时, 实验组的表达量和对照组相比无显著差异(图 6a); 高温应激之后, 实验组 HdSBP1基因的表达量在第 1 时相(28°C)和第 3 时相(31°C, 4 h)显著高于对照组(P<0.05), 其它各时相实验组与对照组无显著差别(图6b)。缺氧和高温联合应激之后, 实验组 HdSBP1的表达量在 192 h时显著性高于对照组(P<0.05), 而在其它各时相实验组的表达量和对照组相比无显著性差异(图6c); 副溶血弧菌注射感染之后,在6 h和24 h时, 实验组的表达量显著性高于对照组(P<0.05), 而在3 h和12 h时实验组和对照组的表达量并未表现出显著性的差异(图6d)。
在经过缺氧应激的杂色鲍血细胞中, 实验组HdSBP1的表达量在192 h时显著高于对照组(P<0.05),而在其它时相实验组和对照组的表达量无显著差异(图7a); 高温应激后, 实验组HdSBP1的表达量在第3时相时显著性高于对照组(P<0.05), 其它各时相均没有显著性变化(图 7b); 缺氧和高温联合应激后, 实验组HdSBP1的表达量在0 h、4 h和24 h时显著性高于对照组(P<0.05), 而在96 h和192 h时, 实验组的表达量和对照组相比并无显著差异(图7c); 副溶血弧菌注射感染之后, 实验组的HdSBP1基因在每个时相的表达量都显著性地高于对照组(P<0.05)(图7d)。
3 讨论

图1 杂色鲍HdSBP1基因cDNA及其推导的氨基酸序列Fig.1 The cDNA and deduced amino acid sequence of HdSBP1 gene from H. diversicolor
硒结合蛋白 1是一种高度保守的蛋白(Bansal et al, 1989; Bevan et al, 1998)。它广泛参与抑制癌细胞的增长(Morrison et al, 1988; Yang et al, 1998)、氧化/还原反应的调控(Yang et al, 1998)、解毒(Ishii et al,1996)以及高尔基体蛋白的转运(Porat et al, 2000)等过程中。本实验首次成功克隆了杂色鲍 HdSBP-1基因的全序列, 共编码497个氨基酸, 二级结构预测结果显示其结构以β-折叠为主, 仅含有少数α-螺旋。多重比对结果表明, 不同物种中的SBP-1具有很高的相似性。而杂色鲍SBP-1蛋白与同为软体动物的皱纹盘鲍的SBP-1蛋白的一致性达到了93%, 与斑马鱼的一致性也达到了67%。另外, 在HdSBP-1的氨基酸序列中包含有保守的硒结合蛋白信号基序, 如: CXXC基序、金属螯合基序和内质网螯合信号等等。CXXC基序普遍存在于巯基/二硫键氧化还原酶中, 主要负责催化氧化疏基以及还原蛋白质异构体的二硫键(Chivers et al, 1997; Fomenko et al, 2003)。相关研究已经表明 CXXC特征基序对于硒和其它重金属离子具有很强的结合特性(Jamba et al, 1997; Liu et al,1997)。同时, 多个保守的金属结合位点(如HXXH和HXD等)也包含在HdSBP-1的氨基酸序列中, 这些位点都有可能参与到了对硒离子以及其它重金属离子的结合的过程中(She et al, 2003; Urvoas et al, 2003)。此外, 在 HdSBP-1的氨基酸序列中还包含有一个内质网螯合信号基序, 这也表明 HdSBP-1可能参与细胞膜的流动运输以及高尔基体转运蛋白的过程(Porat et al, 2000; Teo et al, 2001)。
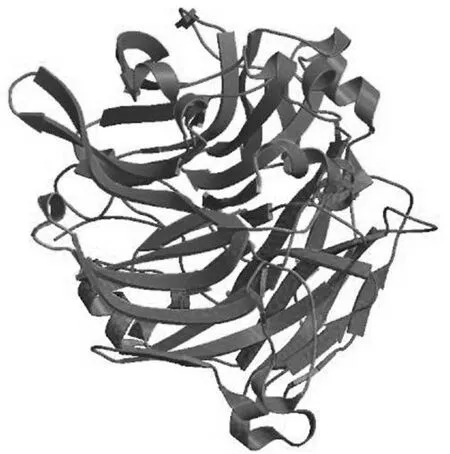
图2 HdSBP1的三维空间结构模型Fig.2 The predicted three-dimensional space structure of HdSBP1

图3 氨基酸序列的多重比对Fig.3 Multiple alignment of the SBP1 amino acid sequence

图4 HdSBP1系统进化树Fig.4 Phylogenetic tree of the SBP1 amino acid sequences between H. diversicolor and other species
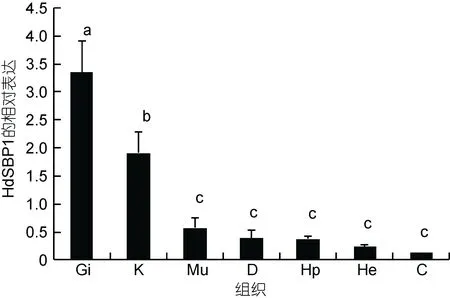
图5 HdSBP1基因在不同组织器官中的表达情况Fig.5 Distribution pattern of HdSBP1 in different tissues of H.diversicolor

图7 在各种应激下HdSBP1基因在杂色鲍血细胞中的表达Fig.7 The change of HdSBP1 expression in haemocytes after various types of stresses
目前SBP1作为一种肿瘤标记物已在人类中得到了广泛研究, 并且已被证明在多种组织(如: 心、肝、肾和肺)以及细胞系中均有表达(Chang et al, 1997;Yang et al, 1998)。在本实验中所检测的杂色鲍各组织中, 同样均有HdSBP-1基因的表达, 并且在鳃组织中的表达量显著性地高于其它组织。针对这一结果, 推测原因可能是由于在较为低等的软体动物以及甲壳动物中均不含有免疫球蛋白, 而鳃组织作为水生生物的主要呼吸器官, 在免疫系统中就扮演了第一道防线的重要角色。因此, HdSBP-1基因在鳃组织中的高表达, 也间接表明了该基因可能参与到了杂色鲍应对外界环境变化的免疫调节机制中。
在软体动物中, Song等(2006)在研究栉孔扇贝被微生物感染以及H2O2的氧化应激处理之后发现, SBP的表达量逐渐上升。通过实时荧光定量PCR技术, 本实验报道了在应对不同环境因子的应激条件下,HdSBP-1的表达情况。结果表明, 在缺氧诱导的环境条件下杂色鲍鳃组织中的HdSBP-1表达在24 h时显著上调, 随后表达量虽有所下降但实验组中的表达量均要高于对照组。在血细胞中, 直到192 h时, 实验组的表达量才表现出显著性上调。产生这一现象的可能原因是鳃组织作为低等水生生物的免疫系统第一道防线, 当环境中的氧浓度下降时, HdSBP-1在鳃中率先表达, 并由此开启了机体对外界刺激的免疫调控机制, 随后, HdSBP-1在血细胞中的表达也被开启, 这样就开启了整个机体应对缺氧环境的调节机制。高温应激下, 无论是在杂色鲍鳃组织还是在血细胞中, HdSBP-1的表达都在应激初期表现出显著性上调, 这一现象表明在高温初始阶段, 机体的免疫调节机制被迅速激活, 从而使 HdSBP-1的表达在第 1时相和第 3时相显著上调以阻止细胞凋亡。随着高温持续时间的延续, 机体对这一环境的变化逐渐适应, 并由此导致HdSBP-1的表达量逐渐回归到与对照组相当的表达水平。通过对高温和缺氧实验结果的对比, 发现杂色鲍鳃组织和血细胞中的 HdSBP-1在应对高温引起的环境压力方面较缺氧应激敏感。为进一步研究这两种应激同时存在时杂色鲍的免疫调节机制, 作者进行了高温和缺氧的联合应激实验,结果表明在鳃组织中, 应激 192 h时才检测到HdSBP-1的显著性变化, 由此说明, 高温和缺氧双重因子的联合作用并未使HdSBP-1在杂色鲍鳃组织中的免疫调节机能得到更进一步的加强, 而是有可能激活了别的调节途径来共同应对更加复杂的外界环境变化。血细胞中, 在双重环境因子的共同作用下, 实验组HdSBP-1在0 h、4 h和24 h时的表达均显著高于对照组, 这也表明了HdSBP-1在血细胞中的表达相对鳃组织而言对环境因子的依赖性更强。此外, 当被副溶血弧菌感染以后, HdSBP-1在血细胞的整个应激阶段以及鳃组织中的初期和末期也均表现出了显著上调的现象, 这一结果也与对栉孔扇贝进行的研究结果存在一定的相似性(邹慧斌, 2005),同时也表明了HdSBP-1基因参与到了杂色鲍应对弧菌感染的免疫应答过程中。但是, 在上述不同应激条件下HdSBP-1的具体作用机理还不清楚, 仍需进一步深入研究。
总之, 本实验成功克隆了杂色鲍HdSBP-1的全长cDNA序列。实时荧光定量PCR结果显示, HdSBP-1基因在高温应激、缺氧诱导、高温和缺氧联合应激以及副溶血弧菌感染的情况下, 无论是在血细胞还是鳃组织中的表达量均有显著性变化的发生。通过本实验的一些基础研究, 可以在一定程度上表明该基因作为一种免疫相关基因, 无论是在应对环境刺激还是病菌感染时都在杂色鲍的免疫应答机制中起到了重要的作用。同时, 这些数据也可以为今后更进一步揭示杂色鲍在不同应激条件下的分子防御机制提供一定的理论依据。
王艺磊, 张子平, 2003. 日本对虾精巢和卵巢全长cDNA文库的构建. 动物学杂志, 38(6): 9—13
苏天凤, 2006. 杂色鲍与九孔鲍种质资源研究进展. 南方水产,2(2): 64—67
邹慧斌, 2005. 栉孔扇贝和海湾扇贝G型溶菌酶基因及栉孔扇贝硒结合蛋白基因的克隆和表达研究. 青岛: 中国海洋大学硕士学位论文, 31—34
张 鑫, 黄贻涛, 蔡秀红等, 2014. 杂色鲍 14-3-3ζ基因的克隆及其在应激下的表达. 水产学报, 38(4): 491—501
周 晶, 蔡俊鹏, 杨洪志, 2006. 南方杂色鲍苗大规模死亡病原菌的分离鉴定及其回归感染试验. 海洋湖沼通报, 03:54—59
Bansal M P, Cook R G, Danielson K G et al, 1989. A 14-kilodalton selenium-binding protein in mouse liver is fatty acid-binding protein. Journal of Biological Chemistry,264: 13780—13784
Bevan M, Bancroft I, Bent E et al, 1998. Analysis of 1.9 Mb of contiguous sequence from chromosome 4 of Arabidopsis thaliana. Nature, 391: 485—488
Chang P W, Tsui S K, Liew C C et al, 1997. Isolation,characterization, and chromosomal mapping of a novel cDNA clone encoding human selenium binding protein.Journal of Cellular Biochemistry, 64: 217—224
Chivers P T, Prehoda K E, Raines R T, 1997. The CXXC motif: a rheostat in the active site. Biochemistry, 36: 4061—4066
Fomenko D E, Gladyshev V N, 2003. Identity and functions of CXXC-derived motifs. Biochemistry, 42: 11214—11225
Hassan M, Stohs S, Murray W, 1983. Comparative ability of TCDD to induce lipid peroxidation in rats, Guinea pigs, and Syrian golden hamsters. Bulletin of Environmental Contamination and Toxicology, 31: 649—657
Huey R B, Ward P D, 2005. Hypoxia, global warming, and terrestrial Late Permian extinctions. Science, 308: 398—401 Ishii Y, Hatsumura M, Ishida T et al, 1996. A coplanar PCB induces a selenium binding protein as a major cytosolic protein in rat liver. Chemosphere, 32: 509—515
Jamba L, Nehru B, Bansal M, 1997. Redox modulation of selenium binding proteins by cadmium exposures in mice.Molecular and Cellular Biochemistry, 177: 169—175
Liu S Y, Stadtman T C, 1997. Heparin-binding properties of selenium-containing thioredoxin reductase from HeLa cells and human lung adenocarcinoma cells. Proceedings of the National Academy of Sciences, 94: 6138—6141
Morrison D G, Dishart M K, Medina D, 1988. Intracellular 58-kD selenoprotein levels correlate with inhibition of DNA synthesis in mammary epithelial cells. Carcinogenesis, 9:1801—1810
Pörtner H, 2001. Climate change and temperature-dependent biogeography: oxygen limitation of thermal tolerance in animals. Naturwissenschaften, 88: 137—146
Porat A, Sagiv Y, Elazar Z, 2000. A 56-kDa selenium-binding protein participates in intra-Golgi protein transport. Journal of Biological Chemistry, 275: 14457—14465
She Y M, Narindrasorasak S, Yang S et al, 2003. Identification of metal-binding proteins in human hepatoma lines by immobilized metal affinity chromatography and mass spectrometry. Molecular and Cellular Proteomics, 2: 1306—1318
Song L, Zou H, Chang Y et al, 2006. The cDNA cloning and mRNA expression of a potential selenium-binding protein gene in the scallop Chlamys farreri. Developmental and Comparative Immunology, 30: 265—273
Teo M, Tan L, Lim L et al, 2001. The tyrosine kinase ACK1 associates with clathrin-coated vesicles through a binding motif shared by arrestin and other adaptors. Journal of Biological Chemistry, 276: 18392—18398
Urvoas A, Amekraz B, Moulin C et al, 2003. Analysis of the metal-binding selectivity of the metallochaperone CopZ from Enterococcus hirae by electrospray ionization mass spectrometry. Rapid Communications in Mass Spectrometry,17: 1889—1896
Yang M, Sytkowski A J, 1998. Differential expression and androgen regulation of the human selenium-binding protein gene hSP56 in prostate cancer cells. Cancer Research, 58:3150—3153
Zhang W, Wu C, Mai K et al, 2011. Molecular cloning,characterization and expression analysis of heat shock protein 90 from Pacific abalone, Haliotis discus hannai Ino in response to dietary selenium. Fish and Shellfish Immunology, 30: 280—286
猜你喜欢
杂志排行
海洋与湖沼的其它文章
- 俄罗斯鲟(Acipenser gueldenstaedtii)家系构建及不同家系间生长性能比较*
- 盐度调控对花鲈(Lateolabrax maculatus)生长相关基因表达的影响*
- 鳗弧菌(Vibrio anguillarum)侵染对青蛤(Cyclina sinensis)髓样分化因子88基因表达的影响*
- 连续降温对大菱鲆(Scophthalmus maximus)成鱼血清生化指标及Wap65-1基因表达的影响*
- 洞庭青鲫(Carassius auratus var. Dongtingking)与三个鲫品系群体遗传多样性的ISSR分析*
- 复合酶制剂对欧洲鳗鲡(Anguilla anguilla)生长性能、消化酶及非特异性免疫的影响*
