鳗弧菌(Vibrio anguillarum)侵染对青蛤(Cyclina sinensis)髓样分化因子88基因表达的影响*
2015-03-08任毅鹏潘宝平闫春财
高 晶 任毅鹏 潘宝平 闫春财
(天津师范大学生命科学学院 天津市动植物抗性重点实验室 天津 300387)
青蛤(Cyclina sinensis)是我国习见的海产经济动物, 由于其肉质细嫩鲜美, 营养丰富, 是我国南北沿海地区人们喜爱的鲜食贝类, 目前已成为重要的海水养殖对象之一(宋欣等, 2010)。由于近年来沿海地区的水质污染较为严重, 水生微生物病原体大量繁殖, 青蛤养殖业受到严重制约(孙国铭等, 2004)。鳗弧菌(Vibrio anguillarum)是引起水产养殖动物病害的重要病原微生物之一, 常给水产养殖造成巨大的损失,目前在我国江苏等省区已经引起青蛤的大面积病害和死亡现象(王兰萍等, 2007; 罗凯娅等, 2012)。
髓样分化因子88(myeloid differentiation 88, MyD88)是Toll样模式识别受体(Toll-like receptor, TLR)跨膜信号转导引发免疫反应的重要转接分子, 是信号向下游级联反应引发效应分子表达的关键靶分子。MyD88属于Toll/IL-1R家族, 包含N端死亡结构域(death domain,DD)中间区域和C端的Toll区。MyD88在Toll样受体2, 3, 4, 7, 9信号转导通路中起着非常重要的作用(赵兴旺等, 2011)。目前, 已有多个哺乳类、禽类、鱼类等动物的MyD88分子相继被鉴别(朱炳林等, 2010),有关软体动物MyD88分子的研究比较罕见。
本研究通过建立转录组文库并从中筛选克隆得到MyD88基因的cDNA序列, 进一步针对该基因的TIR结构域进行了结构分析和功能预测。在鳗弧菌胁迫下, 利用实时荧光定量 PCR技术检测了青蛤MyD88基因在不同组织的时序表达过程, 讨论了该分子在贝类免疫信号传导中的重要作用, 为深入揭示研究软体动物的免疫应答机制提供一定的实验数据, 同时为青蛤养殖中的病害防治提供新的思路。
1 材料与方法
1.1 实验材料
活体青蛤(Cyclina sinensis)采自天津大港滩涂,将其暂养于人工海水中, 海水密度 1.02—1.04g/cm3,水温 21—24°C, 持续曝气, 每天投喂 5‰的小球藻(Chlorella sp.), 一周后进行侵染实验。
1.2 实验方法
1.2.1 侵染实验 鳗弧菌(Vibrio anguillarum)用2216E培养基于 28°C下培养 24h后, 用无菌海水重悬菌液, 将浓度调为OD600= 0.4。实验采用随机分组方法, 每次试验均设 10个平行组。实验组青蛤注射50μL/只的鳗弧菌菌液, 对照组注射等量的灭菌生理盐水。注射前准确称取青蛤肝脏、外套膜、闭壳肌和鳃各50mg, 迅速放入液氮冷冻。注射后0h、3h、6h、12h、24h、48h、96h时提取血淋巴。取出冷冻组织在预冷匀浆器中按质量体积比1∶9加入预冷生理盐水进行匀浆, 4°C、4500r/min离心15min, 取上清液备用。血淋巴置于4°C条件下, 8000r/min离心10 min收集血细胞, 加入1mL Trizol, 置于 –80°C超低温冰箱中备用。
1.2.2 转录组文库的构建及数据筛选 Trizol法提取活体青蛤血淋巴总RNA, mRNA的分离按QIAGEN公司的Oligotex mRNA Kits试剂盒操作手册进行。纯化后的 mRNA加入裂解缓冲液将其打断成短片段,采用随机引物逆转录法合成 cDNA。纯化的双链cDNA再经末端修复、加A尾、加测序接头、纯化、PCR扩增等步骤完成整个文库制备。采用 Illumina MiSeq二代测序仪, pair end双端模式完成转录组测序。去冗余后的数据采用 Unigene编码蛋白框 ORF预测分析, 并与 NR数据库、Uniprot/Swissprot数据库和Unigene ggNOG数据库等多重BLAST分析比对,通过 Blast2GO软件完成 Unigene的 GO注。根据KEGG数据库注释信息进一步对 Unigene进行Pathway通路的注释和预测, 对 Unigene进行差异表达分析。
1.2.3 MyD88基因序列分析 从转录组文库中筛选出青蛤 MyD88基因类似序列, 设计特异性引物进行基因克隆, 同时与 GenBank核酸数据库作BLASTX分析, 使用开放阅读框(Open Reading Frame,ORF)在线分析, ProtParam工具在线预测序列的分子式、分子量和等电点, SignalP 3.0和SMART查找信号肽及结构域, Clustal W对氨基酸序列进行多重比对和同源性分析, 利用 MEGA4.1以邻接法(NJ)构建分子系统树。
1.2.4 MyD88基因在青蛤各组织内的表达分析参照 1.2.1方法, 将青蛤肝脏、外套膜、闭壳肌和鳃的匀浆上清液与青蛤注射后0h血细胞分别置于1mL TRIZOL中提取总RNA并反转成cDNA, 以cDNA为模板, β-actin基因为内参基因进行实时荧光定量PCR。RT-PCR 引物分别为: β-actin-F: 5’ CACCACA ACTGCCGAGAG 3’,β-actin-R: 5’ CCGATAGTGATGA CCTGACC 3’; MyD88-F: 5’ GACCTGTGCCACCAATA 3’, MyD88-R: 5’ GGGTTCCTGGG CTTTA 3’; 反应在Rotor-Gene 6000实时定量PCR仪上进行, 扩增体系为20μL, 反应程序为: 95°C预变性30s, 94°C变性5s,60°C退火30s, 72°C延伸30s, 40个循环。数据处理采用2-ΔΔCT法计算(Livak et al, 2001), 使用SPSS软件分析数据。
1.2.5 鳗弧菌刺激下青蛤MyD88基因在血淋巴中的时序性表达 参照 1.2.1方法, 提取鳗弧菌刺激下0h、3h、6h、12h、24h、48h、96h时血淋巴样品, 提取总RNA并反转成cDNA, 以cDNA为模板, β-actin基因为内参基因进行实时荧光定量PCR。RT-PCR引物参照1.2.4。反应程序为: 95°C预变性30s, 95°C变性5s, 58°C退火30s, 72°C延伸30s, 40个循环。数据处理采用2-ΔΔCT法, 使用SPSS软件对同一时间点实验组与对照组, 实验组和空白组的表达水平进行单因素方差分析。
2 结果
2.1 青蛤MyD88基因的结构分析
构建的转录组文库, 有893个基因注释到15个免疫相关的通路中。经随机挑取克隆并测序后, 利用BLASTX比对和ORF在线分析发现青蛤MyD88基因部分片段。青蛤 MyD88基因 cDNA开放阅读框为1521bp, 编码 506个氨基酸(图 1), 其理论分子量为57.14kDa, 理论等电点 pI=5.80, 分子式为 C2496H3912N698O806S17, 氨基酸组成中丝氨酸(Ser)最高, 占14.0%。N段存在完整的DEATH结构域, C段存在完整的TIR结构域。青蛤MyD88基因在GenBank中的注册号为KJ841930。
2.2 青蛤MyD88基因的分子系统学分析
用MEGA4.1软件以邻接法(NJ)构建了MyD88的系统树(图2), 采用bootstrap 1000个循环检验拓扑结构的置信度。拓扑图显示: 青蛤 MyD88与长牡蛎(Crassostrea gigas)、紫贻贝(Mytilus galloprovincialis)、三角帆蚌(Hyriopsis cumingii)、菲律宾蛤仔(Ruditapes philippinarum)聚在一个分支上; 而与鱼类如红笛鲷(Lutjanus sanguineus)、鳜鱼(Siniperca chuatsi)、布氏新亮丽鲷(Neolamprologus brichardi)、斑马鱼(Danio rerio)、鲤鱼(Cyprinus carpio)以及鸟类和哺乳类如原鸡(Gallus gallus)、人(Homo sapiens)、小家鼠(Mus musculus)、褐家鼠(Rattus norvegicus)进化距离较远。而海蜗牛(Aplysia californica)则与栉孔扇贝(Chlamys farreri)单独聚成一支。

图1 青蛤MyD88基因cDNA序列的开放阅读框及功能域分析Fig.1 The open reading frame of CsMyD88 gene and analysis on the structural domain
2.3 青蛤MyD88基因在不同组织间的表达
以β-actin在各组织中的表达量为内参对照, 利用实时荧光定量PCR分析了MyD88基因在青蛤血淋巴、肝脏、外套膜、闭壳肌、鳃五个组织的表达情况(图3), 结果显示MyD88基因在青蛤的以上五个组织中表达量存在明显差异, 其中血淋巴中表达量最高,显著高于其它组织(P<0.05), 是表达量最低的肝脏的50倍, 外套膜表达次之。表明青蛤MyD88基因主要在血淋巴中表达。
2.4 在鳗弧菌刺激下青蛤MyD88基因在血淋巴中的时序性表达
在鳗弧菌侵染青蛤后, 以β-actin为内参基因,利用实时荧光定量PCR分析了青蛤MyD88基因在血淋巴中的表达时序变化(图 4)。发现实验组在感染后24h表达量高于空白组; 到48h时出现了骤升并且达到最大值, 与对照组有极显著性差异(P<0.01), 约为对照组的 10倍左右; 且与空白组有极显著性差异(P<0.01)。96h后其表达量开始下降, 恢复并接近至正常水平。
3 讨论
目前有关MyD88分子的研究报道主要集中在鱼类、鸟类和哺乳动物中, 相对在软体动物中的研究资料比较罕见, 主要集中在栉孔扇贝(邱丽梅, 2006; 王孟强, 2010)、菲律宾蛤仔(Lee et al, 2011)、长牡蛎(Timothy et al, 2013)和紫贻贝(Mylène et al, 2014)等传统养殖对象中。本研究通过实时定量 PCR分析了青蛤 MyD88基因在不同组织中的表达情况, 结果显示在青蛤血淋巴、肝脏、外套膜、闭壳肌、鳃五个组织中均有表达, 但在血淋巴中的表达量与其它组织有显著性差异(P<0.05)。该结果与栉孔扇贝 CfToll-1的组织表达情况(邱丽梅, 2006)相似。青蛤的先天性免疫主要依赖于血淋巴的循环, 其在软体动物的内部防御中起到至关重要的作用(Pipe et al, 1997;Wootton et al, 2003)。鳗弧菌侵染青蛤48h后, MyD88基因的相对表达量达到最大, 可能是由于鳗弧菌产生的细胞毒素入侵青蛤血细胞后, 被一些识别因子或受体蛋白所识别, 进一步激活了青蛤Toll通路信号传递, 从而引起相关因子表达量的变化, 并最终诱导产生一系列免疫反应。青蛤MyD88基因在鳗弧菌刺激下的表达情况与栉孔扇贝MyD88基因在LPS刺激下的实验结果类似(王孟强, 2010)。本研究结果同时发现, 鳗弧菌刺激青蛤12h以内MyD88基因的相对表达量有所下调, 其结果与 PGN刺激下栉孔扇贝MyD88和TRAF6两种重要衔接蛋白mRNA的表达情况(邱丽梅, 2006)相似。该现象可能与mRNA处在动态平衡状态有关, 当病原体入侵较短时间内, mRNA被消耗用于合成更多的蛋白从而参与机体防御。
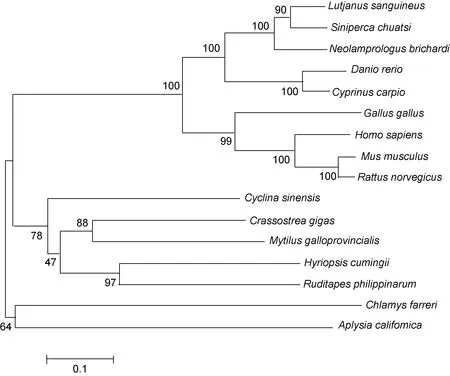
图2 使用邻接法(NJ)构建的16个物种MyD88氨基酸序列系统树Fig.2 The plylogenetic tree constructed by the amino acid sequences of MyD88 of 16 species using NJ (neighbor joining) method

图3 青蛤MyD88基因在青蛤不同组织间的表达情况Fig.3 Expression characterization of C. sinensis in organs revealed by real time PCR
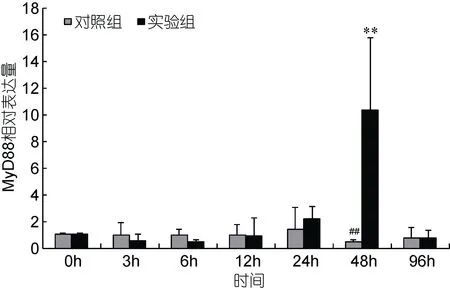
图4 青蛤血淋巴中MyD88基因在鳗弧菌刺激不同时间相对表达量的变化Fig.4 The relative expression of CsMyD88 gene in hemolymph of C. sinensis infected by V. anguillarum in different times
本研究通过构建青蛤转录组文库筛选并克隆得到TLR通路信号分子MyD88的cDNA序列, 利用分子系统学分析后发现, 青蛤的MyD88基因与长牡蛎、紫贻贝、三角帆蚌、菲律宾蛤仔亲缘关系相近, 并且与长牡蛎的 MyD88基因相似性最高, 一致性达到50%。利用 SMART在线分析软件对青蛤 MyD88基因进行蛋白质序列分析, 发现青蛤 MyD88氨基酸序列N段存在DEATH结构域, C段存在TIR结构域。MyD88属于Toll/IL-1R家族和死亡结构域家族成员,MyD88的TIR结构域与TLRs和IL-1Rs的TIR结构域相结合, 而死亡结构域可与白细胞介素1受体相关激酶(IL-1R-associated kinase, IRAK)的死亡结构域相互作用, 募集IRAK到受体复合体进而介导信号向下游传导(赵兴旺等, 2011)。通过构建系统树发现青蛤的MyD88基因的分子进化地位与其形态分类地位基本一致, 但与海蜗牛、栉孔扇贝差异明显, 说明该序列在软体动物进化过程中选择压力小的区域产生了明显的变异分歧。
本研究中有关青蛤 MyD88基因在鳗弧菌胁迫下, 不同组织的时序表达过程能够初步阐明贝类Toll通路中MyD88信号因子的传递特征, 为今后深入探索软体动物的免疫应答机制提供了重要的实验数据。
王兰萍, 耿荣庆, 刘 意等, 2007. 我国青蛤种质资源研究与利用现状. 江苏农业科学, 4: 254—255
王孟强, 2010. 栉孔扇贝(Chlamys farreri)Toll样受体信号通路免疫功能研究. 青岛: 中国科学院海洋研究所博士学位论文, 74, 106—109
朱炳林, 李 俊, 方维焕等, 2010. 中华鳖 MyD88部分序列克隆及其在组织中的表达差异分析. 水产学报, 34(7):1018—1024
孙国铭, 万夕和, 刘培庭等, 2004. 通州海区滩涂青蛤死亡原因的初步分析. 水产养殖, 25(2): 26—27
邱丽梅, 2006. 栉孔扇贝(Chlamys farreri)Toll样受体及其信号传递相关基因的克隆与表达. 青岛: 中国科学院海洋研究所博士学位论文, 75—78, 85—86
宋 欣, 张丽岩, 高玮玮等, 2010. 鳗弧菌(Vibrio anguillarum)侵染对青蛤(Cyclina sinensis)磷酸酶活性的影响. 海洋与湖沼, 41(2): 254—258
罗凯娅, 刘欣欣, 葛端阳等, 2012. 鳗弧菌(Vibrio anguillarum)侵染对青蛤(Cyclina sinensis)谷胱甘肽硫转移酶及其基因表达的影响. 海洋与湖沼, 43(4): 735—740
赵兴旺, 刘冉冉, 郑麦青等, 2011. 鸡髓样分化因子88的原核表达及单克隆抗体制备. 生物技术通讯, 22(6): 850—854
Lee Youngdeuk, Whang Ilson, Umasuthan Navaneethaiyer et al,2011. Characterization of a novel molluscan MyD88 family protein from manila clam, Ruditapes philippinarum. Fish &Shellfish Immunology, 31: 887—893
Mylène Toubiana, Umberto Rosani, Sonia Giambelluca et al,2014. Toll signal transduction pathway in bivalves:Complete cds of intermediate elements and related gene transcription levels in hemocytes of immune stimulated Mytilus galloprovincialis. Developmental & Comparative Immunology, 45(2): 300—312
Pipe R K, Farley S R, Coles J A, 1997. The separation and characterisation of haemocytes from the mussel Mytilus edulis. Cell Tissue Res, 289: 537—545
Timothy J Green, Caroline Montagnani, 2013. Poly I: C induces a protective antiviral immune response in the Pacific oyster(Crassostrea gigas) against subsequent challenge with Ostreid herpesvirus (OsHV-1 μ var). Fish & Shellfish Immunology, 35: 382—388
Wootton E C, Dyrynda E A, Ratcliffe N A, 2003. Bivalve immunity: comparisons between the marine mussel(Mytilus edulis), the edible cockle (Cerastoderma edule)and the razor-shell (Ensis siliqua). Fish Shellfish Immunol,15: 195—210
