盐度调控对花鲈(Lateolabrax maculatus)生长相关基因表达的影响*
2015-03-08迟美丽温海深蒙张亚晨黄政举宋志飞柴森浩
张 沛 迟美丽 温海深 钱 焜 倪 蒙张亚晨 黄政举 宋志飞 柴森浩
(中国海洋大学水产学院 青岛 266003)
生长激素受体(growth hormone receptor, GHR)是一种单链跨膜糖蛋白, 属于细胞因子/红细胞生成素受体超家族, 结构分为胞外区、跨膜区和胞内区。哺乳动物中仅鉴定出一种GHR, 而鱼类中GHR主要分为GHR1和GHR2两种亚型。近年来, 系统进化分析及结合实验研究表明, GHR1可能为生长催乳素受体(somatolactin receptor, SLR), GHR2才是生长激素(growth hormone, GH)真正的受体(Fukamachi et al,2005, 2007)。玉丽体鱼(Cichlasoma dimerus) (Rhee et al, 2012)和莫桑比克罗非鱼(Oreochromis mossambicus)(Pierce et al, 2007)研究也表明GHR1实际为SLR。生长催乳素由腺垂体分泌, 为鱼类特有激素, 属于生长激素家族。动物生长发育可通过GH/IGF轴介导。GH是由生长激素释放激素诱导垂体分泌的蛋白类激素。GH与靶细胞表面生长激素受体(GHR)结合, 通过JAK2/STAT信号转导途径, 激发靶细胞合成胰岛素样生长因子(insulin-like growth factor, IGF), 再通过血液循环到达靶组织, 促进细胞生长和分化。GHR为GH/IGF轴中心环节, 在生长内分泌调控中发挥重要作用。GH在高渗适应中有重要作用(McCormick,2001), 研究表明GH可参与渗透压调控, 环境盐度变化可改变垂体GH细胞数量及血浆GH浓度, 且这种改变存在种间差异(Mancera et al, 1998)。急性高盐度刺激可上调巴西牙鲆(Paralichthys orbignyanus)GH、GHR和IGF-1基因转录(Meier et al, 2009)。
高盐度可促进虹鳟(Oncorhynchus mykiss) GHR1 mRNA表达, 进而提高鳃中 Na+-K+-ATP酶α1a mRNA水平(Flores et al, 2012)。GH转基因斑马鱼(Danio rerio)的高渗及代谢调节能力显著提升(Daniela et al, 2013)。盐度升高可提高尼罗罗非鱼(Oreochromis niloticus)血浆GH, 进而提高GHR mRNA水平, 而莫桑比克罗非鱼无变化(Breves et al, 2010)。低渗适应是否受GH/IGF轴信号通路调控研究较少, 且GHR可能的渗透压调控作用是否通过上下游的GH和IGF介导尚有待探明。
花鲈(Lateolabrax maculatus)为东北亚特有种类,主要分布于中国、日本、朝鲜沿海, 属广温广盐性浅海近岸中下层鱼类, 为我国南、北方重要的网箱与池塘养殖经济鱼类之一(张美昭等, 2001)。花鲈因其肉质鲜美, 颇受消费者的喜爱, 社会需求日益增加。目前, 花鲈形态学、饲料与养殖技术方面研究较多, 而盐度对花鲈生理影响的研究较少。杜涛等(2013)研究了不同盐度下1龄花鲈生长特性的差异, 表明其最适生长盐度为 16—17, 而花鲈盐度调控生理分子机制研究尚未见报道。我国沿海花鲈产量有限, 且南方沿海网箱养殖的花鲈种质退化, 抗病力降低, 花鲈淡水养殖有待研究。内陆多地开始探索淡水养殖花鲈。而淡水驯化将引起花鲈内分泌改变。GHR作为调控生长的GH/IGF轴重要的中间环节, 在生长内分泌调控中发挥重要作用。然而, 有关 GHR在渗透压调控中的作用研究较少。
本研究克隆得到花鲈GHR1和GHR2基因, 并对其序列进行分析, 探究了低盐度调控后GHRs及上下游基因 GH和 IGF-1表达差异, 旨在为研究花鲈GH/IGF轴在盐度适应中的功能奠定基础, 同时为花鲈淡水驯化养殖提供理论依据。
1 材料与方法
1.1 实验材料及处理
从山东省青岛市胶南近海网箱养殖的同规格、健康花鲈 78尾, 平均体重为(803.5±49.8)g, 平均体长为(40.5±1.4)cm。在实验室水族箱中海水暂养, 期间禁食。实验用海水为沙滤自然海水(盐度32), 淡水为曝气后自来水, 实验温度为(17.5±0.4)°C。暂养3d后进行实验。首先取6尾作为实验原点, 实验分为3组:海水组、半海水组和淡水组, 每组设4个平行水族箱(0.6×0.8×1.0)m3, 每个水族箱放养 6尾花鲈。海水组盐度不变; 半海水组和淡水组每12h盐度分别降低4、8, 降至16、0后保持稳定。每天9:00和21:00各换水 3/4, 各盐度实验用水以海水和淡水按比例混匀调温后加入水族箱。24、48、96、144、192h时, 每实验组随机选4尾, 早晨8:00采样, MS-222麻醉解剖取14个组织(肠、脾、肌肉、心脏、胃、精巢、肝脏、鳃、脑、盲肠、头肾、肾、胸腺、垂体), 样品液氮冷冻后–80°C冰箱保存。

表1 花鲈基因克隆与荧光定量引物Tab.1 Primers used for cloning and qPCR of seabass
1.2 花鲈GHRs cDNA克隆
取花鲈肝脏, Trizol法提取总 RNA, Biodropsis BD-1000核算测定仪测定RNA的浓度, 1%琼脂糖凝胶电泳检测RNA完整性。用PrimerScript RT reagent Kit试剂盒反转录成cDNA后–80°C冰箱保存。取肝脏总RNA, 用SmartTMRace cDNA Amplification kit试剂盒, 依说明书合成全长克隆cDNA模板。
参照近缘鱼类GHRs氨基酸序列, 用CODEHOP设计简并引物(表1)。片段克隆PCR反应: 94°C预变性 5 min; 94°C30s, Tm30s, 72°C60s, 35 个循环;72°C10 min。1.5%琼脂糖凝胶电泳检测 PCR 产物;SAGECREATION电泳凝胶成像系统分析获得目的条带, 目的片段产物利用TIANgel Midi Purification kit进行凝胶回收; 连接 pEASY-T1载体; 转化到 Trans-T1感受态细胞; 氨苄抗性固体培养基 37°C过夜培养;挑菌以氨苄抗性液体培养基培养; 菌体 PCR检测;阳性菌液送北京华大基因科技公司测序。
用SMARTTMRACE cDNA Amplification Kit试剂盒扩增 5’端和 3’端。据获得 GHRs片段, 用 Primer5设计与试剂盒中UPM匹配引物(表1), RACE PCR反应程序参照试剂盒说明。RACE PCR产物测序同片段克隆。DNAMAN拼接基因获得基因全长。
1.3 GHRs基因序列分析
用 DNAMAN预测开放阅读框并推测氨基酸序列, 用Signal P 4.1 server分析信号肽; 用Scratch程序预测二硫键。预测的氨基酸序列在NCBI进行Blast搜索, 用 DNAMAN将其与其它物种GHRs氨基酸序列进行多重序列比对。选取部分物种GHRs氨基酸序列, 用Clustal X和MEGA 4.0软件, 以邻接法(Neighbour-Joining, NJ)构建系统进化树。用DNAMAN进行同源性分析。
1.4 GHRs、IGF-1、GH荧光实时定量PCR
据花鲈GHRs、GH (GenBank: L43629)和 IGF-1(GenBank: JQ327805)cDNA序列设计表达引物(表1)。以β-actin为内参基因, 检测花鲈14个组织中GHRs表达水平, 并检测实验各组肝脏中GHR1,2, IGF-1和垂体中 GH表达水平。用 SYBR Green Premix Ex TaqTM(Tli RNaseH Plus)试剂盒, 在ABI step one plus实时定量PCR仪上进行反应, 实验设3个重复。各基因荧光定量采用两步法, PCR程序: 94°C 30s, 94°C 5s,Tm30s, 40个循环; 溶解步骤。用2-ΔΔCt法处理各基因荧光定量所得数据, 并分析扩增效率。
1.5 数据分析
实验数据用平均值±标准误(Mean±SEM)表示,SPSS 19.0进行单因素方差分析, 进行Duncan’s多重比较, 当P<0.05时, 表示差异显著。
2 结果
2.1 花鲈GHR1、GHR2 cDNA结构分析
克隆得到花鲈GHR1 cDNA全长序列2436bp, 其中编码区1911bp, 编码637个氨基酸; GHR2 cDNA全长序列2940bp, 其中编码区1746bp, 编码582个氨基酸。序列已经提交到GenBank: GHR1, KF601961;GHR2, KF770840。GHRs氨基酸序列结构及多序列比对分析如图1所示。花鲈GHRs由信号肽、胞外区、跨膜区、胞内区组成。前端信号肽氨基酸, GHR1为28个, GHR2为19个。胞外区在靠近跨膜区的位置有一个保守的区域, GHR1中为 FGEFS, GHR2中为FGGFS。胞外区半胱氨酸残基, GHR1有7个, GHR2有6个。胞外糖基化位点, GHR1有6个, GHR2有4个。跨膜结构域氨基酸同源性较低。胞内区有保守Box1和Box2。胞内酪氨酸残基, GHR1有8个, GHR2有4个。胞外半胱氨酸残基位点(GHR1: 1、2、3、4、5、6、8, GHR2: 1、2、3、4、7、8)。胞外糖基化位点(GHR1: 1、3、4、5、6、7, GHR2: 1、2、5、6)。胞内酪氨酸残基位点(GHR1: 1、2、3、4、5、6、7、8, GHR2: 2、4、5、8)。GHRs氨基酸系统进化分析如图 2所示, 硬骨鱼类 GHR1为一支, 硬骨鱼类GHR2为一支, 而达氏鳇与高等脊椎动物为一支。系统进化树符合物种间传统分类地位。花鲈 GHR1与GHR2间氨基酸序列同源性为36.09%。
2.2 GHRs mRNA组织表达模式
花鲈各组织表达结果如图3所示, 14个组织中均检测到GHRs mRNA表达, 但GHR1和GHR2组织分布存在差异。GHR1在脑中表达最高, 其次为垂体、胃、肝脏、肾、盲肠、鳃、心脏, 在肠、头肾、胸腺、脾、肌肉、精巢中表达较低。GHR2在肌肉中表达最高, 其次为垂体、肝脏、盲肠、心脏、胸腺、胃, 在肠、脑、肾、脾、鳃、头肾、精巢中表达较低。其中, 脑、肾、鳃中 GHR1表达明显高于 GHR2; 而在肌肉、垂体、肝脏、盲肠、胸腺、心脏中, GHR2表达明显高于GHR1。
2.3 低盐度调控花鲈GHRs、IGF-1、GH表达规律
本实验检测了急性低盐度调控后花鲈肝脏中GHR1、GHR2和IGF-1及垂体中GH的转录水平(图4)。24h时, 各组GHR1保持稳定, 而 GHR2、GH、IGF-1显著下降。淡水组和半海水组GHR1mRNA在96h后均显著高于海水组。且在96h和192h时, 淡水组 GHR1显著高于半海水组。淡水组 GHR2 mRNA在 96h后显著高于海水组和半海水组, 半海水组GHR2 mRNA在144h后显著高于海水组, 且在144h和192h淡水组与半海水组间无显著差异。淡水组GH mRNA在 96h后显著低于海水组, 半海水组 GH mRNA在144h后显著高于海水组, 且在144h和192h淡水组与半海水组间无显著差异。淡水组 IGF-1mRNA在192h显著高于海水组和半海水组, 半海水组IGF-1 mRNA在144h和192h显著高于海水组和淡水组, 且在192h时淡水组与半海水组间无显著差异。
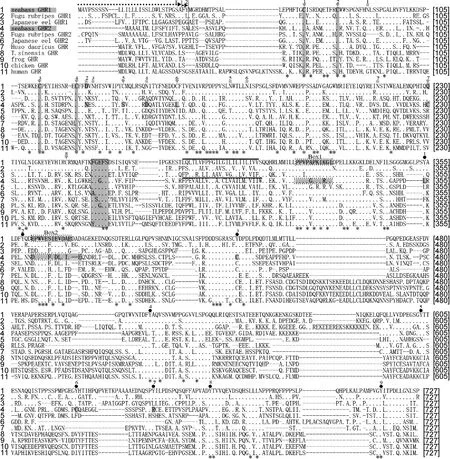
图1 GHRs氨基酸多序列比对Fig.1 Multiple sequence alignment of GHRs
3 讨论
3.1 花鲈GHRs结构及组织分布
首次克隆得到花鲈GHR1与GHR2基因, 并研究了二者差异。GHR1与GHR2间氨基酸序列结构上存在差异。胞外半胱氨酸残基数量GHR1比GHR2多一个, 两基因在 5个位点半胱氨酸残基保持一致, 在 3个位点存在差异, 而多序列比对显示物种间共4个半胱氨酸残基位点高度保守, 不同位点半胱氨酸残基构成二硫键不同, 可能改变空间结构, 造成功能差异。胞外N-糖基化位点GHR1比GHR2多2个, 这种不同可能造成GHRs在信号转导过程中的差异。BOX1富含脯氨酸(P), 在整个信号转导过程起关键作用; Box2是与受体的内化作用相关。多序列比对表明物种间BOX1序列同源性较高, 而Box2保守性较差。胞内酪氨酸残基, GHR1有比GHR2多4个, 酪氨酸残基的磷酸化作用可为信号传导提供停靠位点(Wang et al, 1996)。因此, GHRs胞内酪氨酸数目的差异可能影响GH与GHRs结合。多物种间GHRs氨基酸序列比对表明 GHRs相对保守性存在较大的种间差异, 物种间GHRs功能是否存在差异有待研究。花鲈GHR1与GHR2同源性仅为30.09%。黄鳍鲷(Sparus latus)GHR1与 GHR2间同源性为 36.7%(马细兰等,2011)。而鱼类种间GHR1同源性和种间GHR2同源性均较高, 表明GHR1和GHR2在进化中差异较大。
进化树分析显示, 硬骨鱼类GHR1和GHR2分为明显的两支, 表明种内GHRs亚型间差异较大, 而种间GHRs差异较小。硬骨鱼GHR2与高等动物GHR亲缘关系较近, 暗示GHR2为鱼类GH受体, 而鱼类GHR1可能为SL受体。鱼类GHRs的确定尚需从更多鱼类中验证。
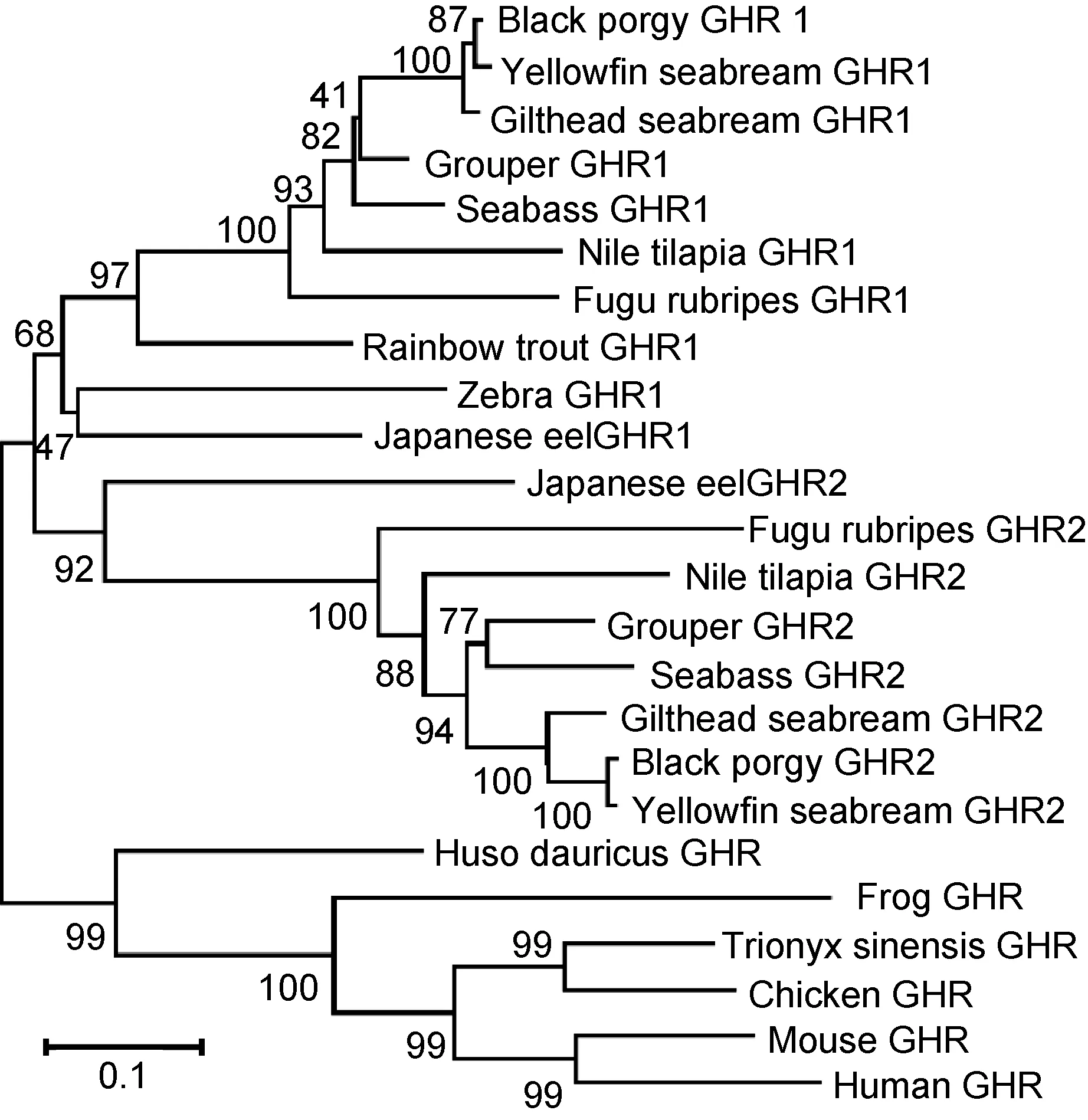
图2 GHRs氨基酸N-J系统进化树Fig.2 The Neighbor-joining tree of deduced amino acid sequences of GHRs
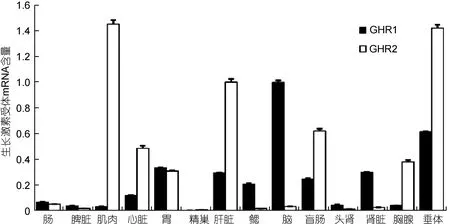
图3 花鲈各组织GHRs mRNA相对表达量Fig.3 Relative expression levels of GHRs mRNA in tissues of seabass
花鲈GHR1和GHR2组织分布不同, 推测其功能可能存在差异。脑、鳃和肾中GHR1显著高于GHR2,而鳃和肾是重要的渗透压调节器官, 推测GHR1可能更多地参与渗透压调控; 脑中高表达, 推测其负反馈调控中枢可能在下丘脑。肌肉、心脏、肝脏、盲肠、胸腺和垂体中GHR2高于GHR1, 而这些均为GH/IGF轴中重要的功能器官, 推测GHR2更多在生长方面发挥重要作用。此外, 斜带石斑鱼(Epinephelus coioides)(Li et al, 2007)、黄鳍鲷(马细兰等, 2011)、黑鲷(Acanthopagrus schlegelii) (Jiao et al, 2006)、尼罗罗非鱼(Ma et al, 2007)等鱼类研究同样表明了GHR1与GHR2的组织分布存在差异, 且存在种间特异性。
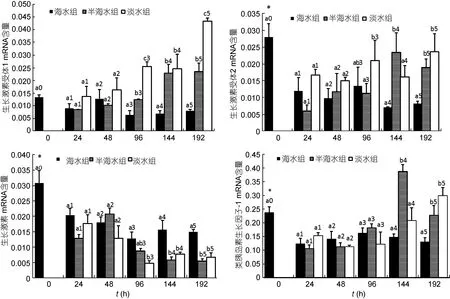
图4 肝脏GHR1、GHR2和IGF-1及垂体GH相对表达量Fig.4 Relative mRNA expression of GHR1, GHR2, IGF-1 in live and GH in pituitary
3.2 低渗调控花鲈GH/IGF轴表达改变
本实验中24h时, 各组GHR1表达保持稳定, 而GHR2、GH、IGF-1显著下降。有研究表明慢性胁迫及外源皮质醇(Cortisol, Cor)处理可以大幅降低鱼体生长率(Mommsen et al, 1999), 这可能包含皮质醇与GH/IGF轴间的交互作用。Peterson等(2005)报道, 高水平外源Cor可降低斑点叉尾(Ictalurus punctatus)垂体 GHmRNA表达。许多调控因素都可升高鱼体Cor, 即使是对照组也经常会检出高的 Cor水平(Hori et al, 2008; LeBlanc et al, 2011)。推测实验组鱼体受低渗诱导后, 可能会出现高 Cor水平, 抑制 GH表达,进而抑制 GHR2表达降低, 但未引起 GHR1表达改变。在24h时, 低渗调控可能抑制了GH/IGF轴表达。据此推测, IFG-1表达降低可能是通过GH对GHR2的调控通路实现的, 同时暗示了GHR2可能为GH的真正受体。
24h后, 相对于海水组, 淡水组和半海水组GHRs和IGF-1表达随调控时间而升高, 而GH则表现出下降趋势。哺乳动物研究中, 小鼠(Mus musculus)肾脏(Butler et al, 1996)和鸡(Gallus gallus)肝脏(Mao et al,1997)中发现GH与GHR负相关。鱼类中, 莫桑比克罗非鱼在低渗适应中也发现GH与GHR负相关(Pierce et al, 2007)。GH与GHRs间关系较为复杂, 可能受其它因素干扰。罗非鱼进行Cor注射后, 其肝脏IGF-1表达降低, 并呈现出剂量依赖性, 而血浆GH含量未改变, 表明 Cor可能造成 GH抵抗(Kajimura et al,2003)。因此, GHRs变化, 可能是通过改变 GHR对GH反应的敏感性。此外, GHRs改变也可能并非仅有GH诱导一种途径, 而是通过其它因子介导调控。据此推测, 低渗调控可激活GHRs转录, 而GHRs的增加并非通过GH对GHRs诱导表达来实现, 可能是低渗调控直接诱导上调了GH与GHR的结合敏感性或通过其它因子介导实现增加GHRs转录, 进而激活下游IGF-1表达, 增强低渗调节能力。GH的渗透调节能力有可能是通过渗透调控诱导GHRs表达, 并激活下游通路来实现。花鲈渗透调节能力可能是通过增加GHRs而增加的。
此外, 在实验后期, 淡水组GHRs和IGF-1表达要高于海水组, 而淡水组GH含量要低于半海水组。半海水组盐度理论上为花鲈生长最适宜盐度。如果仅从生长方面分析, 半海水组GH/IGF轴中各因子应表现出更高的含量, 但实验中检测到可反映其更适宜花鲈生长的GH/IGF轴指标。据此推测, 可能是急性的低渗调控占主导作用, 实验中花鲈尚未能完全适应盐度改变, GH/IGF轴的生长调控功能尚未恢复到正常水平。
本研究克隆出花鲈GHR1和GHR2基因, 并探究了低盐度调控后 GH/IGF轴部分相关基因的表达情况。同时, 对GH/IGF轴在花鲈低渗调控中的作用进行分析, 而更为系统的调控机制有待进一步研究。
马细兰, 冷婷婷, 刘启智等, 2011. 黄鳍鲷(Sparus latus)两种生长激素受体的 cDNA克隆及组织表达分析. 海洋与湖沼,42(2): 830—838
杜 涛, 黄 洋, 覃雪迎等, 2013. 不同盐度养殖Ⅰ龄花鲈(Lateolabrax japonicus)的生长特性差异分析. 海洋与湖沼,44(2): 337—341
张美昭, 高天翔, 2001. 花鲈亲鱼人工培育与催产技术研究.青岛海洋大学学报, 31(2): 195—200
Breves J P, Hasegawa S, Yoshioka M et al, 2010. Acute salinity challenges in Mozambique and Nile tilapia: Differential responses of plasma prolactin, growth hormone and branchial expression of ion transporters. General and Comparative Endocrinology, 167: 135—142
Butler A A, Funk B, Breier B H et al, 1996. Growth hormone(GH) status regulates GH receptor and GH binding protein mRNA in a tissue and transcriptspecific manner but has no effect on insulin-like growth factor-I receptor mRNA in the rat. Molecular and Cellular Endocrinology, 116: 181—189
Daniela V A, Camila M G M, Márcio A F et al, 2013. Growth hormone transgenesis affects osmoregulation and energy metabolism in zebrafish (Danio rerio). Transgenic Research,22: 75—88
Flores A M, Shrimpton J K, 2012. Differential physiological and endocrine responses of rainbow trout, Oncorhynchus mykiss,transferred from fresh water to ion-poor or salt water.General and Comparative Endocrinology, 175: 244—250
Fukamachi S, Meyer A, 2007. Evolution of receptors for growth hormone and somatolactin in fish and land vertebrates:lessons from lungfish and sturgeon orthologues. Journal of Molecular Evolution, 65: 359—372
Fukamachi S, Yada T, Mitani H, 2005. Medaka receptors for soma tolactin and growth hormone: phylogenetic paradox among fish growth hormone receptor. Genetics, 171: 1875—1883 Hori T S F, Avilez I M, Iwama G K, et al, 2008. Impairment of the stress response in matrinxa juveniles (Brycon amazonicus)exposed to low concentrations of phenol. Comparative Biochemistry and Physiology C, 147C: 416—423
Jiao B W, Huang X G, Chan C B et al, 2006. The co-existence of two growth hormone receptors in teleost fish and their differential signal transduction, tissue distribution and hormonal regulation of expression in sea bream. Journal of Molecular Endocrinology, 36(1): 23—40
Kajimura S, Hirano T, Visitacion N et al, 2003. Dual mode of cortisol action on GH/IGF-I/IGF binding proteins in the tilapia, Oreochromis mossambicus. Journal of Endocrinology,178: 91—99
LeBlanc S, Middleton S, Gilmour K M et al, 2011. Chronic social stress impairs thermal tolerance in the rainbow trout(Oncorhynchus mykiss). Journal of Experimental Biology,214: 1721—1731
Li Y, Liu X, Zhang Y et al, 2007. Molecular cloning,characterization and distribution of two types of growth hormone receptor in orange-spotted grouper (Epinephelus coioides). General and Comparative Endocrinology, 152:111—122
Ma X, Liu X C, Zhang Y et al, 2007. Two growth hormone receptors in Nile tilapia (Oreochromis niloticus): molecular characterization, tissue distribution and expression profiles during different gonad developing stages. Comparative Biochemistry and Physiology B, 147(2): 325—339
Mancera J M, McCormick S D, 1998. Osmoregulatory actions of the GH/IGF axis in non-salmonid teleosts. Comparative Biochemistry and Physiology B, 121: 43—48
Mao J N, Cogburn L A, Burnside J, 1997. Growth hormone downregulates growth hormone receptor mRNA in chickens but developmental increases in growth hormone receptor mRNA occur independently of growth hormone action.Molecular and Cellular Endocrinology, 129: 135—143
McCormick S D, 2001. Endocrine control of osmoregulation in teleost fish. American Zoologist, 41: 781—794
Meier K M, Fig.eiredo M A, Kamimura M T, 2009. Increased growth hormone (GH), growth hormone receptor (GHR),and insulin-like growth factor I (IGF-I) gene transcription after hyperosmotic stress in the Brazilian flounder Paralichthys orbignyanus. Fish Physiology and Biochemistry,35: 501—509
Mommsen T P, Vijayan M M, Moon T W, 1999. Cortisol in teleosts:dynamics, mechanisms of action, and metabolic regulation.Reviews in Fish Biology and Fisheries, 9: 211—268
Peterson B C, Small B C, 2005. Effect of exogenous cortisol on the GH/IGF-I/IGFBP network in channel catfish. Domestic Animal Endocrinology, 28: 391—404
Pierce A L, Fox B K, Davis L K et al, 2007. Prolactin receptor,growth hormone receptor, and putative somatolactin receptor in Mozambique tilapia: Tissue specific expression and differential regulation by salinity and fasting. General and Comparative Endocrinology, 154: 31—40
Rhee J S, Kim B M, Seo J S et al, 2012. Cloning of growth hormone, somatolactin, and their receptor mRNAs, their expression in organs, during development, and on salinity stress in the hermaphroditic fish, Kryptolebias marmoratus.Comparative Biochemistry and Physiology A, 161: 436—442 Wang X, Darus C J, Xu B C et al, 1996. Identification of growth hormone receptor (GHR) tyrosine residues required for GHR phosphorylation and JAK2 and STAT5 activation. Molecular Endocrinology, 10(10): 1249—1260
