连续降温对大菱鲆(Scophthalmus maximus)成鱼血清生化指标及Wap65-1基因表达的影响*
2015-03-08纪利芹张明明王宝杰韩龙江蒋克勇
纪利芹 张明明 王 雷 王宝杰 刘 梅 韩龙江 蒋克勇①
(1. 中国科学院海洋研究所 海洋生态养殖技术国家地方联合工程实验室 青岛 266071;2. 中国海洋大学水产学院 青岛 266003)
大菱鲆(Scophthalmus maximus)自然分布于大西洋东侧沿岸, 是低温经济鱼类中较名贵的品种。自1992年被引进我国后, 因其生长速度快、耐低温、繁殖快、风味独特兼有丰富的胶原蛋白、市场价格高等优点, 已成为我国北方为数不多的养殖较为广泛的经济品种之一(雷霁霖等, 2005)。
近年来, 随着我国经济发展的加快和人民群众生活水平的提高, 人们对水产品的品质要求也愈发趋向鲜活。而水产品的养殖基地与消费市场往往相距很远, 因此寻找鲜活鱼运输方法成为研究人员亟待重视和解决的新课题。传统的有水充氧运输方法成活率低、运输效率低且成本高, 鱼贝类易受到损伤而影响口感, 而利用生态冰温无水活运技术运输水产品,不仅缩短了运输时间、增加了运输密度更有利于产品品质的保持(Berka, 1986)。
将需要保活的水产品置于水体中降温至保活运输的温度是无水保活的首要条件。当温度降低时, 降温速率越快, 水产品机体受到的刺激越强烈, 应激反应就越大, 从而造成生物个体的损伤甚至死亡。因此,有效减少降温过程中引发的应激反应也是实现生态冰温无水活运技术的重要环节(刘小玲, 2007)。由Selye(1956)的应激理论可知, 应激反应会导致鱼体激素和血液代谢水平的变化, 也会引起分子的表达的改变(Chen et al, 1995; Weber et al, 2005)。其中, Wap65(warm-temperature-acclimation-associated protein)于1995年由 Kikuchi等(人在鲫鱼(Carassius auratus)中首次发现, 主要参与机体内温度相关应激反应和免疫应答反应, 在鱼类适应温度变化方面发挥重要作用(Kikuchi et al, 1997)。
本实验通过研究降温过程中血液生化指标及Wap65-1基因表达量的变化, 从生理生化和分子生物学的角度初步揭示了降温过程中大菱鲆机体的新陈代谢变化及应激反应的强弱程度, 为大菱鲆和其它水产动物的低温生物学和无水保活提供理论依据和数据积累。
1 材料与方法
1.1 实验材料
实验用大菱鲆(Scophthalmus maximus)购买自山东省青岛市胶南通用水产养殖场, 暂养于实验室控温循环水系统中, 暂养期间控制水温为(18.0 ± 1)°C,溶氧6mg/L以上, pH约为7—8, 盐度31, 循环水过滤, 水深维持在 0.9m左右。实验前2天停止投喂。
1.2 实验设计
大菱鲆暂养 2天后, 选取规格一致的成鱼 30尾进行实验, 个体的初始体重为(800.5±10.5)g, 实验共设置6个实验组, 每组放养大菱鲆5尾。采用实验室自行设计的降温循环水装置实现逐步降温, 所设大菱鲆的采样温度点分别为: 18°C、13°C、8°C、5°C、3°C 和 1°C, 水温降温速率设置为 10°C 以上≤5°C/h;10—1°C≤2°C/h; 1°C 以下≤0.5°C/h。
1.3 样品采集
实验开始后在 18°C时取样作为起始对照, 降温至 13°C、8°C、5°C、3°C 和 1°C 处立刻进行取样, 每个温度点处取 5尾平行。取出后立刻放入浓度为200mg/L的 MS-222溶液中做快速深度麻醉, 配制MS-222溶液所用水的温度与相应温度点的温度一致,尾静脉采血, 用1 mL注射器于鱼尾柄动脉采血5mL以上, 血液不加抗凝剂, 在4°C冰箱静置5h后, 4°C,12000r/min, 离心 20min制备血清, 血清移入–80°C保存。采血后解剖, 分离出脑、胃、肝脏、头肾、肾脏、脾脏、肌肉、肠道和心脏等组织液氮中速冻后, 于–80°C低温保存、待测。
1.4 实验试剂及测定方法
离心后的血清采用全自动生化分析仪测定部分生化指标(迈瑞 BS-180), 测定项目包括: 谷丙转氨酶(ALT)、乳酸脱氢酶(LDH)、肌酐(CR)、血糖; 血清皮质醇含量利用天津九鼎医学生物工程有限公司的试剂盒(CAT#/PID RA1)放免法测定。
实验中克隆和表达所需的引物均由南京金斯瑞(上海)有限公司合成; RNA提取过程中所需试剂Taq酶、Easytaq buffer、dNTPs及 DNaseⅠ(RNasefree)、RNA 酶抑制剂以及克隆用到的感受态细胞 Trans-5a均购自北京全式金生物技术有限公司。表达所需要的SYBR Premix Ex Taq购自TaKaRa公司; 普通琼脂糖胶回收试剂盒, pGM-T载体购自北京天根生物科技有限公司。
1.5 基因片段克隆及表达引物设计
参考与大菱鲆亲缘关系较近的牙鲆(Paralichthys olivaceus)已克隆的 Wap65-1序列全长(登录号:GQ396265.1), 利用primer premier软件设计特异性引物,经过筛选得到一对特异性引物(Wap65-1 F1, Wap65-1 R1), 见表1, 经克隆、测序得到大菱鲆Wap65-1基因的片段。设计荧光定量PCR引物(Wap65-1 F2, Wap65-1 R2), 见表 1, 用于基因的定量表达分析, 并选取大菱鲆的β-actin 基因作为内参, 内参引物见表1。

表1 Wap65-1基因片段克隆及表达引物设计Tab.1 Primers used in the cloning and expression of Wap65-1
1.6 荧光实时定量PCR标准曲线的建立以及目的基因的定量表达
对大菱鲆各组织的 cDNA 进行 10倍梯度稀释,以稀释后的cDNA为模板进行荧光实时定量PCR, 每个模板3个重复。用Line-Gene K荧光定量PCR仪(Bori, 杭州)检测, 根据SYBR Premix Ex Taq试剂盒(TaKaRa, 日本)的说明书进行操作。25μL荧光定量反应体系包括: 12.5μL Mix (含 SYBR 染料), 引物各0.5μL (表 1), cDNA 模版 2μL 和 ddH2O 9.5μL。荧光定量之前, 测定熔解曲线, 检查引物的特异性。荧光定量PCR反应程序如下: 95°C预变性30s, 35个循环(95°C变性 5s, 60°C退火 30s, 72°C延伸 15s), 72°C延伸3min。根据实时荧光定量PCR的结果, 以β-actin为内参基因, 根据目的基因以及β-actin的Ct值, 按照样品中目标基因相对内参基因的拷贝比例进行分析, 采用2–△△Ct法计算目的基因的相对表达水平。
1.7 数据处理
血清指标数据及 Wap65-1基因的表达量均采用SPSS 17.0统计软件包中的单因素方差分析和Duncan氏多重范围比较进行分析, P<0.05表明差异显著, 所有结果均以平均值±标准差表示。
2 结果
2.1 连续降温对大菱鲆血清生化指标的影响
由图1可知, 大菱鲆血清中谷丙转氨酶活性随温度的降低总体呈现先升高后下降的趋势, 在8°C时活性最高为(14±0.83)U/L, 温度低于8°C时活性有所回落但仍显著高于对照组。除 13°C实验组外, 其它实验组活性都显著高于初始对照组(P>0.05)。

图1 连续降温对大菱鲆谷丙转氨酶活性的影响Fig.1 Effects of continuous cooling on activity of serum ALT inS. maximus
由图2可知, 随温度降低肌酐浓度呈升高趋势,在 13°C 时浓度最低为(60.67±3.06)μmol/L, 在 3°C时浓度达最高值(91±10.15)μmol/L且显著高于除1°C之外的其它实验组, 其余各组之间没有显著差异(P>0.05)。
由图3可知, 随温度降低, 血清中乳酸脱氢酶活性呈现先升高后降低的趋势, 在 13°C时乳酸脱氢酶活性达最高值为(19.33±2.65)U/L, 在 3°C 时降到最低值为(1.33±0.31)U/L, 13—5°C 温度范围内的酶活显著高于其它实验组(P<0.05), 13—5°C 该温度范围内的实验组之间无显著性差异(P>0.05)。
由图4可知, 血糖浓度随温度降低, 呈现先降低后升高再降低的趋势, 8°C时浓度最高为(1.15±0.12)mg/g,当温度降到1°C时回到初始水平, 8—3°C温度范围内的血糖浓度显著高于其它实验组(P<0.05), 且该温度范围内的实验组之间无显著性差异(P>0.05)。

图2 连续降温对大菱鲆血清肌酐浓度的影响Fig.2 Effects of continuous cooling on concentrations of serum creatinine in S. maximus

图3 连续降温对大菱鲆血清乳酸脱氢酶活性的影响Fig.3 Effects of continuous cooling on activity of serum lactate dehydrogenase in S. maximus

图4 连续降温对大菱鲆血液葡萄糖浓度的影响Fig.4 Effects of continuous cooling on concentrations of serum glucose in S. maximus
由图5可知, 血清皮质醇含量随温度降低呈现升高趋势, 降到 1°C时达到最高值(6.47 ± 0.32)ng/mL,显著高于其它实验组(P<0.05)。除13°C组外, 其它实验组皮质醇浓度都显著高于对照组(P<0.05)。

图5 连续降温对大菱鲆血清皮质醇含量的影响Fig.5 Effects of continuous cooling on contents of lactic acid of muscle in S. maximus
2.2 片段克隆结果
通过分子克隆, 得到一段长度为430bp的大菱鲆wap65-1基因片段。经过与其它物种进行对比验证后,片段序列已经提交到NCBI数据库, GenBank登录号:KF879928。测序结果如下:

2.3 Wap65-1片段实时荧光定量表达结果
由图6可知, 脑组织的Wap65-1表达量基本上随温度的降低而升高, 在 1°C时脑组织的表达量激增,显著高于起始温度 1000多倍(P<0.05), 由图 7、图 8和图 9可知, 胃组织、肝脏组织和头肾组织中Wap65-1基因的表达量随温度降低整体呈升高趋势。在 8°C、3°C 和 1°C 时表达量显著升高(P<0.05), 其余温度下Wap65-1表达量较少甚至不表达。
由图10可知, 肾组织在降温过程中Wap65-1表达量总体呈现先升高后降低的趋势, 在 18°C时几乎不表达, 在5°C时的表达量最高, 且显著高于其它实验组(P<0.05), 5°C之后Wap65-1表达量有所回落但仍显著高于对照组(P<0.05)。
由图 11可知, 脾脏组织在降温过程中 Wap65-1表达量总体呈现先升高后降低的趋势, 在5°C时的表达量最高, 且显著高于其它实验组(P<0.05), 5°C之后Wap65-1表达量有所回落但仍显著高于对照组(P<0.05)。

图6 连续降温对大菱鲆脑组织Wap65-1的相对表达量的影响Fig.6 Effects of continuous cooling on the abundance of Wap65-1 mRNA in the brain tissue of S. maximus

图7 连续降温对大菱鲆胃组织Wap65-1的相对表达量的影响Fig.7 Effects of continuous cooling on the abundance of Wap65-1 mRNA in the craw tissue of S. maximus

图8 连续降温对大菱鲆肝脏组织Wap65-1的相对表达量的影响Fig.8 Effects of continuous cooling on the abundance of Wap65-1 mRNA in the liver tissue of S. maximus
由图12和图13可知, 肌肉组织和肠组织在降温过程中Wap65-1表达量整体呈升高趋势, 其中肌肉组织 Wap65-1基因的相对表达量在 13°C时有最高值,且显著高于其它实验组(P<0.05)。肠组织Wap65-1基因的相对表达量在1°C时有最高值, 且显著高于其它实验组(P<0.05)。

图9 连续降温对大菱鲆头肾组织Wap65-1的相对表达量的影响Fig.9 Effects of continuous cooling on the abundance of Wap65-1 mRNA in the head kidney tissue of S. maximus

图10 连续降温对大菱鲆肾组织Wap65-1的相对表达量的影响Fig.10 Effects of continuous cooling on the abundance of Wap65-1 mRNA in the kidney tissue of S. maximus

图11 连续降温对大菱鲆脾脏组织Wap65-1的相对表达量的影响Fig.11 Effects of continuous cooling on the abundance of Wap65-1 mRNA in the spleen tissue of S. maximus

图12 连续降温对大菱鲆肌肉组织Wap65-1的相对表达量的影响Fig.12 Effects of continuous cooling on the abundance of Wap65-1 mRNA in the muscle tissue of S. maximus

图13 连续降温对大菱鲆肠组织Wap65-1的相对表达量的影响Fig.13 Effects of continuous cooling on the abundance of Wap65-1 mRNA in the intestine tissue of S. maximus
由图 14可知, 心脏组织在降温过程中 Wap65-1表达量整体呈先升高后降低的趋势, 在 13°C时表达量激增, 且显著高于其它实验组, 13°C、5°C 和 3°C三组温度下 Wap65-1的表达量都显著高于对照组(P<0.05), 其余温度下无显著性差异。
3 讨论
血清中酶活性的变化能够反映机体新陈代谢和应激反应的状况, 以及组织器官的功能状态(惠天朝等, 2004; 冀德伟等, 2009)。谷丙转氨酶(ALT)主要存在于肝细胞中, 是肝脏损伤的重要指示酶(刘伟等,1996)。ALT在低于 8°C的温度区间内的活性明显高于初始浓度, 说明从8°C开始, 低温对肝功能产生了一定的影响甚至使之产生了损伤, 使肝脏中的 ALT释放到血液中致使其浓度升高。这与何福林等研究水温对虹鳟(Oncorhynchus mykiss)血液影响的结论一致(何福林, 2007)。乳酸脱氢酶(LDH)正常情况下主要存在于心肌细胞中, 当心肌细胞受损时, 会使其从细胞释放到血液中, 因此可以通过测定其活性升高反应心机细胞的受损情况及功能状态(崔杰峰等, 2000)。LDH活性随温度降低呈现先升高后降低的趋势, 说明降温初期对心肌细胞产生了一定影响, 使其代谢加快进而导致细胞通透性增加(王涛等, 2013), 冀德伟等(2009)发现在低温胁迫下, 大黄鱼(Pseudosciaena crocea)LDH活性显著升高, 本实验中LDH活性显著升高后又下降, 可能与大菱鲆对降温过程产生适应性有关, 也可能与心脏功能稳定性和对外界刺激较强的适应性相关。血清肌酐(CR)是肌酸代谢产物, 产生后由肾小球排除体外, 是反映肾脏功能的重要指标(Sano et al, 1960)。CR浓度随温度降低呈现先升高后降低的趋势, 可能在降温初期对鱼体肾脏功能产生一定影响, 降温后期一方面鱼体的新陈代谢降低,体内代谢物产生量减少使血清中CR浓度降低, 另一方面也可能与鱼体的肾脏功能对低温产生适应性有关(冀德伟等, 2009)。
血糖是机体的主要供能物质, 正常情况下, 其在血液中的浓度在一定范围内保持相对稳定。研究发现,应激状态下, 鱼体的血糖含量明显升高症(洪磊等,2005; 彭士明等, 2011), 当环境降温初期, 生物体内主要通过血糖分解代谢来增加产热量以增强御寒机能, 机体在产热时消耗大量葡萄糖(何福林, 2007)。随着低温胁迫的加强或胁迫时间的延长, 大量的葡萄糖被机体分解为 ATP提供能量, 而使葡萄糖浓度降低。本实验中葡萄糖的变化规律与此规律相符, 在3°C之前随温度降低血浆葡萄糖总体呈现升高趋势,说明在3°C之前大菱鲆处于应激状态, 温度降低血糖含量升高以增强鱼体的抗胁迫能力, 当温度继续降低到 3°C以下, 大菱鲆机体葡萄糖代谢酶活性降低,使葡萄糖产生量减少且大部分血糖被分解生成 ATP,消耗量增加, 使血糖总量减少。
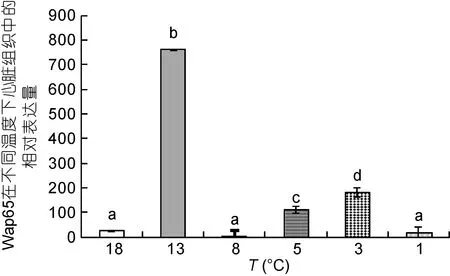
图14 连续降温对大菱鲆心脏组织Wap65-1的相对表达量的影响Fig.14 Effects of continuous cooling on the abundance of Wap65-1 mRNA in the heart tissue of S. maximus
Strange(1980)认为低温能使血清皮质醇浓度升高。血清中皮质醇含量的变化也是检测应激反应的指标之一(Mansfield et al, 2010)。本实验中连续降温使大菱鲆血清皮质醇含量相对初始浓度显著升高, 这说明低温使大菱鲆机体产生了应激反应, Chen等(1995)研究发现将鲤鱼(Cyprinus carpio)置于 4°C 的水中后, 血清中的皮质醇含量显著升高, 这与本实验结果一致。
目前, 日益增多的鱼类 Wap65基因已经被克隆出来, 人们对其结构已经有了清楚的认识, 但其具体功能还无清楚明确的结论, 仍停留在摸索阶段。Wap65基因根据其分子特征的差异可以分为多个异构体, 常见的有Wap65-1和Wap65-2两个异构体, 二者除在分子特征上有所不同以外, 还有其它的差异(Paoli et al, 1999; Nakaniwa et al, 2005; Sarropoulou et al, 2010)。首先, 二者的表达特征不同, 研究发现, 青将(Oryzias sinensis)中的Wap65-1在胚胎中的早期受精卵开始表达, 而Wap65-2在原肠后期到孵化前有所表达; 其次, 二者的空间表达特征有所不同, 有学者对青鳉的组织进行原位杂交发现: Wap65-2只在肝脏中表达, Wap65-1的表达范围较广(Kikuchi et al,1995); 再次, 不同物种中两种异构体的空间表达也有差异, 例如Wap65-2只在青鳉的肝脏中表达, 而在红鳍东方鲀(Fugu rubripes)的Wap65-2在肝脏和脑中都有表达(Peatman et al, 2007, 2008)。
通过对本实验克隆的片段进行分析, 该基因的片段在所有组织中都有所表达, 且将该基因在 NCBI数据库中进行 BLAST比对发现, 该基因与其它鱼类的 Wap65-1基因序列相似度高达 87%, 有研究表明Wap65-1基因存在多种, 可以判断该基因片段为Wap65-1的一种。
对不同组织中的 Wap65-1基因片段在不同温度下进行实时荧光定量检测, 结果表明: 本实验中所有组织的 Wap65-1基因表达量在连续降温过程中都有不同程度的上调(脑、胃、肝脏、头肾、肾、脾脏、肌肉、肠、心脏)。Kikuchi等(1997)将金鱼从10°C放到30°C水中发现肝胰腺表达量升高最显著。本实验中, 脑、胃和肝脏初始时表达量很少或者基本不表达,只在 3—1°C时表达量大量上调, 这说明降温到 3—1°C对这3种组织的功能稳定性产生影响, 从而通过增加 Wap65-1基因表达量适应外界环境温度变化(Kinoshita et al, 2001)。Pierre将鲈鱼(Lateolabrax japonicus)从12°C放置在30°C中一段时间, 肾脏自始至终不表达, 而脾脏在第四周时开始表达(Pierre et al,2010), 而本实验中头肾、肾脏和脾脏组织这3种组织在正常温度下表达量很低甚至不表达, 低温刺激后这三种组织在特定的温度处表达量上调, 其中肾脏的分子表达结果与肌酐变化趋势所反应的结果一致,说明降温初期在一定程度上影响了机体的排泄和免疫功能, 在降温后期, 表达量又有所回落, 可能与机体产生了温度适应性使应激反应减弱有关(Pierre et al, 2010)。Pierre实验中, 肌肉在高温应激下的表达呈阶段性, 在应激初期和末期表达量较高, 肠道只在末期表达量较高, 本实验降温过程中肌肉和肠这2种组织的表达量整体高于对照组, 这可能与鱼的种类和刺激因子的不同有关。Sha发现在升温刺激下斑点叉尾鮰心脏表达量升高, 本实验中心脏Wap65-1基因表达量只在13°C时表达量激增随后表达量减少甚至不表达, 说明心脏在降温过程中稳定性和适应低温能力较强(Sha et al, 2008; Díaz-Rosales et al, 2012)。
总之, 连续降温过程使大菱鲆所有组织Wap65-1基因在特定温度下表达量上调(脑、胃、肝脏、头肾、肾脏、脾脏、肌肉、肠道、心脏)。其中, 脑、胃、头肾、肾脏和心脏这5种组织中的Wap65基因在正常温度下基本不表达, 只在降温过程中表达; 肝脏、脾脏、肠道和肌肉这4种组织中的Wap65-1在正常温度下有所表达, 且随温度降低表达量升高。
4 结论
综合血液生化及分子生物学指标变化的趋势发现: 当温度在18—8°C时, 降温对大菱鲆体内代谢影响不大; 当温度降到 8—3°C 时, 大菱鲆开始出现应激反应, 各种指标变化较大; 当温度继续低到1°C时,各种指标数值都基本回落到初始状态, 大菱鲆体内的各种代谢基本处于停滞状态, 说明1°C比较接近大菱鲆的生态冰温点, 可以在此温度点附近进一步进行低温生理及无水保活的相关探索。
王 涛, 苗 亮, 李明云等, 2013. 突降盐度胁迫对大黄鱼(Pseudosciaena crocea)血清生理生化及鳃丝 Na+/K+-ATP酶活性的影响. 海洋与湖沼, 44(2): 421—426
刘 伟, 李佐锋, 1996. 温度对链鳙鱼生理生化指标的影响.东北师范大学学报(自然科学版), 02: 108—112
刘小玲, 2007. 鱼类应激反应的研究. 水利渔业, 27(3): 1—3
何福林, 向建国, 李常健等, 2007. 水温对虹鳟血液学指标影响的初步研究. 水生生物学报, 31(3): 363—369
洪 磊, 张秀梅, 2005. 环境胁迫对许氏平鮋和花鲈血糖、血沉降的影响. 中国水产科学, 12(4): 414—418
崔杰峰, 潘柏申, 2000. 急性心肌梗死血清酶标志物沿革. 上海医学检验杂志, 15(1): 13—14
彭士明, 施兆鸿, 李 杰等, 2011. 运输胁迫对银鲳血清皮质醇、血糖、组织中糖元及乳酸含量的影响. 水产学报, 35(6):831—837
惠天朝, 王家刚, 朱荫湄等, 2004. 镉对罗非鱼脑 AChE及组织中代谢酶的影响. 浙江大学学报(农业与生命科学版),30(6): 673—678
雷霁霖, 马爱军, 陈 超等, 2005. 大菱鲆(Scophthalmus maximus L)养殖现状与可持续发展. 中国工程科学, 7(5):30—34
冀德伟, 李明云, 王天柱等, 2009. 不同低温胁迫时间对大黄鱼血清生化指标的影响. 水产科学, 28(1): 1—4
Berka R, 1986. The Transport of Live Fish A Review. FAO: Food and Agriculture Organization of the United Nations, 76—81
Chen G R, Sun L T, Lee Y H et al, 1995. Characteristics of blood in common carp, Cyprinus carpio, exposed to low temperatures. Journal of Applied Aquaculture, 5(3): 21—31
Díaz-Rosales P, Romero A, Balseiro P et al, 2012. Microarraybased identification of differentially expressed genes in families of turbot (Scophthalmus maximus) after infection with viral haemorrhagic septicaemia virus (VHSV). Marine Biotechnology, 14(5): 515—529
Kikuchi K, Watabe S, Aida K, 1997. The Wap65 gene expression of goldfish (Carassius auratus) in association with warm water temperature as well as bacterial lipopolysaccharide(LPS). Fish Physiology and Biochemistry, 17(1—6): 423—432
Kikuchi K, Yamashita M, Watabe S et al, 1995. The warm temperature acclimation-related 65-kDa protein, Wap65, in goldfish and its gene expression. Journal of Biological Chemistry, 270(29): 17087—17092
Kinoshita S, Itoi S, Watabe S, 2001. cDNA cloning and characterization of the warm-temperature-acclimationassociated protein Wap65 from carp, Cyprinus carpio. Fish Physiology and Biochemistry, 24(2): 125—134
Mansfield G S, Desai A R, Nilson S A et al, 2010.Characterization of rainbow trout (Oncorhynchus mykiss)intestinal microbiota and inflammatory marker gene expression in a recirculating aquaculture system. Aquaculture,307(1—2): 95—104
Nakaniwa M, Hirayama M, Shimizu A et al, 2005. Genomic sequences encoding two types of medaka hemopexin-like protein Wap65, and their gene expression profiles in embryos.Journal of Experimental Biology, 208(10): 1915—1925
Paoli M, Anderson B F, Baker H M et al, 1999. Crystal structure of hemopexin reveals a novel high-affinity heme site formed between two β-propeller domains. Nature Structural &Molecular Biology, 6: 926—931
Peatman E, Baoprasertkul P, Terhune J et al, 2007. Expression analysis of the acute phase response in channel catfish(Ictalurus punctatus) after infection with a Gram-negative bacterium. Developmental & Comparative Immunology,31(11): 1183—1196
Peatman E, Terhune J, Baoprasertkul P et al, 2008. Microarray analysis of gene expression in the blue catfish liver reveals early activation of the MHC class I pathway after infection with (Edwardsiella ictaluri). Molecular Immunology, 45(2):553—566
Pierre S, Coupé S, Prévot-d'Alvise N et al, 2010. Cloning of Wap65 in sea bass (Dicentrarchus labrax) and sea bream(Sparus aurata) and expression in sea bass tissues.Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 155(4): 396—402
Sano Y, Kawamoto M, 1960. Histologische Untersuchungen Endozellulärer Kapillaren Neurosekretorischer Zellen.Zeitschrift für Zellforschung und Mikroskopische Anatomie,2(1): 152—156
Sarropoulou E, Fernandes J M O, Mitter K et al, 2010. Evolution of a multifunctional gene: The warm temperature acclimation protein Wap65 in the European seabass(Dicentrarchus labrax). Molecular Phylogenetics and Evolution,55(2): 640—649
Selye H, 1956. The Stress of Life. New York: McGraw-Hill, 91—101
Sha Z X, Xu P, Takano T et al, 2008. The warm temperature acclimation protein Wap65 as an immune response gene:Its duplicates are differentially regulated by temperature and bacterial infections. Molecular Immunology, 45(5):1458—1469
Strange R J, 1980. Acclimation temperature influences cortisol and glucose concentrations in stressed channel catfish.Transactions of the American Fisheries Society, 109(3):298—303
Weber J, Bochi V C, Ribeiro C P et al, 2008. Effect of different cooking methods on the oxidation, proximate and fatty acid composition of silver catfish (Rhamdia quelen) fillets. Food Chemistry, 106(1): 140—146
