洞庭青鲫(Carassius auratus var. Dongtingking)与三个鲫品系群体遗传多样性的ISSR分析*
2015-03-08刘良国杨品红谢春华王晓艳徐黎明
刘良国 杨品红 谢春华 王晓艳 徐黎明
(湖南省水产高效健康生产协同创新中心 动物学湖南省高校重点实验室 湖南文理学院生命科学学院 常德 415000)
洞庭青鲫(Dongtingking crucian carp, Carassius auratus var. Dongtingking, 暂命名)是近年来在洞庭湖区澧水北民湖水域发现的天然二倍体鲫鱼(2N=100)新品系(杨品红等, 2005a)。因其具有生长速度快、养殖产量高、抗逆性强、原汁原味等综合性状优势, 深受广大渔农和消费者青睐, 具有极为广阔的生产应用前景。在前期的工作中, 作者从形态特征、染色体组型、生殖方式等方面对洞庭青鲫进行了研究(杨品红等, 2005b, 2007; 吴珊等, 2006), 初步证实洞庭青鲫是一个具有两性繁殖方式、形态性状和染色体数目稳定的二倍体(2N=100)鲫鱼品系。与已报道的众多鲫品系相比较, 洞庭青鲫与 2个鲫品系性状较为相似:一是彭泽鲫, 二是普通的野鲫。彭泽鲫原产于江西省彭泽县丁家湖、芳湖和太白湖等天然水域, 最初江西省水产研究所认为彭泽鲫也是二倍体(2N=100)两性生殖鱼类(傅永进, 1996), 但随后报道的彭泽鲫均为染色体数目在 150条左右的雌核发育鱼(Zhou et al,2002; 刘良国等, 2004)。洞庭青鲫与最初报道的彭泽鲫一样, 也是行两性生殖方式的二倍体鲫鱼种群。另外, 作者对洞庭湖区普通野鲫的染色体组型进行研究, 结果表明在洞庭湖区同时存在染色体数为100和150±而且在形态上无法区分的两种倍性野鲫群体(刘良国等, 2012)。因此, 从洞庭青鲫的来源和染色体倍性上看, 它又与洞庭湖区的野鲫具有一定的相似性。为了进一步了解洞庭青鲫这一新型鲫鱼品系的遗传结构特征, 揭示不同鲫品系之间的遗传关系, 有必要从分子生物学的角度对洞庭青鲫和三个与之性状较为相似的彭泽鲫(C. auratus var. Pengze)、野生二倍体和三倍体鲫进行比较分析。
ISSR (inter-simple sequence repeat, 单一的序列重复区间)分子标记是在SSR标记基础上发展起来的一种实验技术(Zietikiewicz et al, 1994), 它结合了SSR和RAPD技术的优点, 具有模板需要量少、多态性丰富、实验成本低、操作简单、实验稳定性较高等优点, 现已广泛应用于物种的种质鉴定、亲缘关系的分析、遗传多样性与进化等研究领域(Kojima et al,1998; Reddy et al, 2002; Jian et al, 2004; Ai et al,2006)。本实验采用ISSR分子标记技术, 分析了洞庭青鲫种群与其它鲫品系的分子遗传多样性, 对于探讨鲫鱼乃至脊椎动物多倍体的起源与进化机制具有一定的理论意义, 同时对二倍体洞庭青鲫种质资源的保护及育种实践、养殖发展也具有指导意义。
1 材料与方法
1.1 材料
本实验所用洞庭青鲫(F6)和彭泽鲫取自大湖股份湖南省水产工程技术研究中心实验基地, 所用二倍体和三倍体野鲫采自洞庭湖区的沅水和澧水水域。在通过肾细胞染色体活体制片方法, 确定不同鲫品系的染色体倍性后, 每个鲫品系各取样 30尾, 分别剪其背部肌肉用95%乙醇保存备用。
1.2 基因组DNA提取
取1.0g肌肉提取基因组DNA, 参照常规的酚-氯仿抽提程序进行。提取后的DNA用0.8%琼脂糖凝胶电泳检测其质量, 用紫外分光光度计估算浓度和纯度, 调整浓度至40ng/μL, 4°C保存备用。
1.3 ISSR-PCR扩增
采用加拿大British Columbia大学公布的ISSR引物序列, 由北京鼎国昌盛生物技术有限责任公司合成。PCR反应体系为 25μL, 其中 40ng/μL DNA 模板 2.0μL, 10μmol/L ISSR 引物 1.0μL, 2.5 mmol/L dNTPs 2.5μL, 10× PCR buffer 2.5μL, Taq DNA polymease 1.0μL (1U/μL), ddH2O 16μL。PCR 扩增程序为: 95°C 5 min, 接着 95°C 30 s, 52°C 45 s, 72°C 2 min,共45个循环, 最后72°C 10 min。扩增产物在4%的变性聚丙烯酰胺凝胶上电泳(50 W恒功率2.5 h), ABI PRISM 377测序仪扫描, 得到电泳图。并以50—1000 bp标准分子质量进行对照。
1.4 数据统计
用GENESCAN3.1软件打开由ABI PRISM 377测序仪扫描得到的电泳图, 对胶图进行数据提取, 得到各片段大小的结果, 导出结果并将结果保存为XLS格式, 对EXCEL表内数值进行0/1赋值记带, 形成由“l”和“0”组成的原始二元数据矩阵。
根据 Apostol等(1996)的假设, 将每个条带视为一个位点进行多态分析, 多态位点比例(P) = 多态位点数/总位点数×100%。由Lynch(1990)的方法计算群体内、群体间的遗传相似指数和遗传距离: 两个体间的遗传相似指数Sxy= 2Nxy/ (Nx+ Ny), 其中Nxy表示个体x和y之间共有的DNA扩增片段数, Nx和Ny分别是个体x和y的DNA扩增片段数。群体内的遗传相似指数 S为群体内所有的两个体间遗传相似指数的平均值, 群体内的遗传距离D = 1-S; 群体间的遗传相似指数Sij为群体i和群体j中所有随机配对的两个体间遗传相似指数的平均值, 群体间的遗传距离Dij= 1–Sij。
1.5 聚类分析
根据各样本之间的遗传距离, 用MEGA4软件包中的UPGMA (unweighted pair-group methods with arithmetic means)方法进行聚类分析。
2 结果
2.1 ISSR-PCR扩增结果
从96个ISSR引物中, 筛选出扩增结果稳定、多态型高、重复性好的引物9个。9个引物在四个鲫品系群体中共检测到 1637个扩增位点, 片段大小在75—1000 bp之间, 每个引物检测出的位点数 141—232个不等(图1)。在1637个扩增位点中, 多态位点数 1572个, 多态位点比例 96.03%, 不同引物扩增出的多态位点比例均在 90%以上(表 1), 表现出丰富的多态性。
2.2 群体内的遗传多样性
对四个鲫品系群体内的扩增条带(位点)进行统计分析, 得到四个鲫品系群体的多态位点比例和遗传距离(表 2)。从多态位点比例和遗传距离数据指标来看, 洞庭青鲫群体明显低于二倍体鲫和三倍体鲫两个群体(P<0.05), 而与彭泽鲫群体的差异不显著(P>0.05)。表明洞庭青鲫、彭泽鲫等选育养殖群体的遗传多样性明显低于野生鲫群体。而在野生鲫群体中,又以三倍体鲫群体的遗传多样性最高。
2.3 群体间的遗传相似系数与遗传距离
四个鲫品系群体间的遗传相似系数和遗传距离见表 3。计算结果表明, 四个群体之间的平均遗传相似系数在 0.8622—0.8809, 平均遗传距离为 0.1191—0.1378。其中洞庭青鲫与彭泽鲫的遗传相似系数最高(0.8809), 遗传距离最小(0.1191); 而二者与三倍体鲫的遗传相似系数最小(均为0.8622), 遗传距离最远(均为 0.1378)。

图1 引物(GA)8YT和(CTTCA)3对四个鲫品系群体的ISSR扩增图谱Fig.1 The ISSR amplified results for the population of 4 strains of crucian carp by the primer (AG)8YT and (CTTCA)3 M. ROX1000 Ladder marker; 1—7. 洞庭青鲫; 8—14. 二倍体野鲫; 15—21. 三倍体野鲫; 22—28. 彭泽鲫
2.4 聚类分析
根据四个鲫品系群体间的遗传距离数据, 采用MEGA 4软件包中的 UPGMA方法进行聚类分析,得到四个鲫品系群体的 UPGMA分支树状图(图 2),结果为洞庭青鲫与彭泽鲫聚成一个分支, 二倍体鲫与三倍体鲫聚成一个分支, 然后两个分支再聚合在一起。
3 讨论
3.1 ISSR分子标记技术在不同鲫品系遗传多样性研究中的应用
采用ISSR分子标记对种群遗传多样性进行分析时, 由于 ISSR引物可以与整个基因组内多个位点进行杂交, 因此可以获得大量的遗传信息, 在同一物种内的不同品系或群体的遗传多样性研究中, 是一种非常有效的手段(Kol et al, 2007)。鲫(C. auratus)是一Liu等(2009)、高丽霞等(2011)用琼脂糖凝胶电泳和紫外光检测淇河鲫、野鲫和红鲫的ISSR研究结果。本实验结果表明, 在对不同鲫品系群体进行遗传多样性分析时, 采用 ISSR技术比 RAPD技术更为高效,更能揭示它们之间的遗传差异, 这与两种标记的检测位点不同有关, RAPD标记是对生物基因组的随机个分布广泛、适应性强、多样性高、遗传背景复杂的类群(肖俊等, 2010), 采用ISSR分子标记技术对不同鲫种群的遗传多样性研究已有报道: 如 Liu等(2009)利用12个ISSR引物对异源四倍体鲫鲤及其原始亲本红鲫和鲤鱼群体进行分析, 高丽霞等(2011)用 8个ISSR引物对淇河鲫和两个野生鲫鱼群体进行扩增,均检测出非常丰富的遗传多样性。
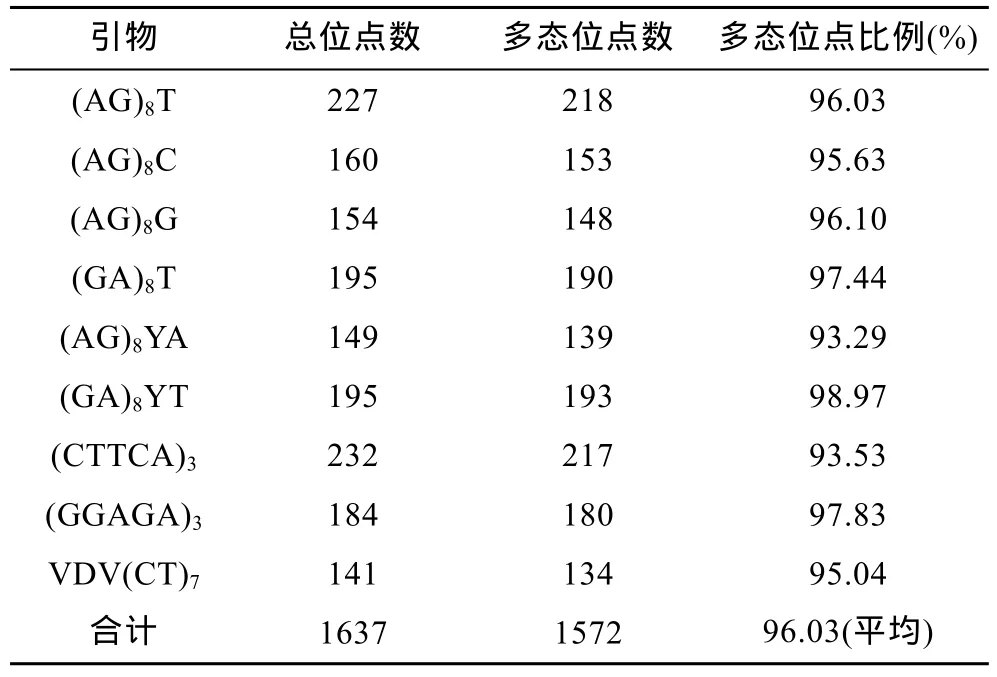
表1 ISSR引物在四个鲫品系群体中检测的多态位点数及多态位点比例Tab.1 Number of polymorphic loci and the percentage in the population of the 4 strains of crucian carp with a single primer by ISSR analysis
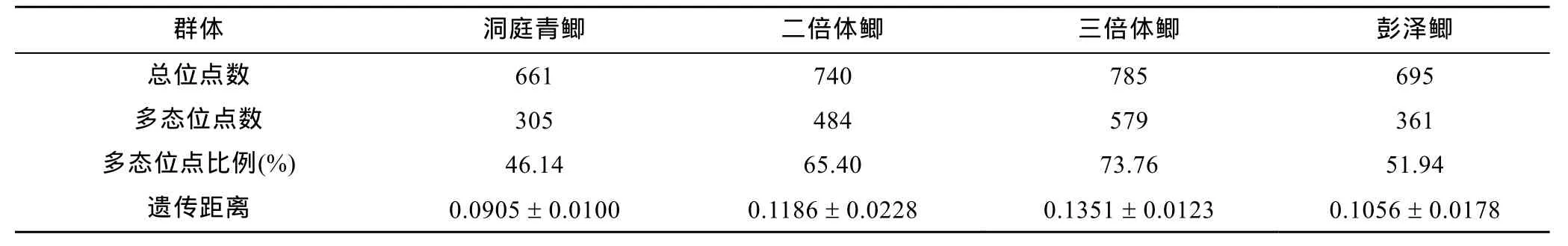
表2 四个鲫品系群体内的遗传多样性Tab.2 The genetic diversities within the population of 4 strains of crucian carp

表3 四个鲫品系群体间的遗传相似系数(对角线上方)和遗传距离(对角线下方)Tab.3 The genetic similarities (above diagonal) and genetic distances (below diagonal) among the 4 strains of crucian carp
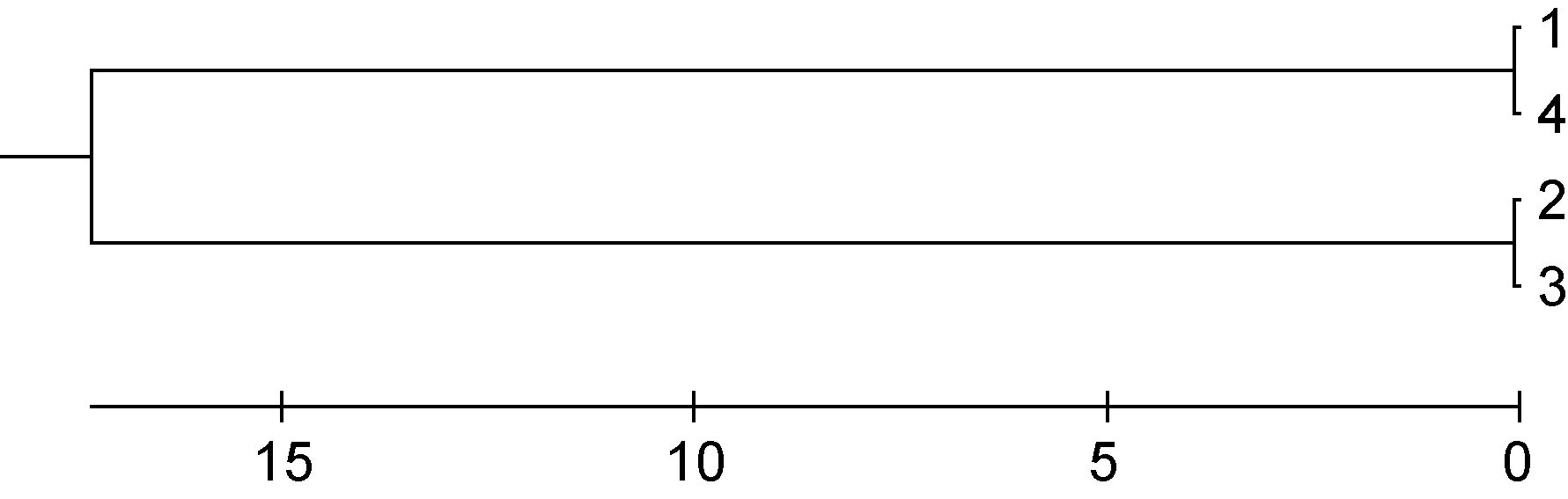
图2 四个鲫品系群体的UPGMA聚类图Fig.2 UPGMA dendrogram for the 4 strains of crucian carp
本实验采用9个ISSR引物对四个鲫品系群体进行扩增, 在四个鲫品系群体中, 平均每个 ISSR引物扩增的位点数为182, 多态位点为175。9个ISSR引物共扩增出 1637个条带, 其中单态位点只有 65个,其余1572个为多态位点, 多态位点比例高达96.03%,高于Zhou等(2000)用RAPD技术研究银鲫、刘良国等(2008)用 RAPD 技术研究彭泽鲫的结果, 也高于选择扩增, 而 ISSR标记是检测基因组内广泛存在的微卫星DNA片段和间隔区DNA (Mattioni et al, 2002);同时, 扩增片段的不同电泳检测方法也直接影响到遗传多样性结果。本实验的 ISSR扩增片段是在 4%的变性聚丙烯酰胺凝胶上电泳后, 再采用 ABI PRISM 377自动测序仪对胶图上的条带进行扫描检测(可以检测出两个碱基差异大小的片段), 与琼脂糖凝胶电泳和普通的紫外光电泳检测相比, 检测出的基因片段数目更多、多态性更为丰富。综上所述, 采用本实验方法, 能够更加高效地对同为一个物种的不同鲫品系群体遗传多样性进行检测。
3.2 不同鲫品系群体的遗传关系和资源保护
洞庭青鲫是从天然水域中选育的二倍体鲫鱼新品系, 经过连续7代的人工选育, 其遗传性状已趋于稳定。从表2可见, 在四个鲫品系群体中, 洞庭青鲫群体内的多态位点比例、遗传距离值均为最低, 说明了其遗传性状的相对稳定。彭泽鲫也是人工养殖的群体, 其种群内的遗传多样性只略高于洞庭青鲫, 这可能与其在雌核生殖的过程中, 彭泽鲫卵子接受了少量异源精子基因有关。与洞庭青鲫、彭泽鲫品系相比,野生鲫品系的遗传多样性明显偏高, 其中三倍体鲫的遗传多样性又高于二倍体鲫, 这可能与野生鲫品系采自洞庭湖水系天然水体, 不同个体或物种之间存在基因交流有关。笔者曾经对洞庭湖水系两种不同倍性野鲫的数量和生殖方式进行研究(刘良国等,2012), 发现二倍体鲫所占比例(15%)远小于三倍体鲫(85%), 认为三倍体鲫是一种行雌核发育生殖方式的鲫, 其卵子无论是与同源还是异源精子结合, 都能产生正常的三倍体鲫后代; 而二倍体鲫是行两性生殖方式的鲫, 其卵子只有与二倍体鲫的精子结合, 才能产生正常的二倍体后代。由于三倍体鲫在生殖过程中存在异精雌核发育的现象, 因此, 本实验检测出三倍体鲫的遗传多样性高于二倍体鲫。
Thorp(1982)的研究认为, 不同物种间的遗传相似系数I = 0.2—0.8 (遗传距离D = 0.2—0.8), 同科属群体间I = 0.1—0.5 (D = 0.5—0.9), 同种群体间I =0.8—0.97 (D = 0.03—0.2)。本实验研究表明, 四个鲫品系群体之间的遗传相似系数在0.8622—0.8809 (遗传距离为 0.1191—0.1378), 符合同种群体间的遗传相似系数范围, 说明四个鲫品系仍然属于同一个物种C. auratus。四个鲫品系群体间的遗传距离和聚类分析表明, 洞庭青鲫和彭泽鲫之间、二倍体鲫和三倍体鲫之间的亲缘关系较近, 而洞庭青鲫、彭泽鲫与二倍体鲫、三倍体鲫的亲缘关系相对较远。洞庭青鲫与彭泽鲫均起源于天然水域的二倍体鲫, 因其都具有优良的经济生长性状而被多代人工选育, 因而在遗传性状上二者可能也具有较大的相似性, 表现出亲缘关系较近; 野生二倍体和三倍体鲫生活于相同的水体, 二者在形态上很难区分, 据刘良国等(2012)报道, 三倍体鲫的来源可能是由于二倍体鲫因环境因素(如温度的剧变等)产生二倍体的卵子, 这些二倍体卵子再与正常的单倍体精子杂交形成, 本实验得出二者亲缘关系较近与之相符。有报道表明(沈俊宝等,1983; 王蕊芳等, 1988), 由于环境急变或天然杂交等原因, 二倍体鲫可以特化成三倍体鲫, 由于三倍体鲫行雌核发育, 具有较强的繁殖力和适应性, 因而种群上具有较强的优势, 这可能就是天然水域中三倍体鲫的比例远大于二倍体鲫的原因。最初发现的二倍体彭泽鲫现在都是行雌核发育的三倍体, 也可能与上述原因有关。据此推测, 二倍体洞庭青鲫一旦遭遇急剧的环境变化, 其中部分个体也有可能特化为行雌核发育生殖方式的三倍体, 进一步通过人工选育, 就有可能导致新的三倍体洞庭青鲫种群的形成和二倍体洞庭青鲫种群的消失。因此, 自然界中, 二倍体洞庭青鲫和二倍体野生鲫的存在就显得尤为珍贵, 对二倍体鲫种质资源的保护必须引起重视。
王蕊芳, 施立明, 贺维顺, 1988. 不同地理区域鲫鱼染色体银染核仁组织者的比较研究. 动物学研究, 9(2): 165—170
刘良国, 杨春英, 杨品红等, 2012. 洞庭湖水系沅水和澧水野鲫的染色体组型及资源保护, 动物学杂志, 47(2):112—119
刘良国, 赵 俊, 陈湘粦等, 2004. 彭泽鲫两个雌核发育克隆的染色体组型分析. 遗传学报, 31(8): 780—786
刘良国, 赵 俊, 陈湘粦, 2008. 彭泽鲫两个雌核发育克隆的RAPD分析. 水生生物学报, 32(2): 213—219
杨品红, 王晓艳, 吴维新等, 2007. 洞庭青鲫的核型分析及品种鉴定. 淡水渔业, 37(3): 3—7
杨品红, 吴维新, 张小立等, 2005a. 洞庭青鲫选育技术研究,湘科鉴字[2005]第006号
杨品红, 吴维新, 谢春华等, 2005b. 洞庭青鲫的生物学特性.当代水产, 30(3): 44—45
肖 俊, 罗永巨, 2010. 我国鲫鱼研究进展, 广西水产科技, 4:12—18
吴 珊, 吴维新, 2006. 洞庭青鲫形态性状遗传分析. 激光生物学报, 15(1): 90—93
沈俊宝, 王国瑞, 范兆廷, 1983. 黑龙江主要水域鲫鱼倍性及其地理分布. 水产学报, 7(2): 87—94
高丽霞, 李学军, 李永东等, 2011. 淇河鲫与两野生鲫鱼群体遗传多样性的ISSR分析. 水产科学, 30(7): 421—424
傅永进, 1996. 彭泽鲫的生物学性状及养殖技术. 淡水渔业,26(2): 25—26
Ai H L, Jian B W, 2006. Genomic evolution of Brassica allopolyploids revealed by ISSR marker. Genetic Resources and Crop Evolution, 53: 603—611
Apostol B L, Black W C, Reiter P et al, 1996. Population genetics with RAPD-PCR markers: the breeding structure of Aedes aegypti in Puerto Rico. Heredity, 76: 325—334
Jian S G, Tang T, Zhong Y et al, 2004. Variation in inter-simple sequence repeat (ISSR)in mangrove and non-mangrove populations of Heritiera littoralis (Sterculiaceae) from China and Australia. Aquatic Botany, 79: 75—86
Kojima T, Nagaoka T, Noda K, 1998. Genetic linkege map of ISSR and RAPD markers in Einkorn wheat in relation to that of RFLP markers. Theor Appl Genet, 96: 37—45
Kol N V, Lazebny O E, 2007. Polymorphism of ISSR-PCR markers in Tuvinian population of reindeer Rangifer tarandus L. Russion Journal of Genetics, 42: 1464—1466
Liu L G, Yan J P, Liu S J, 2009. Evolutionary analysis of allotetraploid hybrids of red crucian carp×common carp,based on ISSR, AFLP molecular markers and cloning of cyclins genes. Chinese Science Bulletin, 54(16): 2849—2861
Lynch M, 1990. The similarity index and DNA fingerprinting.Mol Biol Evo, 7: 478—484
Mattioni C, Casasoli M, Gonzalez M, 2002. Comparison of ISSR and RAPD markers to characterize three Chilean Nothofagus species. Theoretical Applied and Genetics, 104: 1064—1070 Reddy M P, Sarla N, Siddiq E A, 2002. Inter simple sequence repeat (ISSR) polymorphism and its application in plant breeding. Euphytica, 128: 9—17
Thorp J P, 1982. The molecular dock hypothesis: Biochemical evolution, genetic differentiation, and systematics. Annual Review of Ecology Systematics, 13(1): 139—168
Zhou L, Gui J F, 2002. Karytypic diversity in polyploid gibel carp,Carassius auratus gobelio Bloch. Genetica, 115: 223—232
Zhou L, Wang Y, Gui J F, 2000. Analysis of genetic heterogeneity among five gynogenetic clones of silver crucian carp, Carassius auratus gobelio Bloch, based on detection of RAPD molecular markers. Cytogenet Cell Genet, 88: 133—139
Zietikiewicz E, Rafalski A, Labuda D, 1994. Genome fingerprinting by simple sequence repeat (ISSR) anchored and polymerase chain reaction amplification. Genomica, 20:178—183
