草菇生长发育过程中胞外酶活性变化*
2015-03-07吴圣进王灿琴韦仕岩
吴圣进,王灿琴,汪 茜,韦仕岩
(广西农业科学院微生物研究所,广西 南宁 530007)
草菇生长发育过程中胞外酶活性变化*
吴圣进,王灿琴,汪 茜,韦仕岩
(广西农业科学院微生物研究所,广西 南宁 530007)
对9个草菇菌株生长发育过程中的胞外羧甲基纤维素酶(CMCase)、木聚糖酶(Xylase)和漆酶(Laccase)活性变化进行监测,结果表明,不同菌株的胞外酶活性变化规律基本一致,其中CMCase和Xylase活性都在菌丝期最高,此后呈下降趋势,仅Xylase活性在蛋形期时有所上升;Laccase活性则在菌丝期最低,针头期迅速上升,纽扣期时达最高,此后又迅速降低。不同菌株间的CMCase和Xylase活性在菌丝期有明显差异,而Laccase活性则在针头期和纽扣期的差异最大。生物学效率较高的菌株V9、V112和V木-2在菌丝期CMCase和Xylase活性较高,并在针头期和纽扣期Lac case活性很高。
草菇;胞外酶;活性变化
草菇(Volvariella volvacea),是一种具有极高营养价值和保健功能的大型食用菌真菌,为高温型食用菌,盛产于我国南方地区,总产量在人工栽培的食用菌品种中位列前10名[1]。
栽培草菇常用原料有棉籽壳、废棉、稻草、玉米秸秆、玉米芯等草质纤维原料,主要组成成分为纤维素、半纤维素和木质素,这些大分子物质只有在相应水解酶作用下分解为小分子物质才能被草菇吸收利用。草菇为草腐类真菌,拥有较完备的纤维素酶系和半纤维素酶系[2-3],而木质素降解酶系较欠缺,被认为缺少漆酶、锰过氧化物酶和脂质过氧化物酶等木质素降解酶类[4-5],因此更适合在木质素含量低的纤维材料上生长。但近年来更多研究表明,草菇具一定漆酶活性[6-7]。草菇胞外木质纤维素酶活性对其生物转化率具有重要影响,拥有较高酶活性的菌株,子实体产量也往往更高[8],因此酶活性大小作为一个衡量指标,可用于草菇高产菌株的筛选。食用菌胞外酶活性在其生育期内处于动态变化中[9-12],它们的变化直接反映食用菌各生育期的营养生理需求。本研究对草菇不同生育期胞外木质纤维素酶活性进行测定,以了解其动态变化规律,从而为更好地利用酶活性指标进行草菇高产菌株选育和高效生产调节提供依据。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株
草菇菌株V木-2、V蚌、V广、V5、V9、V10、V26、V112、V365,均来自广西农业科学院微生物所的保存菌株。
1.1.2 原材料
木薯渣由广西武鸣县锣圩酒精厂提供,木薯酒精渣自然风干后使用;棉籽壳、麦麸、石灰等材料市场上购买。
1.2 试验方法
1.2.1 草菇栽培试验
采用熟料袋栽方法,栽培原料为木薯渣180 kg、棉籽壳180 kg、石膏4 kg、石灰12 kg。原料加水拌匀,水分调节为65%左右,堆制好后用薄膜覆盖3 d;添加麦麸40 kg,再拌匀,调节pH为8。原料配制好后用17 cm×35 cm×0.04 cm高压聚丙烯栽培袋装料,每袋装原料约1 kg(折合干料重约350 g),扎紧袋口,常压灭菌8 h。灭菌后等袋内原料温度降至40℃,按照3%接种量接种,其中每一草菇菌株各接种80袋;接种后移入培养室内避光培养。菌丝生长阶段气温为24℃~35℃,空气相对湿度70%左右;菌丝满袋后移入出菇房,开袋口,并齐培养料剪去袋口塑料袋,准备出菇。出菇温度28℃~35℃,空气相对湿度90%左右,光照强度80 lx~100 lx,每天通风2次~3次。在草菇长至蛋形期时采收,并分别统计每一草菇菌株的子实体产量,计算生物学效率(P),公式为:
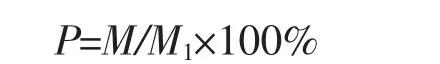
式中:M表示草菇子实体鲜重;M1表示栽培原料干重。
1.2.2 样品采集
分别在草菇菌丝期(菌棒菌丝长满2/3)、原基期、纽扣期、蛋形期和成熟期采样。采样时,每一菌株随机抽取3袋菌棒,每一菌棒先去除旧种、原基和子实体,再刮去表层约厚1 cm的培养料,取表层下2 cm~5 cm深度的菌曲约100 g,混匀,密封于塑料袋,置于-20℃保存。
1.2.3 粗酶液的提取
取草菇固体曲样品10 g于容量250 mL的三角瓶,加入40 mL提取液(50 mmol·L-1KHPO4缓冲液,pH6.5),在28℃、150 r·min-1下摇床浸提2 h,4层纱布压榨过滤,所得滤液进一步在4℃、1×104r·min-1下离心30 min,上清液即为粗酶液,4℃保存备用。
1.2.4 木质纤维素酶活测定
纤维素酶(CMCase) 和木聚糖酶(Xylanase)的测定参考包衎等[13]的方法,移取适当稀释的酶液0.5mL于试管中(空白对照用0.5 mL无菌水替代酶液),加入含0.5%羧甲基纤维素钠盐(CMC-Na)或者1%橡木木聚糖的柠檬酸缓冲液(0.05 mol·L-1,pH4.5) 1.5 mL,然后在50℃水浴锅中准确作用30 min后,加入DNS试剂2.0 mL,摇匀,置于沸水中煮沸10 min,取出置于冷水中冷却,在722型分光光度计上比色(UV-1600型分光光度仪,北京瑞利分析仪器公司),在520 nm(或540 nm)用1 cm比色皿比色,测得OD值,查阅葡萄糖(或木糖)标准曲线,求得含糖量。定义每分钟催化CMC-Na(或木聚糖)水解生成1 μmol葡萄糖(或木糖)的酶量为1个酶活力单位“IU”。漆酶(Laccase)的测定参考雷德柱等[7],3mL反应总体积中,加入适当稀释的酶液0.3 mL、0.1 mol·L-1醋酸-醋酸钠缓冲液(pH4.5)2.5 mL、5 mmol·L-1的ABTS 0.2 mL,室温下反应5 min,测定反应液在420 nm处吸光值。定义每分钟使吸光度增加0.001所需的酶量为1个酶活单位(U)。
1.2.5 数据统计分析
草菇生物学效率为50袋菌棒的平均值。酶活和菌丝生长速度为随机抽取的3袋菌棒即3个重复的平均值。采用SPSS18.0统计软件进行数据的多重比较(Duncan法)。
2 结果与分析
2.1 草菇不同生育期的纤维素酶活性
草菇不同生育期的羧甲基纤维素酶(CMCase)活性变化见图1。
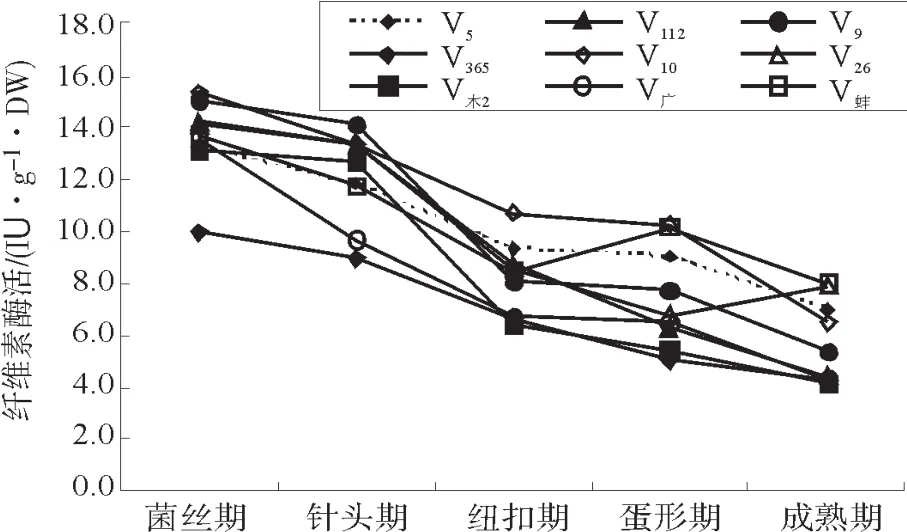
图1 草菇不同生育期的纤维素酶活Fig.1 Actitities of CMCase of Volvariella volvacea at different growth stage
被测的9个草菇菌株在菌丝期CMCase活性最高,并随着生育期由菌丝期、针头期、纽扣期、蛋形期至成熟期发展,CMCase活性呈逐渐下降的趋势,其中菌丝期至针头期下降较缓,至纽扣期时酶活性下降幅度最大,蛋形期下降幅度小,部分菌株(如V蚌和V9)在蛋形期的酶活性有所上升。菌丝期、针头期、纽扣期、蛋形期至成熟期的CMCase活性范围分别为:10.0 IU·g-1·DW~15.3 IU·g-1·DW、9.0 IU·g-1·DW~14.1 IU·g-1·DW、6.4 IU·g-1·DW~10.7 IU·g-1·DW、5.0 IU·g-1·DW~10.3 IU·g-1·DW、4.2 IU·g-1·DW~8.0 IU·g-1·DW。不同菌株的CMCase活性变化幅度不同,其中菌株V9、V112和V木-2的酶活性变化幅度大,在菌丝期和针头期处于最高水平,达12.7 IU·g-1·DW~15.0 IU·g-1·DW,但在蛋形期以后处于较低水平。
2.2 草菇不同生育期的半纤维素酶活性
草菇不同生育期的半纤维素酶(木聚糖酶,Xylase)活性变化见图2。
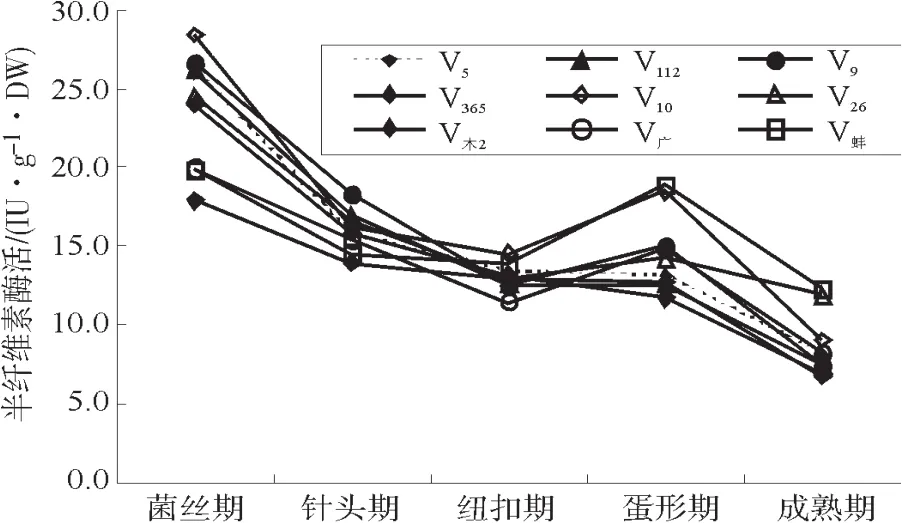
图2 草菇不同生育期的半纤维素酶活Fig.2 Activities of Xylase of Volvariella volvacea at different growth stage
测定的9个菌株的木聚糖酶活性均在菌丝期达到最高,至针头期时急速下降,纽扣期的酶活性继续下降,但下降幅度变小,至蛋形期酶活性有所上升或维持不变,但成熟期的酶活性又急速下降。各菌株在菌丝期、针头期、纽扣期、蛋形期和成熟期的Xylase活性范围分别为:17.8 IU·g-1·DW~28.4 IU·g-1·DW、14.0 IU·g-1·DW~18.3 IU·g-1·DW、11.5 IU·g-1·DW~14.5 IU·g-1·DW、11.7 IU·g-1·DW~18.9 IU·g-1·DW、6.7 IU·g-1·DW~12.3 IU·g-1·DW。各菌株Xylase活性在菌丝期差异最大,其中酶活性较高的有V5、V112、V9、V木-2、V26和V10,酶活性较低的有V蚌、V广和V365。针头期和纽扣期各菌株间酶活性差异较小。菌株V9、V112和V木-2酶活性在菌丝期和针头期处于较高水平,纽扣期及之后则处于较低水平。
2.3 草菇不同生育期的漆酶活性
草菇不同生育期的漆酶活性变化见图3。
各菌株漆酶活性在菌丝期最低,之后随生育期进程急速上升,至纽扣期达最高,蛋形期时则急速下降,成熟期又有所回升。菌丝期时,各菌株的漆酶活性差异不明显,而在针头期和纽扣期,菌株V9、V112和V木-2的酶活性远远高于其它菌株。
2.4 草菇不同菌株的菌丝长势和生物学效率
对9个草菇菌株的菌丝生长速度、长势及其生物学效率进行测定,结果见表1。
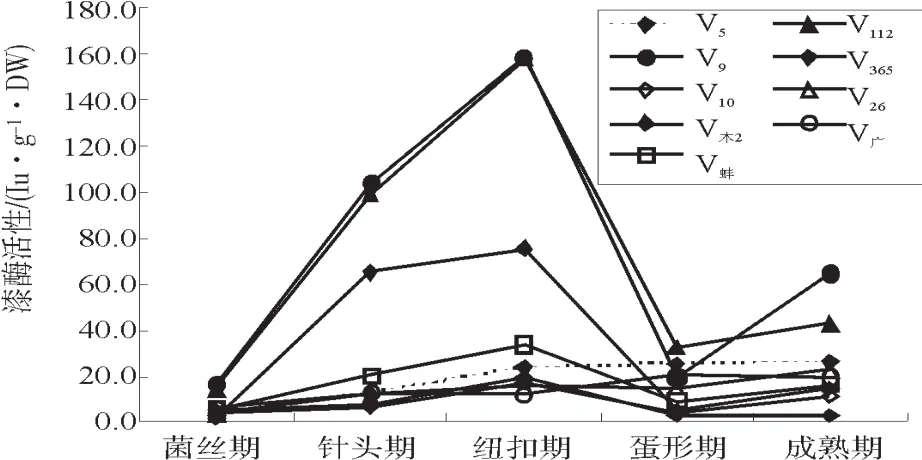
图3 草菇不同生育期的漆酶活性Fig.3 Activities of Laccase of Volvariella volvacea at different growth stage

表1 不同草菇菌株的菌丝长势和生物学效率Tab.1 Mycelium growth and biological efficiency of different Volvariella volvacea strains
由表1可见,V9、V112、V365和V10菌丝生长速度最快,V5、V广、V26和V蚌次之,V木-2最慢;V9、V112和V蚌菌丝长势最强,菌丝浓密洁白,V木-2的菌丝长势最差,菌丝稀疏;V9、V112和V木-2的生物学效率最高,为26.1%~31.8%,V蚌和V365次之,分别为18.3%和16.5%,V5的生物学效率最低,仅8.5%。
3 结果与讨论
食用菌生长发育过程中依赖菌丝细胞分泌的多种胞外酶水解环境中大分子有机物,维持其生命过程,生育期内胞外酶活性的动态变化反映了不同时期的营养需求。本研究结果表明,草菇CMCase和Xylase活性均在菌丝期达到最高,并随着生育期的进展而逐渐下降,表明草菇菌丝期对养分的需求最大;Xylase活性在蛋形期有所回升,这一时期由于子实体快速膨大,对养分的需求也增加。但是,Ding等[14]在检测草菇内切葡聚糖酶基因eg1和eg2的转录表达水平时发现,其表达高峰均出现在蛋形期至成熟期,而在菌丝定殖期转录水平很低,与本研究中胞外CMCase活性变化趋势相反。由于草菇至少存在5个以上的内切葡聚糖酶[5],其胞外酶活性是多个同工酶的总体表现,仅凭1个~2个酶的表达水平可能无法反映该酶的总体水平。此外,胞外酶活性还受基因翻译水平、酶胞外分泌水平等诸多因素影响,这也可能是结果不一致的原因。菌丝期出现纤维素酶和半纤维素酶活性高峰的现象在其他非木腐类食用菌中也有发现,如大球盖菇[12]和柱状田头菇[9]的CMCase和Xylase活性高峰均出现在菌丝定殖时期。也有研究发现,非木腐类食用菌姬松茸[15]和四孢蘑菇[16]的CMCase和Xylase活性低峰对应菌丝期,高峰对应子实体成熟期,与本研究中草菇的正好相反,但它们都利用发酵料栽培,不能排除原料中其他微生物对酶活性的贡献。草菇与木腐类食用菌的CMCase和Xylase活性变化规律则完全不同。据报道,姬菇、鲍鱼菇[17]、金顶侧耳[18]和灰树花[10]等木腐型食用菌的CMCase和Xylase活性高峰均出现在子实体成熟期,而菌丝定殖期的活性最低。同时,这些食用菌的漆酶均在菌丝定殖期间活性很高,而子实体发生与生长期很低,这被认为是优先降解木质素以便释放被束缚的纤维素所需。本研究中草菇漆酶活性却在菌丝期很低,针头期急速上升,纽扣期达到高峰,这与Chen等[6]的研究结果一致,他们认为草菇漆酶可能与子实体形态建成有关,而不是行使其降解木质素的功能。漆酶在草菇降解木质纤维素过程中的作用还有待进一步研究,总之,漆酶对草菇子实体的发育都有重要影响。
本研究中,不同草菇菌株的胞外酶活性变化趋势基本一致,但菌株间的酶活性大小存在差异,其中菌株间的CMCase活性差异在整个生育期都较明显,Xylase活性差异最明显的时期为菌丝期,而Laccase活性差异最明显的时期为针头期和纽扣期。Ahlawat等[8]认为胞外酶活性可作为筛选草菇高产菌株的衡量指标,因为拥有较高酶活性的菌株子实体产量也往往更高。本研究中菌株V9、V112和V木-2拥有最高的生物学效率,菌丝长势也最强(V木-2除外),相对应,它们在菌丝期和针头期拥有相对较高的CMCase和Xylase活性,以及在针头期和纽扣期拥有远远高于其他菌株的Laccase活性,与上述论断相符。但是,这些胞外酶在其他发育时期的活性却无明显的比较优势,相对更低些,说明利用胞外酶活性作为草菇高产性能的衡量指标时应确定好对应的生育期。本研究结果表明,菌丝期至针头期的CMCase和Xylase和针头期至纽扣期的Laccase活性指标可能最能反映草菇菌株的高产性能。
综上所述,草菇CMCase和Xylase的活性高峰出现在菌丝定殖时期,它们对纤维素和半纤维素的高效分解作用可为草菇菌丝的定殖提供更多的养分,该时期的养分累积可能是后期草菇子实体发育和产量形成的重要基础;草菇Laccase活性在针头期和纽扣期最高,可能对子实体的形态建成和发育产生作用,并最终影响草菇子实体产量。本研究结果为草菇高产菌株的选育和生产调控提供了依据。
[1]张俊飚,李波.对我国食用菌产业发展的现状与政策思考[J].华中农业大学学报:社会科学版,2012,101(5):13-21.
[2]李讯,吴华伟,邵蔚蓝.草菇纤维素酶系统的诱导、分布及初步定性 [J].无锡轻工大学学报,2002, 21(6):623-626.
[3]裴建军,胡沂淮,邵蔚蓝.草菇半纤维素酶系统的诱导、分布及初步定性 [J].无锡轻工大学学报,2003,22(1):61-64.
[4]Chang SC,Steinkraus K.H.Lignocellulolytic enzymes produced by Volvariella volvacea,the edible straw mushroom[J]. Applied and Environmental Microbiology,1982,43(2):440-446.
[5]Buswell John A,Cai YJ,Chang ST,et al.Lignocelluloytic enzyme profiles of edible mushroom fungi[J].World Journal of Microbiology and Biotechnology,1996(12):537-542.
[6]Chen Shicheng,Ma Dengbo,Ge Wei,et al.Induction of laccase activity in the edible straw mushroom Volvariella volvacea[J].FEMS Microbiology Letters,2003,218(1): 143-148.
[7]雷德柱,龙嘉欣,田长恩.产漆酶的草菇菌株的筛选[J].工业微生物,2008,38(3):51-55.
[8]Ahlawat OP,Gupta P,Dhar BL.Profile of the extracellular lignocellulolytic enzymes activities as a tool to select the promising strains of Volvariella volvacea (Bull.ex Fr.)Sing [J].Indian J.Microbiol.,2008(48):389-396.
[9]王南,沈锋,谭琦,等.柱状田头菇生长发育中9种胞外酶活性的测定 [J].菌物系统,2000,19(4):540-546.
[10]倪新江,丁立孝,冯志勇,等.灰树花生长发育过程中的几种胞外酶活性变化[J].微生物学杂志,2001,21(3):24-25.
[11]韩增华,张丕奇,孔详辉,等.黑木耳胞外酶活性变化与栽培性状比较的研究[J].食用菌学报,2007,14(4):41-46.
[12]于萍,孙萌,傅常娥,等.大球盖菇栽培期间胞外酶活性变化研究 [J].中国食用菌,2014,33(1):48-50.
[13]包衎,王晓辉,张伟琼,等.纤维素分解菌的选育及酶活测定 [J].生物学杂志,2007,24(2):56-58.
[14]Ding SJ,Ge W,Buswell JA.Clonging of multiple celluase cDNAs from Volvariella volvacea and their differential expression during substrate colonization and fruiting[J].FEMS Microbiol.Lett.,2006(263):207-213.
[15]倪新江,丁立孝,潘迎捷,等.姬松茸在两种培养基上生长期间九种胞外酶活性变化 [J].菌物系统,2001,20(2):222-227.
[16]郭倩,何庆邦.四孢蘑菇生长过程中四种胞外酶活性和木质纤维素降解的变化规律 [J].食用菌学报,1998,5(2):13-17.
[17]初洋,倪新江,杨桂文,等.姬菇和鲍鱼菇生长期间8种胞外酶活性变化比较 [J].烟台大学学报:自然科学与工程版,2008,21(2):138-142.
[18]李娟.金顶侧耳不同生长期几种胞外酶活性变化 [D].济南:山东师范大学,2007.
Extracellular Enzyme Production by Volvariella volvacea During Its Growth and Development
WU Sheng-jin,WANG Can-qin,WANG Qian,WEI Shi-yan
(Institute of Microbiology,Guangxi Academic of Agricultural Sciences,Nanning 530007,China)
Activities of extracellular CMCase,Xylase and Lccase of 9 Volvariella volvacea strains were detected during their growth and development.The results showed that the changes of extracellular enzymes activity on different growth stages were similar among the strains.The activity peaks of CMCase and Xylase occurred at the stage of mycelial growth and decreased gradually thereafter,exceptionally an increase in activity of Xylase at egg stage.The Laccase activity was at the lowest level at the stage of mycelial growth,but greatly increased and reached the highest level during the pinhead stage and button stage,and greatly decreased thereafter.Among strains of Volvariella volvacea,the obvious difference in activities of CMCase and Xylase were found at the stage of mycelial growth,while that of the Laccase activity was at the pinhead and button stage.Strain V9,V112and V木-2had the higher biological efficiency,and also had the higher activity of CMCase and Xylase at the stage of mycelial growth and much higher activity of Laccase at the pinhead and button stage.
Volvariella volvacea;extracellular enzymes;activity changes
S646.1
A
1003-8310(2015)01-0053-04
10.13629/j.cnki.53-1054.2015.01.015
广西农业科学院基本科研业务重点项目(桂农科2013YZ18);广西自然科学基金项目(2013GXNSFAA019066);国家现代农业技术体系广西食用菌创新团队专项。
吴圣进(1973-),男,博士,副研究员,主要从事食用菌品种选育和栽培技术研究。E-mail:gxwusj@gxaas.net
2014-11-28
