冬虫夏草菌培养物抗氧化活性研究*
2015-03-07赵聃聃黄罗冬索菲娅吴长奎
赵聃聃,黄罗冬,索菲娅,吴长奎,卢 帅,叶 星
(1.新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046;2.云南大学生命科学学院,云南 昆明 650091)
冬虫夏草菌培养物抗氧化活性研究*
赵聃聃1,2,黄罗冬2,索菲娅1**,吴长奎1,2,卢 帅1,叶 星1
(1.新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046;2.云南大学生命科学学院,云南 昆明 650091)
采用清除DPPH自由基法、普鲁士蓝法2个指标研究冬虫夏草菌培养物不同极性相的抗氧化活性。结果表明,冬虫夏草菌培养物的正丁醇相E、乙酸乙酯相D、氯仿相C、石油醚相B均有良好的DPPH自由基清除能力,且清除自由基能力与浓度呈现一定的线性关系,随着浓度的增加抗氧化活性不断增强。正丁醇相E、乙酸乙酯相D、氯仿相C、石油醚相B的IC50值分别为0.083 mg·mL-1、0.132 g·mL-1、0.081 mg·mL-1、0.143 mg·mL-1,均大于水相F、醇提物A,其中正丁醇相E和氯仿相C的清除能力最强。总还原能力的强弱大小依次为乙酸乙酯相D、氯仿相C、正丁醇相E、石油醚相B,且前三者均比水相F、醇提物A总还原能力强,其中乙酸乙酯相D最强,氯仿相C次之。综上,冬虫夏草菌不同极性相具有较强的抗氧化能力,正丁醇、乙酸乙酯、氯仿部位抗氧化效果明显,可以作为最佳提取溶剂。
冬虫夏草;培养物;提取物;不同极性相;抗氧化活性
冬虫夏草Ophiocordyceps sinensis(Berk.)G.H. Sung,J.M.Sung,Hywel-Jones&Spatafora,是冬虫夏草菌寄生在鳞翅目蝠蛾属Hepialus幼虫后形成子座及其幼虫尸体的复合体[1]。作为藏族民间用药已有上千年历史[2],同时作为国家二级保护的名贵药材被广泛使用,与人参、鹿茸并列为中国的三大补品[3]。在传统中医中,认为冬虫夏草性温、味甘、平,入肺、肾经,具益精气、补虚损,止咳嗽。药理研究表明冬虫夏草具有抗病毒、抗肿瘤、抗氧化、调节免疫力、降血压、调节内分泌[4-11]等多种药理作用。
抗氧化物质是指能够清除氧自由基,抑制或消除以及减缓氧化反应的一类物质。天然抗氧化剂也称生物抗氧化剂,主要是指在生物体(动物、植物、微生物)内合成的具有抗氧化作用或诱导抗氧化剂产生的一类物质[12-14]。随着对氧自由基与疾病关系的理论研究不断深入,发现氧化损伤与癌症、炎症、衰老、心脑血管疾病、糖尿病及其并发症、肺纤维化、神经退行性疾病等[15-18]诸多疾病均有密切关系,并认为是导致衰老的重要原因之一,因而抗氧化剂的应用价值日益受到重视。但由于人工合成抗氧化剂的安全性问题,人们将注意力重新转向天然植物。天然抗氧化剂基本上是水溶性的,在实际应用时需加以改进,确保在油脂中的分散性,以保证其抗氧化的效果[19]。到目前为止对冬虫夏草的抗氧化活性的研究已有大量的报道,大多数以野生冬虫夏草为研究材料,但由于野生冬虫夏草材料稀缺,导致其应用受到限制。冬虫夏草无性型中国被毛孢则可以在实验条件下无限发酵扩大,具有很强的市场前景,但对无性型菌株抗氧化研究较少。故本研究以冬虫夏草菌培养物为研究材料,采用清除DPPH自由基法、普鲁士蓝法对冬虫夏草菌不同极性相进行抗氧化能力的初步评价,探索冬虫夏草菌菌丝体抗氧化活性成分在不同极性相的分布,以期为进一步研究冬虫夏草菌抗氧化活性成分提供理论依据。
1 材料与方法
1.1 实验材料
新鲜冬虫夏草(O.sinensis)采自于西藏那曲,分离得到冬虫夏草无性型菌株中华被毛孢(Hirsutella sinensisLiu et al)[20],该菌株由云南大学中草药生物资源研究生云百草实验室提供。
将冬虫夏草菌于PPDA培养基(PDA+1%蛋白胨)上固体培养,15℃~18℃恒温培养箱中培养2个月,刮取菌丝体,烘干,粉碎过40目筛,密封保存备用。
1.2 主要仪器和试剂
索氏提取器,PTHW型电热套,河南巩义英峪予华仪器厂;HH-S型水浴锅,河南巩义英峪予华仪器厂;精密天平BCD-216TX、SHB-BA95型循环水式多用真空泵,河南巩义英峪予华仪器厂;Spectrumlab 53型紫外分光光度计,上海精密科技有限公司;分液漏斗、旋转蒸发仪、RE-52A,上海亚荣生化仪器厂。二苯代苦味基肼自由基(DPPH·)、70%乙醇、95%乙醇、50%乙醇、60%乙醇、铁氰化钾K3Fe(CN)6、三氯乙酸、FeCl3、蒸馏水、正丁醇、乙酸乙酯、氯仿、石油醚。
1.3 提取物的制备
冬虫夏草有效成分提取分离过程见图1。精确称取冬虫夏草菌培养物50.0 g,置于索氏提取器中,用70%乙醇索氏提取3次,每次3 h,合并提取液,减压浓缩制成提取物,蒸干后得醇提物A为20.27 g。再用100 mL蒸馏水溶解,按照极性小到大依次用石油醚、氯仿、乙酸乙酯、正丁醇按1:1萃取,分别萃取3次,每次1 h。合并萃取液,减压浓缩,得4个不同极性部位提取物,即石油醚相B为0.08 g、氯仿相C为0.08 g、乙酸乙酯相D为0.26 g、正丁醇相E为1.52 g、水相F为3.93 g,用蒸馏水分别制成1 mg·mL-1的不同极性相提取物,为母液,备用。
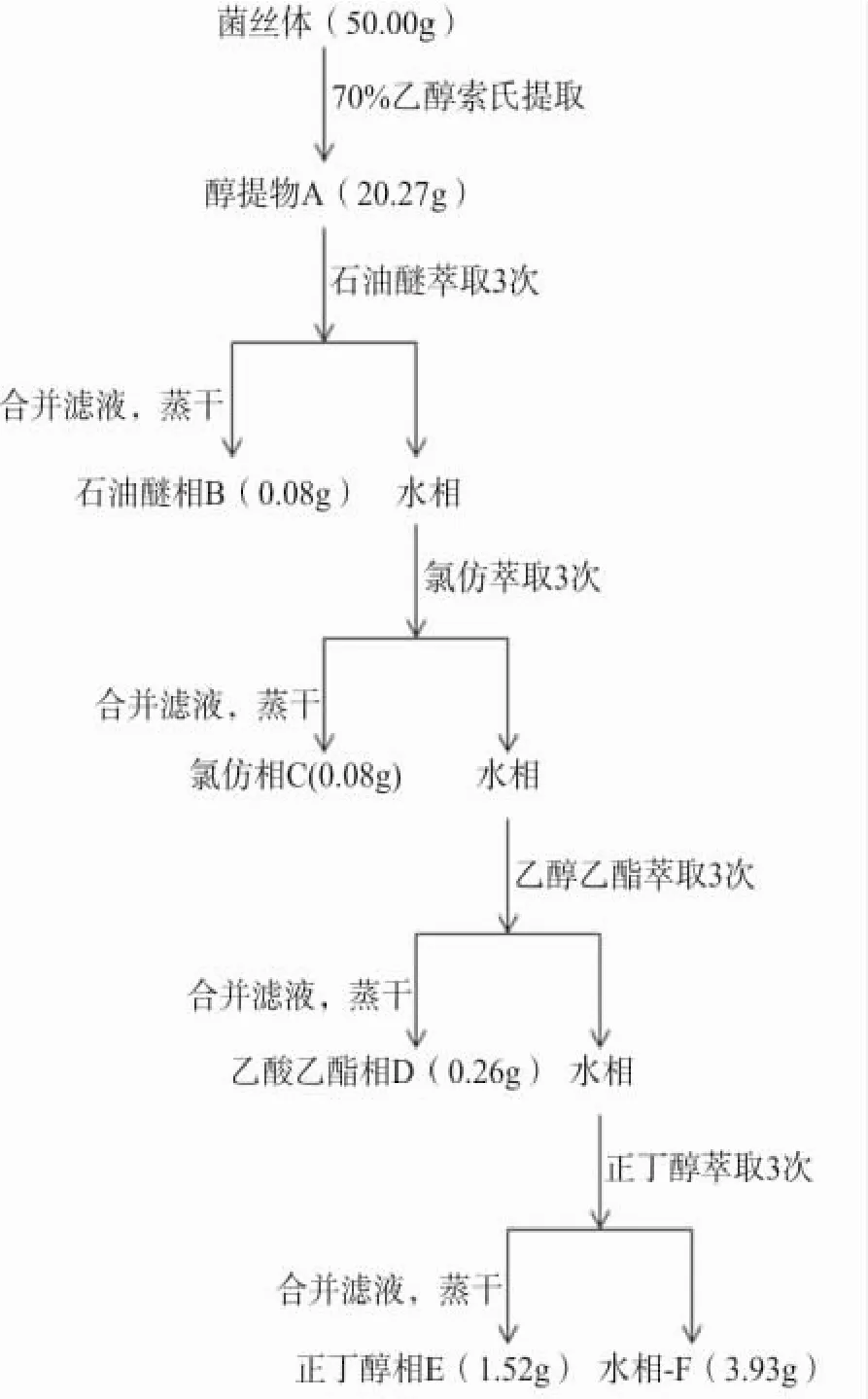
图1 冬虫夏草有效成分提取分离过程Fig.1 The extracted and separated processes of effective components from O.sinensis
1.4 抗氧化活性的测定
1.4.1 DPPH自由基清除率的测定
参照Lee等[21]和Tsai等[22]清除DPPH自由基的方法,并进行优化。精密称取DPPH标准品0.0206 g,用70%乙醇定容于50 mL,作为母液,备用。吸取10 mL母液,用70%乙醇定容于100 mL,配成浓度为0.0415 mg·mL-1的标准液。从DPPH标准液中精密移取3 mL、6 mL、9 mL、12 mL、15 mL的溶液,均用70%乙醇溶液定容至25 mL。以70%乙醇为对照,在波长为517 nm下测溶液的吸光度,做出标准曲线。
分别吸取配置好的不同极性部位母液0.06 mL、0.12 mL、0.18 mL、0.24 mL、0.3 mL、0.36 mL、0.42 mL、0.48 mL、0.54 mL、0.6 mL,定容至3 mL,置于25mL试管中,再加入3 mL DPPH标准液,混匀,暗反应40 min,于517 nm处测其吸光值。按公式计算DPPH自由基清除率。最终以样品溶液浓度为横坐标,清除率为纵坐标,绘制清除率曲线,得到标准回归方程,计算IC50,通过比较IC50值判断各极性部位清除DPPH自由基的能力。DPPH自由基清除率公式为(S):

式中:A0为空白对照;Ai为反应液吸光值;Aj为溶液本地吸光值。
1.4.2 总还原力的测定
参照Oyaizu[23]研究葡萄糖胺总还原能力的测定方法。分别吸取配置好的不同极性部位母液0.04 mL、0.08 mL、0.12 mL、0.16 mL、0.2 mL、0.24 mL、0.28 mL、0.32 mL、0.36 mL、0.4 mL,定容至2 mL,依次加入0.4 mL的pH 6.5磷酸缓冲、1.0 mL的1%K3Fe(CN)6,放置于50℃的水浴锅中水浴20 min,取出后立即加入2.0 mL 10%的三氯乙酸终止反应。取上述反应液3.0 mL,加6.0 mL蒸馏水和0.4 mL的1%FeCl3,混匀,放置10 min,在700 nm处测其吸光值。吸光值越大表示总还原能力越强。
2 结果与分析
2.1 培养物的特性
将冬虫夏草菌在15℃~18℃低温下,在PPDA培养基上培养1个月后,菌落基本形成,培养2个月后菌落直径1 cm~2 cm,生长缓慢,菌丝光滑紧密,质地坚硬,背面褐色。菌落紫褐色,中间有微微突起的瘤块,见图2。
2.2 DPPH自由基清除率的测定
2.2.1 DPPH标准曲线的制备
以DPPH质量浓度为横坐标,以吸光度为纵坐标,绘制标准曲线,见图3。
由标准曲线得到线性回归方程为y=1.315x+ 0.010(R2=0.999)。可知DPPH溶液在质量浓度为0.00498 mg·mL-1~0.0249 mg·mL-1时线性关系良好。
图2 中华被毛孢的菌落形态Fig.2 The colony characteristics of Hirsutella sinensis

图3 DPPH标准曲线Fig.3 The standard curve of DPPH
2.2.2 不同极性部位DPPH自由基清除率的测定
以不同极性部位浓度为横坐标,清除率(平均值)为纵坐标,绘制清除率曲线,如图4。
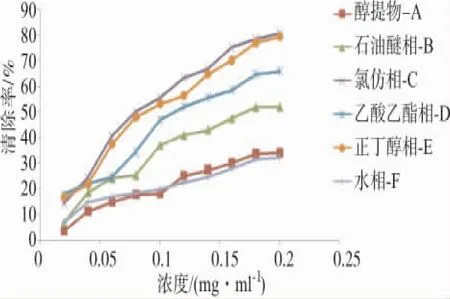
图4 不同极性部位DPPH自由基清除率Fig.4 The scavenging capacities of DPPH·from different polar parts of O.sinensis
不同极性部位均具有不同程度的DPPH自由基清除能力,不同极性部位的浓度与DPPH自由基清除能力基本上呈线性关系,随着浓度的增加,清除能力逐渐增强。当浓度达0.2 mg·mL-1时,醇提物A的清除率为34%,石油醚相B的清除率为52%,氯仿相C的清除率为80%,乙酸乙酯相D的清除率为65%,正丁醇相E的清除率为79%,水相F的清除率为32%。
2.2.3 不同极性部位IC50的测定
不同极性部位的清除能力均大于醇提物A、水相F,不同极性部位DPPH自由基清除率的IC50值见表1。

表1 不同极性部位DPPH自由基清除率的IC50值Tab.1 The IC50of DPPH scavenging capacities from different polar parts of O.sinensis
用IC50值来表示DPPH自由基清除率的大小,由表1可知,IC50由大到小依次为氯仿相C>正丁醇相E>乙酸乙酯相D>石油醚相B>醇提物A>水相F。
由图4、表1可以看出,氯仿相C和正丁醇相E清除DPPH自由基十分相近,由此可说明冬虫夏草菌菌丝体清除DPPH的能力多数集中于氯仿相C和正丁醇相E,为提取的最佳溶剂。
2.3 总还原力的测定
以不同极性部位的浓度为横坐标,700 nm处的吸光值(平均值)为纵坐标,吸光值越大,其总还原能力就越大,绘制曲线图,见图5。

图5 不同极性部位总还能力Fig.5 The total reduction capacities of different polar parts of O.sinensis
由图5可知,不同极性部位均具有一定的总还原能力,随着不同极性部位浓度的增加,吸光值越大,且基本呈现线性关系,即总还原力与浓度呈线性关系,浓度越大,还原能力越强,其中乙酸乙酯相D远强于其他各相,氯仿相C次之。当不同极性部位浓度达0.2 mg·mL-1时,醇提物A的吸光值为0.103,石油醚相B的吸光值为0.072,氯仿相C的吸光值为0.202,乙酸乙酯相D的吸光值为0.338,正丁醇相E的吸光值为0.159,水相F的吸光值为0.079。因而总还原能力为乙酸乙酯相D>氯仿相C>正丁醇相E>醇提物A>水相F>石油醚相B,其中乙酸乙酯相D、正丁醇相E、氯仿相C总还原力均大于醇提物A、水相F,乙酸乙酯相D最高,氯仿相C次之。由图5说明乙酸乙酯相D聚集了具有总还原能力的物质,为提取的最佳溶剂,其次是氯仿相C,同样具有较强的总还原能力,可作为提取的溶剂。
3 结论与讨论
自从1956年Harman[24]提出自由基学说以来,自由基与疾病的关系越来越受到重视。当体内自由基与自由基清除剂之间平衡被破坏后,自由基或氧化剂会将细胞和组织分解,影响代谢功能,并会引起不同程度的健康问题。
抗氧化研究已在各种虫草中展开,杜秀菊等[24]用氯仿、乙酸乙酯、乙醇提取北虫草子实体,并用化学发光法和抗H2O2损伤法评价了北虫草的抗氧化性,说明乙酸乙酯相提取物抗氧化活性较强且是保护PC12氧化损伤的有效部位。董秀英等[25]采用DPPH法对九州虫草不同极性部位的抗氧化性进行了评价,表明九州虫草具有较强的抗氧化性,其水相提取物、正丁醇相提取物、乙酸乙酯相提取物、石油醚提取物相都具有一定清除DPPH自由基的能力,其中乙酸乙酯相提取物的抗氧化活性强于其他相提取物。陈畅等[26]采用邻苯三酚自氧化法比较研究了蒙山虫草,蛹虫草与冬虫夏草的抗氧化活性,结果显示3种虫草均具有较强的抗氧化性,且抗氧化活性比较相近。随后武守华等[27]对4种子囊菌甲醇提取物的抗氧化活性的研究中表明冬虫夏草、古尼虫草、蛹虫草和黑柄炭角菌子实体的自由基清除能力、总还原力均高于菌丝体,但4种子囊菌的子实体的DPPH自由基清除能力无显著差异。韩洪坤[28]对冬虫夏草菌-中国被毛孢菌丝体水提物通过FRAP法、清除DPPH自由基能力、·OH的清除能力、螯合铁离子能力进行抗氧化活性研究,表明菌丝体具有抗氧化活性,但并未对菌丝的不同极性相进行研究。从而表明冬虫夏草无性型菌的水提物和醇提物都具有抗氧化活性。结果表明虫草具有一定的抗氧化活性,且不同极性部位也有不同程度的抗氧化活性,可为研究冬虫夏草抗氧化活性提供依据。
目前,对野生冬虫夏草的抗氧化研究已有较多的报道,但对其无性型菌株中华被毛孢的研究较少,对其不同极性部位的抗氧化活性评价还未见报道。故本文采用清除DPPH自由基法、普鲁士蓝法对冬虫夏草无性型菌株菌丝体不同极性部位抗氧化活性进行了较为系统的研究,氯仿相C、正丁醇相E对DPPH自由基清除能力强于其他各相,且二者清除能力相当;乙酸乙酯相D的总还原能力强于其他各相,氯仿相C次之。结果显示,菌丝体在不同极性部位中均有不同程度的抗氧化活性,极性大的水相F和极性小的石油醚相B抗氧化活性相比不明显,因而冬虫夏草菌抗氧化活性物质可能集中在中极性部位,由此可知其抗氧化活性物质可能是中极性物质。综合两种方法的结果显示,氯仿相C具有较好的抗氧化活性,在氯仿相中含有较多的生物碱,生物碱是一种天然的抗氧化物质,可以认为冬虫夏草菌菌丝体中生物碱含量较多。
本试验仅限于对冬虫夏草菌培养物醇提物进行体外抗氧化活性研究,为研究冬虫夏草菌活性成分分布打下基础,为进一步开发利用和研究冬虫夏草资源提供一定的理论依据。下一步将对冬虫夏草菌氯仿部位化学成分进行分离纯化,对其有效成分进行分析鉴定,弄清其具有抗氧化活性的化学物质,并对冬虫夏草开展体内抗氧化能力进行探索,最终实现冬虫夏草的可持续利用。
[1]Shimitsu D.Cordyceps New Science Company[M].Japan: Green Book,1978.
[2]吕献康,沈建华,舒小英.冬虫夏草生态生物学特征性考察报告 [J].中国现代应用药学杂志,2005,22(2):134-135.
[3]古德祥,张古忍,王江海,等.冬虫夏草研究的回顾与展望 [J].中国食品学报,2006,6(2):137-140.
[4]李锋,高兴玉,饶邦复,等.冬虫夏草提取液对实验性病毒性心肌炎小鼠免疫功能的影响 [J].细胞与分子免疫学杂志,2006,22(3):321-323.
[5]张淑兰,孙云汉,刘晓平,等.冬虫夏草及人工虫草菌丝体抗小鼠Lewis肺癌作用的研究 [J].中华肿瘤杂志,1987(2):53-54.
[6]俞宙,何建新.冬虫夏草水提液对心肌细胞脂质过氧化的影响 [J].第一军医大学学报,1998,18(2):110-111.
[7]陈畅,罗珊珊,孙迎节,等.3种虫草抗氧化活性的研究[J].中国生化药物杂志,2004,25(4):212-214.
[8]魏涛,唐粉芳,郭豫,等.冬虫夏草菌丝体改善肺免疫功能的研究 [J].食品科学,2001,123(8):276-279.
[9]王雨秾,张玮.冬虫夏草菌丝对乙型慢性病毒性肝炎免疫功能的影响 [J].辽宁中医杂志,2006,33(5):513-514.
[10]程代薇,邹勇,吴曙光,等.复方冬虫夏草制剂对人-猪异种皮肤移植免疫排斥反应的影响 [J].中国病理生理杂志,2007,23(2):345-347.
[11]钱俊轩.冬虫夏草的国内研究概况 [J].鄂州大学学报,2010,17(2):53-56.
[12]凌关庭.天然食品添加剂手册 [M].北京:化学工业出版社,2000.
[13]凌关庭.食品添加剂手册 [M].北京:化学工业出版社,2003.
[14]赵宝路.氧自由基和天然抗氧化剂 [M].上海:科学出版社,1999.
[15]Paterson RRM.Cordyceps-A traditional Chinese medicine and another fungal therapeutic biofactory fungal therapeutic biofactory[J].Phytochemistry,2008(69):1469-1497.
[16]Floyd RA.Antioxidants oxidative stress and degenerative neurological disorder[J].Experimental Biology and Medicine, 1999,222(3):236-245.
[17]Leipnitz G,Arnaral AU,Femandes CG,et a1.Pristanic acid promotes oxidative stress in brain cortex of young rats:A possible pathophysiological mechanism for brain damage in peroxisomal disorders[J].Brain Research,2011(1382): 259-265.
[18]Taguchi,Keiko,Motohashi,et a1.Molecular mechanisms of the Keapl-Nrf2 pathway in stress response and cancer evolution[J].Genes to Cells,2011,16(2):123-140.
[19]杜红霞,李洪军,李小勇,等.国内外香辛料抗氧化效果最新研究进展 [J].食品科学,2008,29(1):359-363.
[20]Jiang Y,Yao YJ.Names related to Cordyceps sinensis anamorph[J].Mycotaxon,2002(84):245-254.
[21]Lee YL,Yen MT,Man JL.Antioxidant properties of various extracts from Hypsizigus marmoreus[J].Food Chemistry, 2007,104(1):1-9.
[22]Tsai SY,Huang SJ,Man JL.Antioxidant properties of hot water extracts from Agrocybe cylindracea[J].Food Chemistry,2006,98(4):670-677.
[23]Oyaizu M.Studies on products of browning reactions-antioxidative activities of products of browning reaction prepared from glucosamine[J].Japanese Journal of Nutrition, 1986(44):307-315.
[24]Harman D.Aging:a theory based on free radical and radiation chemistry[J].J Gerontol,1956,11(3):298-300.
[25]杜秀菊,张秀省,张劲松,等.北虫草体外抗氧化和PC12氧化损伤修复作用的有效部位的筛选 [J].天然产物研究与开发,2011(23):905-908.
[26]董秀英,吕清涛,张国英,等.DPPH测定九州虫草不同部位抗氧化活性 [J].中国实验方剂学杂志,2011,17 (10):70-73.
[27]陈畅,罗珊珊,孙迎节,等.3种虫草抗氧化活性的研究[J].中国生化药物杂志,2004,25(4):212-214.
[28]武守华,张晓君,张平,等.四种子囊菌甲醇提取物的抗氧化活性研究[J].菌物学报,2010,29(1):113-118.
[29]韩洪坤.冬虫夏草菌—中国被毛孢(Hirsutella sinensis)菌丝体水提物抗氧化活性研究 [D].上海:上海师范大学,2012.
Study on Antioxidant Activities of Cultured Ophiocordyceps sinensis
ZHAO Dan-dan1,2,HUANG Luo-dong2,SUO Fei-ya1,WU Chang-kui1,2,LU Shuai1,YE Xing1
(1.College of Life Science and Technology,Xinjiang University,Urumqi 830046,China; 2.Yunnan Herbal Laboratory,Institute of Herb Biotic Resources,Yunnan University,Kunming 650091,China)
In order to compare the different polar antioxidant activities of the fungus culture of Ophiocordyceps sinensis, DPPH scavenging method and Prussian blue method were used.The results showed that the fungus culture of Ophiocordyceps sinensis had significant scavenging capacity on DPPH radical in n-butanol phase E,ethyl acetate phase D, chloroform phase C,petroleum ether phase B.Meanwhile,the free radical scavenging ability and concentrations showed a linear relationship and with the concentration raised,the ability enhanced.The half maximal inhibitory concentration (IC50)were assayed as 0.083 mg·mL-1,0.132 g·mL-1,0.081 mg·mL-1and 0.143 mg·mL-1of n-butanol phase E,ethyl acetate phase D,chloroform phase C,petroleum ether phase B,respectively.The IC50were more active than aqueous phase F and alcohol extract A.The n-butanol phase E and chloroform phase C scavenging capacity were strongest.In addition, the total reduction capacities were investigated to different polar showed a good activities.And the extractive of ethyl acetate phase D,chloroform phase C,n-butanol phase E were stronger than aqueous phase F and alcohol extract A,the ethyl acetate phase D was the strongest,and the chloroform phase C was second.In short,different polarity phase had strong antioxidant activities,and the n-butanol,ethyl acetate and chloroform parts were used as the best extraction solvent.
Ophiocordyceps sinensis;culture;extract;different polarity phase;antioxidant activity
S646.9
A
1003-8310(2015)01-0065-05
10.13629/j.cnki.53-1054.2015.01.018
新疆维吾尔科技支疆项目(201091245);国家自然科学基金项目(31160073);新疆教育厅高等学校科研计划(XJEDU2010I12)。
赵聃聃(1991-),女,在读硕士研究生,研究方向主要是植物化学和药用植物资源。E-mail:792120182@qq.com
**通信作者:索菲娅(1964-),女,硕士,副教授,主要从事植物资源评价、植物化学与新药研发的研究。E-mail:sophi3106@sina.com.cn
2014-10-10
