结核分枝杆菌Rv3425与Rv3614c的相互作用
2015-02-22黄琪徐文玺粟海波李光华宋娜孔聪朱琳王洪海徐颖
黄琪,徐文玺,粟海波,李光华,宋娜,孔聪,朱琳,王洪海,徐颖
复旦大学生命科学学院遗传工程国家重点实验室,上海 200438

结核分枝杆菌Rv3425与Rv3614c的相互作用
黄琪,徐文玺,粟海波,李光华,宋娜,孔聪,朱琳,王洪海,徐颖
复旦大学生命科学学院遗传工程国家重点实验室,上海 200438
摘要:为探究结核分枝杆菌脯氨酸-脯氨酸-谷氨酸(PPE)蛋白家族Rv3425的生物学功能,利用免疫共沉淀联合质谱分析,在卡介苗(BCG)中筛选与Rv3425相互作用的蛋白。首先,以聚合酶链反应(PCR)扩增获得Rv3425基因,并克隆于pMV261载体。将重组载体转化入BCG,裂解细胞,蛋白免疫印迹法证实目的蛋白可在BCG中表达。通过免疫共沉淀,用特异抗体分离出BCG中的Rv3425蛋白复合体,质谱鉴定其成分,在美国国立生物技术信息中心(NCBI)数据库中检索各蛋白的功能,筛选与Rv3425相互作用的蛋白,并用谷胱甘肽S-转移酶(GST) pulldown验证。结果显示,免疫共沉淀联合质谱分析筛选到10个与Rv3425 相互作用的蛋白,在细胞内Rv3425协同作用下参与肽聚糖合成途径、分枝菌酸合成途径、ESX-1蛋白分泌系统及细菌毒力调控。GST pulldown验证发现Rv3614c与Rv3425可体外结合。本研究证实Rv3425与Rv3614c存在相互作用,Rv3425可能与ESX-1蛋白分泌系统及结核分枝杆菌致病机制密切相关。
关键词:结核分枝杆菌;Rv3425;免疫共沉淀;谷胱甘肽S-转移酶pulldown;蛋白质相互作用
结核病(tuberculosis,TB)是严重危害人类健康的一种慢性传染病。2013年,全球大约有900万新增结核病病例,150万死于该病,其中36万例是人类免疫缺陷病毒(human immunodeficiency virus,HIV)阳性患者[1]。随着HIV 与结核分枝杆菌(Mycobacteriumtuberculosis,M.tuberculosis)共感染及耐多药菌株的出现,结核病的传播呈逐年上升趋势,已成为全球严重的公共卫生和社会问题[2]。
富含甘氨酸的脯氨酸-谷氨酸(Pro-Glu,PE)/脯氨酸-脯氨酸-谷氨酸(Pro-Pro-Glu,PPE)蛋白家族编码基因约占整个结核分枝杆菌基因组的10%,该蛋白家族可能是细菌毒力和抗原变异的主要来源,对其结构和生物学功能的研究将对结核分枝杆菌感染的血清学诊断和结核分枝杆菌疫苗的开发具有重要意义[3]。目前研究显示,PE/PPE蛋白家族的许多蛋白有作为新型结核病诊断抗原及结核分枝杆菌疫苗候选组分的潜力。已进入临床试验Ⅱa期的M72,就重组有PPE蛋白家族PPE18[4]。
Rv3425,位于结核分枝杆菌H37Rv基因组RD11区,其编码的蛋白PPE57是PPE蛋白家族第3亚组成员。PPE57 (Rv3425) 于结核病血清学诊断研究中被发现,是一个潜在的B细胞抗原[5],后期小鼠实验表明其可诱发Th1型免疫反应并产生γ干扰素(interferon γ,IFN-γ),是一个新型优良的疫苗候选抗原[6]。作为PE/PPE蛋白家族的一员,Rv3425的生物学功能尚未清楚,为此本研究以结核分枝杆菌 H37Rv 基因组为模板,采用聚合酶链反应(polymerase chain reaction,PCR)克隆Rv3425c基因构建重组卡介苗(recombinant bacillus Calmette-Guérin,rBCG),利用免疫共沉淀和谷胱甘肽S-转移酶(glutathioneS-transferase,GST)pulldown试验,筛选并验证与Rv3425相互作用的蛋白,进一步揭示Rv3425的功能。
1材料与方法
1.1 材料
BCG(Danish)由上海生物制品研究所提供,大肠埃希菌(Escherichiacoli,E.coli)DH5α、BL21(DE3)购自北京全式金生物公司,载体 pMV261由本实验室保存,载体pGEX-4T-1由复旦大学吴家雪研究员馈赠,限制性内切酶、T4 DNA连接酶购自TaKaRa公司,质粒提取试剂盒、凝胶回收纯化试剂盒购自Axyge公司,硝酸纤维素(nitrocellulose,NC)膜购自GE Healthcare公司,Anti-6X His-tag单克隆抗体购自Abcam公司,GST 单克隆抗体购自天津三箭公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗小鼠IgG购自上海鼎国生物科技有限公司,免疫共沉淀试剂盒、GST pulldown试剂盒购自Thermo公司。
1.2 质粒pMV261-Rv3425-His的构建
根据结核分枝杆菌 H37Rv 的Rv3425 基因序列及 pMV261 载体克隆位点序列设计PCR引物。上游为5′-AATCGAATTCATGCATCCAATGA-TACCAGC-3′,下游为5′-AATGTCGACCTA-GTGATGGTGATGGTGATGCCCGCCCCTGTA-GATCT-3′,上下游引物分别引入EcoRⅠ 和SalⅠ 的酶切位点。以H37Rv基因组DNA为模板进行PCR 扩增。循环参数:98 ℃预变性2 min;98 ℃变性10 s,60 ℃退火40 s,72 ℃延伸40 s,30个循环;72 ℃延伸5 min。将PCR扩增序列和pMV261载体进行双酶切并纯化,酶切后的质粒和基因按摩尓比1∶3混合,T4 连接酶4 ℃连接过夜。连接产物转化至大肠埃希菌DH5α感受态细胞中,加入800 μl无菌LB液体培养基37 ℃震荡培养45 min,复苏后将菌液均匀涂布在含50 mg/L卡那霉素的平板上,37 ℃培养过夜。随机挑取转化平板上长出的单克隆,37 ℃震荡培养。菌液经PCR、双酶切及DNA序列分析,鉴定结果为阳性的重组质粒即为 pMV261-Rv3425-His。将构建好的重组质粒电转入BCG中得到rBCG∷Rv3425-His。
1.3 蛋白免疫印迹法检测 Rv3425-His 融合蛋白的表达情况
收集对数期的rBCG,超声破菌后收集上清液,选用12.5%分离胶、5%积层胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),电泳至溴酚蓝达分离胶底部结束。用200 mA 恒电流将蛋白从胶上转移至NC膜上,用含吐温20的Tris缓冲液(Tris buffered saline with Tween-20,TBST)配制的5%脱脂奶粉封闭1 h,抗Rv3425(1∶1 000稀释)多克隆抗体4 ℃孵育过夜,HRP标记的山羊抗小鼠IgG(1∶10 000 稀释)室温孵育1 h,洗膜,增强化学发光(enhanced chemiluminescence,ECL)显色系统检测目的蛋白,显影。
1.4 免疫共沉淀筛选BCG中与Rv3425相互作用的蛋白
将rBCG∷Rv3425-His及rBCG∷pMV261(阴性对照)在37 ℃培养至对数后期,12 000g离心2 min;用2 ml裂解液重悬裂解细菌,将细胞裂解液与20 μl偶联His抗体的Protein A/G 琼脂糖混合,4 ℃旋转结合1 h,1 000g离心1 min;弃上清液,用500 μl细胞裂解液洗涤与琼脂糖偶联的抗His抗体颗粒(15 min,4次),1 000g离心1 min;弃上清液,保留琼脂糖颗粒,加50 μl洗脱液洗脱,洗脱液中加入5×SDS-PAGE上样缓冲液,100 ℃变性5 min。将上述2份样品进行12% SDS-PAGE,考马斯亮蓝染色4 h后脱色观察。此实验同等条件重复3次。与阴性对照泳道相比,实验组存在差异条带。切割差异蛋白条带进行质谱分析,鉴定其组成。
1.5 质谱分析差异条带
质谱分析由复旦大学化学系/生物医学研究院分析中心进行,用基质辅助激光解析电离飞行时间质谱分析(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF MS)鉴定未知蛋白质。得到的质谱数据用Thermo Scientific Proteome Discoverer Software Version 1.4软件在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库内(Organism source:MycobacteriumbovisBCG str. Release 2014-08-11, with 44610 sequences)进行检索。
1.6 GST pulldown验证免疫共沉淀产物与Rv3425的相互作用
对Rv3425及质谱分析所获候选蛋白进行文献调研及生物信息学分析,推测Rv3614c、Rv3867、Rv2145c、Rv0206c是Rv3425的高可信相互作用蛋白,进一步用GST pulldown验证其与Rv3425的相互作用。构建GST的原核表达pGEX-4T-1载体,以异丙基-β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)为诱导剂,诱导GST-融合蛋白在大肠埃希菌BL21菌株中大量表达。将诱导表达GST-融合蛋白和pGEX-4T-1载体表达获得GST(阴性对照)的细胞裂解液分别与25 μl GST琼脂糖4B树脂混合,4 ℃旋转孵育1 h。用细胞裂解液洗5次,洗去未结合的杂蛋白。再将表达Rv3425-His蛋白的细胞裂解液与GST琼脂糖4B树脂混合,室温下孵化2 h。用细胞裂解液洗5次,洗脱后进行SDS-PAGE和蛋白免疫印迹分析。
2结果
2.1 质粒pMV261-Rv3425-His的PCR及双酶切鉴定
随机挑取转化平板上长出的单克隆,37 ℃振荡培养,用Rv3425-His的上下游引物进行菌液PCR扩增,用1%琼脂糖凝胶电泳检测扩增产物。结果显示,扩增产物大小约550 bp。用限制性内切酶EcoRⅠ 和SalⅠ对重组质粒pMV261-Rv3425-His进行双酶切鉴定,1%琼脂糖凝胶电泳检测酶切产物。结果显示,同一泳道可见550 bp左右的目的条带和约5 000 bp 的空质粒条带(图1)。将此质粒测序,结果表明Rv3425-His编码序列正确插入质粒pMV261中。
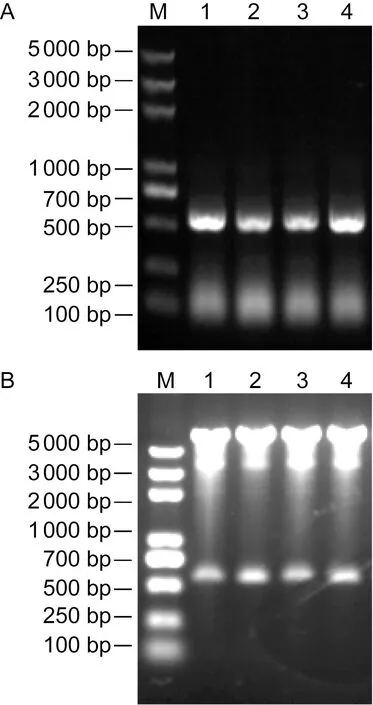
A: PCR confirmation of pMV261-Rv3425-His. M, Marker DL5000; Lanes 1-4, PCR results. B: Double digestion of pMV261-Rv3425-His. M: Marker DL5000; Lanes 1-4, digestion results of double digestion with EcoRⅠ and SalⅠ.图1 重组质粒pMV261-Rv3425-His的PCR 及双酶切鉴定Fig.1 Identification of pMV261-Rv3425-His by PCR and double restriction enzymes
2.2 Rv3425-His融合蛋白在rBCG中表达
收集对数期的rBCG,用蛋白免疫印迹法检测Rv3425融合蛋白的表达情况。转膜曝光后发现,与转导了pMV261的阴性对照相比,在20 000处有一与预期大小一致的目的条带,表明融合蛋白已表达(图2)。
2.3 差异条带的质谱鉴定
针对质谱鉴定到的肽段氨基酸序列,在BCG蛋白质序列数据库中进行检索,确定蛋白种类。剔除操作过程中引入的角蛋白类污染,选择在对照组中未被检出的且2次以上质谱重复鉴定到的蛋白作为后续研究对象(表1)。

-, negative control; Lanes 1-7, rBCG∷Rv3425-His; +, Rv3425 protein.图2 蛋白免疫印迹法检测Rv3425在rBCG中的表达Fig.2 Detection of the expression of Rv3425 in rBCG by Western blotting
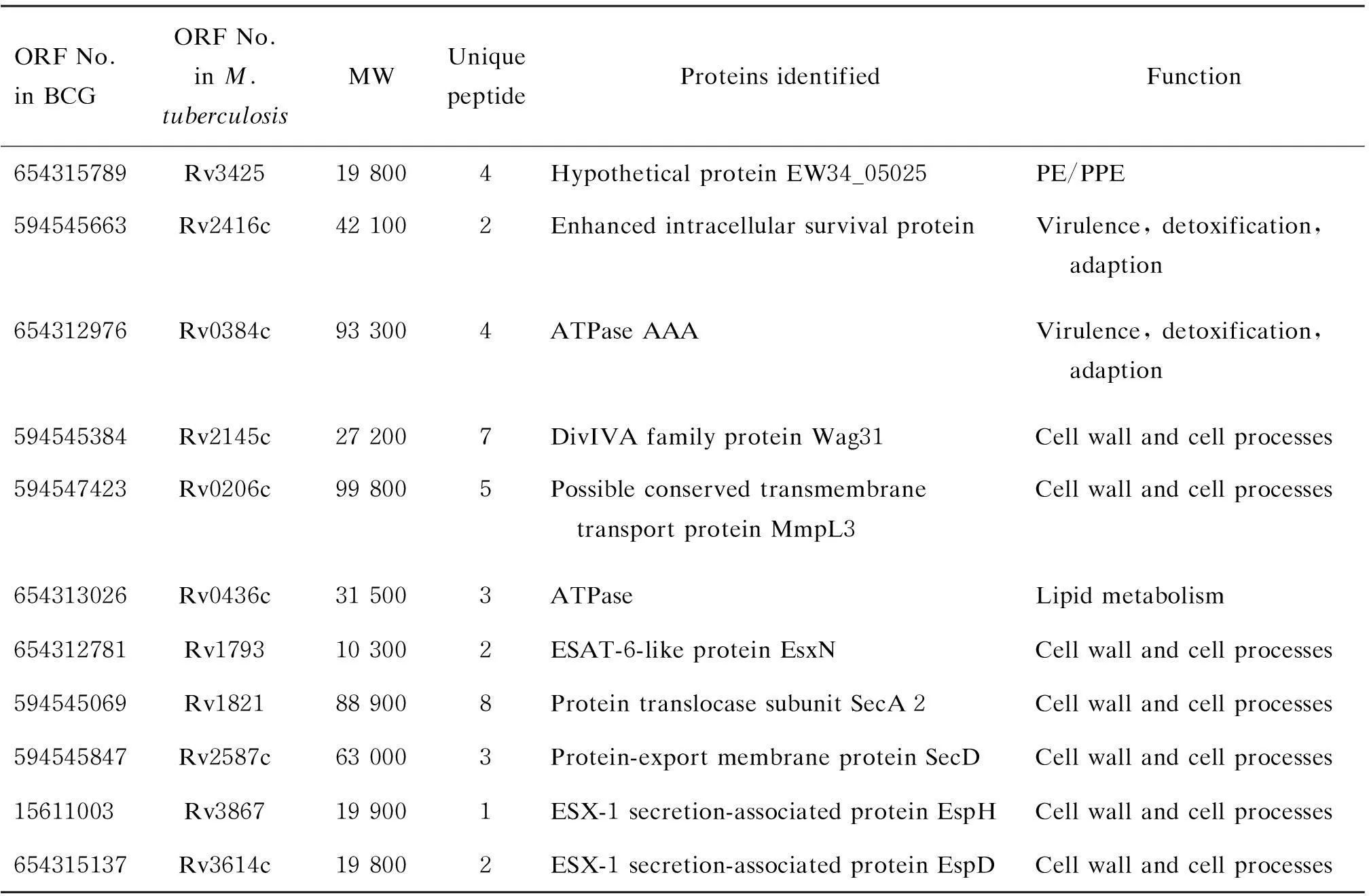
表1 质谱法鉴定差异条带内的蛋白质Tab.1 Identification of cellular proteins in the bands by mass spectroscopic analysis
2.4 GST pulldown验证Rv3425与Rv3614c存在相互作用
将GST-融合蛋白固化在GST亲和树脂上,充当诱饵蛋白,用Rv3425-His的表达液过柱,通过蛋白相互作用捕获Rv3425-His蛋白,洗脱后进行SDS-PAGE和蛋白免疫印迹分析。结果显示,Rv3614c-GST融合蛋白与Rv3425-His有特异性相互作用(图3),而Rv3867、Rv2145c、Rv0206c与Rv3425-His没有特异性相互作用。
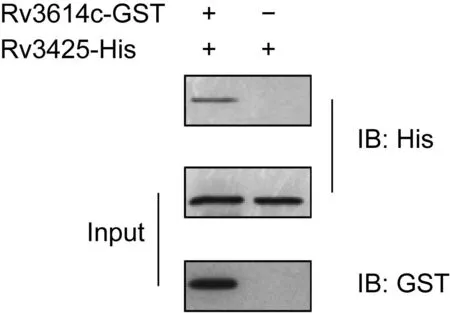
图3 GST pulldown验证Rv3425与Rv3614c相互作用Fig.3 Examination of Rv3425-Rv3614c interactions by GST pulldown assay
3讨论
蛋白之间相互作用形成大的蛋白复合体,在特定的时间和空间内完成特定的功能。大规模蛋白相互作用的研究,对阐明蛋白功能、了解细胞中不同生命活动之间的相互关系十分必要。免疫共沉淀是以抗体与抗原之间的专一作用为基础的用于研究蛋白相互作用的经典方法,可用于研究生理水平蛋白之间的相互作用。质谱技术以极高的检测灵敏度及与色谱的有效联用,广泛用于复杂体系中痕量物质的鉴定或结构测定,具有准确率高和速度快的优点。如今,免疫共沉淀联合质谱分析技术已广泛应用于寻找生理水平新的相互作用[7]。
通过免疫共沉淀实验发现了Rv3425的一系列候选结合蛋白:Rv2416c、Rv0384c、Rv2145c、Rv0206c、Rv0436c、Rv1793、Rv1821、Rv2587c、Rv3867、Rv3614c。这些蛋白按功能主要分3类,参与细胞壁合成、细菌毒力、脂类代谢等。其中,Rv2145c(Wag31)参与肽聚糖合成[8],Rv0206c(MmpL3)参与分枝菌酸的合成[9]。由此推测,Rv3425可能通过与Wag31和MmpL3的作用参与细胞壁的合成。Rv2416c(Eis)与细菌毒力相关,能通过负调节炎症反应、自噬和依赖氧化还原的细胞死亡抑制宿主天然免疫[10]。BCG的保护效果并不稳定,但将Rv3425重组到BCG中后,小鼠实验表明重组疫苗表现出良好的刺激产生Th1型免疫反应的能力,能引起强烈的体液免疫和细胞免疫,有助于控制结核分枝杆菌感染[6],这可能是由于Rv3425与Eis蛋白相互作用抑制了Eis蛋白在宿主天然免疫防御中的拮抗作用。另外,还发现有2个蛋白为ATP酶(Rv0384c、Rv0436c)。细胞壁合成和蛋白跨膜转运过程均需ATP酶辅助代谢,Rv3425可能本身没有酶的活性,而依靠结合ATP酶来辅助这些过程。
结核分枝杆菌细胞壁的特殊性导致其具有高度的疏水性,且通透性极差,这使得结核分枝杆菌表达的蛋白必须要在分泌系统的协助下才能分泌至细胞外。ESX-1分泌系统对结核分枝杆菌在细胞内存活和细菌毒力至关重要,主要负责ESXA和ESXB的分泌[11]。近年来,发现了较多蛋白参与ESX-1的构成。到目前为止,已证实确切参与ESX-1分泌系统组成的有:RD-1区基因区域的Rv3871~Rv3879c9个基因,Rv3614c(EspD)、Rv3615c、Rv3616c(EspA)3个基因[12],Rv3849(EspR)、Rv3864、Rv3867、Rv3868、Rv3869、Rv3870、Rv3881c(EspB)、Rv3882c及Rv3883c(MyP1)[13]。研究发现,很多PE/PPE蛋白家族与结核分枝杆菌细胞壁有关,如PE35(Rv3872)、PPE68(Rv3873),并能与ESX-1其他蛋白相互作用[14]。多个PE/PPE蛋白依赖ESX-1分泌系统而分泌,如PE35[15]。PPE68有作为肺外结核病诊断和结核分枝杆菌候选疫苗的潜力。通过GST pulldown验证,发现Rv3614c与Rv3425在体外存在相互作用。本课题组前期研究发现,Rv3425蛋白定位于结核分枝杆菌细胞壁,猜测其可能是ESX-1分泌系统的组成部分,也可能依赖ESX-1分泌系统由胞内分泌至细胞壁。
本研究筛选到10个与Rv3425相互作用的候选蛋白,为深入研究Rv3425的生物学功能提供了线索,也为利用Rv3425研发疫苗提供了一定的理论依据,具有重要的实际指导意义。本研究利用免疫共沉淀和GST pulldown首次证实,Rv3425与Rv3614c在胞内可直接相互作用,为进一步明确Rv3425在结核分枝杆菌细胞内的分子功能研究提供了良好基础。随着对Rv3425研究的深入,由ESX-1分泌及调节ESX-1分泌系统的组分将进一步被发现、被阐明。目前,尽管存在很多假设,人们对PE/PPE蛋白家族功能仍所知甚少。作为PPE蛋白家族的一员,对Rv3425功能的初步研究也为PE/PPE蛋白家族功能的探索提供了有力帮助。我们有理由相信,对结核分枝杆菌蛋白生物学及免疫学研究的不断深入,将为人类解决结核病这一危害多年的顽疾提供有效帮助。
参考文献
[1]Zumla A, George A, Sharma V, Herbert RH, Baroness Masham of Ilton, Oxley A, Oliver M. The WHO 2014 global tuberculosis report—further to go [J]. Lancet Glob Health, 2015, 3(1): e10-e12.
[2]Dye C, Williams BG. The population dynamics and control of tuberculosis [J]. Science, 2010, 328(5980): 856-861.
[3]Chakhaiyar P, Hasnain SE. Defining the mandate of tuberculosis research in a postgenomic era [J]. Med Princ Pract, 2004, 13(4): 177-184.
[4]Thacher EG, Cavassini M, Audran R, Thierry AC, Bollaerts A, Cohen J, Demoitié MA, Ejigu D, Mettens P, Moris P, Ofori-Anyinam O, Spertini F. Safety and immunogenicity of the M72/AS01 candidate tuberculosis vaccine in HIV-infected adults on combination antiretroviral therapy: a phase I/II, randomized trial [J]. AIDS, 2014, 28(12): 1769-1781.
[5]Zhang H, Wang J, Lei J, Zhang M, Yang Y, Chen Y, Wang H. PPE protein (Rv3425) from DNA segment RD11 of Mycobacterium tuberculosis: a potential B-cell antigen used for serological diagnosis to distinguish vaccinated controls from tuberculosis patients [J]. Clin Microbiol Infect, 2007, 13(2): 139-145.
[6]Wang J, Qie Y, Zhang H, Zhu B, Xu Y, Liu W, Chen J, Wang H. PPE protein (Rv3425) from DNA segment RD11 of Mycobacterium tuberculosis: a novel immunodominant antigen of Mycobacterium tuberculosis induces humoral and cellular immune responses in mice [J]. Microbiol Immunol, 2008, 52(4): 224-230.
[7]孙婷婷,宋丽娜,于淼,李长燕,杨晓明,汪思应.免疫共沉淀联合质谱对肝细胞核因子3β蛋白复合体的分离鉴定[J].生物技术通讯,2011,22(5):662-666.
[8]Kang CM, Nyayapathy S, Lee JY, Suh JW, Husson RN. Wag31, a homologue of the cell division protein DivIVA, regulates growth, morphology and polar cell wall synthesis in mycobacteria [J]. Microbiology, 2008, 154(Pt 3): 725-735.
[9]Varela C, Rittmann D, Singh A, Krumbach K, Bhatt K, Eggeling L, Besra GS, Bhatt A. MmpL genes are associated with mycolic acid metabolism in mycobacteria and corynebacteria [J]. Chem Biol, 2012, 19(4): 498-506.
[10]Shin DM, Jeon BY, Lee HM, Jin HS, Yuk JM, Song CH, Lee SH, Lee ZW, Cho SN, Kim JM, Friedman RL, Jo EK. Mycobacterium tuberculosis eis regulates autophagy, inflammation, and cell death through redox-dependent signaling [J]. PLoS Pathog, 2010, 6(12): e1001230.
[11]Abdallah AM, Gey van Pittius NC, Champion PA, Cox J, Luirink J, Vandenbroucke-Grauls CM, Appelmelk BJ, Bitter W. Type VII secretion—mycobacteria show the way [J]. Nat Rev Microbiol, 2007, 5(11): 883-891.
[12]Chen JM, Boy-Röttger S, Dhar N, Sweeney N, Buxton RS, Pojer F, Rosenkrands I, Cole ST. EspD is critical for the virulence-mediating ESX-1 secretion system in Mycobacterium tuberculosis [J]. J Bacteriol, 2012, 194(4): 884-893.
[13]邓仪昊,何红云,王勇.结核分枝杆菌ESX-1分泌系统的研究进展[J].大理学院学报,2012,11(12):20-23.
[14]Gey van Pittius NC, Sampson SL, Lee H, Kim Y, van Helden PD, Warren RM. Evolution and expansion of the Mycobacterium tuberculosis PE and PPE multigene families and their association with the duplication of the ESAT-6 (esx) gene cluster regions [J]. BMC Evol Biol, 2006, 6: 95.
[15]Brodin P, Majlessi L, Marsollier L, de Jonge MI, Bottai D, Demangel C, Hinds J, Neyrolles O, Butcher PD, Leclerc C, Cole ST, Brosch R. Dissection of ESAT-6 system 1 of Mycobacterium tuberculosis and impact on immunogenicity and virulence [J]. Infect Immun, 2006, 74(1): 88-98.

Corresponding authors. WANG Hong-Hai, E-mail: hhwang@fudan.edu.cn;XU Ying, E-mail: yingxu2520@fudan.edu.cn
Protein-protein interaction between Rv3425 and Rv3614c inMycobacteriumtuberculosis
HUANG Qi, XU Wen-Xi, SU Hai-Bo, LI Guang-Hua, SONG Na, KONG Cong, ZHU Lin, WANG Hong-Hai, XU Ying
State Key Laboratory of Genetic Engineering, School of Life Sciences, Fudan University, Shanghai 200438, China
Abstract:This study aims to investigate the function of Rv3425 in Mycobacterium tuberculosis (M. tuberculosis) by screening its interacting proteins in bacillus Calmette-Guérin (BCG) via co-immunoprecipitation coupled with mass spectrometry. Regions coding for Rv3425 were amplified by polymerase chain reaction (PCR) and cloned into the pMV261 vector. The recombinant vector was transformed into BCG, and the expression of the fusion protein was verified by Western blotting analysis. The Rv3425 protein complex formed in BCG (rBCG) were obtained by co-immunoprecipitation combined with anti-His specific antibody. Mass spectrometry was used to identify protein components in the complex; the function of each protein was obtained from the National Center for Biotechnology Information (NCBI). The candidate proteins interacting with Rv3425 were verified by glutathione S-transferase (GST) pulldown assay. Ten proteins interacted with Rv3425 were obtained. Rv3425 could coordinate with a variety of proteins implicated in intermediary metabolism and respiration, cell wall and cell processes as well as latent infections. The results also demonstrated that Rv3614c protein implicated in ESX-1 secretion system and possible pathogenic mechanism could bind to Rv3425 in vitro.
Key words:Mycobacterium tuberculosis; Rv3425; Co-immunoprecipitation; Glutathione S-transferase pulldown; Protein-protein interaction
收稿日期:(2015-03-25)
通信作者:王洪海,徐颖
基金项目:国家传染病防治科技重大专项(2012ZX10003008)
