分枝杆菌脂质组分加强结核分枝杆菌亚单位疫苗效应的初步研究
2015-02-22何珊珊何娟娟刘勋孔祥熙谭继英祝秉东
何珊珊,何娟娟,刘勋,孔祥熙,谭继英,祝秉东
1. 甘肃省循证医学与临床转化重点实验室暨兰州大学结核病研究中心,兰州730000;2. 兰州大学基础医学院免疫学研究所,兰州 730000;3. 兰州大学基础医学院病原生物学研究所,兰州 730000

分枝杆菌脂质组分加强结核分枝杆菌亚单位疫苗效应的初步研究
何珊珊1,2,何娟娟1,3,刘勋1,3,孔祥熙1,2,谭继英1,2,祝秉东1,3
1. 甘肃省循证医学与临床转化重点实验室暨兰州大学结核病研究中心,兰州730000;2. 兰州大学基础医学院免疫学研究所,兰州 730000;3. 兰州大学基础医学院病原生物学研究所,兰州 730000
摘要:分枝杆菌细胞壁含丰富的脂质组分,其中一些具有抗原性,或具有重要的免疫调节作用。为探讨这些脂质组分在结核分枝杆菌亚单位疫苗中的作用,研发有效疫苗,本研究对卡介苗(BCG)细胞壁总脂成分进行萃取,用硅胶柱色谱法将其分离为非极性脂、中间极性脂和极性脂,检测各类脂质组分在人群中的免疫原性,并将总脂和各类脂质组分分别与佐剂二甲基三十六烷基铵(DDA)和Poly(I∶C)混合,进一步与结核分枝杆菌融合蛋白LT70(ESAT6-Ag85B-MPT64<190-198>-Mtb8.4-Rv2626c)混合,构建含脂质的结核分枝杆菌亚单位疫苗。在小鼠BCG攻击模型中进行保护效率评价,包括BCG初免后含脂质亚单位疫苗的强化免疫保护效率评价。结果显示,结核病患者脂质特异性抗体IgG高于健康人群(P<0.05)。在小鼠BCG攻击模型免疫保护效果评价中,含脂质亚单位疫苗LT70-总脂组小鼠肺部的荷菌数显著低于BCG组(P<0.05)。在BCG初免-含脂质亚单位疫苗加强免疫策略中,LT70-总脂和LT70-中间极性脂组小鼠肺部荷菌数均低于BCG组(P<0.01)和LT70组(P<0.05)。研究表明,分枝杆菌脂质成分具有较强的免疫原性,与亚单位疫苗联合使用能增强亚单位疫苗的抗结核分枝杆菌效果。其中,中间极性脂类强化作用明显,值得深入研究。
关键词:结核分枝杆菌;亚单位疫苗;卡介苗;细胞壁;脂质
结核病(tuberculosis)是全球传播范围最广、持续时间最长、危害最为严重的传染病。据2014年世界卫生组织(World Health Organization,WHO)报告,全球约有900万人罹患结核病,150万人死于结核病;且随着人类免疫缺陷病毒(human immunodeficiency virus,HIV)共感染、多重耐药结核分枝杆菌和广泛耐药结核分枝杆菌增多,结核病的治疗更加困难[1]。因此,人们越来越注重免疫预防性抗结核措施。目前,结核病防治所使用的疫苗卡介苗(bacillus Calmette-Guérin,BCG)能预防新生儿和儿童全身粟粒性结核及结核性脑膜炎,但不能有效预防成人肺结核病,因此寻找新型有效的疫苗尤为重要。现阶段结核分枝杆菌疫苗的研究以重组BCG疫苗、DNA疫苗、病毒载体疫苗和蛋白亚单位疫苗为主,而分枝杆菌脂质成分疫苗的研究尚不多见[2]。
分枝杆菌细胞壁含有大量特异的结构复杂的脂质成分。它们具有抗原性,还可调节宿主抗感染免疫。目前,研究最多的索状因子海藻糖二霉菌酸酯(trehalose-6,6′-dimycolate,TDM)为一种分枝菌酸与海藻糖结合的糖脂,能使结核分枝杆菌相互粘连,促进巨噬细胞释放促炎症因子,提高体液免疫和细胞免疫[3,4]。TDM及其衍生物海藻糖二十二酸酯(trehalose-6,6′-dibehenate,TDB)是结核分枝杆菌亚单位疫苗的有效佐剂。由TDB与二甲基三十六烷基铵(N,N′-dimethyl-N,N′-dioctadecylammonium, DDA)组成的佐剂CAF01可诱导较强的Th1免疫应答,增强Ag85B-ESAT-6(H1)疫苗的保护性[5]。分枝杆菌细胞壁脂质还可通过不同于经典抗原呈递途径的CD1系统活化T细胞,发挥免疫保护效应[6]。已在结核病患者和经BCG免疫的健康人中检测到脂质特异性CD1限制性T细胞,并发现此类细胞通过记忆性免疫应答控制结核分枝杆菌感染[7]。
本实验室前期构建的融合蛋白LT70 (ESAT6-Ag85B-MPT64<190-198>-Mtb8.4-Rv2626c,相对分子质量70 000)包含结核分枝杆菌在不同生长时期表达的抗原,同时证实阳离子脂质体DDA与Poly(I∶C)复合佐剂具有诱导细胞免疫应答的作用[8]。由两者组成的LT70亚单位疫苗在小鼠模型H37Rv攻毒保护效力评价实验中具有较好的抗结核免疫效应。本研究基于以上结果,将BCG细胞壁总脂和各脂质组分萃取、分离,并与LT70疫苗混合构建含脂质亚单位疫苗,采取脂质亚单位疫苗免疫和BCG初免-亚单位疫苗加强免疫策略免疫小鼠,通过BCG攻击评价保护效率,初步探讨分枝杆菌细胞壁脂质成分在结核分枝杆菌亚单位疫苗中的应用。
1材料与方法
1.1 材料
1.1.1菌株BCG(丹麦株)由兰州生物制品研究所惠赠,本实验室传代保存。
1.1.2培养基Middlebrook 7H9液体培养基、Middlebrook 7H11固体培养基、增菌液OADC均购自美国BD公司。
1.1.3主要试剂融合蛋白LT70由本实验室制备,DDA、Poly(I∶C)购自Sigma公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗人总IgG抗体购自北京中杉金桥生物技术有限公司,四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)显色剂、戊巴比妥钠、氨苄西林购自生工生物工程(上海)股份有限公司。
1.1.4实验动物无特定病原体(specific pathogen free,SPF)级BABL/c雌鼠,4~6周龄,体重18~22 g,购自中国农业科学院兰州兽医研究所。
1.2 方法
1.2.1BCG菌种制备将BCG接种于Middlebrook 7H9培养基,37 ℃培养3周,制备成悬液;于苏通培养基(pH 7.2~7.4)37 ℃培养4周,121 ℃灭活20 min;用磷酸盐缓冲液(phosphate buffered sa1ine,PBS)洗3次,收集菌体。
1.2.2总脂和各脂质组分的萃取、分离与检测每10 g BCG菌体加氯仿∶甲醇(2∶1)混合液30 ml,过夜。收集上清液,旋转蒸发氯仿和甲醇获得总脂。硅胶柱色谱法分离总脂,依次用氯仿∶甲醇、氯仿∶甲醇∶水、氯仿∶丙酮∶甲醇∶水洗脱,获得非极性脂、中间极性脂和极性脂。具体方法为:150 ml氯仿浸泡50 g硅胶粉末,过夜,匀浆湿法装柱。氯仿∶甲醇 (2∶1)溶解总脂,浓度为1 g/ml,上样1 ml。依次加入100 ml氯仿∶甲醇(96∶4)、氯仿∶甲醇∶水(100∶14∶0.8)、氯仿∶丙酮∶甲醇∶水(47∶25∶3∶5),分别收集洗脱液,旋转蒸发,获得非极性脂、中间极性脂和极性脂3种脂质组分。用二向薄层色谱(two direction-thin layer chromatography,2D-TLC)法分析鉴定总脂和各脂质组分。脂质成分的鉴定参考Dobson等的TLC分析,展开剂系统a-c见表1[9]。碘熏蒸或磷钼酸乙醇溶液显色检测脂类。

表1 2D-TLC分析脂质用展开剂系统[9]Tab.1 Developing solvent system for 2D-TLC analysis of lipids[9]
1.2.3疫苗制备将DDA分别与各脂质组分混合,用氯仿∶甲醇(9∶1)溶解,真空抽滤蒸干有机溶剂,形成白色薄膜。低温、干燥过夜,除去残余有机溶剂,57 ℃水浴震荡,用PBS溶解,与LT70、Poly(I∶C)混合,制成含脂质亚单位疫苗。每剂疫苗含DDA 250 μg、脂质成分(总脂/非极性脂/极性脂/中间极性脂)250 μg、Poly(I∶C) 50 μg、抗原LT70 10 μg。
1.2.4免疫策略于BABL/c小鼠腹股沟皮下注射含脂质亚单位疫苗,每只200 μl。BCG初免-含脂质亚单位疫苗加强策略组:在小鼠BCG初免(剂量5×106cfu)9周后,亚单位疫苗加强免疫2次,每次间隔3周。含脂质亚单位疫苗免疫策略组:亚单位疫苗共免疫3次,每次间隔3周。BCG(剂量5×106cfu)0周免疫一次作为对照,PBS免疫作为空白对照。
1.2.5保护效率检测所用感染方式用BCG滴鼻方式感染BABL/c鼠。末次免疫5周后,用0.3%戊巴比妥钠腹腔麻醉小鼠(100 μl/10 g),50 μl BCG(2.5×106cfu )菌液滴鼻感染小鼠。
1.2.6肺荷菌量计数BCG攻毒3周后,处死小鼠,取肺组织,研磨成匀浆。用PBS 10倍梯度稀释至10、100、1 000共3个梯度,均匀涂布于Middlebrook 7H11固体培养基(含10% OADC、25 μg/ml氨苄西林)。37 ℃,5% CO2培养3周,菌落计数。结果以每组小鼠每克肺组织的log10cfu均值表示。
1.2.7脂质特异性IgG检测取兰州市肺科医院临床确诊结核病患者22人份全血和甘肃省人民医院健康体检者10人份血清,用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测血清脂质特异性IgG。主要步骤:以正己烷∶甲醇为包被液,用80 μg/ml非极性脂、中间极性脂、极性脂抗原包被,每孔25 μl,室温过夜;1%牛血清白蛋白37 ℃封闭1 h,PBS洗涤,加入倍比稀释的待检血清100 μl,37 ℃孵育1 h;PBS洗5次,加入HRP标记羊抗人IgG 100 μl,37 ℃孵育1 h;PBS洗涤,加入TMB 100 μl,显色15 min;用2 mol/L硫酸终止,检测450 nm处的光密度(optical density,OD)。
1.3 统计分析
数据以mean±SD表示,SPSS19软件进行分析。多组数据比较采用单因素方差分析,两组数据比较采用t检验,P<0.05为有统计学意义。
3结果
3.1 总脂和各脂质组分的萃取和检测
用氯仿∶甲醇萃取BCG细胞壁总脂。为分析总脂中脂质成分的极性和含量,选用3种不同极性的展开剂系统进行检测。极性较低的a展开剂系统可检测到2种成分(图1A);中间极性的b展开剂系统可检测到多种成分(图1B);极性较高的c展开剂系统亦可检测到多种成分(图1C)。
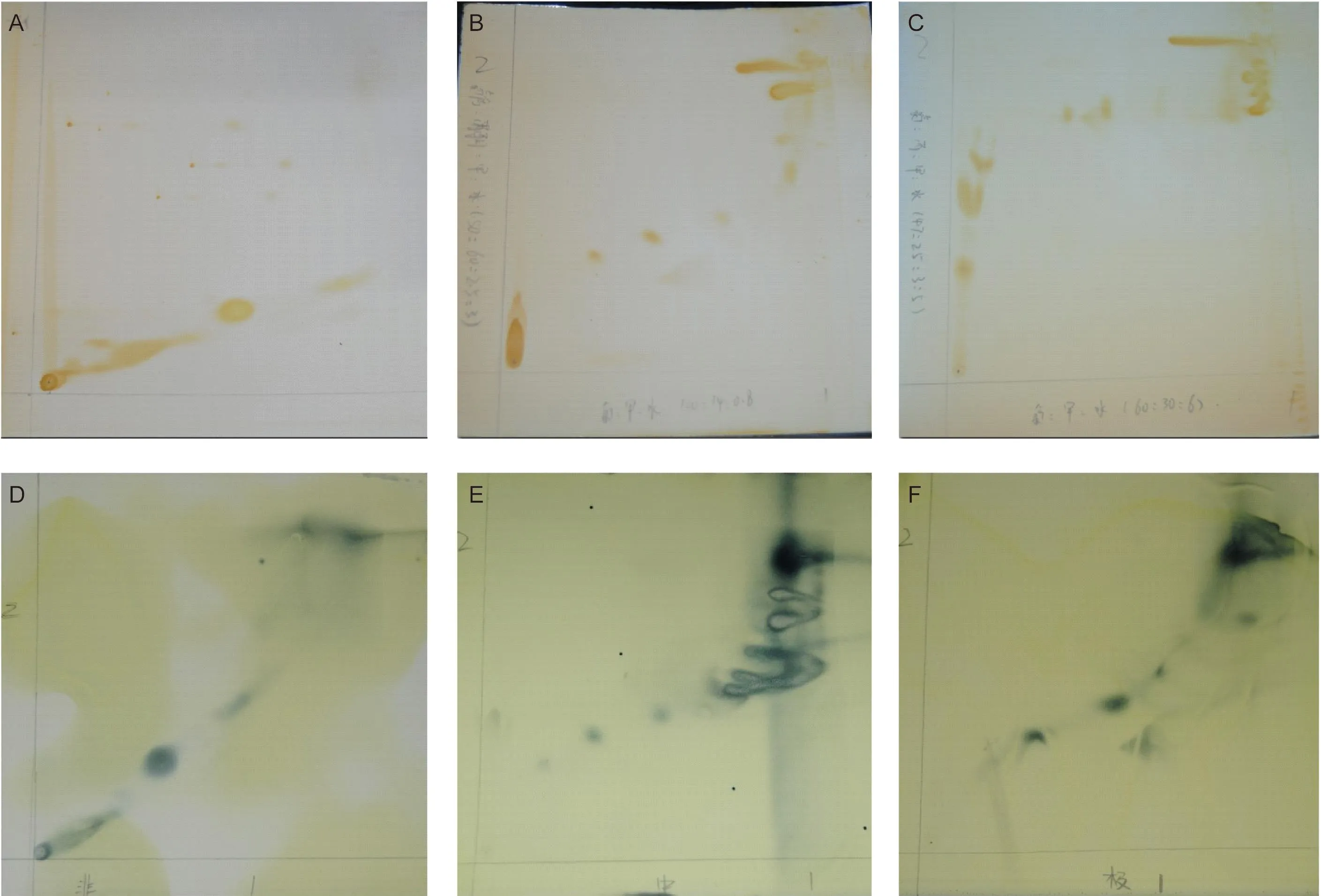
Total lipids were extracted using chloroform-methanol. Three groups of lipids were isolated by silica column. The composition of total lipids and three groups of lipids were analyzed using analytical 2D-TLC. A-C: Total lipids were analyzed with TLC systems a, b, c and visualized by exposing the TLC plates to iodine vapor for 5 min. D: Nonpolar lipids analyzed with TLC systems a; E: Intermediate polar lipids analyzed with TLC systems b; F: Polar lipids analyzed with TLC systems c.图1 总脂和3种脂质组分的2D-TLC分析Fig.1 2D-TLC analysis of total lipids and three groups of lipids
通过硅胶柱色谱法分离获得非极性脂、中间极性脂和极性脂3种脂质组分,非极性脂、中间极性脂和极性脂的比例约为1∶6∶3。根据极性大小,选择相应的展开剂系统检测所含成分的多少并显色(图1D~F)。结合文献分析实验结果[9-11],发现非极性脂质组分含2种成分,可能为结核菌醇二分枝菌酸(phthiocerol dimycocerosate,PDIM)和三酰甘油;中间极性脂质组分主要是糖脂,在总脂中占比较大;极性脂质组分主要含磷脂类,占比介于非极性脂质组分与中间极性脂质组分之间。
3.2 脂质抗原特异性IgG
检测结核病患者和健康人血清中各脂质组分特异性IgG(图2),发现人群中可检测到一定水平脂质特异性IgG,其中极性脂抗体水平在两类人群中最高,非极性脂抗体次之,中间极性脂抗体最低。在健康人中,极性脂IgG水平明显高于其他2种脂质IgG水平。结核病患者血清中非极性脂、中间极性脂和极性脂IgG水平高于健康人。
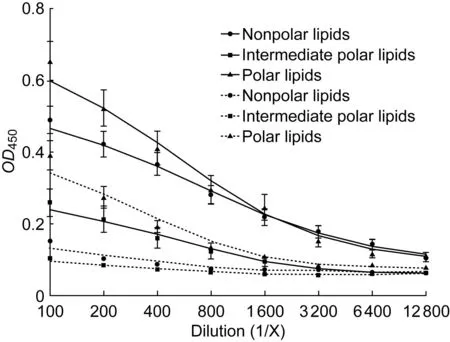
Lipid-specific IgG in sera of twenty-two tuberculosis patients and ten healthy individuals were analyzed by ELISA. Each point represents the average and standard deviation of three independent experiments. The solid line represents sera of tuberculosis patients. The dotted line represents sera of healthy individuals.图2 各脂质组分在人群中的IgG抗体水平Fig.2 Antibody responses to three groups of lipids in human population
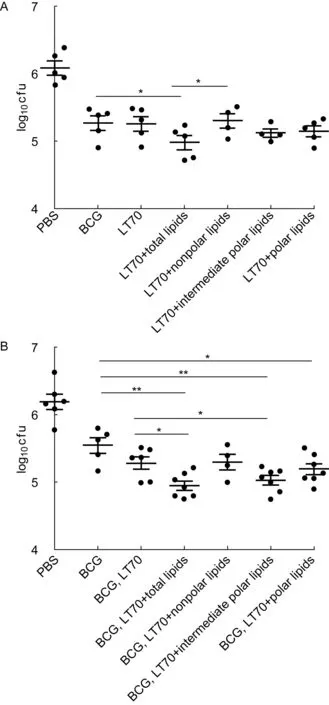
LT70 subunit vaccine was mixed with total lipids, nonpolar lipids, intermediate polar lipids and polar lipids respectively to form subunit vaccines containing different lipids. Mice were immunized three times with subunit vaccines containing different lipids at 0, 3rd, and 6th week (A). Mice were primed by BCG at 0 week and boosted twice with vaccines containing different lipids at 9st and 12th week (B). Five weeks after the last injection, all mice were challenged nasally with 2.5×106 cfu of BCG. Three weeks after infection, cfu in mouse lung were measured. LT70 subunit vaccine was composed of fusion protein ESAT6-Ag85B-MPT64<190-198>-Mtb8.4-Rv2626c. *P﹤0.05, **P﹤0.01.图3 含不同脂质成分亚单位疫苗的保护效应Fig.3 Protective efficacy of subunit vaccine containing different lipids
3.3 保护效率评价
在小鼠模型中评价保护效率。含脂质亚单位疫苗免疫策略组:于BABL/c小鼠腹股沟皮下注射含脂质亚单位疫苗3次,滴鼻感染,感染后3周计数肺部荷菌量。结果显示,LT70-总脂组有较好的保护效率。LT70-总脂组、LT70-中间极性脂组和LT70-非极性脂组小鼠肺部荷菌量(log10cfu)分别为4.98±0.23、5.21±0.12和5.29±0.22。BCG组荷菌量(log10cfu)为5.27±0.23。与BCG组相比,LT70-总脂组肺部荷菌量显著降低(P<0.05);LT70-中间极性脂组肺部荷菌量有所下降,但差异无统计学意义;LT70-非极性脂组肺部荷菌量高于BCG组,但差异无统计学意义(图3A)。
在小鼠BCG初免9周后,用含脂质亚单位疫苗加强免疫2次,滴鼻感染,感染后3周计数肺部荷菌量。结果显示,BCG初免-含脂质亚单位疫苗加强策略组中总脂和中间极性脂显著加强LT70的保护效率。与BCG组荷菌数(log10cfu)5.55±0.25相比,LT70-总脂组、LT70-中间极性脂组和LT70-极性脂组荷菌数均显著下降,分别为4.95±0.18、5.03±0.18和5.19+0.22(P<0.01,P<0.05);与不含脂质的单独LT70疫苗组小鼠肺部荷菌数(log10cfu)5.29±0.23相比,LT70-总脂组和LT70-中间极性脂组具有更高的细菌清除率,差异有统计学意义(P<0.05)。结果表明,脂质组分,尤其是中间极性脂质组分的加入可显著降低小鼠肺部荷菌数,增强LT70的保护性(图3B)。
4讨论
本研究在前期构建的结核分枝杆菌融合蛋白亚单位疫苗LT70的基础上,加入分枝杆菌细胞壁各类脂质组分,构建含脂质的结核亚单位疫苗,检测各类脂质组分在人群中的免疫原性,并用小鼠BCG攻击模型评价疫苗的保护效率。结果显示,在LT70疫苗中加入脂质组分能增加免疫效应和抗结核保护效率,中间极性脂诱导的免疫保护强于其他脂质组分,为进一步研究脂质对疫苗的作用提供参考。
目前,结核疫苗研究的出发点是识别主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ类或Ⅱ类分子呈递的肽类抗原而引发传统的CD4+和CD8+T细胞反应[12]。脂质成分的加入可弥补蛋白疫苗的不足,提高疫苗保护效率。这是因为MHC非依赖途径的非传统T细胞识别非肽类抗原,也参与抗结核免疫反应。此外,与MHC分子相比,CD1分子的多态性非常有限,将CD1限制性脂类抗原作为疫苗能被具有基因多样性的不同人群的免疫细胞识别[13,14]。因此,脂类抗原应与蛋白类抗原联合使用来构建疫苗。
研究表明,通过CD1呈递的分枝杆菌脂质抗原包括分枝菌酸(mycolic acid,MA)、葡萄糖单霉菌酸酯(glucose monomycolate,GMM)、脂阿拉伯甘露聚糖(lipoarabinomannan,LAM)、脂甘露聚糖(lipomannan,LM)、磷脂酰肌醇甘露糖苷(phosphatidylinositol mannoside,PIM)等[6]。单一脂质组分简单,结构明确,但缺乏足够的免疫原性。混合成分的一个明显优势是可激活保护性免疫反应的多个分子,诱导更广泛、更持久的生物活性。因此,本研究构建混合脂质组分疫苗来免疫小鼠,尽可能多地刺激脂质特异性T细胞。
本研究分离了BCG脂类,通过2D-TLC检测并结合文献对总脂和各类脂质组分进行分析[9-11]。非极性脂质组分可能主要为PDIM和三酰甘油;中间极性脂质组分主要是糖脂,在总脂中占比较大,可能包含海藻糖单霉菌酸酯(trehalose monomycolate,TMM)、TDM、GMM、LAM、LM等脂质;极性脂质组分可能是含磷脂类,包含磷脂酰肌醇(phosphatidylinositol,PI)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)、磷脂酰甘油(phosphatidylglycerol,PG)、二磷脂酰甘油(diphosphatidylglycerol,DPG)、PIM等。
将BCG胞壁脂质应用于结核分枝杆菌亚单位疫苗而研究脂质成分保护效率的实验表明,总脂和占总脂比例较大的中间极性脂显著降低小鼠肺荷菌数,增强LT70疫苗的保护性。这与中间极性脂质组分诱导的适应性免疫和天然免疫相关。中间极性脂的可能成分GMM、LAM与LM均可被CD1b限制性 T细胞识别,启动适应性免疫,促进细菌清除[6]。例如,LAM激活的T细胞具有细胞毒作用,并分泌γ干扰素(interferon γ,IFN-γ),被认为是结核保护性免疫中最重要的细胞因子[15]。Toll样受体(Toll-like receptor,TLR)是天然免疫相关分子。体外研究表明,LM通过巨噬细胞表面TLR2活化巨噬细胞,促进巨噬细胞释放Th1型炎症因子白细胞介素12(interleukin 12,IL-12),诱导巨噬细胞凋亡,从而发挥免疫调节作用。PIM2是LM的前体,但没有此作用,两者的差异在于甘露糖核心基团不同,表明糖基对维持LM活性的重要性[16]。中间极性脂富含具有糖基的糖脂,这些脂质成分的共同作用导致总脂和中间极性脂质组分增强LT70疫苗的保护性。Hiromatsu等用H37Ra的脂质疫苗免疫豚鼠后的体外增殖实验和细胞毒性T细胞(cytotoxic T lymphocyte,CTL)实验也获得相似结果,即脾细胞对总脂和糖脂反应强烈,认为这与豚鼠CD1b1和CD1c2分子有关[17]。
非极性脂无论在哪种策略中都没有加强LT70蛋白疫苗的保护性,这可能与其中的PDIM有关。PDIM是分枝杆菌的毒力因子,致病机制还不清楚。有研究表明,PDIM 抑制T 细胞反应,隐藏病原相关分子模式,阻止模式识别受体识别有效分子,诱导趋化因子CCL2释放,招募并感染对分枝杆菌生长有利的巨噬细胞[18,19]。Collins等[20]用澳大利亚帚尾袋貂检测PDIM敲除的牛分枝杆菌免疫保护性,发现缺陷株的保护效果强于野生株。Quintero-Macias等[21]在小鼠体内也获得相同结果,表明PDIM对结核免疫发挥负调节作用。
由于结核分枝杆菌是胞内寄生菌,一般认为细胞免疫在清除结核分枝杆菌的保护性免疫中发挥主要作用,抗体在这一过程中的作用还存在争议。有研究表明,在接种过BCG的健康人和结核病患者体内均可检测到脂质特异性抗体,但这些抗体与清除结核分枝杆菌的保护性免疫没有相关性[22]。本研究发现,保护效应最好的中间极性脂类抗体水平反而最低。
由于BCG与人结核分枝杆菌的脂质大部分相同,所以本研究没有进行H37Rv攻毒实验,而是用BCG攻击评价疫苗保护效率。已有研究表明,BCG攻击模型可区分疫苗诱导的抗结核免疫力的强弱,评价候选疫苗的免疫保护效率[23,24]。当然,BCG攻击也存在缺陷,如无法评价少数具有种属特异性的脂类。脂质组分保护效率最终还需用结核分枝杆菌毒力株攻击模型进行评价,如何应用结核分枝杆菌脂质成分使其发挥最有效的抗结核分枝杆菌作用值得进一步研究。
参考文献
[1]WHO.Global tuberculosis report 2014 [R/OL]. http://www.who.int/tb/publications/global_report/en.
[2]Girard MP, Fruth U, Kieny MP. A review of vaccine research and development: tuberculosis [J]. Vaccine, 2005, 23(50): 5725-5731.
[3]Yamagami H, Matsumoto T, Fujiwara N, Arakawa T, Kaneda K, Yano I, Kobayashi K. Trehalose 6,6′-dimycolate (cord factor) of Mycobacterium tuberculosis induces foreign-body- and hypersensitivity-type granulomas in mice [J]. Infect Immun, 2001, 69(2): 810-815.
[4]Saito R, Tanaka A, Sugiyama K, Azuma I, Yamamura Y. Adjuvant effect of cord factor, a mycobacterial lipid [J]. Infect Immun, 1976, 13(3): 776-781.
[5]van Dissel JT, Joosten SA, Hoff ST, Soonawala D, Prins C, Hokey DA, O’Dee DM, Graves A, Thierry-Carstensen B, Andreasen LV, Ruhwald M, de Visser AW, Agger EM, Ottenhoff TH, Kromann I, Andersen P. A novel liposomal adjuvant system,CAF01,promotes long-lived Mycobacterium tuberculosis-specific T-cell responses in human [J]. Vaccine, 2014, 32(52): 7098-7107.
[6]De Libero G, Mori L. The T-cell response to lipid antigens of Mycobacterium tuberculosis [J]. Front Immunol, 2014, 5: 219.
[7]Montamat-Sicotte DJ, Millington KA, Willcox CR, Hingley-Wilson S, Hackforth S, Innes J, Kon OM, Lammas DA, Minnikin DE, Besra GS, Willcox BE, Lalvani A. A mycolic acid-specific CD1-restricted T cell population contributes to acute and memory immune responses in human tuberculosis infection [J]. J Clin Invest, 2011, 121(6): 2493-2503.
[8]达泽蛟,胡丽娜,王秉翔,姜雯雯,傅林锋,于红娟, 雒或, 祝秉东.二甲基三十六烷基铵及卡介苗多糖核酸佐剂在结核亚单位疫苗加强BCG免疫中的效应研究 [J].中华微生物与免疫学杂志,2010,30(6):555-559.
[9]Dobson G, Minnikin DE, Minnikin SM, Parlett JH, Goodfellow M. Systematic analysis of complex Mycobacterial lipids [M]. In: Goodfellow M, Minnikin DE, eds. Chemical methods in bacterial systematics. London: Academic Prees, 1985 :237-266.
[10]Pirson C, Jones GJ, Steinbach S, Besra GS, Vordermeier HM. Differential effects of Mycobacterium bovis—derived polar and apolar lipid fractions on bovine innate immune cells [J]. Vet Res, 2012, 43: 54.
[11]Rosenkrands I, Agger EM, Olsen AW, Korsholm KS, Andersen CS, Jensen KT, Andersen P. Cationic liposomes containing mycobacterial lipids: a new powerful Th1 adjuvant system [J]. Infect Immun, 2005, 73(9): 5817-5826.
[12]Kaufmann SH, Hussey G, Lambert PH. New vaccines for tuberculosis [J]. Lancet, 2010, 375(9731): 2110-2119.
[13]Brigl M, Brenner MB. CD1: antigen presentation and T cell function [J]. Annu Rev Immunol, 2004, 22: 817-890.
[14]Felio K, Nguyen H, Dascher CC, Choi HJ, Li S, Zimmer MI, Colmone A, Moody DB, Brenner MB, Wang CR. CD1-restricted adaptive immune responses to Mycobacteria in human group 1 CD1 transgenic mice [J]. J Exp Med, 2009, 206(11): 2497-2509.
[15]Sieling PA, Chatterjee D, Porcelli SA, Prigozy TI, Mazzaccaro RJ, Soriano T, Bloom BR, Brenner MB, Kronenberg M, Brennan PJ. CD1-restricted T cell recognition of microbial lipoglycan antigens [J]. Science, 1995, 269(5221): 227-230.
[16]Dao DN, Kremer L, Guérardel Y, Molano A, Jacobs WR Jr, Porcelli SA, Briken V. Mycobacterium tuberculosis lipomannan induces apoptosis and interleukin-12 production in macrophages [J]. Infect Immun, 2004, 72(4): 2067-2074.
[17]Hiromatsu K, Dascher CC, LeClair KP, Sugita M, Furlong ST, Brenner MB, Porcelli SA. Induction of CD1-restricted immune responses in Guinea pigs by immunization with mycobacterial lipid antigens [J]. J Immunol, 2002, 169(1): 330-339.
[18]黄新华,王德成.分枝杆菌细胞壁脂质PDIM致病机制研究进展 [J].科技导报,2012,30(7):63-67.
[19]Cambier CJ, Falkow S, Ramakrishnan L. Host evasion and exploitation schemes of Mycobacterium tuberculosis [J]. Cell, 2014, 159(7): 1497-1509.
[20]Collins DM, de Lisle GW, Aldwell FE, Buddle BM. A new attenuated Mycobacterium bovis vaccine protects brushtail possums (Trichosurus vulpecula) against experimental tuberculosis infection [J]. Vaccine, 2007, 25(24): 4659-4664.
[21]Quintero-Macias L, Santos-Mendoza T, Donis-Maturano L, Silva-Sanchez A, Aguilar D, Orozco H, Gicquel B, Estrada-Garcia I, Flores-Romo L, Hernandez-Pando R. T-cell responses and in vivo cytotoxicity in the target organ and the regional lymphoid tissue during airborne infection with the virulent Mycobacterium tuberculosis MT103 and its lipid mutant fadD26 [J]. Scand J Immunol, 2010, 71(1): 20-28.
[22]Brown RM, Cruz O, Brennan M, Gennaro ML, Schlesinger L, Skeiky YA, Hoft DF. Lipoarabinomannan-reactive human secretory immunoglobulin A responses induced by mucosal bacille Calmette-Guérin vaccination [J]. J Infect Dis, 2003, 187(3): 513-517.
[23]Matsumiya M, Satti I, Chomka A, Harris SA, Stockdale L, Meyer J, Fletcher HA, McShane H. Gene expression and cytokine profile correlate with mycobacterial growth in a human BCG challenge model [J]. J Infect Dis, 2015, 211(9): 1499-1509.
[24]Harris SA, Meyer J, Satti I, Marsay L, Poulton ID, Tanner R, Minassian AM, Fletcher HA, McShane H. Evaluation of a human BCG challenge model to assess antimycobacterial immunity induced by BCG and a candidate tuberculosis vaccine, MVA85A, alone and in combination [J]. J Infect Dis, 2014, 209(8): 1259-1268.
·论著·
Corresponding authors. ZHU Bing-Dong, E-mail: bdzhu@lzu.edu.cn; TAN Ji-Ying, E-mail: tanjy@lzu.edu.cn
Mycobacteriumlipid components enhanced the protective efficacy of tuberculosis subunit vaccine
HE Shan-Shan1,2,HE Juan-Juan1,3,LIU Xun1,3,KONG Xiang-Xi1,2,TAN Ji-Ying1,2,ZHU Bing-Dong1,3
1. Lanzhou Center for Tuberculosis Research & Gansu Provincial Key Laboratory of Evidence-Based Medicine and Clinical Translation, Institute of Pathogenic Biology, Lanzhou University, Lanzhou 730000, China; 2. Institute of Immunology, School of Basic Medical Sciences, Lanzhou University, Lanzhou 730000, China; 3. Institute of Pathogenic Biology, School of Basic Medical Sciences, Lanzhou University, Lanzhou 730000, China
Abstract:Mycobacterium cell wall is rich in lipid components, and some of the lipids may have antigenicity or play an important role in the process of immune regulation. To investigate the effects of the lipids from Mycobacterium cell wall in tuberculosis subunit vaccine, the total lipids were extracted from bacillus Calmette-Guérin (BCG) cell wall and separated by silica column into three different groups: the nonpolar lipids, the intermediate polar lipids and the polar lipids. The lipids were used as the antigen to screen the immune responses in general population. Furthermore, the total lipids and the three groups of lipids were mixed with fusion protein LT70(ESAT6-Ag85B-MPT64<190-198>-Mtb8.4-Rv2626c) in adjuvant of N, N′-dimethyl-N, N′-dioctadecylammonium(DDA) and Poly (I∶C) respectively. The subunit vaccines containing lipids were used to immunize mice and the protective efficacy were evaluated by challenging with BCG. The results showed that the level of lipid-specific IgG in tuberculosis patients was significantly higher than that in healthy people (P<0.05). For the protective efficacy, the number of bacteria harbored in mice immunized with LT70-total lipids significantly declined compared with BCG vaccination (P<0.05). In BCG prime-subunit vaccine boost strategy, LT70-total lipids and LT70-intermediate polar lipids vaccines resulted in significantly low bacterial number than BCG (P<0.01) and LT70 (P<0.05). In conclusion, lipids from Mycobacterium cell wall have high immunogenicity; combination of them, especially the total lipids or intermediate polar lipids, with fusion protein antigen can enhance the antimycobacterial protective efficacy of subunit vaccine.
Key words:Mycobacterium tuberculosis;Subunit vaccine;Bacillus Calmette-Guérin;Cell wall;Lipid
收稿日期:(2015-02-13)
通信作者:祝秉东,谭继英
基金项目:“十二五”国家科技重大专项(2012ZX10003-008-006)
