BDSF抑制临床白假丝酵母菌丝生长的效果分析
2015-02-22徐振华廖勇李梦廖万清翁丽星汪联辉
徐振华,廖勇,李梦,廖万清,翁丽星,4,汪联辉
1. 复旦大学生命科学学院微生物学和微生物工程系,上海 200433; 2. 北京军区总医院皮肤科,北京 100700; 3. 第二军医大学长征医院上海市医学真菌分子生物学重点实验室/全军真菌与真菌病重点实验室,上海 200003; 4. 南京邮电大学地理与生物信息学院,南京 210046; 5. 南京邮电大学信息材料与纳米技术研究院,南京 210046

BDSF抑制临床白假丝酵母菌丝生长的效果分析
徐振华1,廖勇2,李梦3,廖万清3,翁丽星1,4,汪联辉5
1. 复旦大学生命科学学院微生物学和微生物工程系,上海 200433; 2. 北京军区总医院皮肤科,北京 100700; 3. 第二军医大学长征医院上海市医学真菌分子生物学重点实验室/全军真菌与真菌病重点实验室,上海 200003; 4. 南京邮电大学地理与生物信息学院,南京 210046; 5. 南京邮电大学信息材料与纳米技术研究院,南京 210046
摘要:随着现代医学的发展,抗真菌药物广泛应用,白假丝酵母(又称白念珠菌)耐药现象日益严重。由酵母相转变为菌丝相是白念珠菌致病的一个必要过程,抑制菌丝形成可控制其感染。细菌群体感应信号分子BDSF(顺十二碳-2-烯酸)可抑制这一形态的转变,从而抑制白念珠菌的致病力。本研究检测BDSF对60株白念珠菌临床菌株的抑菌丝效果,同时测定这60株临床菌株对氟康唑的敏感度。结果显示,60株临床菌株中8株(13.3%)对氟康唑耐药,最低抑菌浓度(MIC)≥64 μg/ml,而BDSF对耐与不耐氟康唑的临床菌株均能高效抑制菌丝生长。结果表明,BDSF可作为临床治疗白念珠菌感染的新型候选药物,值得进一步研究。
关键词:白假丝酵母;BDSF;氟康唑
假丝酵母(又称念珠菌)是条件致病真菌,一般人可携带但不产生临床症状。在某些情况如抵抗力降低时,机体菌群可能失调,引起念珠菌大量繁殖而致病。1980年以前,由于真菌感染率较低,抗真菌药物的临床应用较少,所以罕见真菌耐药。随着现代医学的发展,细胞毒性药物、广谱抗生素及免疫抑制剂广泛使用,器官及骨髓移植不断开展,恶性肿瘤和免疫缺陷患者普遍增多,带有插管或导管的先进医疗手段逐渐应用,真菌感染的发生率越来越高[1-3]。20世纪80年代初,酮康唑开始应用于临床,不久就有念珠菌感染患者出现耐药情况的报道[1]。随后,氟康唑由于其广谱、强效、不良反应少等优势很快取代了酮康唑,广泛应用于多种深部真菌感染治疗,但很快出现了大量耐药菌株。有研究显示,念珠菌对氟康唑敏感性下降,最低抑菌浓度(minimum inhibitory concentration,MIC)≥16 μg/ml的菌株所占比例由1991~1996年的10.7%升高至1997~2003年的11.7%[4]。至2014年,白念珠菌(Candidaalbicans,C.albicans)感染病例中,20%~30%对氟康唑产生耐药性[5]。白念珠菌为真核生物,其生物化学代谢途径与人类宿主细胞有很高的相似性,因此很多抗生素在抗菌的同时也影响或毒害宿主细胞。近年来,随着越来越多耐药菌株的出现,系统性真菌感染的发生率不断上升,且治疗效果不佳。常用抗生素不仅存在较大的毒副作用,长期使用还有增加菌株耐药性的问题。目前,白念珠菌的耐药现象日益增多,尤其是白念珠菌对唑类药物的耐药更为严重,成为临床治疗的一大难题。
白念珠菌能以酵母(yeast)、假菌丝(pseudohypha)和菌丝(hypha)3种形态存在,并在单细胞酵母相与菌丝相(菌丝或假菌丝)之间转换。酵母态细胞为寄居状态,而菌丝态细胞易附着和侵入宿主组织,逃避人体免疫系统的攻击,更具有致病性。酵母相转为菌丝相是白念珠菌的致病标志,因此需寻找新的治疗真菌的药物,以期找到能有效治疗念珠菌感染的方法。BDSF是一种由洋葱伯克霍尔德菌(Burkholderiacenocepacia)分泌产生的小分子短链脂肪酸。汪联辉等于2008年以酵母相为起点,研究BDSF对白念珠菌菌丝生长的影响,证明其能调控白念珠菌的形态转变。周阿峰等发现,BDSF不仅强烈抑制菌丝生长,还可促使新生的菌丝相向酵母相转化[6-8]。Zhang等也研究证明,在生物膜形成早期,顺式BDSF和反式BDSF能明显抑制白念珠菌生物膜的形成[9]。菌丝形成是白念珠菌致病的关键因素之一,抑制菌丝形成可大大减弱白念珠菌的致病力,因此BDSF有潜在的抑菌作用。此外,BDSF是一种信号分子,只抑制白念珠菌由酵母相向菌丝相转换,并不影响白念珠菌的生长,没有选择压力,不会导致白念珠菌对其产生耐药性。因此,若BDSF能抑制临床白念珠菌菌丝生长,使其保留在酵母状态而不致病,利用免疫系统将其消灭,必将为临床治疗白念珠菌感染提供帮助。本研究检测了BDSF对60株临床分离白念珠菌菌丝的抑制效果,同时测定这60株菌株对氟康唑的耐药性,发现BDSF对临床菌株包括耐药菌均有抑制作用。
1材料与方法
1.1 材料
白念珠菌标准菌株SC5314和60株临床菌株均来自第二军医大学附属长征医院。各菌株以20%甘油培养基保种并保存于-80 ℃低温冰箱中。BDSF为本实验室保存的合成小分子。
1.2 方法
1.2.1菌株活化配制沙氏葡萄糖琼脂培养基:SDA培养基1 L、蛋白胨10 g、葡萄糖40 g,加入去离子水1 L,搅拌溶解后调节pH=7,加入20 g琼脂,121 ℃高压蒸汽灭菌20 min,使用前加入终浓度为100 μg/ml的氯霉素。各菌株从-80 ℃冷冻冰箱里取出,接种活化,在超净台内划线分离并用封口条密封,置30 ℃培养箱内培养48 h,活化后菌株置于4 ℃保存,不超过1周。
1.2.2测定BDSF对白念珠菌SC5314菌丝生长的MIC配制3-(N-吗啡啉)丙磺酸(3-(N-morpholino)propanesulfonic acid,MOPS)+1640培养基:在 RPMI 1640培养基中,加入终浓度为0.165 mol/L的MOPS,用0.22 μm滤膜过滤除菌。配制不同浓度BDSF,用于测定其对白念珠菌菌丝的MIC:BDSF以MOPS+1640培养基倍比稀释,使最终加入96孔板的浓度为64、32、16、8、4、2、1、0、0.5、0.25、0.125 μmol/L。检测不同浓度BDSF对菌丝生长的抑制效果,绘图分析。配制菌悬液:于1.5 ml Eppendorf管中加入1 ml MOPS+1640培养基,挑取已培养好的SC5314单菌落3~5个,吹打均匀。用毛细管取样滴入计数板,在显微镜下观察、计数。控制菌悬液密度为106个/ml(接近107个/ml)。转移至96孔板培养:取90 μl不同浓度的BDSF和10 μl 菌悬液置96孔板,共10组。空白对照组中加入90 μl MOPS+1640培养基和10 μl 菌悬液,于37 ℃ 120 r/min摇床培养3 h。用显微镜观察、拍照,记录每组菌丝生长率,绘制BDSF抑制菌丝生长率曲线。以上步骤重复3次以确定MIC。
1.2.3氟康唑药敏试验采用美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)M27-A2中的微量肉汤稀释法进行氟康唑药敏试验。用标准菌株SC5314绘制标准曲线,测定菌悬液光密度(optical density,OD)与细菌密度的关系。测定其他菌株的OD值,使菌株密度保持在1×106个/ml~5×106个/ml,然后用MOPS+1640培养基稀释制成所需接种体。设置2组对照,即阴性对照(MOPS+1640培养基)和阳性对照﹝不加抗真菌药物,用无菌水或二甲基亚砜(dimethyl sulfoxide,DMSO)代替﹞。其余各孔加入0.1 ml不同菌株及0.1 ml不同浓度抗真菌药物,每种菌株针对不同浓度的药物进行2组平行实验。接种后,35 ℃培养46~50 h。肉眼观察各孔的浑浊度,同时用酶标仪测定OD530来验证MIC。M27-A2中关于肉眼观察MIC有如下规定:将阳性对照记为5,阴性对照记为0,根据不同浑浊度细分为1~4。0代表清澈,1为稍有浑浊,2为浑浊度显著降低(用分光光度计测量浊度减少50%),3为浑浊度轻微降低,4代表浊度没有降低。氟康唑的MIC指使浊度达到2的最低药物浓度。
1.2.4BDSF抑制白念珠菌临床菌株的实验 于1.5 ml Eppendorf管中加入1 ml MOPS+1640培养基,挑取已培养好的白念珠菌临床菌株单菌落3~5个,吹打均匀。用毛细管取样滴入计数板,在显微镜下观察、计数。控制菌悬液密度为106个/ml(接近107个/ml)。取90 μl不同浓度BDSF和10 μl 菌悬液置96孔板,共10组。另设空白对照:90 μl MOPS+1640培养基和10 μl菌悬液。每组做平行实验。96孔板封口后,37 ℃ 120 r/min摇床培养3 h。用显微镜观察、拍照,记录每组菌丝生长率。以上步骤重复3次以确定BDSF抑制菌丝生长的效果。
2结果
2.1 BDSF对白念珠菌SC5314菌丝生长的MIC
BDSF对白念珠菌SC5314菌丝生长的MIC为4 μmol/L,抑制菌丝生长率达91.35%(图1)。
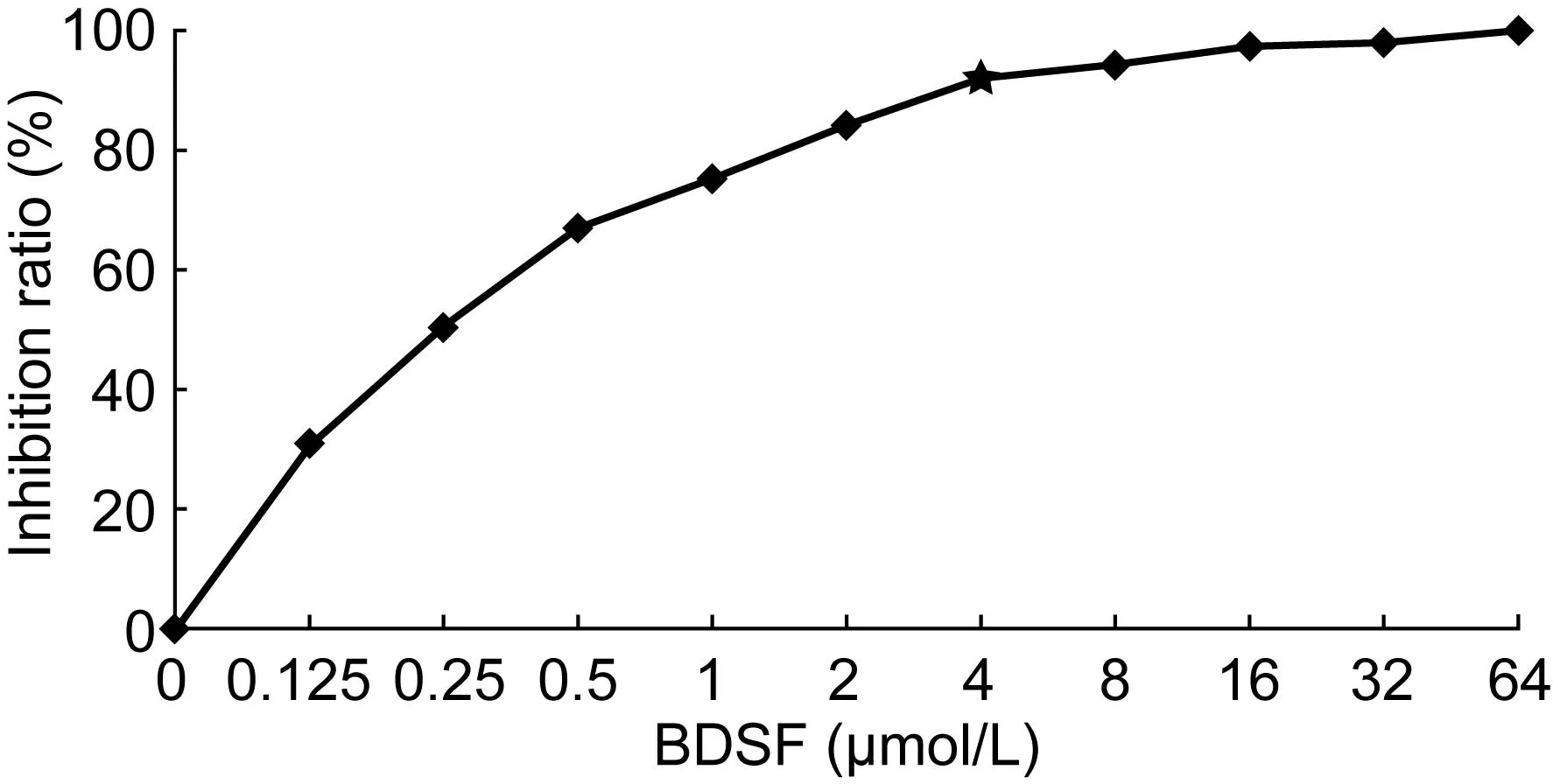
BDSF at 4 μmol/L reached an inhibition ratio of 90%. Higher concentration got stronger inhibitory effect. BDSF at 64 μmol/L could get an inhibition ratio of 100%. The MIC of BDSF was 4 μmol/L, shown by a star in the figure.图1 BDSF抑制 SC5314菌丝生长的浓度曲线Fig.1 The inhibitory effect of BDSF on mycelium growth of SC5314
2.2 白念珠菌临床菌株对氟康唑的耐药率
测量MIC是检验白念珠菌耐药性的方法之一。根据CLSI微量肉汤稀释法,在不搅动的情况下与对照孔比较,氟康唑的MIC为小孔内抑制白念珠菌生长50%的浓度。检测氟康唑对60株白念珠菌的MIC,结果显示8株(13.3%)对氟康唑耐受(MIC≥64 μg/ml)。为保证结果的准确性,用E-TEST试剂条法检测微量肉汤稀释法检出的耐药菌株,2种方法检测结果基本一致。
2.3 BDSF抑制白念珠菌临床菌株的实验结果
当BDSF为4 μmol/L时,菌丝生长抑制率>90%的临床菌株占80%,其余20%在BDSF为40 μmol/L时抑制率>90%(图2)。
2.4 氟康唑药敏试验及BDSF对白念珠菌临床耐药菌株的作用
BDSF为4 μmol/L时,对8株临床耐药菌株的抑制效果较好,40 μmol/L时可完全抑制菌丝生长(图2)。
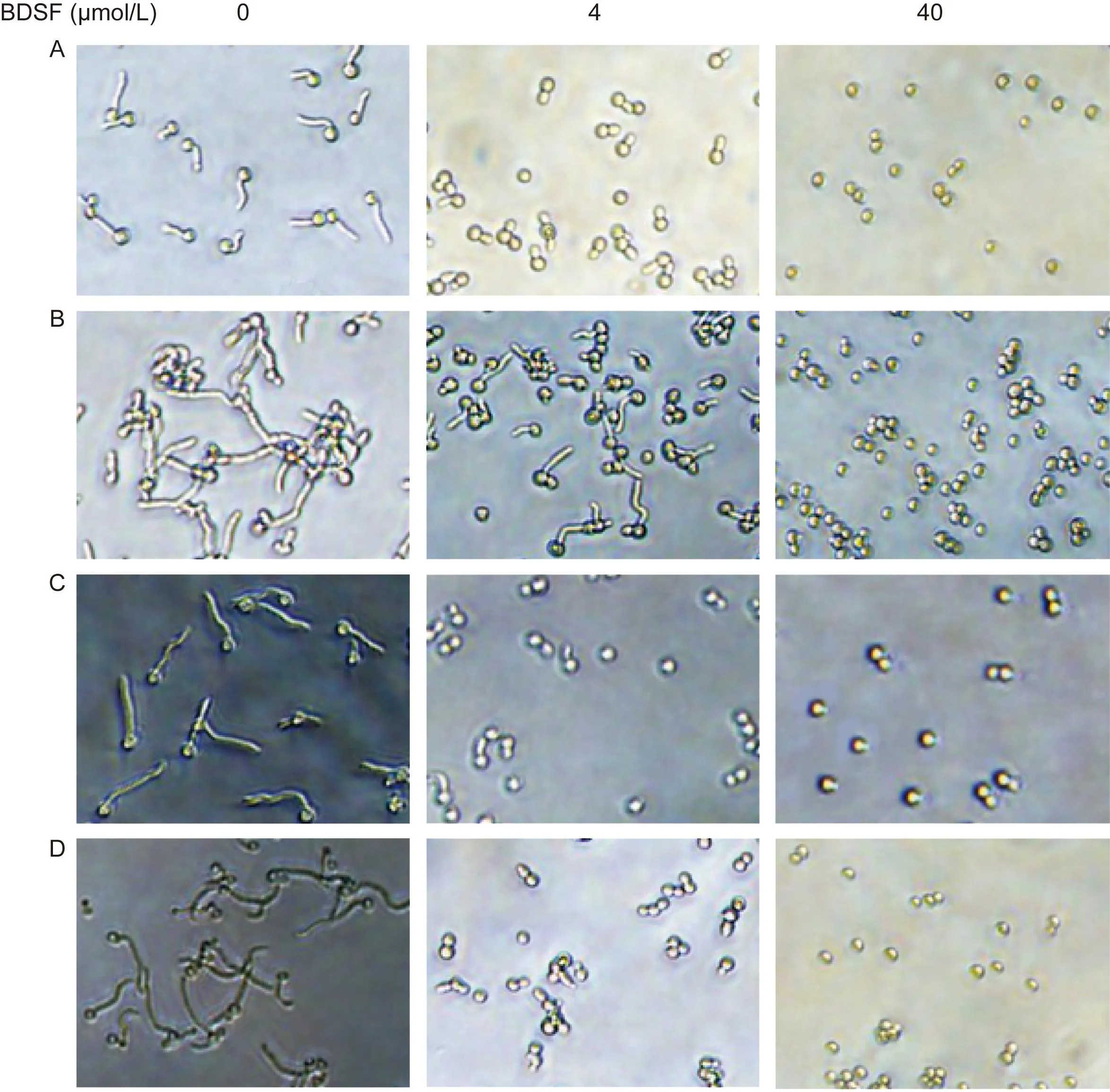
A and B: Fluconazole-sensitive strains. For A, the inhibitory effect was strong at the concentration of 4 μmol/L, and the inhibition ratio reached 100% when the concentration was 40 μmol/L. For B, the inhibition ratio only reached 90% at the concentration of 40 μmol/L. C and D: Fluconazole-resistant strains. The inhibitory effects were strong for both of them when the concentration of BDSF was 4 μmol/L while the growth of mycelium was completely inhibited at the concentration of 40 μmol/L.图2 BDSF对临床白念珠菌菌丝生长的抑制Fig.2 The inhibitory effect of BDSF on mycelium growth of clinical C. albicans strains
3讨论
真菌感染主要为念珠菌感染,其中又以白念珠菌感染最多,占53%~68%。随着唑类药物在临床中的应用越来越普及,对多种唑类耐药的真菌越来越多。有研究证明,对唑类耐药且细胞内固醇类含量降低的真菌也对两性霉素B耐药[10-14],已成为临床治疗的一大难题。中国台湾地区报道侵袭性念珠菌分离株对氟康唑的敏感度为91%~96%[15],西班牙研究显示为91.9%[16],而一项欧洲报道仅为85.3%[17]。本研究中,60株临床念珠菌中有8株对氟康唑耐药,耐药率为13.3%,与上述报道基本一致。但BDSF可有效抑制这些耐药菌的菌丝生长,这为临床治疗严重念珠菌感染提供了新的方法,具有潜在开发价值。
常规抗生素均以微生物的蛋白质合成、核酸合成和细胞壁合成等重要生命代谢过程为靶点,抑制或直接杀死微生物。在这种生存压力的选择下,病原微生物逐渐产生耐药性。近年来,白念珠菌耐药率不断增加导致了顽固的慢性炎症疾病,临床治疗极其困难。BDSF阻止白念珠菌的形态转变意味着可抑制病原菌的致病性,虽然不杀灭病原菌但降低了其毒害,从而让机体免疫系统发挥最大的保护功能。因此,与传统抗生素不同,BDSF这类抑制病原菌致病性的候选药物具有防治慢性感染的优势。
相对于单一药物治疗,联合用药具有更大的药物效力,还能提高用药的安全性和耐受性并减少耐药菌数量,被认为是一种有效抑制真菌耐药性的方法。目前研究显示,联合应用非抗真菌药物与抗真菌药物显示出良好的协同作用,可治疗临床耐药菌株感染。BDSF是一种信号分子,不抑制病原菌的生长,无选择压力,属非抗生素药物。与唑类抗生素相比,其对白念珠菌的作用位点不同,可能具有不同的作用机制。针对生物膜介导的白念珠菌耐药,Zhang等发现BDSF通过抑制菌丝生长破坏生物膜的完整性和稳定性,从而明显破坏白念珠菌生物膜的早期形成[9],也能在一定程度上解决耐药性问题,同时有利于机体免疫系统对病原菌的清除。BDSF不能杀死白念珠菌,不能完全代替传统抗生素,因此BDSF与传统抗生素联用是一种有效解决病原菌耐药性并增强抗菌效果的策略。可尝试低剂量抗生素与BDSF联用,这样病原菌既不产生耐药性又能被消灭,是防治白念珠菌慢性感染的理想方法,值得深入开发和利用。
参考文献
[1]Onyewu C, Blankenship JR, Del Poeta M, Heitman J. Ergosterol biosynthesis inhibitors become fungicidal when combined with calcineurin inhibitors against Candida albicans, Candida glabrata, and Candida krusei [J]. Antimicrob Agents Chemother, 2003, 47(3): 956-964.
[2]Georgopapadakou NH. Antifungals: mechanism of action and resistance, established and novel drugs [J]. Curr Opin Microbiol, 1998, 1(5): 547-557.
[3]Wroblewska MM, Swoboda-Kopec E, Rokosz A, Krawczyk E, Marchel H, Luczak M. Epidemiology of clinical isolates of Candida albicans and their susceptibility to triazoles [J]. Int J Antimicrob Agents, 2002, 20(6): 472-475.
[4]Sandven P, Bevanger L, Digranes A, Haukland HH, Mannsåker T, Gaustad P; Norwegian Yeast Study Group. Candidemia in Norway (1991 to 2003): results from a nationwide study [J]. J Clin Microbiol, 2006, 44(6): 1977-1981.
[5]Arendrup MC. Update on antifungal resistance in Aspergillus and Candida [J]. Clin Microbiol Infect, 2014, 20(Suppl 6): 42-48.
[6]Wang LH, He Y, Gao Y, Wu JE, Dong YH, He C, Wang SX, Weng LX, Xu JL, Tay L, Fang RX, Zhang LH. A bacterial cell-cell communication signal with cross-kingdom structural analogues [J]. Mol Microbiol, 2004, 51(3): 903-912.
[7]周阿峰,汪联辉,翁丽星.BDSF对白假丝酵母体外作用的研究[J].微生物与感染,2012,7(1):44-49.
[8]Boon C, Deng Y, Wang LH, He Y, Xu JL, Fan Y, Pan SQ, Zhang LH. A novel DSF-like signal from Burkholderia cenocepacia interferes with Candida albicans morphological transition [J]. ISME J, 2008, 2(1): 27-36.
[9]Zhang Y, Cai C, Yang Y, Weng L, Wang L. Blocking of Candida albicans biofilm formation by cis-2-dodecenoic acid and trans-2-dodecenoic acid [J]. J Med Microbiol, 2011, 60(Pt 11): 1643-1650.
[10]Kelly SL, Lamb DC, Kelly DE, Manning NJ, Loeffler J, Hebart H, Schumacher U, Einsele H. Resistance to fluconazole and cross-resistance to amphotericin B in Candida albicans from AIDS patients caused by defective sterol delta5,6-desaturation [J]. FEBS Lett, 1997, 400(1): 80-82.
[11]Miyazaki H, Miyazaki Y, Geber A, Parkinson T, Hitchcock C, Falconer DJ, Ward DJ, Marsden K, Bennett JE. Fluconazole resistance associated with drug efflux and increased transcription of a drug transporter gene, PDH1, in Candida glabrata [J]. Antimicrob Agents Chemother, 1998, 42(7): 1695-1701.
[12]Johnson E, Espinel-Ingroff A, Szekely A, Hockey H, Troke P. Activity of voriconazole, itraconazole, fluconazole and amphotericin B in vitro against 1 763 yeasts from 472 patients in the voriconazole phase III clinical studies [J]. Int J Antimicrob Agents, 2008, 32(6): 511-514.
[13]Müller FM, Weig M, Peter J, Walsh TJ. Azole cross-resistance to ketoconazole, fluconazole, itraconazole and voriconazole in clinical Candida albicans isolates from HIV-infected children with oropharyngeal candidosis [J]. J Antimicrob Chemother, 2000, 46(2): 338-340.
[14]Wirsching S, Michel S, Morschhäuser J. Targeted gene disruption in Candida albicans wild-type strains: the role of the MDR1 gene in fluconazole resistance of clinical Candida albicans isolates [J]. Mol Microbiol, 2000, 36(4): 856-865.
[15]Ruan SY, Hsueh PR. Invasive candidiasis: an overview from Taiwan [J]. J Formos Med Assoc, 2009, 108(6): 443-451.
[16]Pemán J1, Cantón E, Quindós G, Eraso E, Alcoba J, Guinea J, Merino P, Ruiz-Pérez-de-Pipaon MT, Pérez-del-Molino L, Linares-Sicilia MJ, Marco F, García J, Roselló EM, Gómez-G-de-la-Pedrosa E, Borrell N, Porras A, Yagüe G; FUNGEMYCA Study Group.Epidemiology,species distribution and in vitro antifungal susceptibility of fungaemia in a Spanish multicentre prospective survey [J]. J Antimicrob Chemother, 2012, 67(5): 1181-1187.
[17]Schmalreck AF, Willinger B, Haase G, Blum G, Lass-Flörl C, Fegeler W, Becker K; Antifungal Susceptibility Testing-AFST Study Group. Species and susceptibility distribution of 1 062 clinical yeast isolates to azoles, echinocandins, flucytosine and amphotericin B from a multi-centre study [J]. Mycoses, 2012, 55(3): e124-e137.
·综述·
Corresponding author. WENG Li-Xing, E-mail: wenglixing@fudan.edu.cn
Inhibitory effect of BDSF on hyphal growth of clinicalCandidaalbicans
XU Zhen-Hua1, LIAO Yong2, LI Meng3, LIAO Wan-Qing3, WENG Li-Xing1,4, WANG Lian-Hui5
1.Department of Microbiology and Microbial Engineering, School of Life Sciences, Fudan University, Shanghai 200433, China; 2. Department of Dermatology, General Hospital of Beijing Military Command, Beijing 100700, China; 3. Shanghai Key Laboratory of Molecular Mycology & PLA Key Laboratory of Fungal Diseases, Changzheng Hospital, The Second Military Medical University, Shanghai 200003, China; 4. College of Geography and Biological Information, Nanjing University of Posts and Telecommunications, Nanjing 210046, China; 5. Institute of Advanced Materials, Nanjing University of Posts and Telecommunications, Nanjing 210046, China
Abstract:The drug resistance of Candida albicans (C. albicans), resulted from gradual application of advanced medical treatments and the widespread use of antifungals, has become a severe problem in clinic. C. albicans is one of the major opportunistic human fungal pathogens. The transition from yeast to hypha is a necessary process in its pathogenic activity, and inhibiting the hypha formation can decrease its infective ability. Quorum sensing signal BDSF (short-chain fatty acid) from Burkholderiacenocepacia can inhibit the yeast-to-hypha transition and hinder the virulence of C. albicans. The drug susceptibility of 60 C. albicans clinical isolates to fluconazole and BDSF were determined respectively. The results showed there were 8 strains (13.3%) resistant to fluconazole, with the minimum inhibitory concentration (MIC) ≥64 μg/ml, but BDSF showed efficiently inhibitory effect on all the clinical isolates no matter the isolates were resistant to fluconazole or not. The results suggest that BDSF might be a new clinical option to treat C. albicans infection.
Key words:Candida albicans;BDSF;Fluconazole
收稿日期:(2014-12-05)
通信作者:翁丽星
基金项目:国家自然科学基金(81273409)
