结核分枝杆菌Rv3872与Rv3873基因的克隆及重组真核表达载体的构建
2017-05-12李双双李木楠关松磊张文慧张林波
李双双+李木楠+关松磊+张文慧+张林波


摘 要:目的:克隆结核分枝杆菌Rv3872与Rv3873基因,并构建Rv3872与Rv3873基因的重组真核表达载体,为研究这2个基因的功能奠定实验基础。方法:利用PCR技术克隆Rv3872与Rv3873基因序列,将其连接至pMD-18T载体,鉴定成功后将Rv3872与Rv3873序列插入真核表达载体pEGFP-C1,构建重组pEGFP-C1-Rv3872和pEGFP-C1-Rv3873真核表达载体,并进行质粒PCR、双酶切以及测序验证。结果:经测序比对后,Rv3872与Rv3873序列与GeneBank中公布的基因序列一致,重组载体构建成功。结论:成功构建重组pEGFP-C1-Rv3872和pEGFP-C1-Rv3873真核表达载体。
关键词:结核分枝杆菌;Rv3872;Rv3873;真核载体
中图分类号 R446 文献标识码 A 文章编号 1007-7731(2017)08-0012-04
Abstract:Objective:Cloning of Mycobacterium tuberculosis Rv3872 and Rv3873 gene and constructing recombinant eukaryotic expression vector of Rv3872 and Rv3873 gene.Methods:The whole gene of Rv3872 and Rv3873 sequence were cloned by PCR,and then the gene were inserted into the pMD-18T,then inserted it into the pEGFP-C1 after successful validation,constructing the recombinant eukaryotic expression vectors of pEGFP-C1-Rv3872 and pEGFP-C1-Rv3873,and then the plasmid was validated by PCR and double enzyme digestion and sequencing.Resluts:Rv3872 and Rv3873 were consistent with the gene sequences published in GeneBank after sequencing,and the recombinant vector was successfully constructed.Conclusion:The recombinant eukaryotic expression vectors pEGFP-C1-Rv3872 and pEGFP-C1-Rv3873 were successfully constructed.
Key words:Mycobacterium tuberculosis;Rv3872;Rv3873;Eukaryotic vector
結核病(Tuberculosis)是一种因感染结核分枝杆菌(Mycobacterium tuberculosis,MTB)而引发的人畜共患传染性疾病。2015年全世界新发结核病数量约为1 040万例,据估计有140万人死于结核病,还有40万艾滋病毒感染者死于结核病[1]。结核分枝杆菌侵入机体后,主要由肺泡巨噬细胞吞噬、消化和摧毁,但结核分枝杆菌仍可以在这种恶劣的环境下生存和复制,其根本原因在于MTB可以调控宿主免疫、干扰细胞凋亡机制,抵御机体对病原菌的清除,进而在体内复制和传播。通过DNA微阵列分析发现,弱毒性结核分枝杆菌与致病性结核分枝杆菌相比存在11个差异区(region of difference,RDs),与牛结核分枝杆菌相比存在16个RD区。RD1区是近年来人们研究的热点,由RD1区分泌的蛋白有望成为结核病潜在的候选疫苗及诊断工具。Rv3872和Rv3873分别是PE和PPE家族成员,研究表明Rv3872与Rv3873编码的PE35蛋白与PPE68蛋白在结核杆菌与巨噬细胞作用过程中发挥重要作用,能够影响宿主细胞的功能[2,3],但目前的研究尚不能完全阐述作用机制。本研究通过分子生物学手段,克隆Rv3872与Rv3873基因并构建重组真核表达载体,为下一步研究Rv3872和Rv3873在胞内的作用机制奠定基础。
1 材料与方法
1.1 质粒和主要试剂 真核表达载体pEGFP-C1载体由厦门大学馈赠。限制性内切酶KpnI、BamHI、E×Taq酶、T4 DNA ligase、10 X T4 DNA Ligase buffer、DL 2000 DNA Marker、DL 5000 DNA Marker(TaKaRa);质粒提取试剂盒(Gene Mark);AxyPrep DNA凝胶回收试剂盒 (Axygen公司)、PCR产物纯化试剂盒(Sangon Bitech)、pMD-18T载体(TaKaRa)。
1.2 方法
1.2.1 Rv3872、Rv3873基因的PCR扩增 根据Genbank中公布的Rv3872、Rv3873基因序列用Prime5.0进行引物设计,引物序列分别为P1 :5′-ATGACAGAGCAGCAGTGGA-3′、P2:5′-CTATGCGAACATCCCAGT-3′、P3:5′-ATGCTGTGGACAGCAA-3′、P4:5′-ATGCTGTGGACAGCAA-3′,设计完成后送至上海生工生物工程有限公司合成。以人型H37Rv全基因组为模板,以P1与P2、P3与P4为引物扩增Rv3872、Rv3873基因,退火温度为63.5℃、69℃,扩增体系为P1/P2、P3/P4各1μL,ExTaq mix 12.5μL,H37Rv全基因组1μL,ddH2O 9.5μL,PCR反应参数为:95℃预变性3min,95℃变性30s,53℃复性30s,72℃延伸1min,共30个循环,最后72℃再延伸l0min,4℃保温l0min。反应结束后,制备1%琼脂糖凝胶,130V,电泳25min。
1.2.2 重组pMD-18T-Rv3872、pMD-18T-Rv3873载体的构建及验证 使用AxyPrep DNA凝胶回收试剂盒回收PCR产物,将回收的PCR产物与pMD-18T连接,连接体系为T4 DNA ligase(350U/μL)1μL、10XT4 DNA Ligase buffer 1μL、pMD-18T3μL、回收目的基因5μL,金屬浴16℃过夜连接,16h。将重组质粒转化E.coli DH5a,转化后将菌液涂布与含有氨苄抗性的LB固培养基,37℃培养过夜,挑取阳性单菌落置于含氨苄抗生素的LB液体培养基内,振荡过夜。提取重组质粒,并进行重组质粒PCR及双酶切验证,验证成功后送至上海生工测序。
1.2.3 重组pEGFP-C1-Rv3872和pEGFP-C1-Rv3873真核表达载体的构建及鉴定 根据pEGFP-C1的载体图谱,在目的基因上下游引物的5′端引入KpnⅠ和BamHⅠ,并加入与之相对应的保护性碱基,具体引物序列设计为:P5:5′-CGGGGTACCATGGAAAAAATGTCACA-3′、P6:5′-CGCGGATCCCTATTCGGCGAAGACG、P7:5′-CGGGGTACCATGCTGTGGACAGCAA-3′、P8:5′-CGCGGATCCTCACCAGTCGTCCTCTTCG-3′,以测序成功的pMD-18T重组质粒为模板,用带酶切位点的引物进行PCR扩增。PCR扩增反应体系和反应条件同前,分别以P5与P6、P7与P8为引物扩增Rv3872和Rv3873基因,反应完成后,用SanPrep柱式PCR产物纯化试剂盒对目的条带产物进行回收。对回收纯化的PCR产物与pEGFP-C1载体分别用KpnI、BamHI双酶切,纯化回收。纯化回收的基因与载体酶切产物连接,连接体系为T4 DNA ligase(350U/μL) 1μL、10XT4 DNA Ligase buffer 1μL、pEGFP-C1 3μL、回收目的基因5μL,金属浴16℃过夜连接,16h。将重组质粒转化E.coli DH5a,转化后将菌液涂布与含有氨苄抗性的LB固培养基,37℃培养过夜,挑取阳性单菌落置于含氨苄抗生素的LB液体培养基内,振荡过夜。提取重组质粒,并进行重组质粒PCR及双酶切验证,验证成功后送至上海生工测序。
2 结果与分析
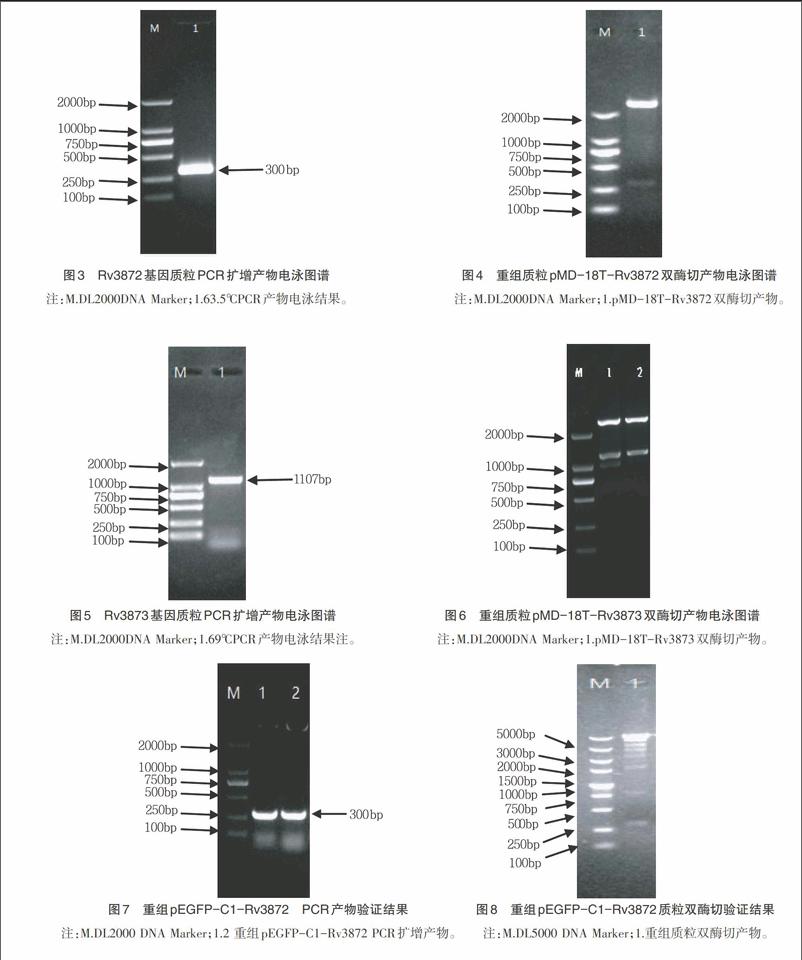
2.1 Rv3872、Rv3873基因的PCR扩增结果 经PCR扩增得到Rv3872、Rv3873基因,其片段长度分别为300bp、1 107bp左右,目的基因产物条带清晰,条带位置与预期位置相一致(图1、2)。
2.2 重组pMD-18T-Rv3872、pMD-18T-Rv3873载体的构建及验证结果 对构建的重组pMD-18T-Rv3872、pMD-18T-Rv3873载体进行质粒PCR验证和双酶切验证,结果表明质粒PCR成功获得长度分别为300bp、1107bp左右的片段,双酶切产物有两个条带,与预期结果一致(图3、4、5、6)。
2.3 重组pEGFP-C1-Rv3872和pEGFP-C1-Rv3873真核表达载体的鉴定 利用质粒提取试剂盒提取重组质粒,将重组质粒用KpnⅠ和BamHⅠ进行质粒PCR及双酶切验证,发现与目的基因大小相一致,且条带单一无杂带,重组真核表达载体验证成功后将其送至上海生工进行测序。对测序结果与Genbank中Rv3872、Rv3873公布的序列进行对比,经DNAMAN Version5.2.2分析显示,二者氨基酸序列同源性均为100%,说明重组pEGFP-C1-Rv3872、pEGFP-C1-Rv3873和pEGFP-C1-Rv3878真核表达载体构建成功(图7、8、9、10)。
3 讨论
作为结核病的病原体,结核杆菌H37Rv全基因组共4 411 529bp,包括4 047个基因,其中4 018个为蛋白编码基因[4]。MTB蛋白广泛参与宿主细胞周期调控、各种代谢途径、细胞运动与胞内运输、RNA加工与转录后修饰、防御机制与信号转导机制、影响细胞结构以及逃逸宿主免疫杀伤,此外还有一些未知的功能有待进一步研究[5,6]。
PE/PPE蛋白家族有多个成员涉及宿主免疫逃避[7-9]。其中PE35和PPE68分泌或与分枝杆菌细胞膜相关,参与介导宿主与病原体之间的相互作用[10,11]。有研究证明PE35和PPE68与分枝杆菌感染的细胞免疫应答相关[12,13]。PE35和PPE68依赖TLR2受体诱导THP-1巨噬细胞分泌IL-10和MCP-1并且降低IL-12p70的分泌,抵御宿主的清除[14-16]。pEGFP-C1载体为目前常用的真核细胞表达载体,含有PUC和SV40双启动子以及多克隆位点,保证外源基因能够在大肠杆菌与哺乳动物细胞内复制。pEGFP-C1载体上含有EGFP绿色荧光蛋白,其为GFP的突变体,其荧光强度为GFP的35倍,有利于外源基因在细胞内的定位标记[17]。
作为MTB潜在的毒力因子,MTB感染宿主细胞后,PE35与PPE68胞内具体如何作用,目前尚不明确。为研究PE35与PPE68在宿主内的作用方式,本实验通过基因工程技术构建pEGFP-C1-Rv3872、pEGFP-C1-Rv3873重组真核表达载体,经质粒PCR及质粒双酶切验证,DNA测序比对,与GenBank上公布的基因序列完全相同,载体构建成功,为进一步研究PE35、PPE68与宿主细胞的作用机制奠定基础。
参考文献
[1]Organization W H.ZH TB:Global Report[EB/OL].http://apps.who.int/tb/publications/global_report/zh/index.html.2016.
[2]Etna M P,Giacomini E,Pardini M,et al.Impact of Mycobacterium tuberculosis RD1-locus on human primary dendritic cell immune functions[J].Scientific Reports,2015,5:17078.
[3]Augenstreich J,Arbues A,Simeone R,et al.ESX-1 and phthiocerol dimycocerosates of Mycobacterium tuberculosis act in concert to cause phagosomal rupture and host cell apoptosis[J].Cellular Microbiology,2017.
[4]Jocelyne M.Lew,Adamandia Kapopoulou,Louis M.Jones,et al.TubercuList-10 years after[J].Tuberculosis,2011,91(1):1-7.
[5]吳雪琼,吴长有.结核病免疫学[M].北京:人民卫生出版社,2016.
[6]Anand P,Sankaran S,Mukherjee S,et al.Structural Annotation of Mycobacterium tuberculosis Proteome[J].Microbiology Spectrum,2014,2(2):1551-1564.
[7]Liu Z,Shuang Q,Li L,et al.Identification of Novel RD1 Antigens and Their Combinations for Diagnosis of Sputum Smear?/Culture+ TB Patients[J].Biomed Research International,2016,2016(1):1-10.
[8]Ganguly P,Sharma S,Sharma P,et al.RD-1 Region of Mycobacterium tuberculosis:Protein Secretion and Virulence[J].Research Gate,2015,2:78-83.
[9]Sharifipour E,Nasiri M J,Farnia P,et al.Evaluation of molecular diversity of Mycobacterium tuberculosis strains by polymorphisms in RD regions[J].Mycobacterial Diseases,2014.
[10]王辉.分枝杆菌PPE38蛋白与宿主相互作用机制的研究[D].上海:复旦大学,2014.
[11]邓万燕.结核分枝杆菌PE/PPE家族蛋白的性质及其在与宿主细胞相互作用中的功能[D].重庆:西南大学,2015.
[12]彭哲.结核分枝杆菌RD1区研究进展[J].重庆医学,2011,40(1):89-91.
[13]Jiang Y,Wei J,Liu H,et al.Polymorphisms in the PE35 and PPE68 antigens in Mycobacterium tuberculosis strains may affect strain virulence and reflect ongoing immune evasion[J].Molecular Medicine Reports,2016,13(1):947.
[14]Tiwari B,Soory A,Raghunand T R.An immunomodulatory role for the Mycobacterium tuberculosis,region of difference 1 locus proteins PE35(Rv3872)and PPE68 (Rv3873)[J].Febs Journal,2014,281(6):1556–1570.
[15]喻晓雯.结核分枝杆菌RD1蛋白PE35经TLR2干扰IL-1β信号传递[D].重庆:西南大学,2014.
[16]Ganguly N,Sharma P.Mycobacterium tuberculosis RD-1 Secreted Antigens as Protective and Risk Factors for Tuberculosis[M]//Understanding Tuberculosis-Deciphering the Secret Life of the Bacilli.InTech,2012.
[17]张松,陈敏,黄淑玲,等.pEGFP-C1-HSP27真核表达载体的构建及其稳定转染人胰腺癌SW1990细胞株的筛选[J].中华胰腺病杂志,2012,12(3):177-180. (责编:张宏民)
