大鼠弥漫性轴索损伤后高迁移率族蛋白1的动态表达及其对神经细胞凋亡的影响
2015-02-18庞宏刚宋锦宁李丹东赵永林黄廷钦翟海程安吉洋
庞宏刚,宋锦宁,李丹东,孙 鹏,赵永林,黄廷钦,翟海程,安吉洋
(西安交通大学医学部第一附属医院神经外科,陕西西安 710061)
弥漫性轴索损伤(diffuse axonal injury,DAI)是脑外伤患者重要的死亡原因,但是其具体机制仍不清楚。近来研究证实,在DAI后轴索损伤部位存在明显的小胶质细胞活化,IL-1、IL-6和TNF-a等炎症因子表达显著升高[1-2],证明炎症反应在DAI后脑损伤中起着重要作用。探索DAI后炎症诱导机制是目前DAI研究亟需解决的关键问题。高迁移率族蛋白1(high mobility group box-1,HMGB-1)是病理情况下诱导多种炎症因子表达的上游激活分子。在动物研究中已证实脑缺血或蛛网膜下腔出血后脑组织中HMGB-1的水平明显升高,并且抑制HMGB-1可以显著减轻缺血后炎症反应,改善预后[3-5]。脑外伤的临床研究中也发现,患者外周血清中HMGB-1的水平明显升高,并且与预后明显相关[6]。上述研究结论均证实,作为重要的炎性分子,HMGB-1可能是DAI后导致脑组织炎性损伤的重要潜在机制。但是,DAI后脑组织中HMGB-1的表达水平及分布的动态变化目前还不清楚,也未见国内外相关研究报道。因此,本研究采用瞬时机械旋转制作大鼠DAI模型,通过免疫组化、Western blot、RT-PCR等方法全面测定DAI后脑组织中HMGB-1的表达,并采用TUNEL观察DAI后细胞凋亡水平,探讨HMGB-1在DAI后脑组织损伤中的作用机制,为临床治疗DAI提供靶点。
1 材料与方法
1.1 实验动物和试剂 雄性健康成年Sprague-Dawley大鼠84只,体质量280~300g,由西安交通大学医学部实验动物中心提供(许可证号:SCXK(陕)2007-001)。采用随机数表法将实验大鼠随即分为正常组(12只)和DAI组6h、1、3、7d组各18只,共84只。兔抗HMGB-1抗体(美国Epitomics公司)和小鼠抗β-actin(美国Santa Cruz公司),TUNEL凋亡试剂盒(美国Promega公司),过氧化物酶标记的链霉卵白素(SP)染色试剂盒及二氨基联苯胺显色试剂盒(北京中杉金桥生物公司),光镜(CX21,日本Olympus公司),图像采集及分析系统(Leica-Q550CW,德国)。
1.2 大鼠头颅瞬间旋转损伤模型 大鼠DAI模型的制作采用刘晓斌等[7]的方法:DAI组大鼠首先使用100g/L水合氯醛(3mL/kg)腹腔注射麻醉,然后将其置于高约20cm的硬质平台上,将大鼠门齿固定于门齿孔,其次将耳棒插入双侧耳道并适度旋紧,将大鼠头部水平固定于造模仪横向杆上,躯干与平台呈25~30°。限位孔设置于90°(即造模时旋转90°),拔除卡位条,限位盘迅速旋转复位并与限位销发生剧烈撞击产生瞬时停止,以此来模仿DAI发病过程中的剪切力作用。上述固定-卡位-打击-复位为1个致伤周期,重复8次。
1.3 常规组织病理学检测与免疫组化检测 正常组及DAI组大鼠分别于术后6h、1、3、7d经生理盐水左心室灌注取脑,40g/L多聚甲醛固定24h,石蜡包埋并自后向前连续冠状切片,片厚5μm,裱于载玻片,用于HE、Glees-Marsland镀银染色、Mallory磷钨酸苏木素染色及免疫组化染色。免疫组化染色采用链霉菌抗生物素蛋白-过氧化物酶链接法。首先将切片脱蜡水化,30mL/L过氧化氢去离子水室温孵育30min,通过微波加热抗原修复,血清封闭后,加抗HMGB-1单克隆抗体(1∶200),4℃恒温过夜。生物素化二抗37℃孵育30min,HRP标记链霉卵白素37℃孵育30min。DAB显色,苏木素复染,脱水并中性树胶封片。光镜下观察皮层脑组织HMGB-1的表达及分布,Leica-Q550CW图像分析系统采集图像。
1.4 RT-PCR检测HMGB-1mRNA的表达 各组大鼠于预定时间点灌注取脑,分离皮层组织。采用RNAiso Plus提取总 RNA,提取总 RNA 500ng,合成cDNA,应用Premix Taq酶以cDNA为模板加入HMGB-1及GAPDH引物(HMGB-1及GAPDH引物序列:HMGB-1上游ATGGGCAAAGGAGATCCTA,下游 ATTCATCATCATCATCATCTTCT;GAPDH 上游 TGGTGGACCTCATGGCCTAC,下游CAGCAACTGAGGGCCTCTCT),通过如下反应条件:94℃5min,94℃50s,56℃ 60s,72℃60s,共30个循环,72℃延伸7min。琼脂糖凝胶电泳确定反应产物,溴化乙锭显色,运用Gel Pro 3.1分析软件计算HMGB-1与内参GAPDH的吸光度比值,以此表示各组HMGB-1的mRNA水平。
1.5 Western blotting检测HMGB-1的表达 各组大鼠于造模后相应时间点灌注取脑,提取皮层脑组织蛋白,BCA法蛋白定量。取50μg蛋白样品,SDSPAGE电泳,半干法转膜,随后将膜置于50g/L脱脂牛奶中37℃封闭2h,一抗(HMGB-1,1∶3 000;β-actin,1∶1 000)4℃孵育过夜。TBST缓冲液洗膜3次,将膜与HRP标记的二抗(1∶5 000)室温孵育1h,TBST洗膜3次后,化学发光法显影,并采用Quantity One软件测定条带吸光度并行统计学分析。
1.6 TUNEL检测皮层神经元凋亡 各组大鼠在造模后相应时间点灌注取脑,40g/L多聚甲醛溶液中固定24h,石蜡包埋后连续冠状切片,片厚5μm。按照TUNEL凋亡试剂盒提供步骤进行TUNEL染色。图像分析系统采集图像,每张切片随机选取5个高倍视野(×400),计数TUNEL阳性细胞数。
1.7 统计学分析 应用SPSS 16.0统计软件对资料进行分析。数据采用均数±标准差(±s)的形式表示,各时间点上实验组与对照组的比较,在满足正态性和方差齐性的条件下,采用独立样本t检验;若不满足条件,则采用秩和检验,P≤0.05为差异有统计学意义。
2 结 果
2.1 DAI后脑组织的病理学改变 HE染色显示,正常脑组织皮层神经细胞形态完整,呈球形或锥形,核大而圆,核异染质少,着色浅(图1A);DAI后皮层脑组织间质明显水肿,神经元呈明显收缩变形,胞核固缩,胞质深染,呈明显嗜酸性(图1B)。Glees-Marsland镀银染色可见,正常神经轴突走形平滑,未见明显迂曲及轴索球(图1C);DAI后出现明显的神经轴索断裂及轴索球形成(图1D)。Mallory磷钨酸苏木素染色可见,正常轴突走形均匀平滑(图1E);DAI后出现明显轴突肿胀,走形迂曲,并伴有断裂(图1F)。

图1 大鼠DAI后脑组织的病理学改变Fig.1 Microscopic observation of the cross-sections of the brain of rats subjected to DAI(×400)
2.2 DAI后大鼠脑组织中HMGB-1的表达及分布
2.2.1 免疫组化染色观察 HMGB-1阳性染色呈棕黄色,在正常大鼠脑皮层组织中HMGB-1有少量表达,主要分布于细胞核,胞质及间质均未见阳性表达(图2A)。DAI后6h及1d组,HMGB-1阳性细胞减少(图2B、2C),DAI后3d及7d组,HMGB-1阳性细胞逐渐增多(图2D、2E)。

图2 HMGB-1在DAI大鼠脑组织中的表达Fig.2 Immunohistochemical observation of HMGB-1on the cross-sections of the cortex following DAI(×200)
2.2.2 Western blot定量分析结果 DAI后大鼠皮层HMGB-1水平在6h、1d时间点呈显著降低,在DAI后3d时间点HMGB-1水平达到峰值,并持续至DAI后7d,统计学分析显示DAI各亚组与正常对照组比较差异有统计学意义(P<0.05,图3)。
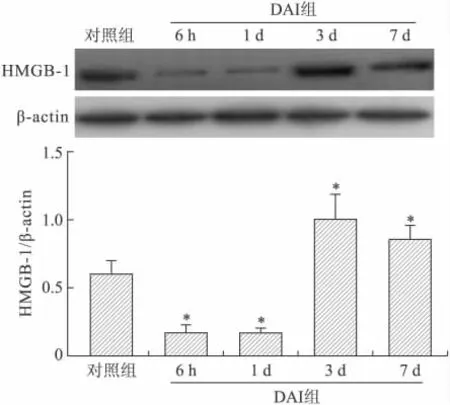
图3 DAI后大鼠皮层HMGB-1水平的时相性改变Fig.3 The dynamic expression of HMGB-1in the cortex of rats subjected to DAI
2.2.3 DAI后脑组织HMGB-1mRNA表达的动态改变 DAI后HMGB-1mRNA表达于造模后6h开始较对照组升高,但差异无统计学意义(P>0.05);DAI后1d开始HMGB-1mRNA水平较对照组明显升高,并于DAI后3、7d呈显著的持续升高。统计学分析显示,DAI后1、3、7d脑组织HMGB-1mRNA水平与对照组之间差异有统计学意义(P<0.05,图4)。
2.3 DAI对脑组织细胞凋亡的影响 正常情况下,脑组织中仅有很少TUNEL阳性细胞(图5A)。DAI后6h,TUNEL阳性细胞明显增加(图5B),并持续增加,至3d时达到最多(图5D),一直持续至DAI后7d(图5E)。统计学分析DAI后各时间点凋亡细胞数与正常对照组之间差异有统计学意义(P<0.05)(图6),并且进一步相关性分析显示细胞凋亡数量与HMGB-1的表达水平并无明显相关性。
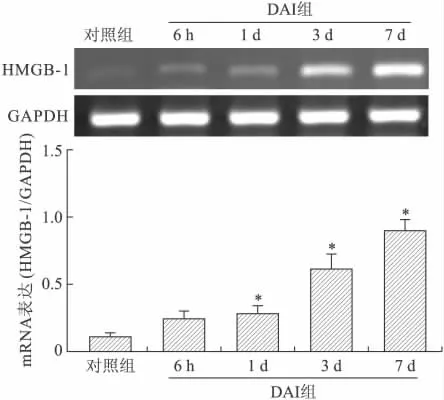
图4 DAI后HMGB-1mRNA的时相性表达Fig.4 The time course of HMGB-1mRNA expression in the cortex after DAI
3 讨 论
本研究采用大鼠头颅瞬间旋转损伤装置制作大鼠DAI模型,该模型制作方法的稳定性已被大量研究证实[8]。在实验中我们采用了HE、Glees-Marsland镀银染色、Mallory磷钨酸苏木素染色3种组织病理学染色对该模型进行了评价,结果显示造模后脑组织出现典型的轴索损伤断裂及轴索球的形成,均证实模型的可靠性与稳定性。
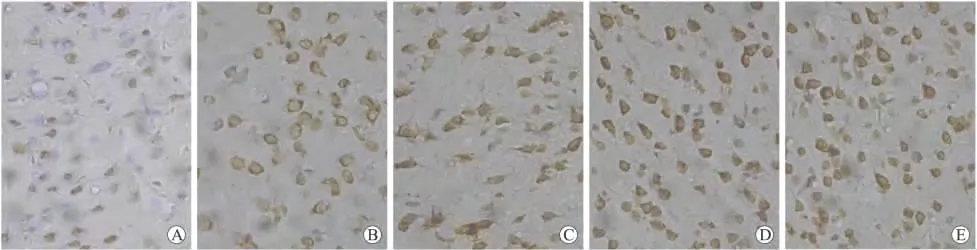
图5 TUNEL染色观察DAI后脑组织中的细胞凋亡情况Fig.5 TUNEL staining of the cortex in DAI groups(×400)
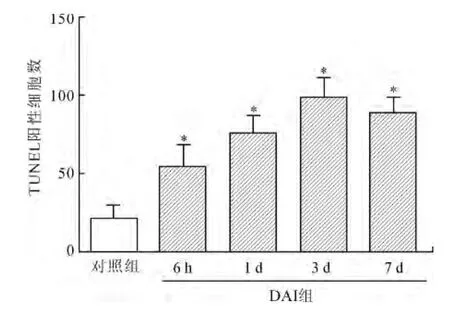
图6 DAI模型组与对照组TUNEL阳性细胞计数的比较Fig.6 Cell count of TUNEL-positive cells in DAI and control groups
HMGB-1是一种DNA结合蛋白,在脑组织中HMGB-1主要存在于神经元及胶质细胞胞核。既往研究发现,脑缺血后HMGB-1可被坏死的神经元或激活的胶质细胞释放至细胞外间隙,与细胞表面炎性受体 RAGE(receptor for advanced glycation end products)及 TLR2/4(Toll-like receptor2/4)受体结合[9-10],激活下游炎性反应信号通路[11],从而诱导多种炎症因子(TNF-α、IL-6、IL-1β等)的表达[12-13]。本实验免疫组化观察结果显示,HMGB-1在正常脑组织中主要存在于细胞核,细胞质及组织间质中几乎无表达;DAI后6h,皮层脑组织中的HMGB-1阳性细胞明显减少,可能为HMGB-1细胞外间隙释放所致,但是随后呈现了逐渐增加的趋势,直到造模后7d,仍然处于较高水平。而采用Western blot对DAI后皮层脑组织中HMGB-1水平进行定量分析发现,DAI后6h及1d,皮层脑组织中HMGB-1水平呈显著降低,直到3d时间点才开始显著升高,一直持续到DAI后7d。分析其原因,首先可能是由于DAI后细胞坏死释放HMGB-1至细胞外发挥作用,导致脑组织中原有的HMGB-1水平降低,而HMGB-1的表达此时并未升高,因此呈现HMGB-1阳性细胞的减少;其次可能是HMGB-1在早期就转录激活并表达升高,而升高的HMGB-1可能与相应的受体结合发挥其作用,从而导致无法测定。本实验同时采用RTPCR对HMGB-1mRNA表达进行检测,发现DAI后早期(6h)HMGB-1mRNA表达较对照组无明显增加,1d时间点增加幅度虽较对照有显著差异,但是仍处于较低水平,直到DAI后3d,HMGB-1mRNA的表达才开始大幅度显著升高,一直持续至DAI后7d。实验结果证实了DAI后HMGB-1水平的这种先降低,后期才开始逐渐升高的动态变化与其mRNA转录激活较晚有关。这也恰好解释了DAI后早期HMGB-1水平仅轻度升高,而到了3d后开始大幅度升高。
近来的研究已经证实多种炎症因子在DAI后表达增加[2]。但是既往研究证实TNF-α等属于早期炎症因子[14],抑制 TNF-α、IL-1、IL-6等炎症因子并不能显著改善脑外伤患者的预后。在本实验中,DAI后早期释放至细胞外间隙的仅是细胞核原有的少量HMGB-1,其mRNA及蛋白水平的表达在DAI后3d才开始大幅度显著升高。这也与既往研究结果一致。HMGB-1属于一种晚期阶段的促炎因子,它早期阶段主要由坏死的细胞释放,而在晚期则主要由激活的炎性细胞表达释放[14]。既往研究证实,在脑缺血后HMGB-1主要来自于坏死的神经元或活化的小胶质细胞[3],而在外周炎症反应中其主要来自于活化的单核巨噬细胞[15]。DAI后,脑组织中也会有大量外周炎性细胞浸润,浸润的炎性细胞是否会大量释放HMGB-1,从而诱发脑组织的炎症反应,目前还不清楚。但是,近来研究人员发现,在蛛网膜下腔出血中,HMGB-1主要来自于活化的小胶质细胞,而并非浸润到脑组织中的巨噬细胞[4]。
在本实验中,DAI后6h神经元凋亡已明显增加,并呈持续增加趋势,DAI后3d达到高峰,一直持续至DAI后7d仍处于较高水平,分析其原因,这是因为HMGB-1主要来自于坏死或活化的细胞,凋亡细胞并不释放HMGB-1至细胞外间隙[16]。因此,凋亡细胞数量的增加并不能导致HMGB-1水平的升高,并且HMGB-1发挥促炎作用不仅与其表达水平相关,还与其向细胞外的释放相关。还有,本研究中将脑组织中HMGB-1水平与神经细胞凋亡做相关性研究并不能完全解释HMGB-1与细胞凋亡之间的本质关系。既往在肝脏疾病的研究中发现,HMGB-1明显参与了肝细胞的凋亡过程[17]。但是也有部分研究证实外源性给予HMGB-1不仅能抑制细胞凋亡,还能促进细胞的增殖[18]。因此,DAI后HMGB-1介导的炎症反应是否可导致DAI后神经细胞凋亡及其潜在机制仍需要进一步的研究。
总之,HMGB-1在脑外伤后作用及其机制的研究仍处于起始阶段,DAI后脑组织内HMGB-1表达呈逐渐升高的动态变化,通过干预HMGB-1是否可以改善DAI患者的预后仍需要更多的研究来证实。
[1]KHUMAN J,MEEHAN WP,ZHU X,et al.Tumor necrosis factor alpha and Fas receptor contribute to cognitive deficits independent of cell death after concussive traumatic brain injury in mice[J].J Cereb Blodd Flow Metab,2011,31(2):778-789.
[2]LIN Y,WEN L.Inflammatory response following diffuse axonal injury[J].Int J Med Sci,2013,10(5):515-521.
[3]KIM JB,LIM CM,YU YM,et al.Induction and subcellular localization of high-mobility group box-1 (HMGB-1)in the postischemic rat brain[J].J Neurosci Res,2008,86(5):1125-1131.
[4]MURAKAMI K,KOIDE M,DUMONT TM,et al.Subarachnoid hemorrhage induces gliosis and increased expression of the pro-inflammatory cytokine high mobility group box 1 protein[J].Transl Stroke Res,2011,2(1):72-79.
[5]LIU K,MORI S,TAKAHASHI HK,et al.Anti-high mobility group box 1 monoclonal antibody ameliorates brain infarction induced by transient ischemia in rats[J].FASEB J,2007,21(14):3904-3916.
[6]COHEN MJ,BROHI K,CALFE CS,et al.Early release of high mobility group box nuclear protein 1 after severe trauma in humans:role of injury severity and tissue hypoperfusion[J].Crit Care,2009,13(6):R174.
[7]刘晓斌,宋锦宁,陈景宇,等.脑弥漫性轴索损伤实验装置的研制及动物模型的建立[J].西安交通大学学报:医学版,2008,29(5):595-598.
[8]LI Y,SONG J,LIU X,et al.High expression of STIM1in the early stages of diffuse axonal injury[J].Brain Res,2013,1495:95-102.
[9]LUAN ZG,ZHANG H,YANG PT,et al.HMGB-1 activates nuclear factor-kappaB signaling by RAGE and increases the production of TNF-alpha in human umbilical vein endothelial cells[J].Immunobiology,2010,215(12):956-962.
[10]YANG QW,WANG JZ,LI JC,et al.High-mobility group protein box-1 and its relevance to cerebral ischemia[J].J Cereb Blood Flow Metab,2010,30(2):243-254.
[11]钟田雨,唐靖,刘亚伟,等.丝裂原活化的蛋白激酶在高迁移族蛋白1诱导内皮细胞释放炎性细胞因子中的作用[J].南方医科大学学报,2009,29(8):1517-1520.
[12]ANDERSSON U,WANG H,PALMBLAD K,et al.High mobility group 1 protein(HMG-1)stimulates proinflammatory cytokine synthesis in human monocytes[J].J Exp Med,2000,192(4):565-570.
[13]AGNELLO D,WANG H,YANG H,et al.HMGB-1,a DNA-binding protein with cytokine activity,induces brain TNF and IL-6 production,and mediates anorexia and taste aversion[J].Cytokine,2002,18(4):231-236.
[14]WANG H,BLOOM O,ZHANG M,et al.HMG-1 as a late mediator of endotoxin lethality in mice[J].Science,1999,285(5425):248-251.
[15]GARDELLA S,ANDREI C,FERRERA D,et al.The nuclear protein HMGB-1 is secreted by monocytes via a non-classical,vesicle-mediated secretory pathway[J].EMBO Rep,2002,3(10):995-1001.
[16]SCAFFIDI P,MISTELI T,BIANCHI ME.Release of chromatin protein HMGB-1 by necrotic cells triggers inflammation[J].Nature,2002,418(6894):191-195.
[17]KURODA N,INOUE K,IKEDA T,et al.Apoptotic response through a high mobility box 1 protein-dependent mechanism in LPS/GalN-induced mouse liver failure and glycyrrhizin-mediated inhibition[J].PloS One,2014,9(4):e92884.
[18]XU X,ZHU H,WANG T,et al.Exogenous high-mobility group box 1inhibits apoptosis and promotes the proliferation of lewis cells via RAGE/TLR4-dependent signal pathways[J].Scand J Immunol,2014,79(6):386-394.
