反向激动剂的特性和研究进展
2015-02-18曹永孝于瑞红
曹永孝,于瑞红
(西安交通大学医学部,陕西西安 710061)
反向激动剂(inverse agonist)又名负性激动剂(negative agonist),是一种新的作用于受体的药物类型。其概念的提出可追溯到20世纪80年代,由于其特别的作用方式和临床价值,已成为近年来的热门研究课题。反向激动剂单独使用时,能产生效应,而拮抗剂单独使用不产生效应,因而不同于拮抗剂;反向激动剂单独使用虽然能产生效应,但没有内在活性,又不同于激动剂。因而其与经典的受体激动剂和拮抗剂既相似、又不同,机制比较复杂。本文从反向激动剂的研究历程、相关理论以及临床应用等方面进行综述,以期更好地认识反向激动剂。
1 反向激动剂的研究历程
1.3 反向激动剂概念的提出 1982年,鉴于在γ-氨基丁酸-苯二氮受体复合物中,β-卡波啉乙酯能降低GABA对受体的亲和力、减弱GABA能神经传导,与苯二氮类激动剂的作用恰好相反,POLC提出了反向激动剂(inverse agonist)的概念[7]。尽管这种提法仅涉及表观药理效应,未涉及到作用本质,也缺乏理论基础,但其反映了这类配体特殊的药理作用。需要指出的是,国内文献多认为此概念系1986年由EHLERT首次提出[9],也有人认为是1985年由CODDING提出[10],事实上在此之前,“inverse agonist”这一术语已经广泛应用于国际文献中,用于表述以β-卡波啉乙酯为代表的这一新的配体类别。
1.4 二态模型解释反向激动剂的作用 1982年NUTT在对β-卡波啉乙酯和苯二氮受体特异性拮抗剂Ro15-1788的作用差异性进行分析时,提出了二态模型的假设[8]。1986年EHLERT根据前人的实验结果进行了假设性推论,运用受体二态模型,借助亲和力常数,量化分析了反向激动剂、激动剂和拮抗剂的特点,明确了各自作用的靶构象。二态模型认为G蛋白耦联受体存在激活态(active,Ra)和静息态(inactive,Ri)两种构象,二者可相互转化,并处于动态平衡,但只有Ra构象的受体可以激活下游信号通路并发挥生物效应。而反向激动剂对静息态构象受体有高亲和力[11]。目前看来,这是一种接近合理的假说,它使受体领域的若干谜团得以解开。
1.5 受体的固有活性是反向激动剂的作用基础EHLERT在论述受体二态模型时,提出受体可能存在基础活性[11]。G蛋白耦联受体在活化状态下,GTP酶活性增高,故GTP酶活性可作为G蛋白耦联受体激活的标示。1989年,COSTA等[12]通过对GTP酶活性的检测证实有些受体在没有激动剂的情况下也具有一定活性,能自发性地产生效应。他通过H3PO4捕获再用活性炭检测的方法,发现在不加入激动剂的情况下,NG108-15细胞株胞膜上的δ-阿片受体能显示活性,表现在与受体耦联的G蛋白有GTP酶活性;用反向激动剂ICI 174孵育后,GTP酶活性明显受到抑制,该实验为反向激动剂的作用机制提供了实质性证据。以无激动剂时GTP酶活性为分母,用GTP酶的活性比表示药物效应,δ-阿片受体的激动剂DADLE和反向激动剂ICI 174分别呈现了大于1的S型和小于1的倒S型量效曲线(图1)。图1中y=1的虚线即δ-阿片受体的固有活性。1993年SAMAMA等[13-14]以类似的方法证明了突变的β2-肾上腺素受体也存在固有活性,并将其提升为一种理论。
至此,反向激动的作用机制基本明朗,并逐步得到认可。认为反向激动剂通过与静息态构象受体结合,拮抗受体的固有活性,使其向没有活性的方向转变,表现出与激动剂相反的效应。随后继续研究其他受体及其配体,例如感染人类巨细胞病毒后,促成US28受体在宿主细胞表达,该受体具有固有活性,可被其反向激动剂VUF2274拮抗[15],拓展了反向激动剂的研究广度。反向激动剂的普遍性及临床价值得到广泛关注,近年来研究较多的有大麻素受体、雌激素受体、5-羟色胺受体、组胺受体等相应的反向激动剂[16-19]。
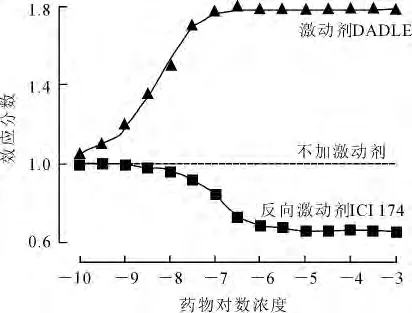
图1 NG108-15细胞膜δ-阿片受体的GTP酶活性[12]Fig.1 GTPase activity ofδ-opioid ligands in NG108-15cell membrane
2 反向激动剂的相关理论
2.1 受体固有活性 固有活性(constitutive activity),又名自发活性或组成性活性,是指G蛋白耦联受体系统在无激动剂作用的情况下,部分受体处于活化状态,能够自发产生一定程度的基础效应。拮抗剂也因此分为不影响受体固有活性的中性拮抗剂和可以抑制固有活性的反向激动剂。这里的中性拮抗剂即以往经典的拮抗剂。然而,经典的受体学说认为受体在无激动剂时,处于静息态,不产生效应;当受体与激动剂结合后,被激动,受体活化,产生效应。固有活性概念的提出是对经典受体学说的补充和完善。
从1989年COSTA等[12]首次证实了固有活性的存在,到1995年5种G蛋白耦联受体被证实系固有活性受体,相应反向激动剂也被发现,分别是δ-阿片受体、β2肾上腺素受体、5-HT2C受体、缓激肽B2受体、M型乙酰胆碱受体[20]。之后大批的固有活性受体被证实。目前相信几乎所有G蛋白耦联受体,包括孤儿受体均具有固有活性,只是活性程度不同。
在多媒体教学过程中,由于PC机的使用频率、故障发生频率、维修维护频率一直居高不下,从而导致PC机的寿命期限也大大缩短,一般在使用到3~4年就需要对PC机进行更新换代。与此同时,传统PC机的能耗相对较高,单台PC机的能耗一般在300~400 W,合计所有多媒体教室使用的PC机,每天的能源消耗都是一笔不小的开支,这些支出都加重了整个学校的运行负担[1]。
已证实包括视紫红质受体、肾上腺素受体、谷氨酸受体在内的多种G蛋白耦联受体固有活性的生成源于对第Ⅲ、第Ⅴ、第Ⅵ和第Ⅶ跨膜螺旋两两之间氢键的破坏导致了跨膜螺旋的重排,受体活化的限制因素被解除[21]。另外,5-羟色氨受体则因带正电荷的氨基酸产生的排斥力导致第Ⅲ跨膜区C末端的外移而活化[22]。简而言之,受体固有活性的生成实际上是激动剂以及突变、自身抗体等病理因素介导下胞质侧G蛋白结合位点的暴露,涉及跨膜螺旋的移位,包括外化或内化。
固有活性理论的提出均基于G蛋白耦联受体,那么其他类型的受体,例如离子通道型受体是否存在固有活性?张厚利等[10]认为除G蛋白耦联受体外,其余受体类型均属静态受体系统,即不具备固有活性,因而不存在反向激动剂的问题。然而,最近发现重组甘氨酸受体以及野生型甘氨酸受体具有固有活性[23],甘氨酸受体是配体门控离子通道受体,介导中枢抑制性信号的传导。
生理状态下绝大多数受体固有活性处于低水平,病理状态下受体固有活性可以增强。而受体高表达、受体基因突变、单核苷酸多态性、RNA剪接异常以及受体自身抗体等因素参与了病理性固有活性的调节[20]。受体高表达属于受体的量变,在相加作用下固有活性更加明显。而其他因素导致受体结构改变,加强了受体激活态构象的形成和维持,使受体的固有活性保持在较高水平。
2.2 反向激动剂的作用机制 反向激动剂是一种新的配体类别,其作用机制可以用受体的占领学说和二态模型学说来解释。其作用的前提是受体固有活性。许多G蛋白耦联受体在没有配体作用的情况下,部分受体具有固有活性,即能自发地激动而产生效应。按照占领学说的理论,反向激动剂能与受体结合,拮抗受体的固有活性,从而产生与相应激动剂作用方向相反的效应。而受体二态模型理论认为受体效应取决于受体激活态(Ra)构象受体的数目,而配体能够调节静息态(Ri)与激活态间的比例。反向激动剂(I)与受体的作用可表示如下:
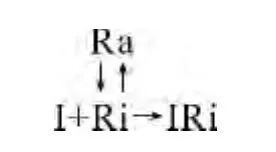
反向激动剂与受体静息态构象结合,形成反向激动剂-受体静息态(IRi)形式,静息态构象被锁定,不能转化为激活态;与无配体结合时的固有状态比较,此时未结合反向激动剂的游离型Ri减少,Ra和Ri之间的平衡被打破,一定量的Ra转化为Ri,即激活态构象静息态化,达成新的动态平衡;转化来的Ri又被反向激动剂结合而锁定,接着又有Ra向Ri转化,如此循环往复,直至Ra构象的数目不同程度地接近0,固有活性降低甚至消失,表现出与激动剂相反的效应。反向激动剂也可分为完全型和部分型,完全反向激动剂可使Ra构象全部静息态化,固有活性完全消失,受体处于无任何效应的零状态;部分反向激动剂的效能较低,固有活性不同程度被减弱。
以首次发现的反向激动剂β-卡波啉乙酯为例,具体阐述反向激动剂的作用机制。γ-氨基丁酸-苯二氮受 体 复 合 物 (γ-aminobutyric acid-benzodiazepine receptor complex)是β-卡波啉乙酯发挥作用的受体系统,本质上是一种离子通道受体,其核心结构是GABA受体和氯离子通道蛋白。GABA受体激活,则氯离子通道开放。该复合物还包括苯二氮受体、巴比妥类的结合位点等功能单位,用于辅助核心结构的功能。
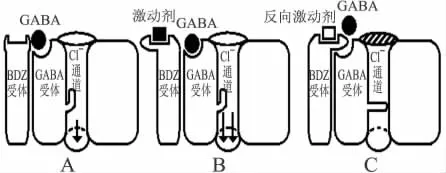
图2 苯二氮受体对GABA效应的调节Fig.2 Regulation of benzodiazepine receptor on GABAergic effect
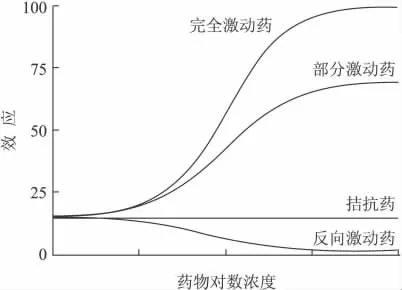
图3 完全激动剂、部分激动剂、拮抗剂和反向激动剂的浓度效应曲线Fig.3 Concentration-effect curve of full agonist,partial agonist,antagonist,and inverse agonist
2.3 反向激动剂的特性 完全激动剂、部分激动剂、拮抗剂和反向激动剂的浓度-效应曲线如图3。可用占领学说解释,完全激动剂能与受体结合,并激动受体,产生强的效应。拮抗剂与受体结合,但无内在活性,不激动受体,因而不产生效应。反向激动剂与受体结合,拮抗受体的固有活性,使受体的固有活性降低,或不发挥作用,因而产生与激动剂作用方向相反的效应。也可用二态模型解释,即激动剂与受体激活态构象结合,并激动受体,使构象平衡转向激活态,产生远高于固有活性的效应。拮抗剂与激活态和静息态构象均能结合,没有选择性,使受体构象平衡回复并保持在无配体时的固有活性状态。反向激动剂与受体静息态构象结合,拮抗受体的固有活性,使受体不发挥作用。
2.3.1 反向激动剂与激动剂 激动剂与反向激动剂均能产生效应,但反向激动剂的效应与激动剂方向相反;二者的机制不同,激动剂因激动受体产生作用,而反向激动剂因拮抗受体固有活性,使受体去激活而产生作用。前者具有内在活性,后者无内在活性。
对同一受体,反向激动剂与激动剂可以在不同亚型之间以及野生型与突变型之间进行角色互换。ICI182780在小鼠子宫野生型雌激素受体上是反向激动剂,而在该受体的突变体表现激动剂的效应[25]。CANAL[26]发现了一种复合物(-)-MBP既是5-羟色氨2C受体特异性的激动剂,同时也是5-羟色氨2A受体的反向激动剂。同种受体的不同亚型之间以及野生型与突变型之间其配体的结合部位结构是极其相似的,同一配体作用于不同受体位点,通过不同形式的变构调节机制发挥不同性质的效应,体现了配体的功能选择性。
2.3.2 反向激动剂与拮抗剂 反向激动剂与拮抗剂均无内在活性,对受体作用的实质均是拮抗。反向激动剂通过拮抗受体的固有活性而产生效应;而拮抗剂单独应用时不产生效应,可通过拮抗激动剂的作用而体现其效应。
反向激动剂是从拮抗剂中派生出来的,具有拮抗剂的特性。2004年的一项研究调查显示,多达85%的反向激动剂曾被认为是拮抗剂[27]。由于在生理状态下多数受体的固有活性处于低水平,即使有些药物具有反向激动作用,也不易发现,此时反向激动剂以拮抗激动剂的效应为主导。只有在某些病理状态下或采用分子生物学手段使固有活性显著,其反向激动效应才显现。
一部分拮抗剂在高浓度下可能具有反向激动剂的效应[8]。不难理解,虽说拮抗剂对受体静息态和激活态没有选择性,但毕竟两种构象存在结构差异,拮抗剂对它们的亲和力并不绝对相同。当拮抗剂以很高浓度与受体结合时,对两种构象亲和力的细微差别便被扩大化,对激活态构象亲和力稍高时便表现了部分激动效应。同理可推测,高浓度下另外一部分的拮抗剂可能表现部分反向激动效应。
3 反向激动剂的临床应用
3.1 反向激动剂与受体固有活性增强性疾病 先天性静止性夜盲是一种由遗传因素引起的先天性眼病,暗视力差。黑暗环境中,视紫红质受体静息态构象的维持对感光细胞保持高灵敏度有重要意义。基因突变可导致该受体固有活性增强,感光细胞脱敏,形成先天性夜盲[28]。促黄体生成素受体突变致家族遗传性男性性早熟,促甲状腺激素受体突变致甲状腺瘤或甲亢,钙离子敏感受体突变可导致低钙血症和高尿钙,均与受体固有活性增强有关。对于这类疾病,反向激动剂可拮抗固有活性介导的类内源性激动剂的效应,缓解症状,改善病情。
肾移植患者发生同种异体移植排斥反应源于移植物刺激下产生血管紧张素Ⅱ1型(AT1)受体特异性的自身抗体[29],造成血管紧张素Ⅱ样作用使AT1受体的下游信号级联放大。洛沙坦(losartan)可消除这种移植排斥反应,是肾移植排斥反应的特效药;而血浆透析去除抗体以及注射免疫球蛋白仅能使排异反应得到一定程度改善[29]。洛沙坦被证实是AT1受体的反向激动剂。Graves病的发生与促甲状腺激素受体刺激性抗体 (thyroid stimulating antibody,TSAb)有关,TSAb与促甲状腺激素受体结合,促进甲状腺细胞增生,增加甲状腺激素的合成和分泌。上述两种疾病的发病机制相似,抗体大幅度增加受体的固有活性,这种高固有活性表现出的效应与激动剂过度激动受体表现的亢进效应相同,反向激动剂为该类疾病提供了理想的治疗策略。
3.2 反向激动剂上调和增敏固有活性受体 长期应用激动剂可使受体下调,表现为受体数量减少。在促甲状腺激素释放激素受体、β1肾上腺素受体、α1肾上腺素受体、组胺H2受体,已证实反向激动剂可逆转受体固有活性的下调。受体失敏常由激酶引起,受体发生磷酸化或与抑制蛋白结合,抑制蛋白促进受体的内化。2002年 MISEREY[30]发现AT1受体突变体经反向激动剂洛沙坦孵育后,内化的受体重新定位到细胞膜上,这个过程使AT1受体对激动剂敏感性增加并促进固有活性恢复。5-羟色氨受体、前列腺素受体上也存在反向激动剂的增敏作用[31-32]。但反向激动剂的这种增敏和上调作用是否具有普遍性,以及具体分子机制还有待研究。
反向激动剂上调和增敏固有活性受体的结果有利有弊。一方面,长期使用反向激动剂治疗受体固有活性增强性疾病,会引起固有活性受体上调,并使其对激动剂的敏感性增加,对病情不利。要产生理想的效应,须增加反向激动剂的剂量,形成药物耐受。但停用反向激动剂会导致疾病复发,甚至反跳。另一方面,这种上调和增敏作用是有益的。2002年LEVIN[33]发现有些心衰患者β1肾上腺素受体的密码子发生突变,这种突变对心衰的治疗有利。经此突变的心衰患者β1肾上腺素受体具有更明显的固有活性。用反向激动剂美托洛尔治疗,并非因其抑制β1肾上腺素受体增高的固有活性,而是基于其上调受体的作用,受体的上调有利于内源性儿茶酚胺更好地发挥兴奋心脏效应,加之突变的β1肾上腺素受体本身具有较高的固有活性,因而,有此突变的心衰患者用美托洛尔治疗后,长期存活率明显提高。
3.3 内源性反向激动剂维持特定生理功能 最新发现组胺是中枢甘氨酸受体的反向激动剂,作为内源性的调节因子参与调控该受体的功能[23]。另外,黑皮质素受体家族在生理情况下固有活性处于较高水平[34],作为内源性的反向激动剂,agouti相关肽以及它的小片段通过抑制黑皮质素受体的固有活性,维持正常的摄食行为和色素沉着功能,防止黑色素瘤和肥胖的发生,说明反向激动剂承担着一定的生理功能。
4 展 望
近30年来,反向激动剂的研究已经取得了长足进展,其机制已基本清楚,研究的广度增大,成批的反向激动剂被发现。但有些问题仍然有待解决,例如,与激动剂相比较,作用于同一受体的反向激动剂的结构有何特殊之处?其特异性结合的受体有何特殊结构?只有获取了这方面信息才能合成、筛选,甚至高通量、高靶向地研发反向激动剂,更好地治疗疾病。
反向激动剂及受体固有活性理论为固有活性增强性疾病的发病机制、诊断与治疗提供了新的思路,深入研究反向激动剂及其机制,对于完善受体学说有重要的理论意义,对于固有活性增强性疾病的诊断和治疗具有重要的临床意义。
[1]BRAESTRUP C,NIELSEN M,OLSEN CE.Urinary and brain beta-carboline-3-carboxylates as potent inhibitors of brain benzodiazepine receptors[J].P Natl Acad Sci-Biol,1980,77(4):2288-2292.
[2]BRAESTRUP C,NIELSEN M.Searching for endogenous benzodiazepine receptor ligands[J].Trends Pharmacol Sci,1980,1(15):424-427.
[3]COWEN PJ,GREEN AR,NUTT DJ.Ethyl beta-carboline carboxylate lowers seizure threshold and antagonizes flurazepam-induced sedation in rats[J].Nature,1981,290(5801):54-55.
[4]BRAESTRUP C,SCHMIECHEN R,NEEF G,et al.Interaction of convulsive ligands with benzodiazepine receptors[J].Science,1982,216(4551):1241-1243.
[5]DOROW R,HOROWSKI R,PASCHELKE G,et al.Severe anxiety induced by fg-7142,a beta-carboline ligand for benzodiazepine receptors[J].Lancet,1983,2(8341):98-99.
[6]FILE SE,LISTER RG,NUTT DJ.The anxiogenic action of benzodiazepine antagonists[J].Neuropharmacology,1982,21(10):1033-1037.
[7]POLC P,BONETTI EP,SCHAFFNER R,et al.A three-state model of the benzodiazepine receptor explains the interactions between the benzodiazepine antagonist ro 15-1788,benzodiazepine tranquilizers,beta-carbolines,and phenobarbitone[J].Naunyn Schmiedebergs Arch Pharmacol,1982,321(4):260-264.
[8]NUTT DJ,COWEN PJ,LITTLE HJ.Unusual interactions of benzodiazepine receptor antagonists[J].Nature,1982,295(5848):436-438.
[9]张幼怡,韩启德.反向激动剂:受体研究中的一个新发现[J].生理科学进展,1997,28(1):9-13.
[10]张厚利,唐泽耀,杨静娴,等.反向激动剂的药理效应特征[J].中国药理学通报,2005,21(11):1285-1288.
[11]EHLERT FJ.Inverse agonists,cooperativity and drug-action at benzodiazepine receptors[J].Trends Pharmacol Sci,1986,7(1):28-32.
[12]COSTA T,HERZ A.Antagonists with negative intrinsic activity at delta-opioid receptors coupled to gtp-binding proteins[J].P Natl Acad Sci USA,1989,86(19):7321-7325.
[13]LEFKOWITZ RJ,COTECCHIA S,SAMAMA P,et al.Constitutive activity of receptors coupled to guanine-nucleotide regulatory proteins[J].Trends Pharmacol Sci,1993,14(8):303-307.
[14]SAMAMA P,COTECCHIA S,COSTA T,et al.A mutationinduced activated state of the beta(2)-adrenergic receptor-extending the ternary complex model[J].J Biol Chem,1993,268(7):4625-4636.
[15]TSCHAMMER N.Allosteric modulation of the g protein-coupled us28 receptor of human cytomegalovirus:Are the smallweight inverse agonist of us28 “camouflaged”agonists?[J].Bioorg Med Chem Lett,2014,24(16):3744-3747.
[16]TONIOLO EF,MAIQUE ET,FERREIRA WA Jr,et al.Hemopressin,an inverse agonist of cannabinoid receptors,inhibits neuropathic pain in rats[J].Peptides,2014,56:125-131.
[17]KOO JY,OH S,CHO SR,et al.Total synthesis of eryvarin h and its derivatives and their biological activity as errgamma inverse agonist[J].Org Biomol Chem,2013,11(35):5782-5786.
[18]PRICE DL,BONHAUS DW,MCFARLAND K.Pimavanserin,a 5-ht2a receptor inverse agonist,reverses psychosis-like behaviors in a rodent model of Alzheimer's disease[J].Behav Pharmacol,2012,23(4):426-433.
[19]LEU-SEMENESCU S,NITTUR N,GOLMARD JL,et al.Effects of pitolisant,a histamine h3inverse agonist,in drug-resistant idiopathic and symptomatic hypersomnia:A chart review[J].Sleep Med,2014,15(6):681-687.
[20]BOND RA,IJZERMAN AP.Recent developments in constitutive receptor activity and inverse agonism,and their potential for gpcr drug discovery[J].Trends Pharmacol Sci,2006,27(2):92-96.
[21]YANAGAWA M,YAMASHITA T,SHICHIDA Y.Glutamate acts as a partial inverse agonist to metabotropic glutamate receptor with a single amino acid mutation in the transmembrane domain[J].J Biol Chem,2013,288(14):9593-9601.
[22]HOSSAIN M,MUNTASIR HA,ISHIGURO M,et al.Mechanism of inverse agonist action of sarpogrelate at the constitutively active mutant of human 5-ht2a receptor revealed by molecular modeling[J].Biol Pharm Bull,2012,35(9):1553-1559.
[23]KLETKE O,SERGEEVA OA,LORENZ P,et al.New insights in endogenous modulation of ligand-gated ion channels:Histamine is an inverse agonist at strychnine sensitive glycine receptors[J].Eur J Pharmacol,2013,710(1-3):59-66.
[24]TOFFANO G,GUIDOTTI A,COSTA E.Purification of an endogenous protein inhibitor of the high affinity binding of gamma-aminobutyric acid to synaptic membranes of rat brain[J].Proc Natl Acad Sci USA,1978,75(8):4024-4028.
[25]MOVERARE-SKRTIC S,BORJESSON AE,FARMAN HH,et al.The estrogen receptor antagonist ici 182,780 can act both as an agonist and an inverse agonist when estrogen receptor alpha af-2 is modified[J].Proc Natl Acad Sci USA,2014,111(3):1180-1185.
[26]CANAL CE,MORGAN D,FELSING D,et al.A novel aminotetralin-type serotonin(5-ht)2c receptor-specific agonist and 5-ht2a competitive antagonist/5-ht2b inverse agonist with preclinical efficacy for psychoses[J].J Pharmacol Exp Ther,2014,349(2):310-318.
[27]KENAKIN T.Efficacy as a vector:The relative prevalence and paucity of inverse agonism[J].Mol Pharmacol,2004,65(1):2-11.
[28]PARK PS.Constitutively active rhodopsin and retinal disease[J].Adv Pharmacol,2014,70:1-36.
[29]DRAGUN D,MULLER DN,BRASEN JH,et al.AngiotensinⅡtype 1-receptor activating antibodies in renal-allograft rejection[J].N Engl J Med,2005,352(6):558-569.
[30]MISEREY-LENKEI S,PARNOT C,BARDIN S,et al.Constitutive internalization of constitutively active angiotensinⅡat(1a)receptor mutants is blocked by inverse agonists[J].J Biol Chem,2002,277(8):5891-5901.
[31]WALSTAB J,STEINHAGEN F,BRUSS M,et al.Differences between human wild-type and c23s variant 5-ht2c receptors in inverse agonist-induced resensitization[J].Pharmacol Rep,2011,63(1):45-53.
[32]LABRECQUE P,ROY SJ,FRECHETTE L,et al.Inverse agonist and pharmacochaperone properties of mk-0524 on the prostanoid dp1 receptor[J].PLoS One,2013,8(6):e65767.
[33]LEVIN MC,MARULLO S,MUNTANER O,et al.The myocardium-protective gly-49 variant of the beta(1)-adrenergic receptor exhibits constitutive activity and increased desensitization and down-regulation[J].J Biol Chem,2002,277(34):30429-30435.
[34]MILLIGAN G.Constitutive activity and inverse agonists of g protein-coupled receptors:A current perspective[J]. Mol Pharmacol,2003,64(6):1271-1276.
