PPARγ及其辅激活子MED1重组腺病毒的制备与生物学功能分析
2015-02-18李倩薇赵四海贾玉枝REDDYJanardan刘恩岐
白 亮,李倩薇,赵四海,贾玉枝,REDDY Janardan K,刘恩岐
(1.西安交通大学医学部心血管中心动脉粥样硬化与脂代谢研究室,陕西西安 710061;2.Department of Pathology,Feinberg School of Medicine,Northwestern University,Chicago,IL 60611,USA;3.西安交通大学医学部医学实验动物中心,陕西西安 710061;4.陕西中医学院,陕西咸阳 712046)
转录因子PPARγ是脂肪代谢的重要调控子,一直是科学研究者们关注的焦点[1-2]。在脂肪组织中,PPARγ表达最为丰富,调控脂肪细胞分化和能量储存[3-4]。研究发现,MED1(mediator 1)是 PPARγ的关键辅激活子[5]。MED1能与许多核受体如PPARs、RARα、RXR和GR等,以及多种转录因子如p53、GATA 家族、PGC-1和C/EBPβ等结合,提示MED1在机体组织以及细胞代谢中具有重要调控作用[5-7]。
重组腺病毒是一类复制缺陷的腺病毒载体,具有转染效率高、感染细胞范围广、病毒滴度高、可感染细胞周期中静止期和分裂期细胞,同时可高效介导基因的体内外转移等优点[8-9]。近年来,构建携带外源基因的重组腺病毒载体越来越多地用于基因功能的研究,还用于遗传病和肿瘤的疾病基因治疗[10]。本研究应用HEK293a细胞包装扩繁Ad/PPARγ、Ad/MED1和对照Ad/LacZ,经CsCl梯度离心纯化,大批量生产了细胞感染及活体注射所需的重组腺病毒,检测了Ad/PPARγ和Ad/MED1的生物学特性,为今后深入研究PPARγ及其辅激活子MED1的基因功能以及二者之间的网络调控关系提供了有利工具。
1 材料与方法
1.1 细胞及腺病毒载体 HEK293a和3T3-L1细胞系均购自美国ATCC细胞库。PPARγ重组腺病毒(Ad/PPARγ)和 MED1重组腺病毒(Ad/MED1)载体由实验室构建。
1.2 重组腺病毒的扩增 用重组腺病毒原液先感染少量HEK293a细胞,36~48h后,约80%的细胞漂浮时,收集细胞,离心弃上清,加入少量DMEM培养液悬浮,在甲醇干冰浴和37℃水浴锅中反复冻融3次,离心取病毒上清。大量培养HEK293a细胞,用所获得的病毒上清感染细胞,裂解获得病毒液,―80℃保存。
1.3 重组腺病毒的纯化、滴度测定 梯度离心:将8mL 1.4mg/mL CsCl加入 Ultra-ClearTM离心管,再缓慢加入6mL 1.2mg/mL CsCl,随后轻轻加入6mL病毒液,23 000r/min 4℃离心90min,去除上层杂质,吸出白色病毒液,稀释之后进行连续梯度离心。即依次加入12mL 1.4mg/mL的 CsCl、14mL 1.2mg/dL的CsCl,最后小心加入8mL上步离心获得的病毒悬液,23 000r/min 4℃离心20h,从管中吸出病毒液。
用Slide-A-Lyzer透析盒透析病毒液3次,前2次每次2h,第3次4℃过夜,次日收集病毒。
对重组腺病毒的纯化,运用非连续CsCl梯度离心去掉细胞杂质和无活性的病毒液(图1A);运用连续CsCl梯度离心法分离获得有活性的病毒液(图1B);并对获得的病毒液进行洗脱透析,以提高病毒纯度和感染效率。
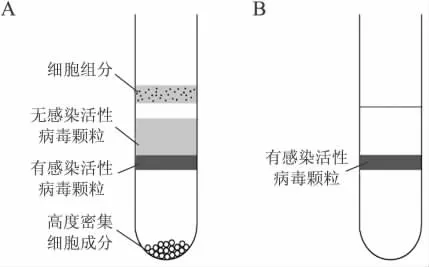
图1 密集CsCl梯度离心示意图Fig.1 Model of CsCl gradient centrifuge
采用病毒颗粒(viral particles,VP)来描述病毒悬液的滴度,即测定260nm波长下病毒颗粒的吸光度(A)。1A相当于1.1×1012virus,具体计算公式如下:A260×viral dilution×1.1×1012VP/mL。将纯化的病毒液按1∶50、1∶25和1∶10比例稀释,55℃水浴15min,用分光光度计测定A260,计算病毒滴度。
1.4 重组腺病毒的体内注射 C57BL/6J小鼠饲养在12h光照和12h黑暗交替的清洁级动物房,自由饮水、采食。5周龄时,给每只小鼠尾静脉注射1×1011VP腺病毒,注射后第5天或第6天处死小鼠,收集肝脏组织。所有动物操作程序均按照美国NIH实验动物保护协会的要求执行。
1.5 组织学检测 X-gal染色法:用100mL/L的冰甲醛固定肝脏组织切片10min,PBS、蒸馏水冲洗,加入X-gal染色液,37℃孵育数小时,PBS、蒸馏水冲洗、封片。
HE染色法:肝脏组织经甲醛固定、脱水、石蜡包埋和切片后,苏木素染色10min,伊红染色2min。
油红O染色法:40g/L多聚甲醛固定肝脏组织切片10min,双蒸水洗3次,600mL/L异丙醇浸泡5min,使组织异丙醇化,以便使油红O着色,然后用5mL/L的油红O染液染色30min;600mL/L异丙醇洗、蒸馏水洗、甘油封片。
1.6 免疫组织化学法检测PPARγ和MED1蛋白将肝脏切片在二甲苯中放置30min,然后放入1 000 mL/L乙醇3min,33mL/L过氧化氢1h;之后放入1 000、900、800mL/L乙醇分别3min,PBS冲洗,用20mL/L马血清封闭2~4h;PPARγ抗体(Santa Cruz,1∶200稀释)或 MED1抗体(Santa Cruz,1∶400稀释)4℃孵育过夜;PBS冲洗,二抗室温孵育1h,PBS冲洗,ABC孵育,DAB显色,脱水透明、封片、照相。
1.7 实时定量PCR检测PPARγ和MED1基因运用Trizol试剂(Invitrogen)提取总RNA,用2μg总RNA进行反转录。TaKaRa(Thermal Cycler Dice Real-Time System)设备运行Q-PCR,每个样品设置3个重复,18S作为内参。20μL实时定量PCR反应体系:2×SYBR Green Master Mix 10μL,ddH2O 6.4μL,10μmol/L上游、下游引物各0.8μL(表1),cDNA 2.0μL。运用2-ΔΔCt来分析基因相对表达水平。

表1 Real-time PCR引物Tab.1 Primers for Real time PCR
1.8 统计学分析 以均数±标准差表示实验数据,用 One-way ANOVA (SPSS 13.0)中的最小显著差数法(LSD)来进行差异检验,P<0.05为差异有统计学意义。
2 结 果
2.1 PPARγ和MED1重组腺病毒的扩繁与纯化及滴度的测定 为了获得大量用于活体注射以及细胞感染的Ad/PPARγ、Ad/MED1及其对照腺病毒Ad/LacZ,依次对3种病毒原液进行了3轮扩繁,以期获得高感染力的病毒。当HEK293a细胞感染病毒后,细胞表现为生长停滞,细胞之间空隙变大。感染24h后,细胞开始变圆,少量细胞漂浮。感染36~48h,可见约80%的细胞漂浮,表明腺病毒感染成功。
病毒滴度的测定结果显示,随着稀释浓度的递增,病毒颗粒的吸光度值也在递减(表2)。用VLB将病毒液分别稀释为1∶50、1∶25和1∶10,测定A260值,代入公式计算获得Ad/LacZ浓度为2.51×1012VP/mL、Ad/PPARγ 浓 度 为 1.57×1012VP/mL,Ad/MED1浓度为2.59×1012VP/mL。
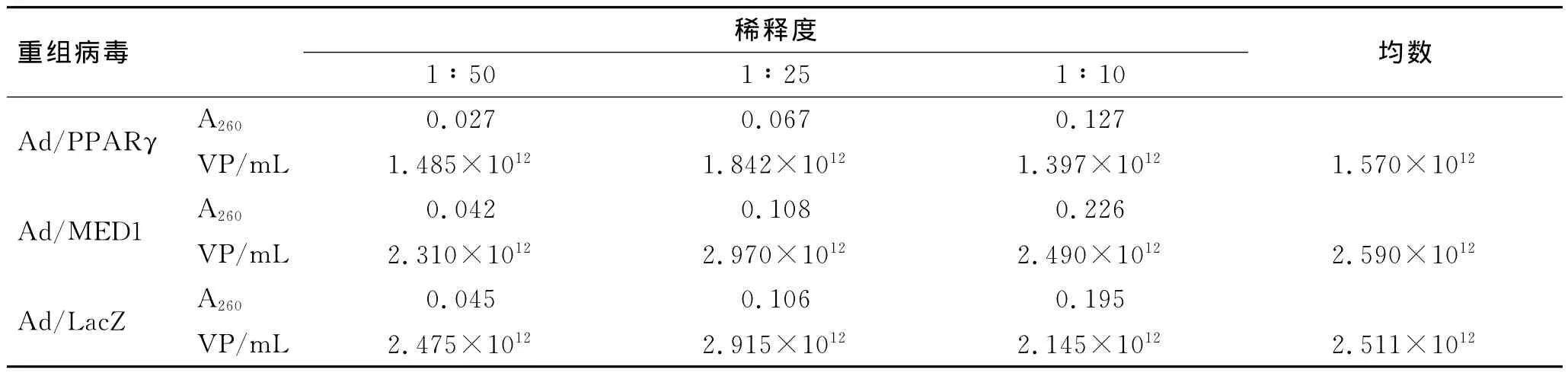
表2 重组腺病毒滴度的测定结果Tab.2 Determination of recombinant adenovirus gradient
2.2 Ad/LacZ的鉴定 在生物科学研究中,Ad/LacZ常作为病毒对照。本研究给C57BL/6J小鼠尾静脉注射Ad/LacZ 6d后,取肝脏组织进行X-gal染色。结果证实,70%以上的肝细胞表达β-半乳糖苷酶(图2)。Ad/LacZ的成功制备可以为Ad/PPARγ以及Ad/MED1的鉴定提供有效对照。
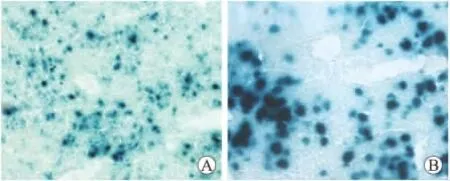
图2 C57BL/6J小鼠肝脏X-gal染色Fig.2 β-galactosidase staining of C57BL/6Jmouse liver
2.3 PPARγ重组腺病毒的鉴定 C57BL/6J小鼠尾静脉注射Ad/PPARγ6d,与空白对照组以及注射Ad/LacZ组相比,注射Ad/PPARγ的小鼠肝脏颜色发白,呈脂肪肝状,肝脏重量指数显著增加(P<0.01,图3)。HE与油红 O 染色证实,注射 Ad/PPARγ的小鼠肝细胞中聚集大量脂滴(图4),肝脏PPARγ和其靶基因aP2mRNA表达显著升高(图5A)。免疫组化染色显示,注射Ad/PPARγ之后,PPARγ在肝细胞核中大量表达(图5B)。上述研究结果均表明成功制备Ad/PPARγ,可用于今后基因功能以及基因网络调控研究。
2.4 MED1重组腺病毒的鉴定 MED1是PPARγ的关键辅激活子。Ad/MED1感染3T3-L1细胞系后,Real-time PCR检测结果表明,MED1mRNA表达明显上调(图6A)。同时,给5周龄C57BL/6J小鼠尾静脉注射Ad/MED1,5d后收集肝脏组织提取总RNA,与Ad/LacZ对照组相比,干预组 MED1mRNA表达水平显著升高(图6B)。而且,免疫组化结果显示,注射组小鼠MED1蛋白在肝细胞核中大量表达(图6C)。上述结果表明,Ad/MED1扩繁和纯化成功,病毒感染力强,可用于细胞感染和活体研究,以便深入研究基因功能。

图3 注射Ad/PPARγ的C57BL/6J小鼠出现脂肪肝(A)及肝-体重量比变化(B)Fig.3 Changes in fatty liver(A)and liver-body mass ratio(B)of C57BL/6Jmice without or with Ad/LacZ or Ad/PPARγinjection
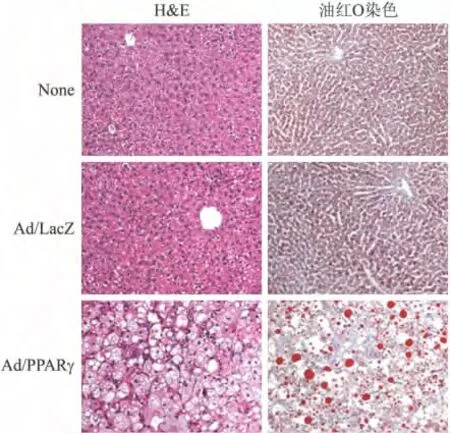
图4 注射Ad/LacZ或Ad/PPARγ小鼠的肝脏组织学改变Fig.4 Histological changes of liver from wild type mice without or with Ad/LacZ or Ad/PPARγinjection(×200)
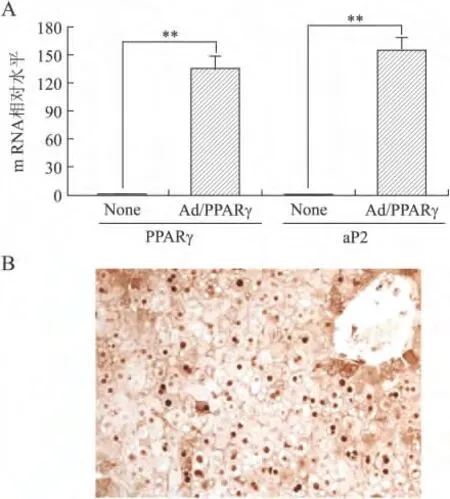
图5 野生型小鼠注射Ad/PPARγ后肝脏高表达PPARγFig.5 Overexpression of PPARγin livers from wild type mice with Ad/PPARγinjection
3 讨 论
PPARγ是机体能量代谢的关键调控基因,它通过调节下游靶基因的表达,在脂肪形成、糖脂代谢、炎症以及免疫系统中发挥重要作用,并与多种疾病如肥胖、脂肪肝、糖尿病、动脉粥样硬化、高血压、癌症等的发生发展密切相关[1,4,11-12]。以 PPARγ为诱饵,从小鼠肝脏中克隆获得转录辅激活子MED1[5]。体外研究发现,即使给予PPARγ刺激,MED1-/-小鼠胚胎成纤维细胞也不能向成脂分化[13]。体内研究表明,肝脏MED1特异性敲除小鼠能够抵抗PPARγ诱导的脂肪肝形成。因而,PPARγ与MED1密切联系,二者相辅相成。
腺病毒是一种大分子双链无包膜DNA病毒,它通过受体介导的内吞作用进入细胞内,进而腺病毒基因组转移至细胞核内,保持在染色体外,不整合进入宿主细胞基因组中[9,14]。本研究通过HEK293a细胞包装、病毒感染扩繁和CsCl梯度纯化,获得了大量Ad/LacZ、Ad/PPARγ和Ad/MED1,经鉴定这些重组腺病毒具有高感染力,可以作为今后基因功能研究的有效工具。
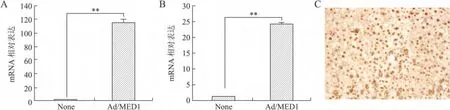
图6 3T3-L1细胞系或野生型小鼠感染Ad/MED1后高表达MED1Fig.6 Overexpression of MED1in 3T3-L1cell line or wild type mice infected with Ad/MED1
腺病毒载体转基因效率高,体外实验通常接近100%的转导效率;可转导不同类型的人组织细胞,不受靶细胞是否为分裂细胞所限;容易制得高滴度病毒载体;进入细胞内并不整合到宿主细胞基因组,仅瞬间表达,安全性高[9,14-15]。因而,重组腺病毒是基因治疗、疫苗治疗和基础生物学的有效工具[16-17]。本研究为了验证重组腺病毒的感染效率,同时做了细胞感染实验和小鼠活体尾静脉注射实验。结果显示,Ad/PPARγ和Ad/MED1对3T3L1细胞系和C57BL/6J小鼠均具有强感染力。重组腺病毒感染后,MED1和PPARγmRNA和蛋白表达均显著上升。其中,Ad/PPARγ活体注射后表现出明显的生物学效应,即小鼠肝脏发生脂肪变性。这些结果均表明,Ad/PPARγ和Ad/MED1的批量扩繁、纯化、鉴定成功,为我们今后研究PPARs代谢途径奠定了坚实的基础。
CsCl密度梯度离心是一种快速、经济、回收率高的经典方法,适合于大规模分离和纯化重组腺病毒。在以往的研究中,我们实验室仅使用一步CsCl连续梯度离心法,然后用Slide-A-lyzer(10 000MWCO)透析来获得纯化病毒,获得的病毒量少,一次只能满足数十只小鼠的注射需求。此外,我们给小鼠注射后,发现有少数小鼠注射病毒后出现死亡情况,分析其原因可能是透析不彻底,存在的氯化铯对小鼠具有潜在的毒性。因此,我们改进了纯化方法,使用两步法,即非连续和连续梯度离心法。透析时使用了Slide-A-lyzer(20 000MWCO)。经改进后,获得的病毒量大,一次可以满足数百只小鼠的注射需求,且对小鼠无任何毒性。
本研究大批量制备了细胞感染、活体注射所需的Ad/PPARγ和Ad/MED1以及对照 Ad/LacZ。经滴度测定和生物学活性分析,所获得的病毒具有高活力,能够有效侵染宿主细胞,为今后核受体PPARγ、转录辅激活子MED1的基因功能研究奠定了坚实的实验基础。
[1]WANG YX.PPARs:diverse regulators in energy metabolism and metabolic diseases[J].Cell Res,2010,20(2):124-137.
[2]REDDY JK.Peroxisome proliferators and peroxisome proliferator-activated receptor alpha:biotic and xenobiotic sensing[J].Am J Pathol,2004,164(6):2305-2321.
[3]TONTONOZ P,HU E,SPIEGELMAN BM.Stimulation of adipogenesis in fibroblasts by PPAR gamma2,a lipid-activated transcription factor[J].Cell,1994,79(7):1147-1156.
[4]ROSEN ED,WALKEY CJ,PUIGSERVER P,et al.Transcriptional regulation of adipogenesis[J].Genes Develop,2000,14(11):1293-1307.
[5]ZHU Y,QI C,JAIN S,et al.Isolation and characterization of PBP,aprotein that interacts with peroxisome proliferator-activated receptor[J].J Biol Chem,1997,272(41):25500-25506.
[6]CRAWFORD SE,QI C,MISRA P,et al.Defects of the heart,eye,and megakaryocytes in peroxisome proliferator activator receptor-binding protein (PBP)null embryos implicate GATA family of transcription factors[J].J Biol Chem,2002,277(5):3585-3592.
[7]LI H,GADE P,NALLAR SC,et al.The Med1 subunit of transcriptional mediator plays a central role in regulating CCAAT/enhancer-binding protein-beta-driven transcription in response to interferon-gamma[J].J Biol Chem,2008,283(19):13077-13086.
[8]GRAHAM FL,PREVEC L.Adenovirus-based expression vectors and recombinant vaccines[J].Biotechnology,1992,20:363-390.
[9]LUO J,DENG ZL,LUO X,et al.A protocol for rapid generation of recombinant adenoviruses using the AdEasy system[J].Nat Protoc,2007,2(5):1236-1247.
[10]MAJHEN D,CALDERON H,CHANDRA N,et al.Adenovirusbased vaccines for fighting infectious diseases and cancer:progress in the field[J].Hum Gene Ther,2014,25(4):301-317.
[11]WANG N,YIN R,LIU Y,et al.Role of peroxisome proliferator-activated receptor-gamma in atherosclerosis:an update[J].Circ J,2011,75(3):528-535.
[12]BLASCHKE F,TAKATA Y,CAGLAYAN E,et al.Obesity,peroxisome proliferator-activated receptor,and atherosclerosis in type 2 diabetes[J].Arterioscler Throm Vasc Biol,2006,26(1):28-40.
[13]GE K,GUERMAH M,YUAN CX,et al.Transcription coactivator TRAP220is required for PPAR gamma 2-stimulated adipogenesis[J].Nature,2002,417(6888):563-567.
[14]HE TC,ZHOU S,DA COSTA LT,et al.A simplified system for generating recombinant adenoviruses[J].Proc Natl Acad Sci USA,1998,95(5):2509-2514.
[15]SILVA AC,FERNANDES P,SOUSA MF,et al.Scalable production of adenovirus vectors[J].Methods Mol Biol,2014,1089:175-196.
[16]MITTEREDER N,MARCH KL,TRAPNELL BC.Evaluation of the concentration and bioactivity of adenovirus vectors for gene therapy[J].J Virol,1996,70(11):7498-7509.
[17]DEAL C,PEKOSZ A,KETNER G.Prospects for oral replicating denovirus-vectored vaccines[J].Vaccine,2013,31(32):3236-3243.
