2型糖尿病致阿尔茨海默病损伤大鼠模型的建立及鉴定
2015-02-18王文婷宋海峰张衍国
刘 涛,王文婷,宋海峰,杨 利,郭 俊,张衍国
(第四军医大学唐都医院:1.皮肤科;2.内分泌科;3.神经内科,陕西西安 710038)
阿尔茨海默病(Alzheimer's disease,AD)是老年痴呆的最常见原因,它是一种原因不明的、进行性的、中枢神经系统的退行性疾病,其特征性病理改变为大脑皮层及脑区的细胞外间隙的β淀粉样蛋白(βamyloid peptide,β-AP)和细胞内多聚Tau蛋白的沉积[1]。2型糖尿病(type 2diabetes mellitus,T2DM)患者认知功能异常或AD的发病率较正常对照人群高2~3倍。有学者提出将 AD称作“3型 DM”[2]。但T2DM致AD的发病机制至今尚未明确,建立T2DM致AD的动物模型有利于研究其具体的发病机制。目前为止,已报道的建模方法与临床上T2DM致AD自然病程存在较大出入,且建模方法及模型评价上尚未统一。本研究采用高脂高糖饮食持续喂养老年大鼠模拟临床T2DM致AD自然病程以建立动物模型并鉴定,以期为更好地阐明T2DM致AD的具体机制提供相对客观真实的大鼠模型。
1 材料与方法
1.1 实验动物 100只体质量500~600g正常雄性SD老龄大鼠(18月龄以上),由第四军医大学实验动物中心提供,动物许可证号:scxk(军)2007-007。
1.2 试剂及设备 链脲佐菌素(streptozotocin,STZ)粉剂(Sigma公司)溶于0.1mol/L pH4.3的柠檬酸钠缓冲液中,配制成20mg/mL的溶液;血糖仪(强生稳豪);DMS-2型Morris水迷宫(第四军医大学唐都医院中心实验室);脑立体定位仪(日本Narishige公司);微透析设备:灌注器推进泵(Baby Bee Syringe Drive,MD 1001),灌注器(1mL Bee Stinger Gastight Syringe,MD 0100),灌注器支架(32Syringe Bracket for Baby Bee,MD1002),流速控制器(Work Bee Controller,MD1000)均为美国BAS公司产品;ELISA检测试剂盒(德国DRG公司;比利时Innogenetics公司);金属电极(TM53A05型电极,美国WPI公司)。
1.3 方法
1.3.1 T2DM致AD损伤大鼠模型的建立及实验分组 老年SD大鼠100只,以高脂高糖饮食(其比例为化猪油23%、蔗糖21%、蛋黄粉9%、基础饲料47%)喂养,连续喂养6周。然后按30mg/kg体质量剂量尾静脉注射STZ后,48~72h后清晨取空腹尾静脉血测空腹血糖和空腹胰岛素水平(强生稳豪血糖仪测血糖,德国DRG公司ELISA试剂盒测空腹胰岛素水平),每天检测1次,连测3d并统计分析。空腹血糖平均值≥16.7mmol/L即确定为T2DM 大鼠。将T2DM大鼠继续饲养4周,采用Morris水迷宫试验对大鼠进行测试,统计分析后筛选出对学习、记忆、新联想形成和执行功能异常大鼠;进一步运用脑脊液微透析技术(microdialysis,MD)和ELISA试剂盒(比利时Innogenetics公司)检测海马区脑脊液中β-AP含量确认AD的发生。将发生AD损伤大鼠入T2DM+AD组,另设普通饮食组(10只老年SD大鼠,普通饲料喂养)和单纯T2DM组进行对照分析;T2DM+AD组大鼠行为学实验结束后行大鼠海马CA1区银浸染色确证AD发生。
1.3.2 银浸染色(Bodian,Bielschowsky) 所有T2DM+AD组大鼠脑标本参照MIRRA等[3]的染色方法,选取含海马CA1区脑组织,经40g/L甲醛溶液固定,常规脱水、浸蜡,石蜡包埋,切5μm厚的连续切片,做银浸染色。
1.3.3 Morris水迷宫试验 建立T2DM大鼠模型,应用 Morris水迷宫(Morris Water Maze,MWM)进行行为学检测,测试其空间学习和记忆能力。Morris水迷宫为直径90cm、高40cm的圆形水池,水深30cm,在水池壁上标明4个入水点,由此将其等分为4个象限,于第3象限中心置一有机玻璃圆形平台,平台低于水面2cm,水温(24±2)℃。测试内容包括:①定位航行实验(place navigation)。历时5d,每天训练2次。将大鼠面向池壁分别从4个入水点放入池中,测其90s内成功寻找到平台所需时间,即逃避潜伏期(escape latency)。若大鼠入水后90s内未能找到平台,则将其置于平台上并停留10s。②空间探索试验(spacial probe test)。定位航行试验结束后撤除平台,任选一个入水点将大鼠面向池壁放入水中,记录90s内跨越原平台位置的次数,以及平台象限内大鼠游泳路径的百分比。数据的采集和处理均通过Morris水迷宫自动监视处理系统完成。
1.3.4 脑脊液微透析技术(microdialysis,MD)和ELISA检测 大鼠麻醉后,固定于脑立体定位仪,头部正中切开,暴露双侧颞骨,根据Paxinos Watson大鼠脑图谱,在前囟后3.3mm,正中矢状缝旁开2mm,硬脑膜下3.5mm,将探针的导轨定位于大鼠海马区,并在导轨周围颅骨上呈三角形固定3枚小螺钉,而后用牙科水泥固定,保证导轨不随大鼠正常活动而移动或松动。术后将大鼠单独饲养,保证清洁充足的饮水及食物,恢复1d,备用。完成导轨埋置手术大鼠,MD检测前在麻醉状态下取下导轨套管塞,将已平衡好的MD探针沿导轨插入大鼠海马内,以人工脑脊液做灌流液,开启MD灌流系统,调节微量注射泵控制灌流液流速恒定为2.5L/min。在脑内稳定平衡60min后,分别在20、40、60、80、100、120min时收集 MD液各50μL,共收集6管。收集好的MD液即刻转入-20℃冰箱保存。透析结束后,颈椎脱臼处死大鼠,断头取脑解剖,找到海马区,观察验证透析探针位置是否正确。收集好的MD液用ELISA检测试剂盒检测。
1.3.5 电生理记录 在屏蔽实验台内利用“在体单细胞电生理记录单元”(S24045-SET购自澳大利亚Powerlab公司)进行电生理记录。大鼠麻醉后,固定于脑立体定位仪,头部正中切开,暴露双侧颞骨,根据Paxinos Watson大鼠脑图谱,在前囟后3.3mm,正中矢状缝旁开2mm,硬脑膜下3.5mm,依次切开头皮各层并切开硬脑膜,微推进器以步进方式调节电极位置(10μm/步),将金属电极缓慢推送至大鼠海马区,用示波器观察记录放电,同时信号经过A/O转换后储存于计算机中。当放电幅值较高时,停止推进电极,并等待约10min,待信号稳定后脑脊液中灌流乙酰胆碱(Ach)开始记录海马区神经元细胞放电序列和频率。
1.4 统计学方法 采用SPSS 13.0统计软件处理。实验数据用(±s)表示,对满足方差齐性的资料采用方差分析及SNK-q检验进行两两比较;否则,采用非参数Kruskal-Wallis H 检验进行组间比较。P<0.05表示差异有统计学意义。
2 结 果
2.1 成功建立了T2DM老年大鼠模型 100只老年SD大鼠持续高脂高糖饮食喂养并STZ处理后,空腹血糖检测表明,其中有97只SD大鼠为T2DM大鼠,T2DM建模成功率为97%。与普通饮食组比较,T2DM组大鼠血糖水平、血浆胰岛素水平显著高于普通饮食组(P均<0.01)。根据HOMA公式计算出的胰岛素抵抗指数(HOMA-IR)显示,T2DM组的HOMA-IR指数显著高于普通饮食组(P<0.01),表明T2DM大鼠造模成功(表1)。
表1 两组实验大鼠实验室检查指标的比较Tab.1 Comparison of laboratory examination results of the experiment animals in the two groups(±s)

表1 两组实验大鼠实验室检查指标的比较Tab.1 Comparison of laboratory examination results of the experiment animals in the two groups(±s)
与 T2DM 组比较,*P<0.01;HOMA-IR=空腹血糖水平(FPG,mmol/L)×空腹胰岛素水平(FINS,IU/L)/22.5。
组 别 数量(只) 血糖(mmol/L) 体质量(g) 血浆胰岛素水平(IU/L)HOMA-IR T2DM 组 97 27.35±4.55 560.2±12.5 25.22±2.14 28.08±4.13普通饮食组 10 5.24±2.61* 420.1±10.2 11.55±3.11* 2.13±1.08*
2.2 动物行为学及β-AP检测 100只老年SD大鼠持续高脂高糖饮食喂养后,在已确认建模成功的97只T2DM老年大鼠中,有13只老鼠表现出认知功能障碍,即T2DM+AD大鼠组。Morris水迷宫检测表明,这部分老年T2DM大鼠出现AD症状(表2),海马区域脑脊液微透析并β-AP水平检测证实AD发生,海马CA1区病理染色确证AD发生(图1)。
2.2.1 大鼠Morris水迷宫实验结果 大鼠确认造模成功后,分别在第2周和第4周用Morris水迷宫测试其定位航行能力。从表2、表3显示的结果可见,普通饮食组和T2DM组大鼠随训练次数的增加,逃避潜伏期越来越短,2组间无统计学差异;T2DM+AD组大鼠的逃避潜伏期在第2周和第4周均明显延长于普通饮食组和T2DM组,差异有统计学意义(P<0.01);特别在后潜伏期(3~5d),T2DM+AD组的逃避潜伏期明显比普通饮食组和T2DM组延长,差异有统计学意义(P<0.01)。穿越实验结果表明,T2DM+AD组大鼠在90s内的穿越平台次数的均值较普通饮食组和T2DM组都有所减少,特别是与T2DM组比较显著减少(P<0.05,表4)。Morris水迷宫实验结果表明,T2DM+AD组大鼠存在明显的学习、记忆功能障碍,而普通饮食组和T2DM组大鼠无明显差异。
表2 各组大鼠建模后第2周逃避潜伏期的测试结果Tab.2 Escape latency test results from different established rat models after two weeks(±s)

表2 各组大鼠建模后第2周逃避潜伏期的测试结果Tab.2 Escape latency test results from different established rat models after two weeks(±s)
普通饮食组与T2DM组比较无明显差异;普通饮食组与T2DM+AD组比,&P<0.01;T2DM组与T2DM+AD组比,*P<0.01;D:天数;s:秒。
组 别 数量(只) D1(s) D2(s) D3(s) D4(s) D5(s)普通饮食组 10 35.62±6.34 14.38±6.23 10.98±4.11& 8.86±3.24& 8.82±4.38&T2DM 组 84 36.67±5.89 16.65±5.68 11.12±3.54* 9.95±2.69* 9.24±4.15*T2DM+AD组 13 38.14±4.67 19.58±6.18 31.55±6.08 30.27±5.67 32.33±6.24
表3 各组大鼠建模后第4周逃避潜伏期的测试结果Tab.3 Escape latency test results from different established rat models after four weeks(±s)

表3 各组大鼠建模后第4周逃避潜伏期的测试结果Tab.3 Escape latency test results from different established rat models after four weeks(±s)
普通饮食组与T2DM组比较无明显差异;正常组与T2DM+AD组比,&P<0.01;T2DM组与T2DM+AD组比,*P<0.01。D:天数;s:秒。
组 别 数量(只) D1(s) D2(s) D3(s) D4(s) D5(s)普通饮食组 10 13.33±3.23& 11.53±3.67 13.69±3.21& 7.58±3.33& 8.82±1.68&T2DM 组 84 15.17±1.28* 10.98±5.66 11.41±4.65* 8.91±2.49* 7.21±3.25*T2DM+AD组 13 31.55±14.47 19.95±9.98 28.31±8.18 25.32±15.16 16.43±6.82
2.2.2 大鼠海马区β-AP的检测结果 3组大鼠海马区β-AP检测结果显示,普通饮食组、T2DM组、T2DM+AD组大鼠海马区域脑脊液中β-AP平均浓度分别为(12.31±1.54)pg/mL、(14.67±1.62)pg/mL和(24.87±3.54)pg/mL,与 T2DM 组及普通饮食组比较,T2DM+AD组大鼠海马区域脑脊液中β-AP水平显著升高(P<0.01)。
2.2.3 大鼠海马CA1区病理检查结果 T2DM+AD组大鼠海马CA1区银浸染色表明,有老年斑和神经原纤维缠结丝存在,确认T2DM+AD组大鼠AD发生(图1)。
2.3 电生理记录 T2DM组和T2DM+AD组各随机挑选10只大鼠行海马神经元灌流Ach并记录所引发的动作电位频率,结果表明,T2DM组大鼠海马神经元放电频率平均为(22±2)Hz,而T2DM+AD组大鼠海马神经元放电频率平均为(11±1)Hz。T2DM组放电频率显著高于T2DM+AD组(P<0.01,图2)。
表4 各组大鼠建模后穿越实验的测试结果Tab.4 Cross experiment results from different established rat models(±s)

表4 各组大鼠建模后穿越实验的测试结果Tab.4 Cross experiment results from different established rat models(±s)
普通饮食组与T2DM组比较无明显差异;T2DM组与T2DM+AD组比,*P<0.05,N:次数。
组 别 数量(只) 第2周(N) 第4周(N)普通饮食组10 3.88±2.11 3.99±1.67 T2DM组 84 4.59±2.21* 4.45±1.65*T2DM+AD组13 2.72±1.34 2.81±2.02
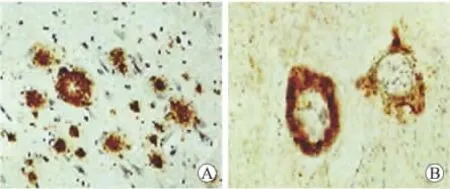
图1 海马CA1区老年斑和神经原纤维缠结丝的病理Fig.1 The pathologic results of senile plaque (SPs)and neurofibrillary tangles(NFTs)in hippocampus CA1areas of the rats
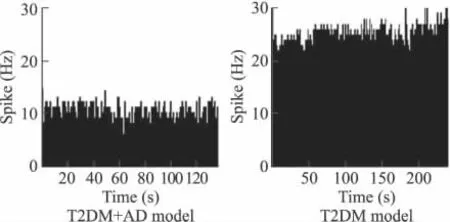
图2 两组大鼠海马神经元平均放电频率Fig.2 Average discharge frequency of two groups of rats in hippocampus neurons(n=10)
3 讨 论
临床观察表明,60岁以上的糖尿病患者中AD患病率约为10%左右[4]。近30年来,我国糖尿病患病率尤其是T2DM患病率显著增加。最近10年糖尿病流行情况更为严重,相应地,我国AD的患病率也在逐年上升[5]。迄今,尽管已提出多种关于AD的发病机制假说,但与T2DM相关的AD潜在发病机制仍未完全阐明,这与缺乏相应合适的动物模型有密切关系。长期以来,国内外不少专家都致力于寻找与临床病程相似的T2DM致AD动物模型以探究其发病机制,已有的动物模型均为采用在T2DM老年大鼠海马区域注射Aβ人为促使AD的发生[6],这样建立的动物模型不能较好地模拟T2DM致AD自然过程,认可度并不高。本研究采用高脂高糖饮食持续喂养老年大鼠模拟临床T2DM致AD自然病程以建立T2DM致AD动物模型。Morris水迷宫实验检测表明,T2DM致AD模型大鼠在确诊T2DM基础上表现出明显的学习、记忆功能障碍,并且海马区域脑脊液中β-AP水平明显升高,海马神经元灌流Ach后记录的动作电位频率也显著下降;病理检查结果表明,中枢神经系统中有老年斑和神经原纤维缠结丝发生。这些检测指标均确认建模成功。另一方面,采用本方法建模其成功率为13%,这与临床报道中T2DM患者AD发病率较接近[7],这也间接证明本建模方法能较好地模拟T2DM致AD的临床过程,采用本方法建模的科学性较强。但本建模方法也有其不足,一是建模周期长,二是建模成本较高,需要我们在今后的科研工作不断完善。
已有研究表明,T2DM致神经系统损伤的机制主要包括[8]:高血糖的毒性作用、脑血管的病理改变(脑血管改变、脑血流改变)、神经营养因子的变化(NGF、BDNF、IGF-1)、神经调质的改变(Glu受体改变、胰岛素及其受体改变、神经递质改变)等。尽管目前对T2DM认知功能障碍详尽的神经机制尚不完全清楚,但有研究表明T2DM条件下,中枢神经系统中高血糖的直接毒性、胰岛素抵抗及胰岛素细胞信号转导异常、高胆固醇血症毒性、载脂蛋白E表达增多、胰岛素样生长因子表达异常、IDE基因异常和炎性作用等均可致上述神经系统损伤发生[9],最终导致大脑皮层及脑区的细胞外间隙的β淀粉样蛋白和神经细胞内多聚Tau蛋白的沉积[10],促使AD发生。虽然目前T2DM致AD的发病机制仍未完全阐明,但建立了科学、可靠的动物模型,有助于观察T2DM和AD的密切联系并探讨T2DM致AD的发病机制,进而为AD防治药物开发提供帮助。
[1]朱向阳,牛保峰,董政协,等.2型糖尿病和阿尔茨海默病关系的研究进展[J].医学综述,2011,17(10):1528-1531.
[2]STEEN E,TERRY BM,RIVERA EJ,et al.Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer's disease—is this type 3 diabetes?[J].Alzheimers Dis,2005,7(1):63-80.
[3]MIRRA SS,HART MN,TERRY RD.Making the diagnosis of Alzheimer's disease.A primer for practicing pathologists[J].Arch Pathol Lab Med,1993,117:132-144.
[4]REITZ C,TANG MX,SCHUPF N,et al.A summary risk score for the prediction of Alzheimer disease in elderly persons[J].Arch Neurol,2010,67(7):835-841.
[5]张敏,李小华,宋达琳.降糖药物——阿尔茨海默病治疗的新思路[J].中国老年保健医学,2014,12(6):97-100.
[6]DU LL,CHAI DM,ZHAO LN,et al.AMPK activation ameliorates Alzheimer's disease-like pathology and spatial memory impairment in a streptozotocin-induced Alzheimer's disease model in rats[J].J Alzheimers Dis,2015,43(3):775-784.
[7]吕继辉,周爱红,张力,等.阿尔茨海默病精神行为症状复发的危险因素和特征[J].中国神经精神疾病杂志,2011,37(2):76-79.
[8]石森.2型糖尿病与阿尔茨海默病相关性探讨[J].继续医学教育,2012,26(11):36-39.
[9]MA L,WANG J,LI Y.Insulin resistance and cognitive dysfunction[J].Clin Chim Acta,2015,444:18-23.
[10]CHETELAT G,VILLEMAGNE VL,BOURGEAT P,et al.Relationship between atrophy and beta-amyloid deposition in Alzheimer disease[J].Ann of Neurol,2010,67(3):317-324.
