大蒜素上调蛋白亚硝基化抗动脉粥样硬化研究
2015-02-18陈玉龙黄炳俏朱宁红杨佩刚翟梦君刘恩岐
林 燕,陈玉龙,黄炳俏,朱宁红,杨佩刚,4,白 亮,翟梦君,刘恩岐,
(1.西安交通大学医学部实验动物中心,陕西西安 710061;2.西安交通大学医学部心血管中心脂代谢与动脉粥样硬化研究室,陕西西安 710061;3.西安医学院基础与转化医学研究所,陕西省缺血性心血管疾病重点实验室,陕西西安 710021;4.西安交通大学经济与金融学院,陕西西安 710061;5.湖北省襄阳市口腔医院颌面外科,湖北襄阳 441003)
亚硝基化是一氧化氮(nitric oxide,NO)与蛋白质的半胱氨酸巯基发生氧化还原反应,以共价键可逆性结合形成S-NO键导致蛋白亚硝基化,最终生成亚硝基硫醇的过程[1-2]。与蛋白质磷酸化一样,蛋白亚硝基化普遍存在于细胞信号传导过程中,是一种非常重要的蛋白翻译后修饰过程[1]。NO主要通过两条途径发挥生物学作用:环鸟苷酸(cyclic guanosine monophosphate,cGMP)依赖途径和cGMP非依赖途径。近年来,cGMP非依赖途径是心血管研究的热点。在该途径中,NO能够通过对蛋白的亚硝基化修饰调节血管多种生物学功能[3]。大蒜素是从大蒜的鳞茎中提取的一种具有挥发性的硫化物。最近的研究表明,大蒜素具有抗动脉粥样硬化作用,其机制可能与其上调内皮细胞NO水平有关[4]。然而,NO在大蒜素抗动脉粥样硬化作用中的具体机制不详。内皮细胞蛋白的亚硝基化是NO在心血管疾病中发挥抗炎和抗氧化作用的重要机制之一[3]。大蒜素能否通过上调内皮细胞蛋白亚硝基化水平发挥抗动脉粥样硬化作用仍不清楚。本实验利用高胆固醇饮食喂养apoE-/-小鼠,观察大蒜素对动脉粥样硬化进展的影响,并从内皮细胞蛋白亚硝基化的角度初步探讨大蒜素的抗动脉粥样硬化机制,为大蒜素抗动脉粥样硬化机制的研究提供一种新视角。
1 材料与方法
1.1 主要试剂 大蒜素购自上海禾丰制药有限公司;血脂检测试剂盒为北京中生北控生物科技股份有限公司产品;小鼠血浆氧化低密度脂蛋白(oxidizedlow density lipoprotein,ox-LDL)和肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)检测 ELISA试剂盒购自美国RD公司;兔抗小鼠galectin 3多克隆抗体、兔抗小鼠α-actin单克隆抗体和兔抗亚硝基化的半胱氨酸多克隆抗体均购自英国Abcam公司;辣根酶标记山羊抗兔IgG(H+L)及DAB显色液购自北京中山金桥生物技术有限公司;Ⅰ型胶原酶购自美国Gbico公司;NO及丙二醛(malondialdehyde,MDA)试剂盒均购自南京建成生物工程研究所;M199培养基和胎牛血清均为美国Hyclone公司生产;内皮细胞生长添加物购自美国Scien Cell Research公司;FITC标记的山羊抗兔IgG(H+L)购自美国Santa Cruz公司;ox-LDL购自广州奕源生物科技有限公司。
1.2 实验动物与分组 8周龄雄性apoE-/-小鼠30只,由西安交通大学医学部实验动物中心提供,随机分为3组:对照组、大蒜素低剂量组(LA组)、大蒜素高剂量组(HA组)。3组动物均给予高胆固醇饮食(含21%脂肪,0.15%胆固醇)喂养12周。LA组每日给予大蒜素9mg/kg,HA组每日给予大蒜素18 mg/kg,均用生理盐水稀释后灌胃给药,对照组每日给予灌胃等体积的生理盐水[5]。动物自由摄食及饮水,分笼(3或4只/笼)饲养于SPF级饲养环境。SPF级饲养环境:室温(20±2)℃,相对湿度40%~70%,每日明暗室各12h。每周称量动物的体重及剩余饲料。本研究的动物实验由西安交通大学实验室动物管理委员会依据西安交通大学实验室动物准则和美国国家健康委员会出版的实验室动物福利和使用准则(NIH Publication No.85-23,revised 2011)批准实施。
1.3 apoE-/-小鼠血脂、血浆 NO、MDA、ox-LDL以及TNF-α水平的检测 于实验开始后0、4、8、12周,采用肝素处理的毛细玻璃管于小鼠尾部采血,每只小鼠采血量为3支毛细玻璃管。实验结束后,麻醉小鼠,摘眼球最大量采血。每次采血前小鼠禁食最少8h。3 000r/min离心10min,取上清,待测血浆指标。血浆总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白 胆 固 醇 (low density lipoprotein cholesterol,LDL-C)、NO及MDA均按照试剂盒提供的方法进行检测。血浆ox-LDL和TNF-α水平均采用小鼠ELISA试剂盒检测。具体步骤均参照说明书操作。
1.4 apoE-/-小鼠主动脉根部斑块的病理学观察以及血管蛋白亚硝基化水平的检测 实验结束采集血液标本之后,用磷酸盐缓冲溶液从左心室逆行灌注主动脉后,自心脏至腹主动脉末端左右髂总动脉分叉离断整个动脉树。将所有小鼠心脏连带近心端2~3 mm主动脉切下,制备主动脉根部8μm厚连续冰冻切片。冰冻切片每间隔8张取1张,进行苏木精伊红染色(hematoxylin and eosin,HE)和范吉尔森弹性纤维(elastica van Gieson,EVG)染色,分析大蒜素对小鼠主动脉根部动脉粥样硬化斑块形态及大小的影响;免疫组化染色分析大蒜素对其主动脉根部斑块中巨噬细胞(macrophage,MΦ)和血管平滑肌细胞(vascular smooth muscle cell,VSMC)含 量 的 影响[6]。各标本经组织化学染色后均采集图像,应用Win ROOF V6.5(Mitani Co.,Ltd.,Fukui,Japan)图像分析软件计算斑块及其组分面积[6]。
免疫荧光分析大蒜素对小鼠主动脉根部蛋白亚硝基化水平的影响。主动脉根部冰冻切片室温放置30min后,丙酮室温固定10min,透化液(含1mL/L Trion X-100,30g/L牛血清白蛋白)室温透化15min,50 mL/L山羊血清室温封闭30min,兔抗亚硝基化的半胱氨酸多克隆抗体(1∶100)4℃孵育过夜,FITC标记的山羊抗兔IgG(H+L)室温孵育60min,DAPI染核15min后,甘油封片,荧光显微镜下观察,采集图片[7]。
1.5 人脐静脉内皮细胞的培养及分组 人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)由新鲜的人脐带用1g/LⅠ型胶原酶消化法分离获得后,用含有200mL/L胎牛血清、100U/mL青霉素、100mg/mL链霉素、40μg/mL肝素钠以及10g/L内皮细胞生长添加物的M199完全培养基培养。HUVECs完全融合成典型的“铺路石”状时,用胰酶消化液(0.5g/L的胰蛋白酶+0.2g/L的ED-TANa2)消化并传代,第3代用于实验。
待细胞融合度达90%左右时,用含20mL/L胎牛血清的M199培养基饥饿18h后,实验设正常对照组、安慰剂组[溶解药物等体积的DMSO+ox-LDL(50μg/mL)],低剂量大蒜素组[大蒜素(10μmol/L)+ox-LDL(50μg/mL)]、高剂量大蒜素组[大蒜素(20μmol/L)+ox-LDL(50μg/mL)][8]。分别处理24h后检测各项指标。
本实验所用脐带均由西安交通大学医学部第一附属医院提供,本研究获得西安交通大学伦理委员会许可。
1.6 检测HUVECs培养上清液NO及HUVECs蛋白亚硝基化水平 采用硝酸还原酶法检测上清中NO水平,具体步骤参照说明书操作。细胞爬片经40 g/L多聚甲醛室温固定后,免疫荧光法标记 HUVECs亚硝基化蛋白(具体步骤同主动脉根部免疫荧光法),甘油封片,荧光显微镜下观察,采集图片,利用Image-Pro Plus软件分析荧光强度[7]。
1.7 统计学分析 应用SPSS 18.0统计软件。采用均数±标准差对计量资料进行描述,对各组数据进行正态性及方差齐性检验,符合正态性分布及方差齐性后采用重复测量设计的方差分析、单因素方差分析结合Tukey's test检验分别对其进行统计学分析。若不满足正态性和方差齐性的条件则采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 大蒜素对血脂水平影响 经统计学分析实验数据均为正态分布、方差齐,重复测量设计的方差分析显示,3组实验动物间饲料消耗和体重变化均无统计学差异;各组小鼠血浆 TC(P=0.001)、TG(P=0.001)、LDL-C(P=0.001)和 HDL-C(P=0.023)水平的升高具有时间依赖性;与对照组相比,高、低剂量组小鼠血浆TC(P=0.708)、TG(P=0.324)和LDL-C(P=0.763)水平均有下降趋势,但无统计学意义(图1)。
2.2 大蒜素对氧化应激和炎症相关指标的影响 高胆固醇饮食喂养apoE-/-小鼠12周后,经统计学分析各组实验数据均为正态分布、方差齐,与对照组相比,大蒜素处理组血浆ox-LDL、MDA和TNF-α均明显下降(图2)。LA组和HA组血浆ox-LDL分别下降了27.82% (P=0.014)、26.39%(P=0.029);MDA分别下降了38.86%(P=0.028)和40.87%(P=0.029);TNF-α分别下降了58.92%(P=0.001)和54.71%(P=0.002)。LA组和HA组间的血浆ox-LDL、MDA和TNF-α差异均无统计学意义。
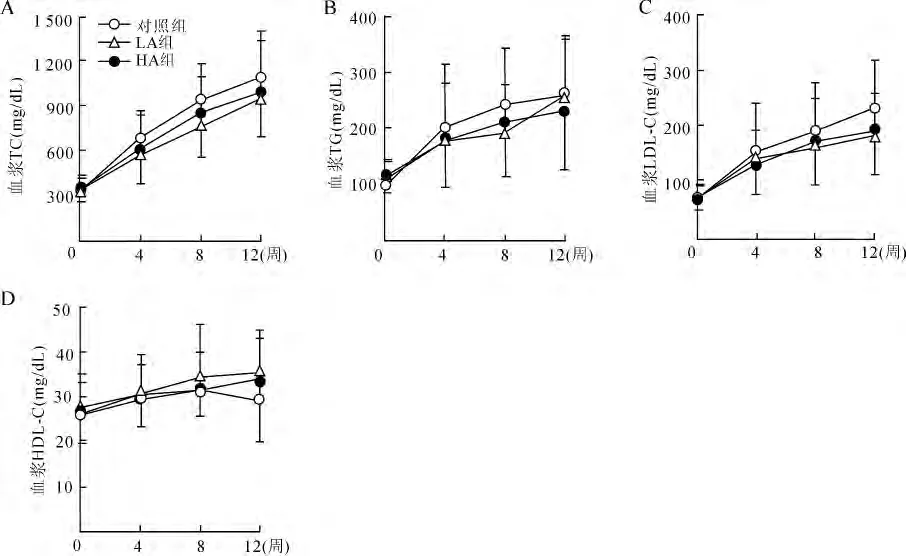
图1 大蒜素对高胆固醇饮食apoE-/-小鼠血脂 TC(A)、TG(B)、LDL-C(C)及HDL-C(D)水平的影响Fig.1 The effects of allicin on the levels of plasma lipids TC(A),TG(B),LDL-C(C)and HDL-C(D)in apoE-/-mice fed with high cholesterol diet
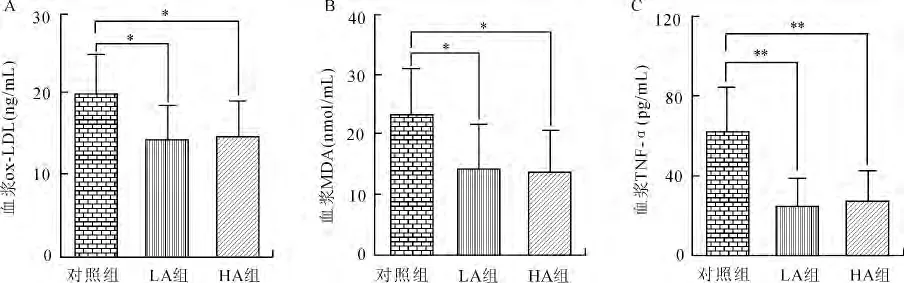
图2 大蒜素对小鼠血浆ox-LDL(A)、MDA(B)、TNF-α(C)的影响Fig.2 The effects of allicin on ox-LDL (A),MDA (B),TNF-α(C)in mice fed with high cholesterol diet
2.3 大蒜素对动脉粥样硬化斑块形成的影响 高胆固醇饮食喂养apoE-/-小鼠12周后,3组小鼠主动脉根部均见斑块形成,斑块内见大量泡沫细胞散在分布,并见脂核(图3A)。EVG染色及免疫组化染色定量结果经检验各组数据均为正态分布、方差齐。与对照组相比,LA组和HA组小鼠主动脉根部斑块面积显著减少,分别减少了46.29%(P=0.003)和39.67%(P=0.012)(图3B);LA组和HA组小鼠主动脉根部斑块中MΦ及VSMC的含量均明显减少,MΦ分别减少了31.58%(P=0.02)和30.12%(P=0.027),VSMC分别减少了40.18%(P=0.018)和37.95%(P=0.026)(图3B);但LA组和 HA组间上述指标差异均无统计学意义。
2.4 大蒜素对小鼠血浆NO水平及主动脉根部蛋白亚硝基化水平的影响 高胆固醇饮食喂养apoE-/-小鼠12周后,经统计学分析各组数据均为正态分布、方差齐,与对照组相比,LA组和HA组小鼠血浆NO水平均显著升高,分别升高了57.24%(P=0.044)和69.41%(P=0.019)(图4)。与血浆NO水平变化趋势一致,大蒜素处理后小鼠主动脉根部蛋白亚硝基化水平较对照组明显升高(图5)。
2.5 大蒜素对HUVECs产生NO及其蛋白亚硝基化水平的影响 各组HUVECs经不同因素处理24h后,细胞形态正常。经统计学分析各实验组细胞上清NO水平及细胞蛋白亚硝基化水平均为正态分布、方差齐。上清中NO检测结果显示,与对照组相比,安慰剂组NO水平显著减少(P=0.001),而高低剂量大蒜素处理组NO水平较安慰剂组显著升高(P均=0.002);与上清液中NO水平变化趋势一致,与对照组相比,安慰剂组HUVECs蛋白亚硝基化水平显著下降(P=0.001),而高低剂量大蒜素处理组 HUVECs蛋白亚硝基化水平较安慰剂组显著升高(均P=0.002)(图6);但两大蒜素处理组间上清液中NO水平及HUVECs蛋白亚硝基化水平差异均无统计学意义。
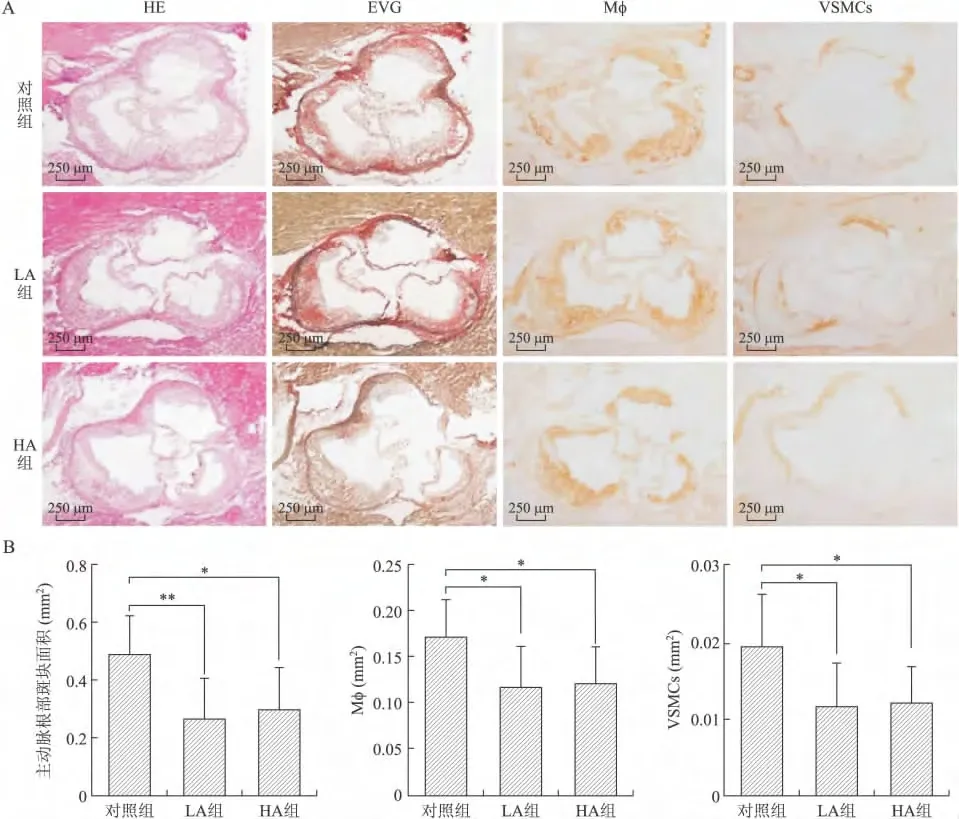
图3 大蒜素对高胆固醇饮食喂养的apoE-/-小鼠主动脉根部斑块形成的影响Fig.3 Histological analysis of aortic atherosclerosis in apoE-/-mice fed with high cholesterol diet

图4 大蒜素对小鼠血浆NO水平的影响Fig.4 The effects of allicin on NO in mice fed with high cholesterol diet
3 讨 论
本研究发现,大蒜素能够明显抑制高胆固醇饮食诱导的apoE-/-小鼠动脉粥样硬化。结果显示,大蒜素不仅能够减少主动脉根部斑块的面积,也能够抑制斑块内MΦ和VSMC的含量;大蒜素还能够显著减少血浆ox-LDL、MDA和TNF-α水平,同时增加血浆NO及主动脉根部蛋白亚硝基化水平。另外,体外实验结果显示,大蒜素能够恢复由ox-LDL所导致HUVECs产生NO及其蛋白亚硝基化水平的抑制。
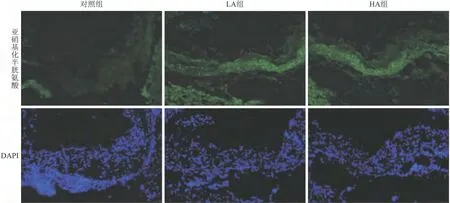
图5 大蒜素对小鼠主动脉根部蛋白亚硝基化水平的影响Fig.5 The effects of allicin on protein S-nitrosylation of the aortic root in the mouse model(×100)

图6 大蒜素处理对培养HUVECs NO的产生及蛋白亚硝基化水平的影响Fig.6 The effects of allicin on protein S-nitrosylation and NO release in HUVECs(×200)
NO生物利用度的减少是内皮细胞功能紊乱的主要特征性表现,内皮细胞功能紊乱又是动脉粥样硬化发生发展整个阶段中的起始环节[9]。近年的研究表明,内皮细胞的蛋白亚硝基化修饰是NO发挥血管调节的重要途径。蛋白亚硝基化是一种体内广泛存在的翻译后修饰,能够影响细胞的代谢过程,从而调控血管功能。迄今为止,被鉴定出的内皮细胞亚硝基化蛋白已达100多种。这些经亚硝基化修饰的蛋白在调控炎症、细胞凋亡、内皮细胞的渗透性、细胞迁移、细胞生长以及血管僵硬度方面发挥重要作用[10-15]。体内的NO主要由一氧化氮合酶(nitric oxide synthase,NOS)分解L-精氨酸产生。在完整的血管中,大部分NO由内皮细胞的内皮NOS(endothelial NOS,eNOS)产生。本实验大蒜素处理组小鼠的血浆NO水平及主动脉根部总蛋白亚硝基化水平均明显升高。这可能与大蒜素提高内皮细胞的eNOS活性有关,并且NO调节细胞功能主要通过蛋白质半胱氨酸残基亚硝基化修饰介导[16]。为了研究血管内皮细胞蛋白亚硝基化水平变化,本实验还观察了大蒜素对ox-LDL刺激的HUVECs产生NO及蛋白亚硝基化水平的影响。结果发现,合用大蒜素处理HUVECs后,其NO水平及蛋白亚硝基化水平明显高于ox-LDL单独刺激组,而ox-LDL能够明显降低内皮细胞产生NO及其蛋白亚硝基化水平。即大蒜素能够有效改善ox-LDL所引起的内皮细胞产生NO及发生蛋白亚硝基化水平的下降。
另外,氧化应激和炎症反应在动脉粥样硬化的发生发展过程中发挥很重要的作用[17-18]。大蒜素能够有效清除超氧阴离子和羟自由基,使脂质过氧化水平降低,从而有效地减轻其对血管内皮和VSMC的损伤,减少血小板在损伤部位的粘附和聚集,同时减少炎症因子的释放,最终发挥其抗动脉粥样硬化作用[19]。已有研究表明,亚硝基化能够通过抑制氧化应激和炎症反应相关蛋白的活性发挥抗氧化应激和抗炎作用。如,NADPH还原性辅酶Ⅱ氧化酶组成因子p47phox的亚硝基化能够抑制该酶的活化,从而抑制内皮细胞发生氧化应激[20-21];核转录因子-κB(nuclear factor-κB,NF-κB)亚基p65的亚硝基化能够抑制其核转位[22],NF-κB亚基p50的亚硝基化能够抑制其与DNA结合[23],从而抑制NF-κB的活化,发挥抗炎作用。本研究结果显示,大蒜素在促进NO产生的同时,能够减少血浆ox-LDL、MDA和TNF-α水平。这表明大蒜素具有抗氧化及抗炎作用,其作用机制可能与NO介导的亚硝基化作用有关。然而,大蒜素的作用效果未显示剂量依赖效应。
综上所述,大蒜素具有显著的抗动脉粥样硬化作用,与其通过上调内皮细胞蛋白亚硝基化水平所发挥抗氧化应激和抗炎作用有关。这将为研究动脉粥样硬化的发生机制及其防治提供理论基础。
[1]DERAKHSHAN B,HAO G,GROSS SS.Balancing reactivity against selectivity:the evolution of protein S-nitrosylation as an effector of cell signaling by nitric oxide[J].Cardiovasc Res,2007,75(2):210-219.
[2]FOSTER MW,HESS DT,STAMLER JS.Protein S-nitrosylation in health and disease:a current perspective[J].Trends Mol Med,2009,15(9):391-404.
[3]LIMA B,FORRESTER MT,HESS DT,et al.S-nitrosylation in cardiovascular signaling[J].Circ Res,2010,106(4):633-646.
[4]LIU D,GAO W,LIANG E,et al.Effects of allicin on hyper-homocysteinemia-induced experimental vascular endothelial dysfunction[J].Eur J Pharmacol,2013,714(1-3):163-169.
[5]GONEN A,HARATS D,RABINKOV A,et al.The antiatherogenic effect of allicin:possible mode of action[J].Pathobiology,2005,72(6):325-334.
[6]ZHANG CF,ZHENG HD,YU Q,et al.A practical method for quantifying atherosclerotic lesions in rabbits[J].J Comp Pathol,2010,142(2-3):122-128.
[7]CHEN YL,ZHAO SH,WANG YL,et al.Homocysteine reduces protein S-nitrosylation in endothelium[J].Int J Mol Med,2014,34(5):1277-1285.
[8]HOREV-AZARIA L,ELIAV S,IZIGOV N,et al.Allicin upregulates cellular glutathione level in vascular endothelial cells[J].Eur J Nutr,2009,48(2):67-74.
[9]BONETTI PO,LERMAN LO,LERMAN A.Endothelial dysfunction:a marker of atherosclerotic risk[J].Arterioscler Thromb Vasc Biol,2003,23(2):168-175.
[10]MATSUSHITA K,MORRELL CN,CAMBIEN B,et al.Nitric oxide regulates exocytosis by S-nitrosylation of N-ethylmaleimide-sensitive factor[J].Cell,2003,115(2):139-150.
[11]KANG-DECKER N,CAO S,CHATTERJEE S,et al.Nitric oxide promotes endothelial cell survival signaling through S-nitrosylation and activation of dynamin-2[J].J Cell Sci,2007,120(Pt 3):492-501.
[12]THIBEAULT S,RAUTUREAU Y,OUBAHA M,et al.S-nitrosylation of beta-catenin by eNOS-derived NO promotes VEGF-induced endothelial cell permeability[J].Mol Cell,2010,39(3):468-476.
[13]PI XC,WU YX,FERGUSON JE3rd,et al.SDF-1alpha stimulates JNK3 activity via eNOS-dependent nitrosylation of MKP7 to enhance endothelial migration[J].Proc Natl Acad Sci USA,2009,106(14):5675-5680.
[14]OLIVEIRA CJ,CURCIO MF,MORAES MS,et al.The low molecular weight S-nitrosothiol,S-nitroso-N-acetylpenicillamine,promotes cell cycle progression in rabbit aortic endothelial cells[J].Nitri Oxide,2008,18(4):241-255.
[15]SANTHANAM L,TUDAY EC,WEBB AK,et al.Decreased S-nitrosylation of tissue transglutaminase contributes to age-related increases invascular stiffness[J].Circ Res,2010,107(1):117-125.
[16]HESS DT,MATSUMOTO A,KIM SO,et al.Protein S-nitrosylation:purview and parameters[J].Nat Rev Mol Cell Biol,2005,6(2):150-166.
[17]BONOMINI F,TENGATTINI S,FABIANO A,et al.Atherosclerosis and oxidative stress[J].Histol Histopathol,2008,23(3):381-390.
[18]LIBBY P,RIDKER PM,HANSSON GK.Inflammation in atherosclerosis:from pathophysiology to practice[J].J Am Coll Cardiol,2009,54(23):2129-2138.
[19]CHAN JY,YUEN AC,CHAN SW,et al.A review of the cardiovascular benefits and antioxidant properties of allicin[J].Phytother Res,2013,27(5):637-646.
[20]SELEMIDIS S,DUSTING GJ,PESHAVARIYA H,et al.Nitric oxide suppresses NADPH oxidase-dependent superoxide production by S-nitrosylation in human endothelial cells[J].Cardiovasc Res,2007,75(2):349-358.
[21]樊洪波,李冬梅,石搏,等.大豆皂苷对糖尿病大鼠心肌组织中NOX4和P22phox表达的影响及其对心肌的保护作用[J].吉林大学学报:医学版,2013,39(2):251-254.
[22]PRASAD R,GIRI S,NATH N,et al.GSNO attenuates EAE disease by S-nitrosylation-mediated modulation of endothelialmonocyte interactions[J].Glia,2007,55(1):65-77.
[23]MARSHALL HE,STAMLER JS.Inhibition of NF-kappa B by S-nitrosylation[J].Biochemistry,2001,40(6):1688-1693.
