G蛋白偶联的内整流型钾通道在哮喘模型大鼠肺组织的表达
2015-02-18杨旭东宁启兰蒋晓刚孙青竹张富军王慧莲
杨旭东,宁启兰,蒋晓刚,孙青竹,刘 莉,韩 燕,张富军,王慧莲
(西安交通大学医学部遗传学与分子生物学系,陕西西安 710061)
过敏性哮喘是一种常见的Th2细胞介导的支气管过敏性炎症性疾病[1]。目前尚无治疗哮喘的有效方法,但近年来过敏性哮喘在我国的发病率却呈不断上升的趋势,深入研究哮喘的发病机制对于建立更有效的治疗方法具有重要意义[2]。大量研究显示,多种外向型钾通道在哮喘气道炎症、气道高反应性以及气道重塑等病理生理过程中均发挥重要的作用,被视为治疗哮喘的药物靶点[3]。而G蛋白偶联的内整流钾通道(G protein-coupled inwardly rectifying potassium channel,GIRK)可在被活化的G蛋白释放的Gβγ复合物激活后产生内向电流,对于膜电位的恢复具有重要意义[4]。研究发现,GIRK通道在正常的气道上皮细胞表面表达[5]。G蛋白偶联受体广泛参与了哮喘的病程[6],并且组胺、乙酰胆碱等多种可引发气道异常收缩的神经递质也都可激活GIRK[7-8]。因此,我们推测GIRK通道与哮喘也有密切的联系。为了验证假说,我们检测了E3大鼠哮喘模型肺组织中构成GIRK的各种亚基表达水平的变化,及受到IL-4刺激的气道上皮细胞中GIRK通道表达的变化。
1 材料与方法
1.1 实验动物与试剂 成年健康E3大鼠,雌雄各半,共16只,体质量160~200g,由西安交通大学医学部遗传学与分子生物学系提供。卵清蛋白(ovalbumin,OVA)和硫酸铝钾(aluminium potassium sulfated)由Sigma公司提供;小鼠抗大鼠IgE重链抗体和辣根过氧化物酶标记的小鼠抗大鼠λ链κ链抗体由 AbD Serotec公司提供;抗 GIRK1和GIRK3的抗体由Bioworld公司提供;辣根过氧化物酶标记抗兔抗体和IL-4由博奥森公司提供。
1.2 哮喘模型的制备 把16只E3大鼠按照随机数字表法分为对照组与哮喘模型组,每组8只。哮喘模型组大鼠腹腔注射1mg/mL OVA、50mg/mL铝佐剂,注射后第14天,令大鼠吸入100μL 1mg/mL OVA的溶液,激发哮喘。每天1次,连续7d。对照组大鼠腹腔注射磷酸盐缓冲液(PBS),注射后14d,令大鼠吸入PBS。末次激发24h后处死动物。
1.3 组织化学染色观察肺组织的病理学改变 取大鼠左侧第三叶肺,经4g/L多聚甲醛固定、脱水,用石蜡包埋组织并切片。用苏木素-伊红染色(HE),在显微镜下观察炎症细胞在肺组织的浸润。高碘酸-雪夫反应(PAS)染色,观察支气管黏液的生成。
1.4 ELISA检测血清总IgE水平 用2μg/mL小鼠抗大鼠IgE重链抗体包被酶标板。在每孔中加入150μL封闭液,在37℃封闭1h。在每一孔中加入50μL 1 000倍稀释的血清样品,37℃孵育1h。在每一孔中加入50μL 3 000倍稀释的辣根过氧化物酶标记的小鼠抗大鼠λ/κ链抗体,37℃孵育30min。在每一孔中加入100μL的TMB底物,37℃孵育20min。随后每孔加入100μL 1.87mol/L的 H2SO4以终止反应,在450nm波长读取A值。
1.5 RT-PCR检测肺组织和A549细胞中GIRK各亚基的mRNA水平 用Trizol提取肺组织和A549细胞中的总RNA,在核酸蛋白定量仪上测定RNA样品的浓度。取2μg总RNA,用MBI的反转录试剂盒反转录为cDNA。PCR所需的引物序列见表1。实时定量PCR扩增,反应体系为10μL,引物浓度为10pmol/μL。扩增条件:94℃ 变性30s,58℃退火30s,72℃延伸30s,40个循环,用凝胶成像系统进行定量。

表1 人与大鼠GIRK各亚基以及管家基因的引物序列Tab.1 The primers for GIRK subunits and house-keeping genes of rats and humans
1.6 Western blot检测肺组织和A549细胞中GIRK1和GIRK3的蛋白水平 用RIPA裂解组织与细胞提取蛋白质。用BCA试剂盒测定蛋白样品的浓度。在100 mL/L分离胶后电泳分离不同的蛋白,电压为120V;把蛋白质从凝胶中转移到硝酸纤维素膜上,电压100V;转膜后,用50g/L的脱脂奶粉封闭;用1 000倍稀释的抗GIRK1或是GIRK3抗体作为一抗,用5 000倍稀释的辣根过氧化物酶标记的小鼠抗兔IgG作为二抗,滴加ECL化学发光液发光,用X光片显影。
1.7 免疫组化染色观察肺组织GIRK1的表达水平肺组织的石蜡切片经脱蜡至水,用0.979mol/L H2O2灭活内源性过氧化物酶。用胰酶修复抗原,用牛血清白蛋白封闭30min,滴加兔抗GIRK1抗体(1∶100)4℃过夜,再滴加生物素标记的抗兔抗体在37℃孵育30min,滴加辣根过氧化物酶标记的链亲和素在37℃孵育20min,用DAB显色。
1.8 IL-4刺激对A549细胞GIRK表达的影响A549细胞用含有100mL/L的小牛血清的1640培养基培养。按照5×105/孔把细胞种到6孔板,分别用0、25、50、100ng/mL IL-4刺激24h;另外用50 ng/mL IL-4分别刺激 A549细胞0、6、12、24、48h,观察IL-4刺激剂量、时间与GIRK表达水平的关系。
1.9 统计学处理 数据用均数±标准差表示,对照组与哮喘模型组之间总IgE的比较采用Student t检验。采用重复测量单因素方差分析来比较IL-4刺激的细胞中GIRK1-4表达情况。所有统计采用统计软件GraphPad Prism5完成,以P<0.05为差异有统计学意义。
2 结 果
2.1 E3大鼠哮喘模型的评估 组织切片HE染色,在光镜下可见对照组肺组织结构正常,气道周围无明显的炎症细胞浸润(图1A);哮喘模型组肺组织的支气管周围可见大量炎症细胞浸润(图1B)。另外,组织切片的PAS染色也显示在对照组的气道上皮生成的黏液较少(图1C),而哮喘模型组的气道上皮中黏液的生成也显著增强(图1D)。哮喘模型组与对照组相比,血清总IgE水平升高,差异有统计学意义(P=0.024,图2)。肺组织的病理切片以及血清中IgE水平的检测都显示OVA在E3大鼠引发炎症,哮喘模型诱导成功。
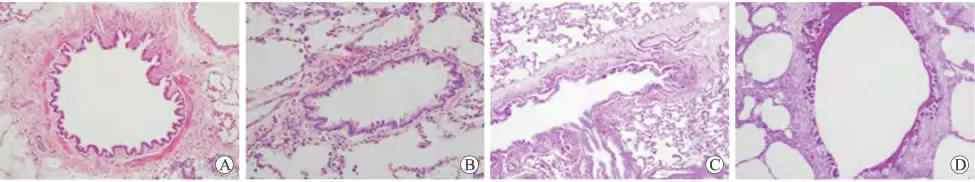
图1 E3大鼠哮喘模型的肺组织的病理改变Fig.1 The pathological changes of the lung in E3rat asthma model
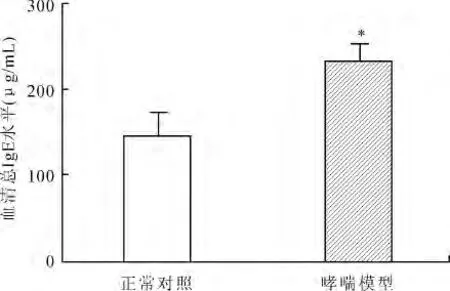
图2 哮喘模型组和对照组血清总IgE水平的比较Fig.2 The levels of total IgE in asthma model and control groups
2.2 GIRK各亚基表达的改变 在正常大鼠以及哮喘模型大鼠的肺组织中,构成GIRK通道的4种亚基,GIRK1、2、3以及4均有表达。与对照组相比,模型组大鼠肺组织GIRK1、2、3、4的mRNA水平低于对照组,差异均有统计学意义(P=0.008、0.005、0.001 6、0.002,图3)。Western blot结果显示,哮喘组大鼠肺组织中GIRK1和GIRK3的蛋白水平低于对照组(图4)。用抗GIRK1亚基的抗体做免疫组化,GIRK1亚基的阳性染色主要分布于气道上皮(图5)。GIRK1在正常对照组染色较少,哮喘模型组大鼠气道上皮的阳性染色增多(图5)。
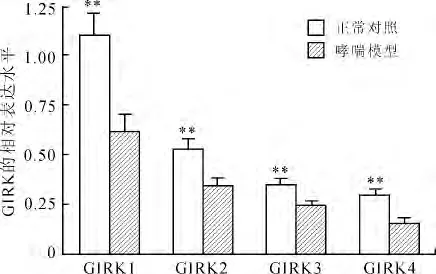
图3 哮喘模型组和对照组肺组织GIRK各亚基mRNA水平的比较Fig.3 The mRNA levels of GIRK subunits in the lung in asthma model and control groups
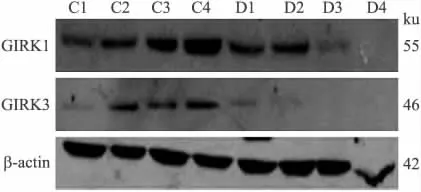
图4 哮喘模型组和对照组肺组织GIRK1、GIRK3蛋白水平的比较Fig.4 The protein levels of GIRK1and GIRK3in the lung in asthma model and control groups
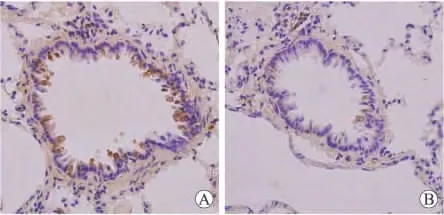
图5 哮喘模型组和对照组肺组织GIRK1的表达Fig.5 The expression of GIRK1in the lung in asthma model and control groups(×400)
2.3 IL-4对A549细胞GIRK通道表达的影响 IL-4可下调GIRK各亚基的表达。在作用24h后,与对照组相比,25、50、100ng/mL的IL-4下调GIRK1、GIRK3和GIRK4mRNA的表达水平,重复测量方差分析显示,各浓度间差异有统计学意义(F=70.86,P<0.000 1;F=67.13,P<0.000 1;F=52.23,P<0.000 1)(表2)。另外,在50ng/mL IL-4处理6、12、24、48h,随着处理时间的延长,GIRK1、GIRK3和 GIRK4 mRNA水平也下降,重复测量方差分析显示,各时间点间差异有统计学意义(F=73.14,P<0.000 1;F=36.62,P=0.0003;F=13.44,P=0.0045)(表3)。而较高浓度IL-4(≥50ng/mL)处理24h以上可下调GIRK2的表达水平,但是GIRK2的mRNA水平与IL-4浓度之间无时间与剂量依赖关系。
2.4 IL-4下调A549细胞GIRK的蛋白水平 Western blot结果显示,不同剂量的IL-4刺激A549细胞24h后,GIRK1和GIRK3的蛋白表达水平也表现出剂量依赖性的下降(图6)。
3 讨 论
长期以来,钾通道在哮喘中的作用一直广受关注,但这种关注主要集中在钾通道开放对气道平滑肌兴奋性的影响上;而对钾通道在肺组织非兴奋性细胞中的作用及变化都较少涉及。近年来,研究人员陆续在气道上皮细胞表面发现了30多种钾通道,它们分别归属于具有6个跨膜结构域的电压依赖性钾通道、具有6个跨膜结构域的Ca2+依赖性钾通道、具有4个跨膜结构域的双孔钾通道和具有2个跨膜结构域的内整流钾通道[9]。而且气道上皮细胞表面的钾通道与细胞的生物学活动也有密切的联系,目前已知多种钾通道可作为气道上皮细胞的氧分压的感受器,并可调节气道上皮细胞的迁移、增殖及氯离子和钠离子的跨膜转运[9]。由于气道上皮对于先天性免疫、继发免疫、气道收缩和重塑等过程有广泛的调节作用[10],气道上皮细胞表面钾通道在哮喘病程中的作用也成为哮喘研究的重点之一。
表2 IL-4刺激24h后GIRK各亚基mRNA的相对表达水平Tab.2 The mRNA levels of GIRK subunits after 24-hour stimulation with IL-4(±s,n=3)
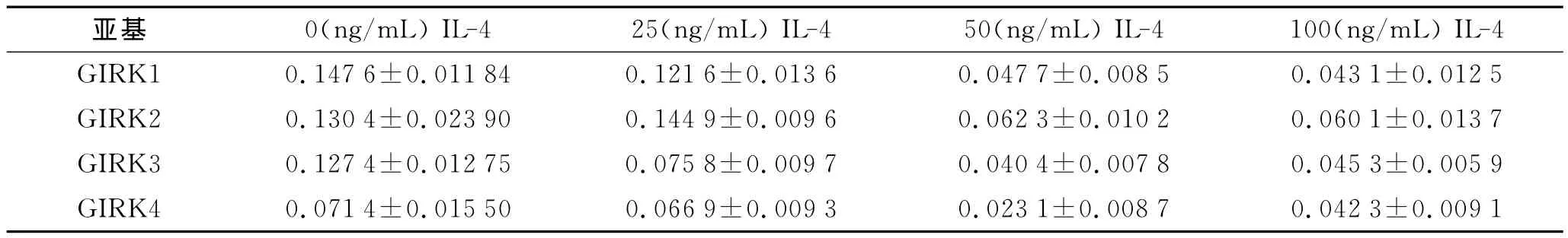
表2 IL-4刺激24h后GIRK各亚基mRNA的相对表达水平Tab.2 The mRNA levels of GIRK subunits after 24-hour stimulation with IL-4(±s,n=3)
亚基 0(ng/mL)IL-4 25(ng/mL)IL-4 50(ng/mL)IL-4 100(ng/mL)IL-4 GIRK1 0.147 6±0.011 84 0.121 6±0.013 6 0.047 7±0.008 5 0.043 1±0.012 5 GIRK2 0.130 4±0.023 90 0.144 9±0.009 6 0.062 3±0.010 2 0.060 1±0.013 7 GIRK3 0.127 4±0.012 75 0.075 8±0.009 7 0.040 4±0.007 8 0.045 3±0.005 9 GIRK4 0.071 4±0.015 50 0.066 9±0.009 3 0.023 1±0.008 7 0.042 3±0.009 1
表3 IL-4刺激不同时间点GIRK各亚基mRNA的相对表达水平Tab.3 The mRNA levels of GIRK subunits after IL-4stimulation at different time points(±s,n=3)
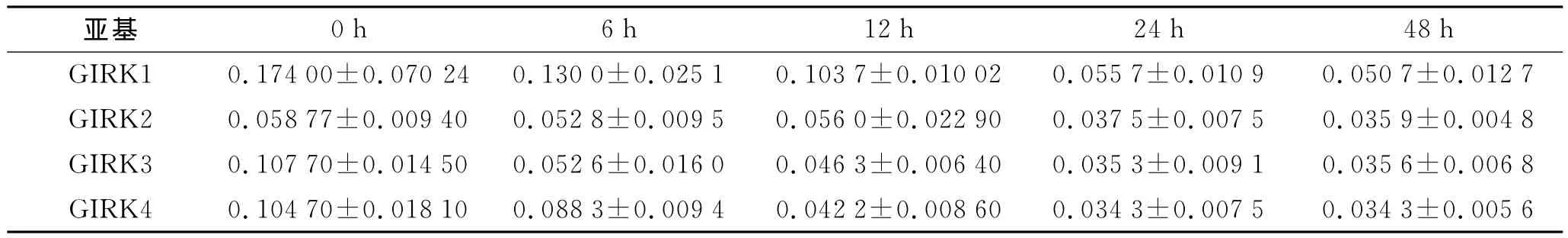
表3 IL-4刺激不同时间点GIRK各亚基mRNA的相对表达水平Tab.3 The mRNA levels of GIRK subunits after IL-4stimulation at different time points(±s,n=3)
亚基0h 6h 12h 24h 48h GIRK1 0.174 00±0.070 24 0.130 0±0.025 1 0.103 7±0.010 02 0.055 7±0.010 9 0.050 7±0.012 7 GIRK2 0.058 77±0.009 40 0.052 8±0.009 5 0.056 0±0.022 90 0.037 5±0.007 5 0.035 9±0.004 8 GIRK3 0.107 70±0.014 50 0.052 6±0.016 0 0.046 3±0.006 40 0.035 3±0.009 1 0.035 6±0.006 8 GIRK4 0.104 70±0.018 10 0.088 3±0.009 4 0.042 2±0.008 60 0.034 3±0.007 5 0.034 3±0.005 6
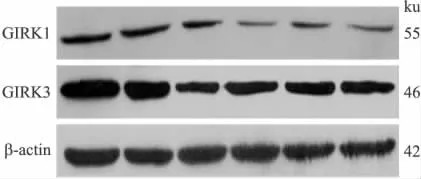
图6 IL-4刺激24hA549细胞中GIRK1和GIRK3的蛋白水平的改变Fig.6 The protein levels of GIRK1and GIRK3in A549cell line after 24-hour stimulation with IL-4
GIRK是内整流钾通道的家族成员,由四种亚基构成的同四聚体或异四聚体,它可形成内向的钾电流[4]。由于GIRK可形成内向型钾电流,所以它与外向型钾通道的作用相反,可导致胞膜去极化[4]。目前对于GIRK通道功能的研究主要集中在神经和心肌等可兴奋组织;关于GIRK通道在肺组织及呼吸系统疾病中作用研究的很少。我们所观察到的GIRK通道在哮喘模型中表达下降是首次报道GIRK通道与过敏性哮喘有关联。
虽然GIRK通道在哮喘病程中的作用还不明确,但由于G蛋白偶联受体与气道炎症、气道收缩、气道重塑等哮喘病程的各个环节都密切相关[5];特别是G蛋白偶联受体在气道上皮功能的调节中有重要的作用[5];而GIRK通道是G蛋白偶联受体下游的效应分子,因此它也成为哮喘调节环路上的一个环节。GIRK可被Gi蛋白激活[12]。目前已经发现多种存在于气道上皮细胞表面的Gi蛋白偶联受体,它们与配体结合后往往可舒张支气管平滑肌、降低趋化因子的释放、抑制炎症发生,从而减轻哮喘的症状。例如,苦味素受体Tas2R[11]和溶血磷脂酸受体P2Y5等[12]受体都与 Gi蛋白偶联[13-14],它们与配体结合后可减轻气道炎症。GIRK通道就是这些Gi蛋白偶联受体的下游分子。因此,GIRK通道表达水平的下降可能与哮喘病程中Gi蛋白偶联受体抑炎作用的削弱有关。
IL-4是哮喘病程中发挥关键作用的促炎因子,它可促进嗜酸性粒细胞浸润、气道炎症以及黏液高分泌[15-16]。此外,IL-4还可调节钾通道的功能,IL-4可增强大电导率 Ca2+激活的钾通道[BK(Ca)]电流[17]。BK(Ca)是外向型钾通道,增强BK(Ca)电流可促进胞膜极化。我们的结果显示,IL-4可下调GIRK通道的表达。GIRK的作用与BK(Ca)相反,会促进胞膜去极化。由此可见,IL-4可以协调不同类型的钾通道的活动,从而调节细胞功能。
IL-4对气道上皮细胞GIRK通道的表达的调节反映了哮喘病程中各种免疫因素与非免疫性的因素之间错综复杂的相互作用,也为我们认识疾病提供了新的视角。进一步阐明GIRK通道在哮喘及气道上皮中的作用必然会促进我们深入了解哮喘的发病机制,并为寻找更有效的治疗策略提供线索。
[1]JUTEL M.Allergen-specific immunotherapy in asthma[J].Curr Treat Options Allergy,2014,12(1):213-219.
[2]SONG WJ,KANG MG,CHANG YS,et al.Epidemiology of adult asthma in Asia:toward a better understanding[J].Asia Pac Allergy,2014,4(2):75-85.
[3]BRADDING P,WULFF H.The K+channels K(Ca)3.1 and K(v)1.3 as novel targets for asthma therapy[J].Br J Pharmacol,2009,157(8):1330-1339.
[4]BODHINATHAN K,SLESINGER PA.Alcohol modulation of G-protein-gated inwardly rectifying potassium channels:from binding to therapeutics[J].Front Physiol,2014,25(5):76-102.
[5]PLUMMER HK,DHAR MS,CEKANOVA M,et al.Expression of G-protein inwardly rectifying potassium channels(GIRKs)in lung cancer cell lines[J].BMC Cancer,2005,18(5):104-113.
[6]GRAS D,CHANEZ P,VACHIER I,et al.Bronchial epithelium as a target for innovative treatments in asthma[J].Pharmacol Ther,2013,140(3):290-305.
[7]SAHLHOLM K,NILSSON J,MARCELLINO D,et al.Voltage sensitivities and deactivation kinetics of histamine H3and H4receptors[J].Biochim Biophys Acta,2012,1818(12):3081-3089.
[8]LEVAY M,KROBERT KA,WITTIG K,et al.NSC23766,a widely used inhibitor of Rac1 activation,additionally acts as a competitive antagonist at muscarinic acetylcholine receptors[J].J Pharmacol Exp Ther,2013,347(1):69-79.
[9]BARDOU O,TRINH NT,BROCHIERO E.Molecular diversity and function of K+ channels in airway and alveolar epithelial cells[J].Am J Physiol Lung Cell Mol Physiol,2009,296(2):L145-155.
[10]GRAS D,CHANEZ P,VACHIER I,et al.Bronchial epithelium as a target for innovative treatments in asthma[J].Pharmacol Ther,2013,140(3):290-305.
[11]TIZZNO M,CRISTIFILETTI M,SBARBATI A,et al.Expression of taste receptors in solitary chemosensory cells of rodent airways[J].BMC Pulm Med,2011,13(11):3-14.
[12]ZYLBERGOLD P,RAMAKRISHAN N,HEBERT T.The role of G proteins in assembly and function of Kir3 inwardly rectifying potassium channels[J].Channels(Austin),2010,4(5):411-421.
[13]MATSUZAKI S,ISHIZUKA T,HISADA T,et al.Lysophosphatidic acid inhibits CC chemokine ligand5/RANTES production by blocking IRF-1-mediated gene transcription in human bronchial epithelial cells[J].J Immunol,2010,185(8):4863-4872.
[14]DEHKORDI O,ROSE JE,BALAN KV,et al.Co-expression of nAChRs and molecules of the bitter taste transduction pathway by epithelial cells of intrapulmonary airways[J].Life Sci,2010,86(7-8):281-288.
[15]WEBB DC,MCKENZIE ANJ,KOSKINEN AML,et al.Integrated signals between IL-13,IL-4,and IL-5 regulate airways hyperreactivity[J].J Immunol,2000,165(1):108-113.
[16]DABBAGH K,TAKEYAMA K,LEE HM,et al.IL-4induces mucin gene expression and goblet cell metaplasia in vitro and in vivo[J].J Immunol,1999,162(10):6233-6237.
[17]MARTIN G,O'CONNELL RJ,PIETRZYKOWSKI AZ,et al.Interleukin-4 activates large-conductance,calcium-activated potassium (BKCa)channels in human airway smooth muscle cells[J].Exp Physiol,2008,93(7):908-918.
