KATP通道对缺血性心肌电平衡的维护作用及机制
2015-02-01熊伟张丽朱迎迎袁振波郑桐祝凯鸽高菲菲伊迪热斯江艾力汤依群
熊伟,张丽,朱迎迎, 袁振波,郑桐,祝凯鸽,高菲菲,伊迪热斯江·艾力,汤依群
(中国药科大学临床药学教研室, 江苏 南京 210009)
KATP通道对缺血性心肌电平衡的维护作用及机制
熊伟,张丽,朱迎迎, 袁振波,郑桐,祝凯鸽,高菲菲,伊迪热斯江·艾力,汤依群*
(中国药科大学临床药学教研室, 江苏 南京 210009)
目的:利用异丙肾上腺素(ISO)诱导大鼠心肌缺血性损伤模型和心肌细胞损伤模型,并对其进行药物干预,探讨心肌ATP敏感性钾通道(KATP通道)维持缺血性心肌电平衡的作用与机制。方法:在动物实验中,将雄性SD大鼠,随机分为5组,正常对照组大鼠皮下注射0.9%氯化钠溶液,其余各组大鼠均皮下注射等量1 g • L-1ISO(qd),连续9 d,其间,在第7~9 d,除了正常对照组和模型组外,其他3组大鼠还分别灌胃给予1.75 g • L-1普萘洛尔(PRO)2 mL • kg-1• d-1、5 g • L-1曲美他嗪(VAS)2 mL • kg-1• d-1或腹腔注射给予5 g • L-1二苯基碘(DPI)1 mL • kg-1• d-1。在造模期间不同时间点,对各组大鼠进行心电图检查,并制备心肌标本,检测其中KATP通道亚基KIR6.2蛋白表达水平。在细胞实验中,将H9C2心肌细胞分成对照组(不给药)、ISO组、ISO+PRO组、ISO+DPI组和ISO+VAS组,后3组细胞均在1 μmol • L-1ISO加入前30 min,分别给予2 μmol • L-1PRO、10 μmol • L-1DPI和10 μmol • L-1VAS,且在加入ISO后,与ISO组细胞一样,再孵育1和24 h,采用实时荧光定量 PCR法测定各组细胞中KATP通道亚基KIR6.2和SUR2A基因表达水平。结果:大鼠实验显示,与正常对照组相比,模型组大鼠在造模的第3、7 d,心电图参数QTc明显缩短,心率加快(P<0.05),且心肌中KIR6.2蛋白表达明显增多(P<0.01),而造模9 d后,其QTc明显延长(P<0.01),心率减慢(P<0.05),心肌中KIR6.2蛋白表达显著降低(P<0.01);ISO+PRO、ISO+DPI和ISO+VAS各组大鼠在持续3 d分别接受3种药物治疗后,其QTc较模型组明显缩短,心率升高,均趋于恢复正常水平。细胞实验显示,与对照组相比,ISO组H9C2细胞经ISO孵育1 h后,KIR6.2和SUR2A的mRNA表达显著上调(P<0.05),而在ISO孵育24 h后,KIR6.2和SUR2A的mRNA表达显著下调(P<0.01);与ISO组相比,各给药组细胞经ISO孵育1 h后,KIR6.2和SUR2A的mRNA表达均有不同程度下调,而在ISO孵育24 h后,KIR6.2和SUR2A的mRNA表达均显著上调(P<0.05或P<0.01)。结论:KATP通道对维护缺血性心肌电平衡起重要作用。持续性激动β受体、氧化应激或能量供应不足等体内多条途径都会影响KATP通道的表达和功能,而保护KATP通道功能,对于维持心电平衡,抑制心律失常基质形成,意义重大。
ATP敏感性钾通道;异丙肾上腺素;缺血性心肌损伤;大鼠模型;细胞模型;心电平衡
ATP敏感性钾通道( ATP-sensitive K+channel,KATP通道)是由Noma首先在心肌细胞上发现的[1],是由4个内向整流钾通道(KIR) 和4个磺酰脲类受体(sulfonylurea receptor, SUR) 两部分亚基组成的八聚体[2]。心脏组织中KATP通道是由KIR6.2和SUR2A共同表达产生的[3],其受腺苷及胞内ATP浓度调控。正常生理条件下,心肌细胞上KATP通道是关闭的,不参与正常的心电兴奋-复极过程调节。心肌缺血时,致使KATP通道开放,促使细胞复极,减轻钙超载,减少能量消耗,是细胞重要的内源性保护机制[4]。在病变心脏中,心电离散度增加,形成心律失常。而在疾病状态下,KATP通道是否参与心电兴奋-复极过程,其通道功能变化与心电参数改变是否相关联,至今尚未见有系统研究报道。
本文通过建立大鼠和心肌细胞模型,考察异丙肾上腺素(ISO)所致心电复极异常与KATP通道表达的关系和ISO对心肌细胞KATP基因表达的影响以及药物干预的作用,探讨KATP通道在维护缺血性损伤心肌电平衡中的作用及机制。
1 材料
1.1 药品与试剂
ISO(美国Sigma公司);普萘洛尔(PRO,常州康普药业有限公司);曲美他嗪(VAS,天津施维雅制药有限公司);二苯基碘(DPI,美国Sigma公司)。肝素钠(Biosharp 公司);水合氯醛(国药集团化学试剂有限公司);Trizol试剂(Bio Basic公司);荧光定量PCR扩增试剂盒(Maxima SYBR Green qPCR MM,ROX,Thermo Scientific公司);膜蛋白提取试剂盒(上海生工有限公司);羊抗KIR6.2一抗(美国Santa Cruz 公司);鼠抗GAPDH一抗(Bioworld公司);HRP标记兔抗羊二抗(美国Santa Cruz 公司);HRP标记山羊抗小鼠二抗(南京天为生物科技有限公司);ECL化学发光试剂盒(Biouniquer 公司)。
1.2 仪器
BL-420S生物机能实验系统(成都泰盟科技有限公司);实时荧光定量PCR仪(德国Eppendorf公司);TGL20M冷冻离心机(湖南凯达科学仪器有限公司);Leica DFC425倒置光学显微镜(德国Leica公司);Thermo Fisher 8000WJ细胞培养箱(美国Thermo Fisher公司);分子酶标仪(美国Thermo Fisher公司)。
1.3 动物和细胞株
SPF级SD大鼠,雄性,体质量250~300 g,购自上海西普尔-必凯实验动物中心,合格证号:SCXK (沪) 2008-0016。饲养环境:温度25 ℃,12 h光照/12 h黑暗,自由进水进食。
大鼠心肌细胞株H9C2,购于上海细胞库。
2 方法
2.1 动物实验
2.1.1 分组及造模和给药方法 将大鼠随机分成5组,除正常对照组大鼠皮下注射0.9% 氯化钠溶液1 mL·kg-1·d-1外,其余各组大鼠均皮下注射等量1 g·L-1ISO,连续9 d,其间,在第7~9 d,除了正常对照组和模型组外,其他3组大鼠还分别灌胃给予1.75 g·L-1PRO 2 mL·kg-1·d-1、5 g·L-1VAS 2 mL·kg-1·d-1或腹腔注射给予5 g·L-1DPI 1 mL·kg-1·d-1。
2.1.2 心电图参数测量 各组大鼠在造模的第1、3、7 d给药前及第10 d处死前记录标准Ⅱ导联心电图(ECG),计算心率和QTc。
2.1.3 心肌标本制备 模型组在造模的第3、7 d给药前及第10 d而正常对照组在第10 d,分别取3只大鼠左心室,置于-80 ℃冰箱冷冻保存,备用。
2.1.4 western-blot法测定大鼠心室组织KATP通道亚基蛋白的表达 取大鼠左心室组织0.1 g,剪碎,用膜蛋白提取试剂盒匀浆离心,分离出的膜蛋白再经SDS-聚丙烯酰胺凝胶电泳分离,转膜,封闭,一抗4 ℃孵育过夜;TBST洗膜,二抗室温摇床孵育,HRP-ECL法显色,ImageJ凝胶图像分析软件分析,以目的蛋白与GAPDH蛋白灰度值的比值计算目的蛋白的表达水平,重复3次。
2.2 细胞实验
2.2.1 细胞培养 于5% CO2、37 ℃环境条件下,将H9C2细胞在含有10% FBS、100 U·mL-1青霉素和100 g·L-1链霉素的DMEM 培养基中培养,当细胞融合80%~90%时,用0.25% 胰蛋白酶消化传代,1×106个细胞接种到100 mL培养瓶中;当细胞融合70%~80% 时,用2% FBS同步化过夜,并用于实验。
2.2.2 细胞活力测定 将H9C2细胞以每孔5 000个的密度接种于96孔板中,孵育10 h后,以1 μmol·L-1ISO分别孵育1、2、24 h,吸出含药培养基并用磷酸缓冲液(PBS)洗2遍,每孔加入5 g·L-1MTT溶液20 μL和无血清培养基80 μL,37 ℃孵育4 h,然后每孔加入160 μL 三联液,37 ℃孵育过夜,用分子酶标仪在 570 nm处测各孔的吸光度值(A值),测得细胞活力,同时设不给药的对照组平行操作,计算给药组细胞的相对存活率:给药组A值/对照组A值(用于计算存活率的各组A值均已减去本底空白A值)。
2.2.3 细胞分组与实时荧光定量 PCR基因检测 H9C2细胞分组:对照组(不给药)、ISO组、ISO+PRO组、ISO+DPI组和ISO+VAS组,后3组细胞均在1 μmol·L-1ISO加入前30 min,分别给予2 μmol·L-1PRO、 10 μmol·L-1DPI和10 μmol·L-1VAS,且在加入ISO后,与ISO组细胞一样,再孵育1和24 h,即可提取RNA。
各组细胞用PBS洗2遍后,加入1 mL Trizol试剂,按照试剂盒说明书提取 RNA,RNA的纯度通过测定其在260 nm处的吸光度值来确定,2 μg总RNA按照第一链cDNA合成试剂盒(First Strand cDNA Synthesis Kit,AMV)说明书用于逆转录,取 1 μL 的cDNA 产物用于每个PCR 反应,用扩增试剂盒(Maxima SYBR Green Qpcr MM,ROX)按照说明书进行实时荧光定量PCR检测。由于GAPDH基因在组织中的表达高度稳定,因此被选作内参基因。检测数据用 2-⊿⊿ct方法处理,各个基因的引物序列(见表1)由上海生工有限公司设计并合成。

表1 用于实时荧光定量 PCR的引物寡核苷酸序列Table1 Oligonucleotide primers used for RT-PCR
2.3 统计学分析
实验数据运用Graphpad Prism.v5.0统计学软件处理,以±s表示,多组间比较采用双侧t检验,P≤0.05和P≤0.01分别表明有显著和非常显著性差异。
3 结果
3.1 异丙肾上腺素致大鼠心电复极异常与KATP通道表达的关系
ECG显示,与正常对照组相比,模型组大鼠在连续皮下注射ISO的第3、7 d时,QTc明显缩短及心率明显升高(P<0.05),而9 d后,QTc显著延长(P<0.01)及心率显著下降(P<0.05)(见图1-A、1-B)。westernblot实验检测显示,与正常对照组相比,模型组大鼠在造模的第3、7 d时,心室组织中KATP通道亚基KIR6.2蛋白的表达显著上调(P<0.01),而9 d后,KIR6.2蛋白表达明显下调(P<0.01)(见图1-C)。可见,在造模期间,模型组大鼠心肌复极过程中QTc先缩短后延长,而心肌中KIR6.2的表达先上调后下调,即心肌复极异常与KATP通道表达呈负相关。
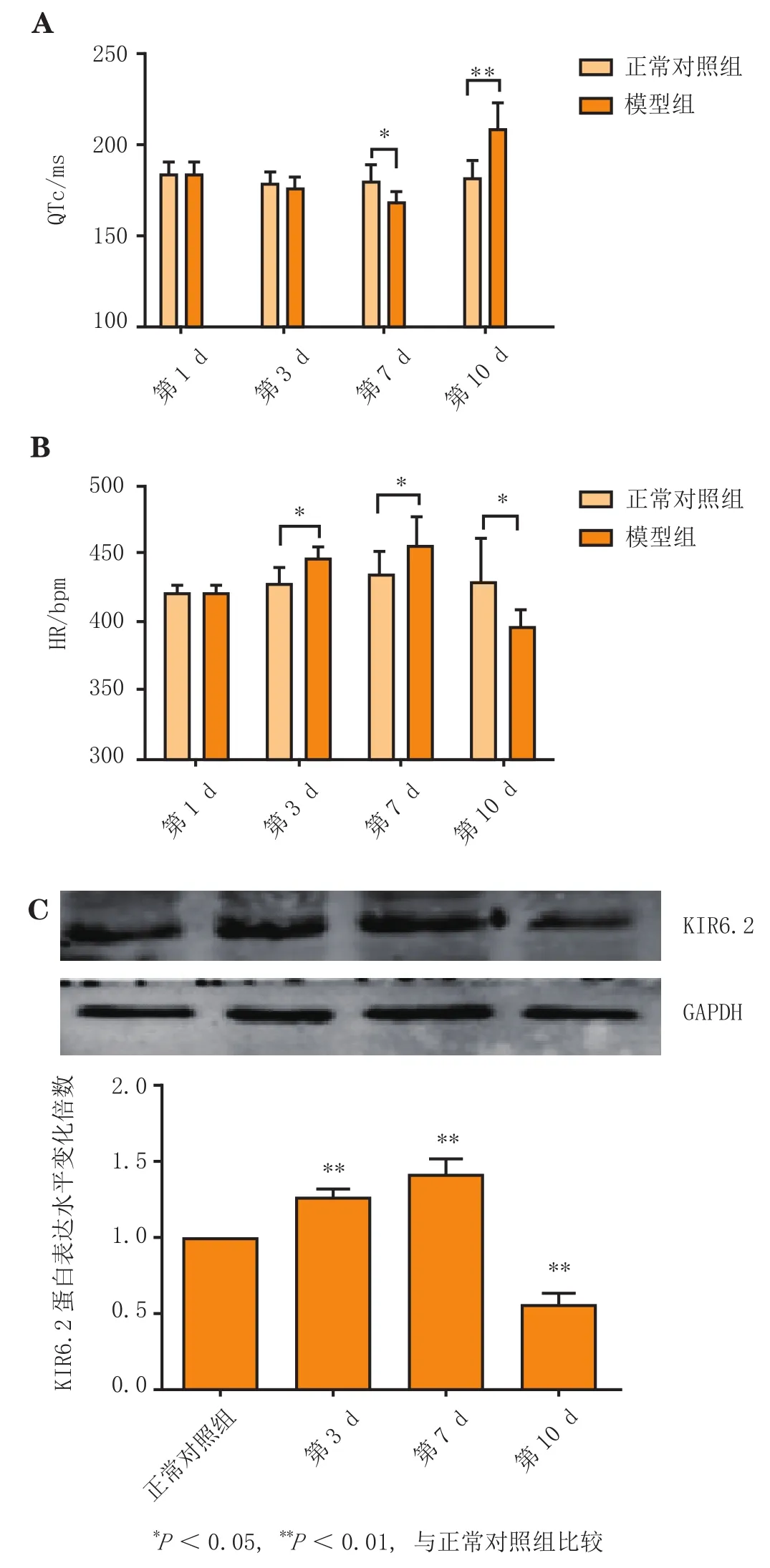
图1 造模期间模型组大鼠ECG参数(n=6)和心肌中KIR6.2蛋白表达(n=3)的变化Figure 1 Changes in ECG parameters and KIR6.2 protein expression in myocardium of the model rats during modeling period
3.2 药物干预对异丙肾上腺素所致大鼠心电复极异常的改善作用
ECG显示,与正常对照组相比,模型组大鼠在造模9 d后,其QTc明显延长(P<0.01),心率降低(P<0.05),表明,大鼠心肌复极延迟,诱发心电异常;ISO+PRO、ISO+DPI和ISO+VAS各组大鼠在持续3 d分别接受3种药物治疗后,其QTc较模型组明显缩短,心率升高,均趋于恢复正常水平(见图2)。

图2 造模9 d后各组大鼠ECG参数比较(n=6)Figure 2 Comparison of ECG parameters among each group of rats after 9 d- modeling
3.3 异丙肾上腺素对心肌细胞的损伤作用
MTT实验结果显示,与不给药的对照组相比,H9C2细胞经1 μmol·L-1ISO分别孵育1、 2、 24 h后,其存活率分别为97.29%、87.81%和84.62%。
3.4 异丙肾上腺素对心肌细胞KATP通道基因表达的影响
实时荧光定量 PCR检测显示,与对照组相比,H9C2细胞经ISO孵育1 h 后,其KIR6.2和SUR2A的mRNA表达水平明显升高(P<0.05);而24 h后,其KIR6.2和SUR2A的mRNA表达水平明显降低(P<0.01)(见图3)。
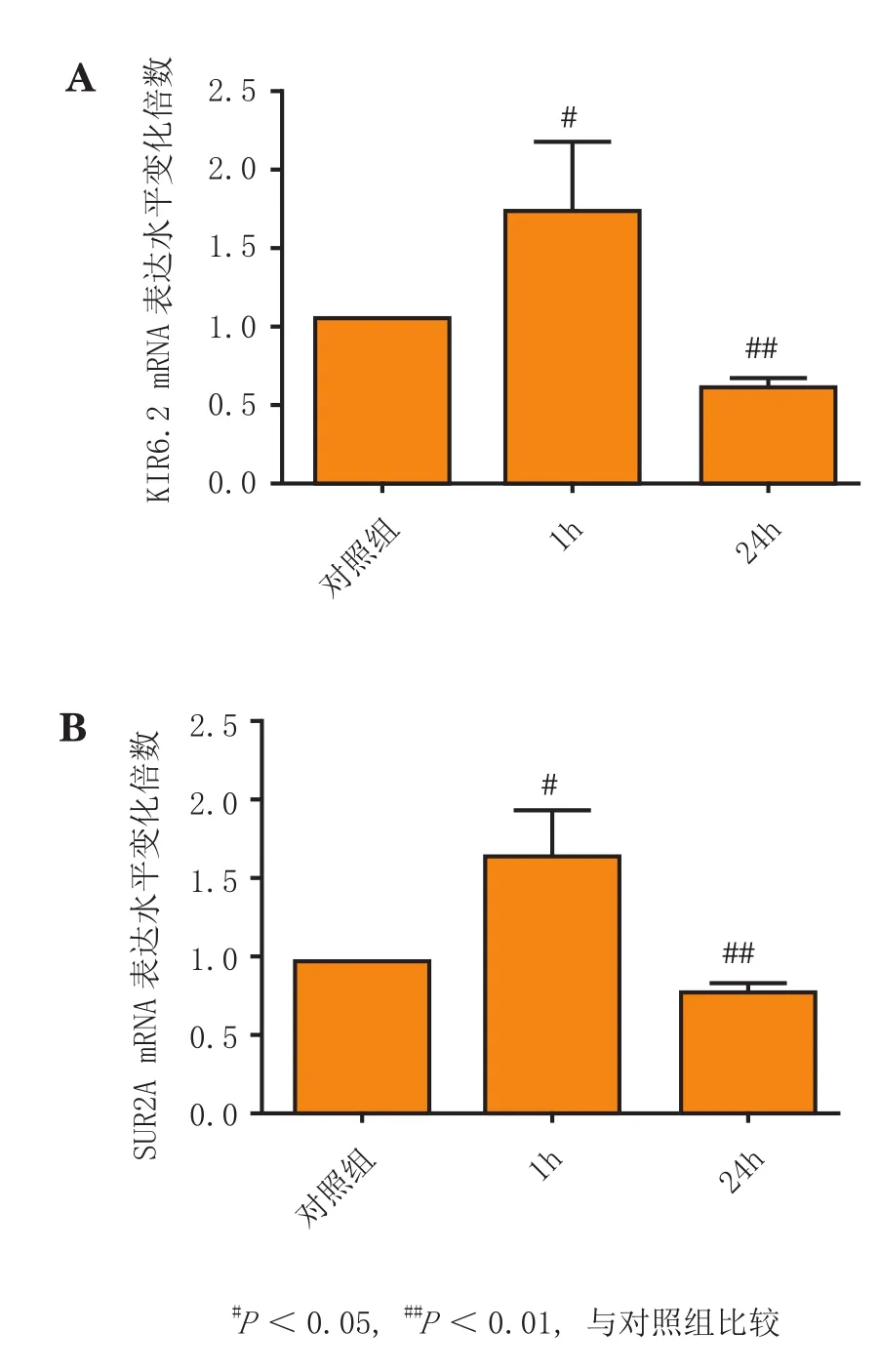
图3 H9C2细胞经ISO孵育1 和24 h后其KIR6.2(A)和SUR2A(B)的mRNA表达水平变化(n=3)Figure 3 Changes in mRNA expression of KIR6.2(A) and SUR2A(B) in H9C2 cells in response to 1 h- and 24 h-incubation with ISO
3.5 药物干预1 h对异丙肾上腺素所致心肌细胞KATP通道基因表达变化的影响
实时荧光定量 PCR检测显示,经ISO孵育1 h 后,ISO+PRO、ISO+DPI和ISO+VAS各组H9C2细胞的KIR6.2 mRNA表达水平与ISO组均无显著差异,但较对照组明显上调(P<0.05或P<0.01)(见图4-A);这3组细胞的SUR2A mRNA表达水平较ISO组均有所下降,其中ISO+DPI和ISO+VAS两组与ISO组有显著差异(P<0.05)(见图4-B)。提示,在心肌损伤早期,KATP通道亚基表达增加,可自身代偿性缓解心肌损伤。

图4 各组H9C2细胞经ISO孵育1 h后其KIR6.2(A)和SUR2A(B)的mRNA表达水平变化(n=3)Figure 4 Changes in mRNA expression of KIR6.2(A) and SUR2A(B) in each group of H9C2 cells in response to 1 h-incubation with ISO
3.6 药物干预24 h对异丙肾上腺素所致心肌细胞KATP通道基因表达变化的影响
实时荧光定量 PCR检测显示,经ISO孵育24 h后,ISO组H9C2细胞KIR6.2和SUR2A的mRNA表达水平均较对照组显著下调(P<0.01),这可能是由于持续的ISO刺激造成KATP通道损伤,使得自身代偿性开放不足以改善心肌损伤所致;而ISO+PRO、ISO+DPI和ISO+VAS各组细胞KIR6.2和SUR2A的mRNA表达水平均较ISO组显著上调(P<0.05或P<0.01)(见图5)。推测,ISO可能通过激动β-肾上腺素受体(β-AR)、诱导氧化应激以及能量代谢障碍而造成心肌损伤。
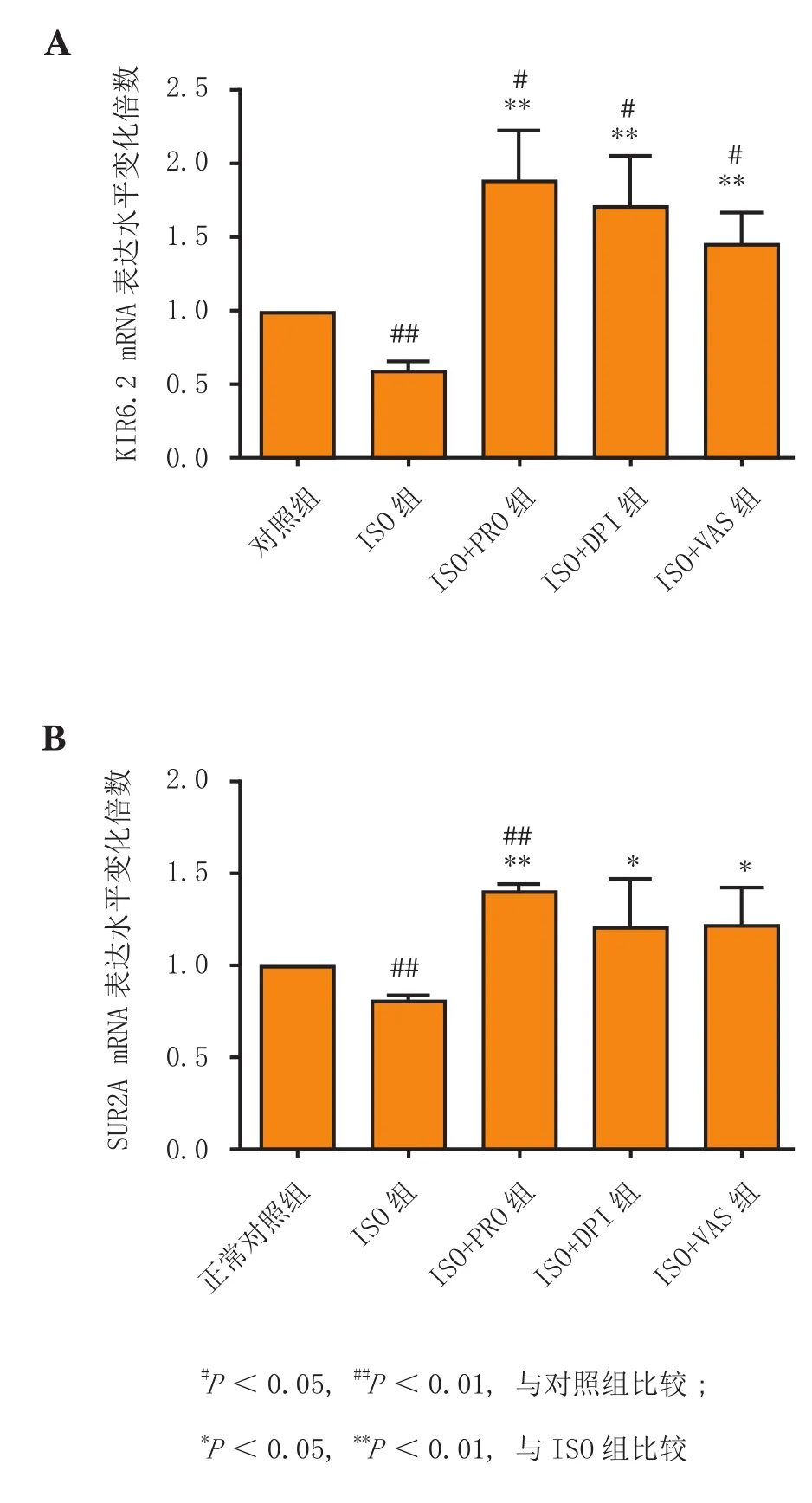
图5 各组H9C2细胞经ISO孵育24 h后其KIR6.2(A)和SUR2A(B)的mRNA表达水平变化(n=3)Figure 5 Changes in mRNA expression of KIR6.2(A) and SUR2A(B) in each group of H9C2 cells in response to 24 h-incubation with ISO
4 讨论
当心肌细胞缺血缺氧、ATP含量减少时,KATP通道开放可促进钾外流,使细胞趋于复极化或超极化,动作电位时程(APD)缩短,Ca2+内流减少,降低细胞兴奋性,减少细胞能量消耗[5]。减轻缺血造成的心肌损伤,是心肌细胞重要的内源性保护机制[6]。本文首次在ISO诱导的心肌缺血性损伤模型上,观察KATP通道功能的动态变化与心电改变的关系。
ISO能使心肌兴奋性增高,收缩性增强,心肌耗氧量增加,其大剂量可造成心肌缺血性损伤,诱发心电紊乱。ISO诱导的心肌缺血模型因制作简单,不需要特殊设备,近年来被广泛应用于各种药理、药效学研究[7]。在目前报道的实验研究中,诱导心肌缺血性损伤模型时所用ISO的最小剂量是0.5 mg·kg-1[8],最大剂量为500 mg·kg-1[9]。本文通过预实验确认,诱发心肌缺血模型所用ISO的最适剂量为1 mg·kg-1。
本文在观察ISO造模的不同时间点大鼠心电复极参数的变化与KATP 通道亚基表达间的关系时,所用参数QTc间期是按心率校正的QT间期,为反映心脏去极化和复极作用的指标。QTc间期延长表明心脏复极延迟及心电异常,通常与心律失常的发生密切相关[10]。本文的实验研究发现,大鼠在ISO造模的第3、7 d时,QTc缩短,心率升高,表明ISO作为β受体激动剂,短时间的刺激,能使心肌收缩力增强、心肌耗氧量增加及心率加快;同时,大鼠心肌KATP通道亚基KIR6.2蛋白表达上调,提示早期的ISO刺激能激活KATP通道,自身代偿性地缓解损伤。而大鼠在造模9 d后,心率明显下降,QTc延长,出现心肌复极延迟及心电异常,且心肌中KIR6.2蛋白表达明显下调。即大鼠在ISO造模过程中,不同时间段的QTc与KIR6.2蛋白表达呈负相关。
为了探讨ISO引起心肌损伤的机制,本文在细胞实验中,将H9C2心肌细胞与ISO共孵育1和24 h,采用PCR技术观察细胞中KATP通道的主要组成亚基KIR6.2和功能亚基SUR2A基因表达水平,结果显示,经ISO孵育1 h后,H9C2细胞中KIR6.2和SUR2A的mRNA表达上调,而孵育24 h后,细胞中KIR6.2和SUR2A的mRNA表达下调,与动物实验结果类似。可见,心肌细胞在损伤早期,可启动心肌内源性保护机制,如KATP通道开放等,保护细胞活力;但持续长时间的刺激性损伤,会导致细胞中KATP通道亚基KIR6.2和SUR2A基因表达下调,即KATP通道受损,内源性保护作用减弱,细胞活力降低,MTT检测数据亦有所反映。
心肌细胞中持续的β受体激动,会产生大量活性氧(ROS),过量的ROS能引起氧化应激反应,造成损伤[11-12]。PRO是β受体阻断剂,能阻断β受体的持续激动,改善心肌损伤。DPI是NADPH氧化酶抑制剂,能通过阻断ISO诱导的氧化应激途径,保护心肌KATP通道,阻止心肌细胞损伤[13]。VAS作为能量供给剂,可通过改变心肌细胞的有氧代谢途径,优化心肌能量代谢,从而改善心肌细胞的功能[14]。本文在动物实验中,利用PRO、DPI和VAS对ISO诱导的心肌缺血性损伤模型大鼠进行药物干预,致使模型大鼠的QTc明显缩短。且在细胞实验中,PRO、DPI和VAS均能使ISO诱导损伤的心肌细胞中KIR6.2和SUR2A的mRNA表达上调。这进一步说明,改善心肌中KATP通道表达水平,能影响心肌复极过程,减少心律失常的发生。
综上所述,KATP通道对维护缺血性损伤心肌电平衡起重要作用,是参与心电复极的重要离子通道。持续性激动β受体、氧化应激或能量供应不足等体内有多条途径都会影响KATP通道的表达和功能,而保护KATP通道功能,对于维持心电平衡,抑制心律失常基质形成,意义重大。
[1]Noma A.ATP-regulated K+channels in cardiac muscle[J].Nature, 1983, 305(5930): 148-148.
[2]Geiseler S J, Ludvigsen S, Folkow L P.KATP-channels play a minor role in the protective hypoxic shut-down of cerebellar activity in eider ducks (Somateria mollissima)[J].Neuroscience, 2015, 284: 751-758.
[3]Suzuki M, Li R A, Miki T, et al.Functional roles of cardiac and vascular ATP-sensitive potassium channels clarifed by Kir6.2-knockout mice[J].Circ Res, 2001, 88(6): 570-577.
[4]Seino S, Miki T.Physiological and pathophysiological roles of ATP-sensitive K+channels[J].Prog Biophys Mol Biol, 2003, 81(2): 133-176.
[5]Zhang H X, Silva J R, Lin Y W, et al.Heterogeneity and function of KATP channels in canine hearts[J].Heart Rhythm, 2013, 10(10): 1576-1583.
[6]Toib A, Zhang H X, Broekelmann T J, et al.Cardiac specific ATP-sensitive K+channel (KATP) overexpression results in embryonic lethality[J].J Mol Cell Cardiol, 2012, 53(3): 437-445.
[7]张云, 王阶, 郭丽丽.异丙肾上腺素诱导心急缺血损伤模型的研究进展[J].医学综述, 2010, 16(23): 3527-3531.
[8]Devika PT, Stanely Maingen Prince P.Protective effect of (-)-epigallocatechin-gallate (EGCG) on lipid peroxide metabolism in isoproterenol induced myocardial infarction in male Wistar rats: a histopathological study[J].Biomed Pharmacother, 2008, 62(10): 701-708.
[9]Prabhu S, Narayan S.Devi C S.Mechanism of protective action of mangiferin on suppression of inflammatory response and lysosomal instability in rat model of myocardial infarction[J].Phytother Res, 2009, 23(6): 756-760.
[10]Cunnington A L, Hood K, White L.Outcomes of screening Parkinson's patients for QTc prolongation[J].Parkinsonism Relat Disord, 2013, 19(11): 1000-1003.
[11]黄涌, 阮经文, 杨春涛, 等.依达拉奉保护H9c2心肌细胞对抗异丙肾上腺素诱导的氧化应激及内质网应激反应[J].中国药理学通报, 2011, 27(3): 410-415.
[12]Giordano F J.Oxygen, oxidative stress, hypoxia, and heart failure[J].J Clin Invest, 2005, 115 (3): 500-508.
[13]Tang Y, Wang M, Le X, et al.Antioxidant and cardioprotective effects of Danshensu (3-(3,4-dihydroxyphenyl)-2-hydroxy-propanoic acid from Salvia miltiorrhiza) on isoproterenol-induced myocardial hypertrophy in rats[J].Phytomedicine, 2011, 18(12): 1024-1030.
[14]Şentürk T, Çavun S, Avcı B, et al.Effective inhibition of cardiomyocyte apoptosis through the combination of trimetazidine and N-acetylcysteine in a rat model of myocardial ischemia and reperfusion injury[J].Atherosclerosis, 2014, 237(2): 760-766.
The Protective Effect of KATP Channel on the Electric Balance in Ischemic Myocardium and Its Mechanism
XIONG Wei, ZHANG Li, ZHU Yingying, YUAN Zhenbo, ZHENG Tong, ZHU Kaige, GAO Feifei, AILI Yidiresijiang, TANG Yiqun (Department of Clinical Pharmacy, China Pharmaceutical University, Nanjing 210009, China)
Objective: To investigate the protective effect of myocardial ATP-sensitive K+channel(KATP channel) on the electric balance in ischemic myocardium and its mechanism using a rat model of myocardial ischemic injury and a model of myocardial cell injury induced by isoproterenol(ISO) and subjected to drug intervention.Methods: In animal trial, male SD rats were randomly divided into 5 groups.The rats in normal control group were administered subcutaneously with a 0.9% sodium chloride solution and the rats in rest groups were administered subcutaneously with the same amount of 1 g • L-1ISO (qd) for 9 d.Meanwhile, except the normal control group and model group, the other three groups of rats were administered respectively with 1.75 g • L-1propranolol(PRO, 2 mL • kg-1• d-1, po), 5 g • L-1vastarel(VAS, 2 mL • kg-1• d-1, po) and 5 g • L-1diphenyliodonium(DPI, 1 mL • kg-1• d-1, ip) on days 7-9.The ECGs of rats in each group were monitored and their myocardial specimens were prepared for determination of the expression of KATP channel subunit KIR6.2 protein at different time points during modeling period.In cell trial, H9C2 myocardial cells were divided into control group (untreated) , ISO group, ISO+PRO group, ISO+DPI group and ISO+VAS group.The latter 3 groups were treated respectively with 2 μmol • L-1PRO, 10 μmol • L-1DPI and 10 μmol • L-1VAS 30 min prior to treatment with 1 μmol • L-1ISO, and subsequently incubated with ISO for 1 and 24 h similarly to ISO group.The gene expressions of Kir6.2 and SUR2A in each group of cells were determined by RT-PCR.Results: In rat trial, on days 3 and 7, the ECG parameter QTc of the rats in model group decreased, their heart rates(HR) increased(P< 0.05) and myocardial KIR6.2 protein expression increased (P< 0.01); after day 9, their QTc prolonged (P< 0.01) and HR decreased (P<0.05), compared with normal control group.The QTc of the rats in ISO+PRO group, ISO+DPI group and ISO+VAS group decreased and HR increased, tending towards normal levels, after drug treatment lasting 3 d, compared with model group.In cell trial, compared with control group, the mRNA expression of KIR6.2 and SUR2A in H9C2 cells in ISO group were upregulated (P<0.05)after 1 h-incubation with ISO and were downregulated after 24 h-incubation with ISO (P<0.01); compared with ISO group, the mRNA expression of KIR6.2 and SUR2A in the cells in each treatment group were downregulated to different extent after 1 h-incubation with ISO and were upregulated (P<0.05 or P<0.01)after 24 h-incubation with ISO.Conclusion: KATP channel plays an essential role in the protection of the electric balance in ischemic myocardium.There are multiple ways in vivo to impact the expression and function of KATP channel, such as a persistent excitation of β receptor, oxidative stress or insuffcient energy supply.The protection of the function of KATP channel is of great signifcance to the maintenance of myocardial electric balance and the inhibition of arrhythmic substrate formation.
KATP channel; isoproterenol; ischemic myocardial injury; rat model; cell model; myocardial electric balance
R542.4;R965.1
A
1001-5094(2015)03-0204-07
接受日期:2015-01-17
项目资助:中央高校基本科研业务费专项基金(No.JKZ2011007);国家重大新药创制科技重大专项课题(No.2009ZX09103-088);高校本科生创新实验计划(No.G12091)
*通讯作者:汤依群,副教授; 研究方向:心血管药理; Tel:025-83271070; E-mail:tyq@cpu.edu.cn
·全球药讯·
GLOBAL PHARMACEUTICAL INFORMATION
